ADENOVIRUS – PARVOVIRUS - BOCAVIRUS
Prof. O.E. Varnier – Dott.ssa Martini Isabella
Università degli Studi di Genova
Corso di Laurea in Medicina e Chirurgia A.A. 2013-2014
Corso Integrato di Malattie Infettive e Microbiologia Clinica
Generi: Erythrovirus, Dependevirus e Bocavirus.
ADENOVIRUS - Morfologia
Virus a DNA
bicatenario
Diametro di 70-100 nm
Simmetria icosaedrica (20
facce triangolari)
Non rivestito da involucro membranoso (pericapside assente).
Capside di 252 capsomeri (240 esoni + 12 pentoni).
Capsomeri ai vertici della struttura (pentoni) presentano 1 o 2 proiezioni filamentose
rigide (fibre); esoni sono capsomeri non ai vertici.
ADENOVIRUS - Morfologia
Il nucleo formato da acidi nucleici e
da diverse proteine basiche, adatte a
interagire con il DNA (complessano,
stabilizzano, ancorano il
genoma al
capside, coinvolte nella duplicazione del
genoma)
Fibre, esoni e pentoni hanno caratteristiche diverse e funzioni specifiche:
le fibre sono emoagglutinine tipo-specifiche; svolgono funzione di legame al R
e rappresentano bersaglio degli Ab neutralizzanti.
i pentoni sono coinvolti nel meccanismo di adsorbimento e penetrazione alle
cellule; hanno attività citopatica.
gli esoni hanno un'antigenicità comune a tutti gli Adenovirus
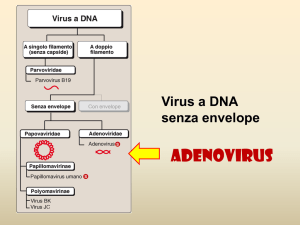
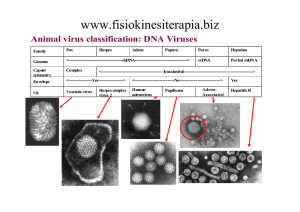
ADENOVIRUS - Classificazione
Famiglia Adenoviridae ; 4 generi: Mastadenovirus (mammiferi), Aviadenovirus
(aviari), Atadenovirus (mammiferi e aviari) e Siadenovirus (rana e aviari).
Virus che infettano uomo (HAdV) appartengono al genere Mastadenovirus e sono
suddivisi in:
Specie (o gruppi); sulla base della distanza filogenetica (>10%)
Sierotipo (55 sierotipi); definiti tradizionalmente in base alla neutralizzazione
da parte di antisieri specifici, ma anche in base alle differenze genetiche nella
regione della fibra.
ADENOVIRUS - Replicazione
Si replicano efficacemente solo in cellule epiteliali.
I. Adesione e ingresso nella cellula bersaglio
Il virus, attraverso la porzione distale delle
fibre, si adsorbe alla “CAR protein” (recettore 1)
della cellula bersaglio.
Avvenuto il contatto, i pentoni interagiscono con
integrine cellulari (recettore 2) promuovendo
l’internalizzazione con una endocitosi recettoremediata (formazione endosoma).
ADENOVIRUS - Replicazione
Nel citoplasma: i pentoni, al pH basso citoplasmatico, si attivano e rompono
l’endosoma e virus viene liberato (acidificazione e degradazione).
Trasporto del virus verso il nucleo cellulare mediato da sistema microtubulare.
Nei pressi del nucleo il capside virale subisce processo di disassemblaggio mediato
da proteasi virale.
Il DNA attraversa la
membrana nucleare e
si associa alla matrice
nucleare tramite la
sua proteina terminale (TP).
ADENOVIRUS - Replicazione
II. Fase precoce della replicazione.
comprende i passaggi replicativi precedenti la sintesi del DNA virale.
trascritti geni (E=early) che codificano per molecole coinvolte:
nella replicazione virale
nei meccanismi di protezione della cellula infetta dai processi difensivi dell’organismo ospite.
E1A:
transattivatore dei promotori di geni virali e cellulari; espressione necessaria per
trascrizione dei successivi geni virali
modula ciclo della cellula ospite: si lega a pRB, inibitrice del fattore trascrizionale E2F;
questo, non più inibito, è responsabile della transizione da G1 a S della cellula infettata.
E1B:
blocca l’apoptosi della cellula ospite: trascritto di E1B si lega a fattore cellulare p53
inibendo le sue capacità transattivanti dei geni pro-apoptotici.
E2: polimerasi
N.B. I prodotti di E1 sono in grado di legare proteine citoplasmatiche coinvolte nel controllo del ciclo
cellulare (pRB, p53) inattivandole: questo può spiegare l’oncogenicità degli Adenoviruses.
ADENOVIRUS – Prodotti Genici Precoci
(p.transattivatrice)
pRB
• Lega MHC I nel R.E. limitandone l’espressione ↓attacco T citotossici
(Apoptosi TNF mediata)
• Adenovirus Death Protein
ADENOVIRUS - Replicazione
Replicazione del genoma virale. La polimerasi si associa alla TP legata alle
estremità, con funzione di primer della catena nascente e avviene la sintesi del
nuovo DNA virale.
III. Fase tardiva della replicazione.
Espressione dei geni tardivi (Major Late Promoter + fattore trascrizione cellulare
MajorLateTrascriptionFactor e prodotto del gene precoce-tardivo IVa2 legato a valle)
Singolo trascritto mRNA (29000 bp) → splicing alternativo → 18 differenti mRNA
suddivisi in 5 gruppi (da L1a L5); da questi mRNA avranno origine:
proteine del capside virale (polipepdidi: II-esone, III-pentone e IV-fibra)
proteine strutturali associate al capside e al DNA.
proteasi per l’assemblaggio del capside (L3)
proteine con funzioni ancillari nell’assemblaggio (aggregazione degli esoni
controllata da peptide L4) e nell’encapsidazione del DNA (L1).
Capside
ADENOVIRUS – Prodotti Genici Tardivi
Ancoraggio proteine core e…
Funzioni stabilizzatrice tra i
capsomeri
Nucleo interno
TP: primer per la duplicazione genoma
µ(pX): stabilizzatrice
ADENOVIRUS - Replicazione
IV. Assemblaggio e maturazione virale.
L’assemblaggio e la maturazione dei capsidi (morfogenesi virale) avviene
nel nucleo.
Intervengono prodotti dei geni tardivi:
Proteasi prodotta da unità trascrizionale L3: l’assemblaggio del capside
Peptide prodotto da unità trascrizionale L4: aggregazione degli esoni
Peptide prodotto da unità trascrizionale L1: encapsidazione del DNA
Il risultato è un virione completo, stabile ed infettivo.
V. La cellula muore e si sfalda per azione della massa dei virioni e per
l’effetto citotossico di una proteina E3 (Adenovirus Death Protein), liberando
i virioni (INFEZIONE LITICA).
ADENOVIRUS - Meccanismi patogenetici
Gli adenovirus instaurano infezioni litiche, latenti e trasformanti:
Nelle cellule permissive la crescita facilita la trascrizione e la replica del genoma
causando la morte cellulare attraverso la lisi.
Nelle cellule non permissive il virus instaura un’infezione latente e può stimolare la
crescita cellulare promuovendone la trasformazione.
ADENOVIRUS - Meccanismi patogenetici
Colture in vitro (cellule epiteliali): producono tipico effetto citopatico con
arrotondamento, distacco della cellula dal substrato e aggregazione in grappoli.
Microscopio: in vitro, vistose inclusioni nucleari per accumulo di particelle virali, sono
state osservate anche in sezioni bioptiche di tessuto infetto.
ADENOVIRUS
Meccanismi patogenetici e manifestazioni cliniche
La trasmissione dell'infezione da ADV si può verificare per inalazione del virus
(aerosol), per inoculazione nel sacco congiuntivale (dita→occhi; congiuntiviti “da
piscina”) e probabilmente anche per via orofecale.
Nei soggetti normali (immunocompetenti) le infezioni da ADV provocano
manifestazioni cliniche correlate con l’infezione acuta e la necrosi dei tessuti
epiteliali, probabilmente per azione citopatica diretta del virus.
La diffusione del virus è la conseguenza della propagazione nel tessuto
dell’infezione per contiguità dal sito iniziale d’infezione.
Alcune sedi d’infezione (vescica e l’intestino nei bambini, reni e fegato negli
immunodepressi) sembrano essere provocate per via ematogena da altri focolai.
Nell’uomo, a differenza che nel topo, non sono mai stati riscontrati casi di
neoplasie verosimilmente provocate da adenovirus.
ADENOVIRUS - Manifestazioni cliniche
Bambini: sindrome più comune è infezione del tratto respiratorio superiore accompagnata da
intensa rinite. Talvolta osservabili patologie a carico del tratto respiratorio inferiore, come
bronchiolite e polmonite. Sierotipi 3 e 7, provocano la febbre faringocongiuntivale (malattia acuta
febbrile caratteristica dei bambini; si presenta in forma di epidemie).
Adulti: malattia più frequentemente segnalata è la cosiddetta "malattia respiratoria acuta",
causata nelle reclute militari dagli adenovirus di tipo 4 e 7.
ADV specie B-C: endemiche, colpiscono già in tenera età, spesso asintomatiche.
ADV associati anche a malattie non respiratorie, quali gastroenterite in bambini piccoli e
cheratocongiuntivite epidemica. (N.B. tropismo tissutale dei gruppi specifici e sierotipi del ceppo virale)
ADENOVIRUS - Manifestazioni cliniche
Sindromi cliniche nei soggetti immunodepressi:
Infezioni disseminate tra cui:
polmoniti
epatiti/pancreatiti fulminanti
coliti/gastroenteriti fulminanti
cistiti emorragiche
encefaliti (rare)
Terapia Profilassi & Controllo
Proponibile solo una terapia sintomatica e di supporto, non essendo disponibili farmaci
antivirali clinicamente utili. Es. corticosteroidi topici alleviano i sintomi e abbreviano il
decorso della cheratocongiuntivite epidemica e della congiuntivite da ADV.
Importante il lavaggio per evitare le epidemie di congiuntivite da adenovirus che si
diffondono per contatto con oggetti contaminati (p. es., asciugamani, strumenti, ecc.), con
secrezioni o con dita infette (sterilizzazione degli strumenti, uso guanti e lavarsi le mani).
Per impedire la diffusione del virus è fondamentale anche la clorazione delle piscine.
Per reclute militari (no popolazione civile) sviluppati vaccini con virus vivi, contro gli
ADV tipo 4 e 7 (ampiamente utilizzati per il controllo infezione, hanno provocato una
notevole diminuzione delle Malattia Acuta Respiratoria – MAR, tra i militari)
Vaccini di virus vivi, non attenuati, somministrati attraverso capsule enterosolubili:
l'infezione del tratto gastroenterico con i sierotipi 4 e 7 non causa malattia, ma stimola
la produzione di Ab locali e sistemici che proteggono da successive possibili affezioni
respiratorie acute provocate da questi stessi sierotipi.
In fase di sviluppo alcuni vaccini preparati con subunità purificate di ADV.
ADENOVIRUS - Biotecnologie
Adenovirus nella terapia genica:
Terapia genica: introduzione di geni funzionanti nelle cellule di un paziente per
esprimere funzioni desiderate o per correggere geni difettivi/non funzionanti
La terapia genica trova applicazione in diversi tipi di patologie:
le malattie ereditarie, dovute a deficienze genetiche di un singolo prodotto genico
o all’errata espressione di un gene (ImmunoDeficienza Severa Combinata
associata a deficienza di Adenosina Deaminasi - ADA-SCID)
malattie cardiovascolari;
malattie infettive, causate da singolo agente patogeno batterico o virale (AIDS);
malattie del sistema immunitario (infiammazioni e malattie autoimmuni);
malattie neurodegenerative (Morbo di Alzheimer e Morbo di Parkinson);
i tumori, causati da un’alterazione della divisione e della proliferazione cellulare a
seguito dell’attivazione di un oncogene o dell’inattivazione di un oncosopressore.
ADENOVIRUS - Biotecnologie
81% delle sperimentazioni cliniche di terapia genica eseguite fino ad oggi hanno
riguardato: cancro, malattie cardiovascolari, malattie ereditarie monogeniche.
Terapia genica dei tumori consiste nel cercare di inserire nel genoma della cellula
neoplastica , geni in grado di bloccarne la proliferazione o indurne la morte.
Sistemi di somministrazione devono
essere in grado di introdurre DNA
in cellule-bersaglio appropriate.
Vettori Adenovirali:
ADV possono essere ingegnerizzati
per aumentarne la specificità
per minimizzarne gli effetti indesiderati
(delezione E1 rende virus diffettivo
per la replicazione).
ADENOVIRUS - Biotecnologie
Se l'integrazione nel genoma non è opportuna/richiesta (terapia genica dei tumori),
una classe molto interessante di vettori è rappresentata da ADV.
I vettori adenovirali hanno molte caratteristiche interessanti che li rendono
appropriati per il trasferimento genico:
Efficiente ingresso nel nucleo
infetta vari tipi cellulari di mammifero, proliferanti e non, con alta efficienza
consente transfezione transiente in quanto non si integra nel genoma ospite
Possibili alti livelli di espressione
Disponibili vettori specializzati
Dimensioni dell’inserto fino a 8 Kpb
Possono essere citotossici
Espressione transiente
Può indurre una risposta infiammatoria grave (alta risposta immunitaria)
Da alcuni trials è emersa preoccupazione per la sicurezza
SVANTAGGI
VANTAGGI
ADENOVIRUS - Biotecnologie
Terapia sperimentale
Adenovirus-p53.
del
glioma
umano
tramite
Terapia genica delle neoplasie gastriche mediante
Adenovirus-p53.
Soppressione tumorale per mezzo di Adenovirus-INF-.
Induzione di una risposta immunitaria anti-tumorale
attraverso Adenovirus- IL-12.
ADENOVIRUS - Biotecnologie
2004: messa in commercio della prima
terapia genica per i tumori: Gendicina.
Approvato dalla China' s State Food and
Drug Administration (Ente di autorizzazione
sanitaria equivalente a quello statunitense)
Virus ingegnerizzato per fare da vettore
alla copia sana del gene p53, uno dei più
importanti nel controllare all' interno della
cellula una possibile deriva cancerosa
(nel 50-70% dei tumori umani questo
frammento di Dna è mutato o inefficiente)
Conservato a 20° sotto zero
Si inietta una volta alla settimana
direttamente nell' area tumorale
Costo: 270 euro a fiala
PARVOVIRUS – Morfologia & Classificazione
Virus a DNA lineare a singola elica.
Presenti in molte specie animali (da insetti a primati).
Parvovirus infettanti l’uomo sono pochi e distribuiti nei generi: Erythrovirus, Dependevirus
e Bocavirus.
Virus clinicamente più importante è il Parvovirus B19 (prototipo del genere Erythrovirus)
Tra i più piccoli virus conosciuti: il Virus B19 ha un diametro di 22-24 nm
Parvovirus B19 è privo di involucro lipidico.
Ha una struttura compatta a simmetria
icosaedrica.
Capside è formato da 2 sole proteine (VP1
10% e VP2 90%)
Virione estremamente semplice dal punto di
vista Ag: esiste un solo sierotipo del virus.
Canine Parvovirus
Protein Type 2 Capsid
PARVOVIRUS – Morfologia: genoma
La regione codificante, di circa 4800 nucleotidi, comprende due geni non
sovrapposti. Il gene in posizione 5’ codifica per la proteina non strutturale NS1,
l’altro per le proteine strutturali del capside, VP1 e VP2.
La proteina NS1 è fosforilata e svolge funzioni catalitiche multiple (ATPasi, elicasi,
endonucleasi sito-specifica) e funzioni regolatorie, tra cui una pronunciata
citotossicità.
Si ipotizza l’esistenza di altre due
piccole proteine la cui funzione
è del tutto sconosciuta.
PARVOVIRUS - Replicazione
Penetra nella cellula tramite legame con uno specifico recettore di membrana e
successiva endocitosi.
Il recettore è un glicolipide (globoside o antigene P) espresso principalmente su
eritrociti maturi e cellule immature della linea eritroide, ma anche megacariociti,
cellule endoteliali, cellule della placenta, cellule del fegato e del miocardio fetale.
Replicazione dipende dallo stato di attivazione della cellula ospite: B19 dà
infezione produttiva soltanto in cellule in attiva moltiplicazione.
A differenza di adenovirus e poliomavirus, non è in grado di modificare lo stato
moltiplicativo cellulare.
Racchiuso in vescicole citoplasmatiche, il virione raggiunge il nucleo della cellula e
quindi libera il DNA genomico.
PARVOVIRUS - Replicazione
Nel nucleo la replicazione del DNA virale è piuttosto complessa e passa attraverso la
formazione di un intermedio di DNA bicatenario, sintetizzato da enzimi virali.
L’intermedio bicatenario subisce un taglio a una
estremità a opera della proteina virale NS1,
che determina un nuovo punto d’innesco per la
replicazione e la sintesi di un altro intermedio.
Gli mRNA sono trascritti da una RNA polimerasi cellulare
e trasportati nel citoplasma dove vengono tradotti
nelle varie proteine virali.
Stadi tardivi della replicazione: le proteine del capside
sono assemblate nel citoplasma a formare precursori
vuoti che, arrivati al nucleo, inglobano il DNA virale
e assumono la forma di particelle mature poi rilasciate per lisi.
PARVOVIRUS - Replicazione
Il R globoside è espresso principalmente su cellule eritroidi ma anche su altre cellule:
Cellule eritroidi: l’infezione è seguita dalla produzione di tutti i messaggeri virali e la
sintesi di tutte le relative proteine.
Altri tipi di cellule: produzione preferenziale dell’mRNA di NS1, il cui accumulo porta
a lisi citotossica della cellula senza produzione di progenie virale.
1 persona/200.000 circa è sprovvista
geneticamente del R ed è
naturalmente resistenti all’infezione.
The image shows an enlarged, infected, early erythroid progenitor cell.
The central clearing in the nucleus represents the viral inclusion.
Tulane University, New Orleans, [email protected]
PARVOVIRUS
Meccanismi patogenetici e manifestazioni cliniche
Non facilmente propagabile in vitro (replica a basso titolo, per poco tempo, solo in
colture di cellule eritroidi: colture primarie da midollo osseo, colture cellule
ematopoietiche da sangue cordonale o da fegato fetale, linee cellulari mieloblastoidi) o
in animali sperimentali: ciclo biologico di B19 è stato studiato su volontari umani.
Trasmissione: via naturale respiratoria, sangue e emoderivati, transplacentare,
trapianto.
A seguito dell’inoculazione intranasale, il virus si localizza nell’orofaringe e dopo una
settimana, compare nel sangue.
Sedi principali di replicazione del virus sono: negli adulti, il midollo osseo e nel feto, il
fegato (durante la vita fetale deputato all’eritropoiesi).
La fase viremica è breve e accompagnata da sintomatologia aspecifica simil-influenzale
e coincide con la perdita quasi totale dei precursori eritroidi.
Dopo 10-14 giorni dall’infezione, la viremia cessa con la comparsa della risposta Ab e
appaiono i sintomi classici della malattia esantematica.
Pazienti con infezione persistente da B19 non producono anticorpi neutralizzanti (in
particolare Ab anti-VP1) e mostrano un deficit della risposta cellulomediata, che
sembra quindi essere importante nel controllo dell’infezione.
PARVOVIRUS
Meccanismi patogenetici e manifestazioni cliniche
Infezione diffusa in tutto il mondo e mostra cicli epidemici di 3-4 anni
Maggiore incidenza nell’età scolare quando generalmente avviene la prima
infezione.
Circa 30-70% della popolazione adulta ha Ab anti Parvovirus B19; una volta
contratta, l’infezione conferisce un’immunità che generalmente dura tutta la vita.
Nel 70% dei soggetti infettati l’infezione è sintomatica e si manifesta con malattie
che sono dovute agli effetti diretti del virus sulla cellula ospite (crisi aplastica
transitoria) o alle conseguenze della successiva risposta immune dell’ospite
(eritema infettivo e artropatia).
Il 30% circa delle donne che contraggono un’infezione primaria in gravidanza
trasmettono B19 al nascituro e hanno un rischio del 5-9% di perdere il feto.
Tale rischio è maggiore nei primi 6 mesi gravidanza, quando il R di B19 è
espresso a più alti livelli sulle cellule della placenta.
PARVOVIRUS
Meccanismi patogenetici e manifestazioni cliniche
Ampio spettro di malattie associate al Parvovirus B19:
Terapia, Profilassi & Controllo
Non esiste terapia eziologica specifica; infezione da B19 generalmente non
richiede trattamento.
Nei casi di grave anemia si possono utilizzare Ig aspecifiche endovena a dosi
variabili, per vari giorni, in rapporto alla sintomatologia presentata dal paziente.
L’efficacia nelle infezioni persistenti con anemia è da tempo accertata in adulti e
bambini.
Nei casi più gravi (crisi aplastiche), sono necessarie trasfusioni di sangue, con
eventuale ossigenoterapia.
Per l’artropatia possono rendersi necessari antiflogistici, steroidei o no.
In casi gravi di idrope fetale sono state effettuate trasfusioni intrauterine oppure
infusioni di Ig alla madre, con benefici per il feto non ancora accertati.
Terapia, Profilassi & Controllo
Per specie animali (maiali, cani e gatti) in cui le infezioni da parvovirus possono
essere gravi, sono stati sviluppati validi vaccini utilizzando virus uccisi/vivi attenuati.
L’allestimento di un vaccino anti-B19 sarebbe giustificato non solo dalle crisi
aplastiche o anemie croniche che il virus causa nei soggetti predisposti, ma anche
dalle conseguenze dell’infezione in gravidanza sia immediate che tardive.
La prevenzione dell’infezione per i soggetti a rischio, come le gestanti, è
essenzialmente basata sull’adozione di misure igieniche (lavaggio mani, evitare
di dividere cibo e bevande).
In assenza di un efficiente sistema colturale in cui si possa far sviluppare il B19, si
utilizzano diversi sistemi di espressione per produrre capsidi virali ricombinanti.
A partire dal 2006, sperimentazione (studi di fase I e II) vaccino costituito da
capsidi virali vuoti, ottenuti da entrambe le proteine strutturali (VP1 e VP2): studio
terminato nel 2011 - National Institute of Allergy and Infectious Diseases (NIAID).
BOCAVIRUS – Morfologia & Classificazione
Famiglia Parvoviridae
Sottofamiglia Parvovirinae (Parvovirus infettanti i vertebrati)
Generi: Erythrovirus (Parvovirus B19), Dependevirus e Bocavirus.
Bocavirus Umano (BoV): nuovo membro della famiglia Parvoviridae, elevata
omologia di sequenza con 2 Bocavirus animali: il Canine minute virus e il Bovine
parvovirus.
Identificato nel 2005 in aspirati
nasofaringei di bambini con malattie
respiratorie acute.
Virus a DNA lineare a singola elica.
Capside a simmetria icosaedrica formato da
proteine VP1 e VP2
Privo di involucro lipidico.
Canine Parvovirus
Protein Type 2 Capsid
Bocavirus – Morfologia: genoma
La regione codificante comprende tre geni principali.
Due geni codificano per la proteina NS1 e per le proteine del capside,
VP1 e VP2.
Il terzo gene produce una proteina non strutturale, ad alto grado
omologia con NP1 dei bocavirus animali, a funzione sconosciuta.
Conosciuti almeno 4 genotipi, probabilmente dotati di differente tropismo
tissutale.
BOCAVIRUS
Meccanismi patogenetici e manifestazioni cliniche
Diffuso in tutto il mondo e altamente conservato (Australia, America, Asia ed Europa; campioni
hanno mostrato una elevata identità di sequenza).
Non sembra avere una prevalenza stagionale, distinguendosi così sia dai virus respiratori, che
hanno un picco in inverno, sia dal Parvovirus B19 che ha picchi incidenza in primavera-estate.
Infezione contratta per lo più nella prima infanzia: presenza di Ab in circa il 50% dei bambini
al di sotto dei 2 anni dimostra che il virus è ubiquitario e molto diffuso.
Studi hanno dimostrato che rappresenta un importante fattore eziologico per patologie del
tratto respiratorio superiore ed inferiore.
BoV è presente nelle secrezioni respiratorie del 2-19% dei bambini (IRR- Infezioni
Respiratorie Ricorrenti in pediatria) e del 1-6% adulti, con malattie acute delle vie aeree,
spesso in associazione ad altri patogeni
(RSV, ADV, HSV, Virus parainfluenzale,
Enterovirus) ma anche da solo.
BOCAVIRUS - Terapia, Profilassi & Controllo
Non esiste alcun trattamento, medico o antivirale, specifico anti-bocavirus.
Attualmente, gli unici trattamenti disponibili (per esempio, ossigeno, supporto
respiratorio, aspirazione delle secrezioni e idratazione) sono per il sollievo dei
sintomi (terapia di supporto).
Impiego degli immunomodulanti nelle IRR pediatriche sembrano ridurre numero,
durata e severità delle infezioni respiratorie (studi pubblicati su riviste nazionali,
sperimentazioni ancora in corso).
BOCAVIRUS - Terapia, Profilassi & Controllo
FARMACI
IMMUNOMODULANTI
BOCAVIRUS - Attualità
Lavoro coinvolge Ospedale tedesco e Università Finlandese.
Bambina di otto mesi con alterazioni respiratorie: infezione grave delle basse vie
respiratorie con pericolo di vita.
Nel lavoro si conferma il coinvolgimento del BoV nell’infezione: identificato con
tecniche molecolari di Real Time PCR e sequenziamento.
ADENOVIRUS – PARVOVIRUS - BOCAVIRUS
Prof. O.E. Varnier – Dott.ssa Martini Isabella
Università degli Studi di Genova
Corso di Laurea in Medicina e Chirurgia A.A. 2013-2014
Corso Integrato di Malattie Infettive e Microbiologia Clinica