www.slidetube.it
Ciclo mestruale
Ciclo mestruale: tempo che intercorre tra il primo giorno di sanguinamento uterino mestruale ed il primo
giorno del ciclo successivo, che in condizioni fisiologiche dura circa 28 giorni. È suddivisibile in due periodi:
Periodo follicolare: caratterizzato dalla crescita iniziale con successiva caduta del FSH ed aumento
progressivo dell’estradiolo. In questo periodo avvengono la crescita e la maturazione del follicolo ooforo
che si prepara ad ovulare.
Periodo ovulatorio: acme della secrezione di estradiolo a cui succedono il picco dell’LH e il picco più piccolo
del FSH.
Periodo luteinico: dominato dalla funzione del corpo luteo, che si forma dalla coalescenza dei residui del
follicolo dopo l’ovulazione e produce quantità via via crescenti di progesterone fino all’8°, 9° giorno
dell’ovulazione.
Modificazioni cicliche indotte dagli steroidi ovarici nell’apparato genitale
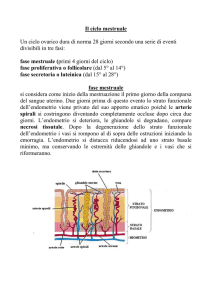
1. Endometrio
L’endometrio è un epitelio composto da diversi strati. Andando dall’interno verso l’esterno si ritrovano:
Strato basale; non ormono sensibile, sottile, rimane anche dopo lo sfaldamento mestruale e da qui riparte
la proliferazione dello strato funzionale.
Strato superficiale o funzionale; costituito dall’epitelio superficiale, dalle ghiandole e da un abbondante
tessuto stromale. Risente dello stimolo degli steroidi, per i quali contiene recettori specifici. È suddivisibile a
sua volta in uno strato compatto superficiale e in uno strato spugnoso profondo, contenente gli sfondati
ghiandolari.
Il ciclo endometriale attraversa quattro fasi:
Fase rigenerativa: nei primissimi giorni del ciclo, subito dopo la fase desquamativa del ciclo precedente.
Consiste nella iniziale ma incompleta ricostruzione dell’epitelio di superficie, e degli sfondati ghiandolari a
partire dallo strato basale. Fase ormono-indipendente.
Fase proliferativa: aumento progressivo dei recettori per gli estrogeni, indotti dagli estrogeni medesimi, con
acme verso la fine del periodo, vicino all’ovulazione. È a sua volta suddivisibile in:
Fase proliferativa iniziale (gg 4-7) le cellule ghiandolari proliferano assumendo una forma cubico-cilindrica.
Lo stroma è ancora rudimentale con poche arterie spirali. La riepitelizzazione è completa verso il 5° giorno.
Fase proliferativa intermedia (gg 8-12) cellule ghiandolari cilindriche pluristritificate. Stroma edematoso con
abbondanti arterie spirali
Fase proliferativa avanzata (gg 13-14) cellule epiteliali e ghiandolari cilindriche più alte, contenenti granuli
di glicogeno nel citoplasma. Ghiandole tortuose con calibro più ampio, che contengono nel loro lume
proteine e mucopolisaccaridi. Le arterie spirali, più abbondanti, raggiungono l’epitelio di superficie. Nelle
cellule aumentano i recettori per il progesterone.
www.slidetube.it
Fase secretiva: caratterizzata dall’azione del progesterone, per il quale si ha aumento progressivo dei
recettori. L’azione di questo steroide riduce i recettori per gli estrogeni. È suddivisibile a sua volta in 3 fasi:
Fase secretiva iniziale (gg 15-18) inizia due giorni dopo l’ovulazione. Scomparsa dell’aumento di volume e
tortuosità delle ghiandole, con acquisizione da parte delle cellule ghiandolari dei tipici vacuoli subnucleari.
Fase secretiva intermedia (gg 19-23); i lumi ghiandolari sono dilatati e ripieni di materiale eosinofilo; le
cellule divengono cubiche con i nuclei in posizione basale.
Fase secretiva terminale (gg 24-27); l’endometrio assume aspetto deciduale: le ghiandole sono festonate e
sempre più dilatate. Le arterie spirali sono differenziate completamente e circondate da cellule stromali
specializzate con citoplasma ampio e ricco di glicogeno. Le cellule epiteliali sono basse con nucleo in
posizione basale. Le cellule stromali si differenziano in cellule predeciduali con aspetto epitelio ide, forma
rotondeggiante e si fanno polinucleate.
Fase desquamativa; la caduta degli ormoni sessuali, e la conseguente assenza di estrogeni e progesterone
determina degenerazione dell’endotelio delle arterie spirali e fuoriuscita di sangue dal letto vascolare. Ci
sono alcune ipotesi circa i meccanismi responsabili della sequenza di eventi e la più accreditata vede come
primum movens la carenza di ormoni sessuali che determina regressione dell’endometrio; quest’ultima
determinerebbe a sua volta aumento della spiralizzazione delle arterie spirali con conseguente stasi
vascolare. Alla stasi seguirebbe la liberazione di PGF2, e quindi ulteriore vasocostrizione. Si crea dunque un
circolo vizioso tra regressione endometriale, stasi vascolare, e vasocostrizione, risultante nello sfaldamento
dell’endometrio, cui collabora la liberazione di enzimi lisosomiali da parte delle cellule della mucosa
uterina.
Nel corso del flusso mestruale si instaurano poi meccanismi volti a frenare l’intensità del flusso: formazione
di trombi di piastrine, vasocostrizione operata soprattutto dalla PGF2 e dal TX, a cui si oppongono fattori
vaso dilatanti come PGE2, e PCI (equilibrio a favore della vasocostrizione).
Il fluido mestruale normale non contiene coaguli, poichè oltre al sangue contiene anche il siero trasudato e
il secreto ghiandolare; la presenza di coaguli è patologica.
Il sovvertimento dei meccanismo di controllo o l’accentuazione dell’attività del sistema anticoagulante o la
carenza di estrogeni indispensabili per dare il via alla rigenerazione possono essere causa di eccesso di
sanguinamento.
Il controllo ormonale del ciclo endometriale è affidato soprattutto agli steroidi ovarici:
Estrogeni: dominano nella fase proliferativa, dove inducono la proliferazione delle cellule
Progesterone: provoca blocco dell’attività proliferativa e stimola invece l’atteggiamento secretivo,
avvalendosi di numerosi mediatori paracrini (progesteron dependent endometrial protein (PEP), insulin like
GF binding protein V (IGFBP-V), utero globulina, prolattina).
www.slidetube.it
Cervice Uterina
La mucosa endocervicale si modifica nel corso del ciclo mestruale.
Nel periodo follicolare le cellule delle cripte cervicali divengono alte, a palizzata, con citoplasma pieno di
muco; la produzione di muco, risulta più abbondante in corrispondenza del picco dell’estradiolo, intorno al
12-13 gg di ciclo. L’effetto degli estrogeni si esplica anche sulle fibrocellule muscolari della cervice, che di
distendono, con apertura dell’orifizio uterino esterno per facilitare la penetrazione degli spermatozoi.
Nel periodo luteinico il volume delle ghiandole si restringe, le cellule sono prive di muco; prevale l’effetto
del progesterone che induce solidificazione del muco e contrazione delle fibrocellule muscolari lisce con
ostacolo alla penetrazione degli spermatozoi.
2. Miometrio
Periodo follicolare: gli estrogeni aumentano la sintesi di miosina e la formazione di gap junctions fra le
cellule con conseguente aumento della capacità contrattile del medesimo.
Periodo luteinico: effetto contrario con diminuzione del tono muscolare del miometrio.
Periodo mestruale: risalita temporanea del tono del miometrio, con comparsa di attività contrattile
mediata dall’azione del PGF2; l’attività contrattile quando raggiunge livelli intensi è responsabile del dolore
mestruale dismenorrea.
3. Vagina
Periodo follicolare: intensa attività proliferativa a livello basale e parabasale, con aumento della coesione
fra le cellule per la sintesi di desmosomi. Le cellule degli strati intermedio e superficiale invece, aumentano
di volume, si riempiono di glicogeno e perdono coesione. Nel periodo pre-ovulatorio le cellule superficiali
cominciano a desquamarsi, mentre le cellule basali divengono piene di lipidi.
Periodo luteinico: il progesterone blocca la differenziazione delle cellule vaginali. Mentre prima si aveva un
progressivo passaggio stato profondo strato superficiale, con la maturazione delle cellule, in questo
periodo, con il blocco della differenziazione, le cellule più superficiali divengono le intermedie.
4. Salpingi
Periodo follicolare: gli estrogeni stimolano lo sviluppo dell’epitelio delle tube, che diviene alto e secretivo.
Le ciglia vibratili si allungano e cominciano a muoversi in modo sincrono. La muscolatura si contrae in senso
antiperistaltico e dalla periferia al centro.
Periodo luteinico: le cellule ritornano piatte riversando tutto il loro contenuto nel lume.
Periodo mestruale: cellule basse, ma contrazioni della muscolatura intense.
www.slidetube.it
Ormoni coinvolti nel controllo della funzione riproduttiva
La riproduzione è controllata dal sistema nervoso e dal sistema endocrino, con integrazione dunque degli
stimoli ambientali e dell’omeostasi interna all’individuo; la riproduzione può avvenire solamente quando il
soggetto si trova in condizioni di tranquillità fisica e psichica.
L’ipotalamo medio basale è la struttura che funge da trasduttore tra il segnale nervoso ed il segnale
endocrino, attraverso la sintesi di gonadotropin releasing hormone (GnRh), neuro-ormone deputato al
controllo della secrezione delle gonadotropine; il GnRh viene secreto in modo pulsatile ogni 60-90 minuti
da una unità relativamente ristretta di neuroni che prende il nome di GnRh pulse generator, ed è
influenzata dall’azione di diversi neuro-trasmettitori, provenienti dalla regione ipotalamica stessa, così
come da altre aree del SNC. Le strutture cerebrali che condizionano la secrezione di GnRh sono:
Sistema limbico: in particolare ippocampo con effetti stimolanti la sintesi di gonadotropine e amigdala con
effetti inibenti la sintesi di gonadotropine
Corteccia cerebrale: influenza la secrezione di GnRh in modo mediato dal sistema limbico
Tronco cerebrale: dalla sostanza reticolare del tronco cerebrale hanno partenza fasci noradrenergici e dal
rafe mesencefalico hanno partenza fasci serotoninergici; entrambi sono diretti all’ipotalamo e stimolano la
secrezione di GnRh.
Epifisi: i prodotti dell’epifisi ed in particolare la melatonina influenzano la funzione riproduttiva
modulandola sul ciclo luce-buio. La melatonina viene prodotta come stimolo di un arco riflesso scatenato
dall’oscurità ed ha azione anti-riproduttiva, con significato fisiologico soprattutto negli anni che precedono
la pubertà.
Numerosi sono i neurotrasmettitori ed i neuro modulatori in grado di influenzare la secrezione di GnRh:
Noradrenalina: i fasci noradrenergici provengono dal tronco encefalico ed possono agire su due tipi di
recettori presenti sulla membrana dei neuroni ipotalamici che producono GnRh: α1, con azione stimolante
la secrezione, α2, con azione inibitoria. In definitiva i neurotrasmettitori noradrenergici sembrerebbero
però determinare l’attivazione intermittente della secrezione di GnRh (secrezione pulsatile)
Dopamina: vi sono due principali fasci dopaminergici. Un fascio rostrale stimolante l’attività del GnRh pulse
generator ed un fascio periferico detto anche fascio tubero infundibolare dopaminergico (TIDA), che
sembrerebbe agire impedendo meccanicamente l’ingresso del GnRh nel circolo portale
Serotonina: origina nella sostanza grigia mesencefalica e pontina e si proietta in due aree distinte
probabilmente con funzione antitetica; prevale però la funzione di feedback positivo sulla secrezione di
GnRh.
Acido gamma-amminobutirrico (GABA): partecipa ai meccanismi di feedback negativo riducendo in modo
decisivo le concentrazione di LH
Neuropeptide Y: sintetizzato principalmente a livello ipotalamico, stimola la secrezione di GnRh e potenzia
la risposta dell’ipofisi al GnRh
www.slidetube.it
Melatonina: azione antiriproduttiva, soprattutto nei periodi di oscurità
Oppioidi endogeni: sono le endorfine, le encefaline e le dinorfine e sono così chiamati per la capacità di
legarsi ai medesimi recettori a cui si lega la morfina ed i derivati dell’oppio, con medesime risposte. In
termini di funzione riproduttiva sembra che essi rallentino l’attività del GnRh pulse generator.
Leptina: ormone proteico prodotto principalmente dal tessuto adiposo e sembra modulare positivamente
l’attività dei neuroni che producono GnRh sia direttamente, che indirettamente.
Il GnRh è un deca peptide i cui recettori sono presenti in numerosi tessuti, ma soprattutto a livello delle
cellule gonadotrope dell’ipofisi ; il complesso GnRh-recettore a livello ipofisario mette in azione diversi
secondi messaggeri:
Sistema del fosfatidil-inositolo con produzione di inositolo trifosfato (IP3) e diacilglicerolo (DAG): stimolano
la costituzione della riserva ipofisaria di LH e FSH e dunque aumentano la sintesi delle gonadotropine.
Sistema dell’acido arachidonico: con produzione in particolare di leucotrieni che inducono la sintesi delle
gonadotropine
Sistema calcio-calmodulina: aumento dell’ingresso del calcio extracellulare dentro la cellula con legame
dello stesso alla calmodulina. I complessi calcio-calmodulina inducono l’attivazione di una proteina-chinasi
che produce fosforilazione dell’actina. Questo sistema di secondi messaggeri sembra invece essere diretto
alla secrezione delle gonadotropine, provocando la contrazione delle fibre di actina e dunque l’esocitosi.
Il GnRh ha anche azione di stimolo dei suoi medesimi recettori self priming, con amplificazione della
risposta ormonale. Il GnRh viene secreto in modo pulsatile e questa modalità è fondamentale, poiché una
secrezione continua provocherebbe desensibilizzazione e down-regulation dei recettori ipofisari. La
secrezione pulsatile è differente nelle diverse fasi del ciclo mestruale e questo si può misurare con la
variazione dei livelli di LH:
Fase follicolare iniziale: secrezione di bassa frequenza (1:90 min) e bassa ampiezza.
Fase follicolare intermedia: aumento della frequenza (1:60 min)e riduzione dell’ampiezza.
Fase follicolare tardiva: frequenza sempre 1:60 min ma aumento dell’ampiezza.
Fase luteinica iniziale: rallentamento della frequenza per l’aumento dei livelli di progesterone; ampiezza
che assume andamento bimodale intercalando secrezioni ampie e non in rapporto 1:1.
Fase luteinica intermedia: stesse caratteristiche ma accentuate; ulteriore riduzione della frequenza e
ampiezza sempre più bimodale, in rapporto alla secrezione pulsatile del progesterone i cui picchi
corrispondono alle secrezioni di minor ampiezza e dunque danno l’impressione di essere indotti dalle
pulsazioni di maggiore ampiezza.
Fase luteinica tardiva: frequenza sempre più bassa (2:24 ore); dopo la dissoluzione del corpo luteo entro
24h si ha ritorno al pattern follicolare iniziale.
L’FSH ha comportamento analogo a quello dell’LH, ma le fluttuazioni di ampiezza sono minori.
www.slidetube.it
Ormoni ipofisari
Gonadotropine: le gonadotropine sono l’ormone luteinizzante LH e l’ormone follicolo-stimolante (FSH),
entrambe di origine ipofisaria, e la gonadotropina corionica umana HCG, di origine placentare. Sono
glicoproteine composte di due sub unità: la sub unità α è comune a tutte e tre, mentre la sub unità β è
ormono-specifica. La produzione delle gonadotropine consta di 2 fasi: la costruzione della catena peptidica
(le catene α vengono sintetizzate in quantità molto maggiori delle catene β, la cui sintesi è dunque la tappa
limitante) e l’aggiunta dei residui oligo-saccaridici. Le gonadotropine vengono secrete secondo un pattern
pulsatile circadiano, con pulsazioni dell’LH caratteristicamente più ampie di quelle del FSH, ma spesso
sincrone con queste. La frequenza e l’ampiezza delle secrezioni dell’LH cambiano con la fase del ciclo, come
già descritto (frequenza >> in fase follicolare vs luteinica), mentre l’ampiezza è in genere inversamente
proporzionale alla frequenza. Le gonadotropine sono dosabili nel sangue con metodi radioimmunologici,
immunoradiometrici, immunofluorimetrico e infine con metodo biologico, che utilizza cellule bersaglio in
vitro e da un indice anche dell’attività dell’ormone medesimo. Le concentrazioni plasmatiche così misurate
variano notevolmente nel corso della vita. Nella vita fetale i livelli di FSH e LH sono molto elevati, con apice
verso la ventesima settimana (5° mese); alla nascita l’HCG diviene rapidamente indosabile, mentre LH ed
FSH si elevano sia pure transitoriamente per poi ridiscendere (LH il 4° mese, FSH il 4° anno di vita) e
rimanere molto basse durante tutta l’età infantile. Alla pubertà l’attività secernente delle cellule
gonadotrope riprende, e nella vita riproduttiva si ha caratteristica oscillazione dei livelli delle gonadotropine
con picco pre-ovulatorio. In menopausa aumentano notevolmente, con aumento maggiore di FSH vs LH. Le
gonadotropine agiscono legandosi ai loro specifici recettori ed attivando la via dell’AMPciclico o del calciocalmodulina (quest’ultima in causa soprattutto nella steroidogenesi).
Prolattina: la prolattina è prodotta principalmente a livello di due sedi; ipofisi, dove viene prodotta dalle
cellule lattotrope soprattutto in corso di gravidanza ed allattamento, e decidua, dove viene prodotta sia nel
ciclo mestruale normale che nella gravidanza. Il rilascio di PRL dall’endometrio umano inizia al 22° giorno
del ciclo e se si instaura una gravidanza aumenta nel corso della ventesima settimana per poi diminuire
nella seconda metà della gestazione; la secrezione sembra indotta prevalentemente dal progesterone. Il
significato biologico della PRL sembra legato al mantenimento del corpo luteo, con modulazione della
risposta immunitaria deciduale all’impianto dell’uovo. La produzione di PRL presenta diverse periodicità:
presenta un ritmo pulsatile, sincrono a quello dell’LH, presenta un ritmo circadiano con livelli minimi al
mattino e a mezzogiorno e picco nelle ore notturne, presenta un ritmo circatrigintano, con livelli in fase
luteinica maggiore vs fase follicolare. La secrezione di PRL è infine influenzata dall’ambiente esterno con
aumento in seguito all’assunzione di un pasto, all’espletamento di un rapporto sessuale, all’esercizio fisico,
allo stress. La secrezione di PRL è aumentata anche in alcune situazioni patologiche: oltre ai tumori ipofisari
prolattina-secernenti, bisogna ricordare alcuni casi di sindrome dell’ovaio policistico, di iperandrogenismo,
la cirrosi epatica, l’IRC. Il ruolo del PRL si esplica soprattutto a livello di ovaio e mammella.
Ovaio: importante fattore di controllo della steroidogenesi soprattutto durante il periodo luteinico, dove
esercita effetto luteotropo mantenendo l’espressione dei recettori per LH sulle cellule luteiniche.
L’iperprolattinemia però paradossalmente esercita azione deleteria sulla funzione ovarica e sulla
steroidogenesi: inizialmente blocca la sintesi di progesterone, con conseguente ipoluteismo; quindi in
concentrazioni maggiori interferisce con lo stimolo dell’FSH sulle cellule della granulosa ed in particolare
inibisce la steroidogenesi prevenendo l’ovulazione; infine porta all’amenorrea. L’iperprolattinemia esercita
anche effetti sull’asse ipotalamo-ipofisario, attraverso attivazione del sistema dopaminergico che inibisce
l’ingresso in circolo del GnRh.
www.slidetube.it
Mammella: in gravidanza i livelli di PRL aumentano notevolmente; dopo il parto la caduta degli ormoni
sessuali scatena la montata lattea. Fino a 2-3 mesi dopo il parto i livelli di PRL rimangono più elevati
innalzandosi 15-30 minuti dopo la suzione. Dal 3-4° mese i livelli dell’ormone si abbassano e la suzione non
li modifica.
Neurosteroidi: steroidi sintetizzati nel SNC a partire dal colesterolo, la cui azione è di modulazione
dell’attività dei neuroni.
Ormoni ovarici
Nella donna la principale cellula endocrina deputata alla sintesi di steroidi sessuali è l’ovaio, che utilizza per
questo scopo le cellule della granulosa, della teca interna e le cellule interstiziali. Dall’ovaio vengono
sintetizzati estrogeni, androgeni e progestinici che condividono la struttura comune dell’anello ciclo
pentano-peridro-fenantrene e si differenziano principalmente per il numero di atomi di carbonio presenti
nella struttura. Il substrato principale per la sintesi di tutti gli steroidi sessuali è il colesterolo plasmatico,
veicolato principalmente dalle LDL; il colesterolo viene convertito dalle cellule ovariche in pregnenolone, il
primo steroide sessuale, il quale può seguire due distinte vie dando luogo a testosterone ed
androstenedione. Questi due prodotti finali possono essere convertiti in estrogeni attraverso il processo
dell’aromatizzazione.
La sintesi degli steroidi sessuali può essere attuata anche in sedi extra-ghiandolari, come avviene nel
periodo post-menopausale. I tessuti più coinvolti sono: tessuto adiposo (conversione precursori in
estrogeni), cute, SNC, fegato (produzione ed inattivazione degli estrogeni).
Essendo ormoni liposolubili tutti gli steroidi sessuali possono penetrare nelle cellule bersaglio tramite
diffusione passiva e dunque migrare dentro il nucleo dove agiscono legandosi a recettori nucleari, e
trasformando questi ultimi in modo tale da favorire il legame del complesso ormone-recettore con
elementi di risposta a livello del DNA, influenzando l’espressione di determinati geni. Per quanto riguarda
gli estrogeni, esistono due tipi di recettori per gli estrogeni; recettori α presenti soprattutto a livello di
utero, ipofisi, mammella e recettori β presenti nell’ovaio, nel polmone, nella vescica e nell’osso. La scoperta
di questa espressione differenziata da parte dei diversi tessuti ha provocato la nascita dei “SERM” (selective
esctrogen receptor modulators), farmaci attualmente utilizzati nella prevenzione dell’osteoporosi. Per
quanto riguarda i recettori per il progesterone essi sono formati da due subunità la cui dissociazione
costituisce un passaggio fondamentale nella trasduzione del segnale progestinico.
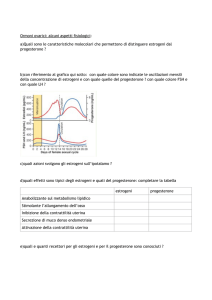
Estrogeni: gli estrogeni sono a loro volta suddivisibili in estradiolo, estrone ed estriolo. L’estradiolo è il
principale estrogeno sintetizzato dall’ovaio; le cellule tecali sono responsabili della sintesi dei precursori
androgenici ed agiscono in associazione alle cellule della granulosa che sono invece responsabili
dell’aromatizzazione. Questo ormone raggiunge un picco in fase pre-ovulatoria, mentre i livelli più bassi si
hanno in fase follicolare precoce. Gli effetti dell’estradiolo sulle cellule bersaglio sono metabolici e
proliferativi. L’estrone invece è il principale estrogeno prodotto durante la menopausa, proprio perché la
sua sintesi può avvenire anche in sede extra ghiandolare. L’estriolo infine, oltre ad essere l’estrogeno
presente in maggiore quantità nelle urine (può essere prodotto per metabolismo degli altri estrogeni) è
l’estrogeno maggiormente prodotto in gravidanza, attraverso una via biosintetica specifica che inizia nel
surrene fetale, con produzione dei precursori androgenici, per concludere con aromatizzazione nel fegato
fetale medesimo. L’attività biologica dell’estriolo è limitata dalla breve durata del legame estriolorecettore.
www.slidetube.it
Tutti gli estrogeni sono catabolizzati ed inattivati nel fegato tramite glucuronazione
Progesterone: è secreto da ovaio e corteccia surrenale durante tutto il ciclo, ma la sua concentrazione
plasmatica rimane bassa fino al momento dell’ovulazione; poco prima dell’ovulazione si verifica infatti
aumento del progesterone, che risulta essere necessario per il picco dell’LH e dunque per l’ovulazione
medesima. Successivamente nel periodo luteinico la produzione dell’ormone aumenta, e le cellule della
granulosa si luteinizzano, cioè si trasformano in elementi deputati alla produzione di progesterone.
Androgeni: il testosterone è il principale ormone androgeno, prodotto nelle donne principalmente per
conversione dell’androstenediolo nei tessuti periferici (50%), quindi da ovaio (25%) e surrene (25%). Il
testosterone per essere attivo necessita di essere trasformato in di-idrotestosterone, presente in quantità
molto ridotta nel plasma in quanto prodotto direttamente negli organi bersaglio. Il testosterone può essere
dosato sia come ormone libero, sia come ormone totale, poiché esso è legato per l’80% alla sex hormone
binding proteine e per il 19% all’albumina. Dunque solo l’1% è disponibile per entrare nelle cellule bersaglio
svolgendo l’attività androgenica.
L’androstenedione è invece prodotto in uguale misura dal compartimento ovarico e da quello surrenalico,
con rapporto variabile a seconda della fase del ciclo. Dopo la menopausa la produzione diminuisce; l’ovaio
della donna in menopausa produce principalmente testosterone.
Infine il deidro-epi-androsterone (DEA) è lo steroide più rappresentato nel plasma umano, ed è prodotto
principalmente da surrene; riveste importanza nelle forme di pseudoermafroditismo femminile e di pseudo
pubertà precoce, dovute ad iperplasia surrenale. Il metabolita principale del DEA compete con l’estradiolo
per i recettori estrogenici, e provoca su di essi effetti estrogeno-specifici.
Controllo endocrino della secrezione delle gonadotropine
I meccanismi di controllo sono piuttosto complessi e basati su una serie di feedback, con finalità bloccanti o
di potenziamento della secrezione delle gonadotropine.
Il feedback ultracorto rappresenta il meccanismo di autocontrollo del GnRh e si basa sull’esistenza di
connessioni multiple tra i vari neuroni che producono GnRh. Molecole analoghe al GnRh con attività
potenziata provocano riduzione della frequenza di scarica dei neuroni producesti GnRh, fino
all’azzeramento della sua produzione
Il feedback corto è quello esercitato dagli ormoni ipofisari che sembra possano inibire la produzione
ipofisaria stessa e la produzione ipotalamica di GnRh.
Vi sono infine diversi meccanismi di feedback lunghi cioè di feedback mediati da estradiolo e progesterone,
i due principali ormoni di produzione ovarica;
Feedback negativo degli estrogeni: l’estradiolo ha meccanismo di feedback negativo sia a livello ipofisario
che ipotalamico; durante la fase follicolare l’aumento progressivo dei livelli di estrogeni si accompagna alla
riduzione dell’ampiezza della produzione delle gonadotropine, ma la frequenza di scarica delle stesse resta
invariata, aumentando addirittura nel periodo pre-ovulatorio; questo suggerisce che nella prima fase del
ciclo gli estrogeni non agiscano direttamente al livello del GnRh pulse generator quanto piuttosto blocchino
la secrezione ipofisaria.
www.slidetube.it
Feedback positivo degli estrogeni: l’aumento della secrezione di estradiolo nel periodo follicolare giunge
fino alla produzione di un picco: quando questo mantiene valori superiori a 150-200pg/ml per almeno 36
ore, si inverte la tendenza inibente dello steroide l’estradiolo stimola la secrezione pre-ovulatoria di FSH
e LH, con conseguente ovulazione
Feedback negativo del progesterone: nel periodo luteinico, quando il progesterone raggiunge
concentrazioni plasmatiche di rilievo, esso inibisce la secrezione di LH attraverso l’azione sull’ipofisi e
inibisce il GnRh pulse generator ipotalamico con riduzione della frequenza di scarica delle gonadotropine.
Feedback positivo del progesterone: nella donna le cellule della granulosa luteinizzate iniziano a produrre
progesterone circa 24 ore prima il picco dell’LH; il meccanismo d’azione del progesterone è di tipo ipofisario
determinando aumento dell’ampiezza delle pulsazioni delle gonadotropine, ma non modificazione della
frequenza. Quindi il progesterone ha effetti duplici sulla funzione riproduttiva: piccole quantità di
progesterone per un periodo limitato di tempo (fase pre-ovulatoria) hanno azione a feedback positivo,
potenziando il feedback positivo degli estrogeni, mentre la secrezione costante della fase luteinica
comporta feedback negativo, con crollo della produzione di LH e regime pulsatile a bassa frequenza.
Il picco dell’LH pre-ovulatorio dipende da numerosi fattori: abbiamo già visto l’azione di feedback positivo
di estradiolo e di progesterone, che inducono la liberazione di gonadotropine che si sono precedentemente
accumulate per l’azione a feedback negativo dei medesimi steroidi ovarici. Altrettanto importante è il GnRh
che esercita azione triplice sulle gonadotropine: stimola la sintesi delle gonadotropine, ne induce la
secrezione con meccanismo calcio-dipendente e aumenta la responsività dell’ipofisi nei confronti di sé
stessa (self priming) con azione sinergica con quella degli steroidi gonadici. Stimolata dall’estradiolo, dal
progesterone e dal GnRh, l’ipofisi secerne le gonadotropine, rispettando la pulsatilità, ma in concentrazione
decisamente aumentate, soprattutto per quanto riguarda l’LH, per il quale si viene a creare un vero e
proprio picco. Il raggiungimento di questo picco è fondamentale permettendo l’ovulazione, la fertilizzazione
e anche per la maturazione ovocitaria e la gravidanza.
Una delle problematiche più interessanti è quella della differenza di comportamento tra LH e FHS, pur
provenendo dalle medesime cellule ipofisarie ed essendo controllate dai medesimi fattori. Il rapporto
FSH/LH è vicino all’unità nel periodo follicolare, si abbassa in fase pre-ovulatoria e rimane basso nel periodo
luteinico. I livelli di LH sono molto alti nell’ovaio policistico, mentre al contrario il rapporto FSH/LH risulta
alto, prima e durante la pubertà, nel post-partum, nel post-menopausa. Il principale responsabile della
differenza di comportamento tra le due gonadotropine è l’inibina, proteina glicosilata formata da una
catena α e da una catena β: a sua volta esistono due forme della catena β, che concorrono a costituire due
diverse strutture di inbine, l’inibina A e l’inibina B. L’inibina è prodotta dalle cellule della granulosa
dell’ovaio e la sua produzione è stimolata dall’FSH nel periodo follicolare; nel periodo luteinico è prodotta
dalle cellule della granulosa luteinizzate e la sua produzione è stimolata dall’LH. L’azione dell’inibina
consiste principalmente nel blocco selettivo della secrezione di FSH, che si opera attraverso il legame
dell’inibina a recettori sulle cellule gonadotrope. Agisce anche sull’ovaio in modo paracrino inibendo la
produzione di estrogeni a favore degli androgeni.
www.slidetube.it
Secrezione delle gonadotropine dalla vita fetale alla pubertà
Il patrimonio ovocitico della donna è predeterminato durante la vita fetale e tende a ridursi nell’arco della
vita riproduttiva della donna, per esaurirsi dunque in menopausa.
Ovaio durante la vita fetale
Intorno alla 5° settimana di gestazione si ha già lo sviluppo delle gonadi indifferenziate, compoata da cellule
germinali primordiali frammiste a cellule celomatiche: le cellule germinali costituiscono i precursori degli
ovociti, mentre le cellule epiteliali celomatiche daranno origine alle cellule della granulosa, e le cellule
mesenchimali allo stroma ovarico. A 6-8 settimane di vita intrauterina ha inizio la moltiplicazione per mitosi
delle cellule germinali ( a questo stadio oogoni), con raggiungimento alla 18° settimana di circa 7 milioni di
cellule: da questo momento la gonade andrà incontro a una deplezione di oogoni fino all’esaurimento
completo del pool di oociti post-menopausale. Intorno alla 12° settimana una parte degli oogoni formatasi
comincia il processo di differenziazione in ovociti primari attraverso l’inizio della prima divisione meiotica,
in particolare della profase: al termine della stessa queste cellule entrano in fase di quiescenza dove
rimarranno per lungo tempo.
Sempre verso il quinto mese di vita fetale si verificano delle modificazioni a carico degli oogoni e delle
strutture adiacenti; la corticale della gonade fetale viene invasa da vasi provenienti dalla zona midollare e
viene suddivisa in segmenti sempre più piccoli fino ad assumere un aspetto cordoni forme (cordoni sessuali
secondari). Intorno ai vasi sanguigni vi sono cellule periva scolari di origine epiteliale e mesenchimale:
queste cellule si dispongono a circondare gli oociti primari, in singolo strato, venendo a formare quello che
è chiamato follicolo primordiale. Le cellule di rivestimento sono dette cellule follicolari epiteliali e si
andranno trasformando successivamente in cellule della granulosa. Il mesenchima residuo si dispone
invece tra i follicoli dando luogo allo stroma ovarico primitivo. Gli ovociti non incorporati nei follicoli
andranno incontro a degenerazione prima della nascita.
Durante la vita fetale non si ha mai la completa maturazione dei follicoli, che sarà invece espressa
dall’ovulazione; infatti la sintesi di estrogeni durante la vita fetale è praticamente assente e l’ovaio fetlae
sviluppa recettori per le gonadotropine solo nella seconda metà della gravidanza, cioè nella fase in cui si ha
lo sviluppo dei follicoli. Anche nell’ultima parte della vita fetale, nonostante il circolo ipotalamo-ipofisario
potrebbe entrare in azione, l’azione prevalente rimane bloccante, in modo mediato dal sistema nervoso
centrale, che blocca direttamente la secrezione di GnRh.
Ovaio alla nascita
Alla nascita il contenuto di ovociti è già sceso a quota circa 1 milione come risultato della deplezione di
cellule germinali verificatasi nelle ultime 20 settimane di gravidanza. La scomparsa della secrezione da
parte della placenta di estrogeni determina aumento dei livelli di FSH le cui concentrazioni divengono
maggiori di quelle rilevabili in un ciclo ovarico in età adulta e simili a quelle puberali; il rialzo di FSH si
associa a quello dell’estradiolo, mentre l’LH è presente in quantità minori. A queste variazioni delle
concentrazioni delle gonadotropine si accompagnano bassi livelli di inibina, come nella fase follicolare del
ciclo mestruale. Dopo l’incremento post-natale della loro concentrazione i livelli di gonadotropine ritornano
a valori minimi, mostrando ancora un lieve aumento tra i 5 e i 10 anni
www.slidetube.it
Ovaio durante l’infanzia
Bassi livelli ematici di gonadotropine per controllo da parte del SNC della secrezione di GnRh. L’ovaio non è
però del tutto quiescente; mentre numerosi follicoli vanno incontro ad atresia, con aumento del volume
stromale e del peso dell’ovaio, una parte dei follicoli può cominciare a maturare raggiungendo addirittura
lo stadio di follicolo antrale, senza mai raggiungere la piena maturazione perché evidentemente manca il
supporto ormonale gonadotropinico.
Pubertà e vita adulta
L’età dello sviluppo puberale è variabile; la pubertà è preceduta dall’adrenarca che è l’avvio della
produzione di androgeni da parte del surrene, di solito intorno agli 8 anni, ed è preceduta da un avvio della
secrezione pulsatile del GnRh, con rilascio ipofisario di LH. Successivamente si ha aumento della risposta
ipofisaria al GnRh con raggiungimento di valori di gonadotropine molto elevato (gonadarca). La
maturazione della capacità riproduttiva si acquisisce solo dopo i primi cicli mestruali, in conseguenza della
capacità di ipofisi ed ipotalamo di rispondere al feedback positivo degli estrogeni.
All’inizio del periodo puberale le cellule germinali sono circa 500.000, all’interno dei follicoli primordiali; nei
successivi 30-40 anni di vita circa 4-500 oociti vengono selezionati ad ogni ciclo mestruale per arrivare
all’ovulazione. Per ogni follicolo che matura circa 1000 vanno incontro a crescita abortiva e atresia per
apoptosi. Nei 10-15 anni che precedono la menopausa si assiste ad un’accelerazione della perdita di
follicoli, correlata ad aumento della sintesi di FSH e riduzione dell’inibina B; l’aumento dell’FHS induce
infatti reclutamento più precoce e crescita follicolare più rapida.
Crescita e maturazione follicolare
Nella donna adulta ad ogni ciclo mestruale viene reclutata una coorte di follicoli candidati all’ovulazione:,
composta da un certo numero di follicoli primordiali quiescenti reclutato in modo continuo (reclutamento
iniziale, che si verifica subito dopo la formazione dei follicoli primordiali, molto prima della pubertà)e un
ulteriore gruppo di follicoli antrali, reclutato al momento dell’incremento del FSH (reclutamento ciclico;
comincia solo dopo la pubertà). Gli oociti contenuti nei follicoli selezionati continuano a maturare e sono
pronti a riattivare la meiosi.
Il reclutamento follicolare è denunciato in primis dall’aumento di volume dell’oocita e dalla proliferazione
delle cellule della granulosa intorno allo stesso; in risposta all’FSH si formano dunque gap-junctions tra le
cellule della granulosa e l’oocita per permettere interscambi di sostanze nutritive. I follicoli che
intraprendono questo processo maturativo divengono follicoli primari. Lo strato della granulosa è separato
dallo stroma da una membrana basale, non vascolarizzata; le cellule stromali intorno si dispongono in strati
concentrici a formare la teca interna ed esterna.
L’innalzamento dell’FSH nel corso della fase follicolare promuove l’ulteriore maturazione di alcuni follicoli
che passano allo stadio preantrale, con aumento ulteriore delle dimensioni dell’oocita, che viene
circondato da una lamina di materiale extracellulare, detta zona pellicida. Le cellule della granulosa
continuano a proliferare e le teche si organizzano ulteriormente. Tale crescita dipende dalle gonadotropine:
LH che stimola le cellule della teca interna a secernere gli androgeni, convertiti in estrogeni dalle cellule
della granulosa, stimolate dall’FSH; estrogeni e FSH mediano l’aumento dei recettori per l’FSH sulle cellule
della granulosa.
www.slidetube.it
Sempre per azione di estrogeni e FSH si verifica il progressivo accumulo di liquido trasudato dai vasi
sanguigni della teca, intorno all’oocita con formazione progressiva di un antro, una cavità. Le cellule della
granulosa ora sono divisibili in due tipi: cellule del cumulo che inglobano l’oocita e cellule murali che
formano la parete interna del follicolo. Nei follicoli antrali i recettori per l’LH sono solo sulle cellule tecali,
mentre i recettori per l’FSH solo sulle cellule della granulosa; come già detto l’LH induce nelle cellule tecali,
la secrezione di androgeni trasformati in estrogeni dalle cellule della granulosa stimolate dal FSH. Solo i
follicoli le cui cellule granulose presentano un numero adeguato di recettori per l’FSH potranno produrre
quantità sufficienti di estrogeni, altrimenti andranno incontro ad atresia.
La selezione del follicolo dominante si compie durante il 5-7° giorno del ciclo, quindi i livelli plasmatici di
estradiolo cominciano ad aumentare in modo significativo da questo momento, rispondendo allo stimolo
dell’FSH. D’altro canto gli estrogeni esercitano feedback negativo sull’ipofisi con soppressione del rilascio di
FSH. In questo modo solo il follicolo che esprime maggiore quantità di recettori per l’FSH sopravviverà,
poiché estrogeni e FSH aumentano la concentrazione di recettori per L’FSH sul follicolo medesimo, con
potenziamento dell’accrescimento, e allo stesso tempo gli estrogeni diminuiscono la secrezione globale di
FSH privando il supporto dell’ormone dagli altri follicoli. Il follicolo dominante deve esprimere un numero di
recettori tale da essere sensibile anche alle concentrazioni più basse di FSH.
A questo punto, selezionati pochi follicoli antrali, sotto lo stimolo dell’FSH si verifica espressione dei
recettori per l’LH sulle cellule murali della granulosa; i livelli di FSH cominciano a diminuire, ma il rialzo in
fase follicolare intermedia dell’estradiolo esercita azione a feedback + sulla secrezione di LH, i cui valori
aumentano nella fase follicolare tardiva.
Se la stimolazione gonadotropinica è adeguata un solo follicolo prosegue la sua maturazione verso
l’ovulazione. Le cellule della granulosa aumentano di volume ed acquisiscono granuli lipidici; nella teca si
formano vacuoli ed aumenta la vascolarizzazione. Il picco della secrezione di estrogeni è raggiunto 24 ore
prima dell’ovulazione ed innesca il picco di LH, dopo circa 10 ore. Nel fornire lo stimolo ovulatorio al
follicolo selezionato, l’innalzamento dell’LH segna il destino dei follicoli senza quantità adeguate di FSH ed
estrogeni, aumentandone ulteriormente il contenuto androginico. L’LH inoltre promuove la luteinizzazione
delle cellule della granulosa, dove dunque inizia la sintesi del progesterone, che a concentrazioni così basse
facilità il meccanismo di feedback positivo sulla secrezione di LH. I follicolo che sono andati incontro ad
atresia vanno a formare tessuto stromale, che conserva però la capacità di risposta all’LH con produzione di
androgeni: ne consegue un aumento dei livelli di androgeni, che oltre a portare all’atresia tutti i follicoli
tranne il dominante, aumenta la libido nel momento più propizio per la fecondazione.
Dopo 36 ore dal picco di LH si verifica la rottura del follicolo ovulatorio, con espulsione dell’oocita: si ha
rottura della membrana basale e i capillari penetrano nella granulosa fino al centro del follicolo che si
riempie di sangue (sotto l’influenza di fattori angiogenetici sotto il controllo dell’LH). L’innalzamento dell’LH
determina la ripresa della meiosi dell’oocita che però non si completerà fino alla fertilizzazione da parte
dello spermatozoo.
www.slidetube.it
Prima della rottura del follicolo e della liberazione dell’uovo le cellule della granulosa hanno incominciato
ad accumulare nel citoplasma un pigmento giallo, la luteina; subito dopo l’espulsione del follicolo anche le
cellule luteiniche della teca, si differenziano dalla teca e dallo stroma prendendo parte al corpo luteo.
La normale funzione luteale necessita dunque di una sviluppo pre-ovulatorio follicolare ottimale, con
adeguata stimolazione da parte dell’FSH, che assicura anche un numero sufficiente di recettori per l’LH. E
con produzione tonica di piccole quantità di LH. L’LH provoca innalzamento dei livelli di progesterone,
prodotto dal corpo luteo, che agisce sia a livello centrale che locale per sopprimere nuovi accrescimenti
follicolari. In quest’azione il progesterone agisce in sinergia con i bassi livelli di gonadotropine circolanti,
dovuti a feedback – esercitato dal progesterone medesimo, dagli estrogeni, dall’inibina A.
Il corpo luteo deteriora rapidamente dopo 9-11 giorni dall’ovulazione, in modo sincrono al decadimento
della sintesi del progesterone a meno che non si sia verificata fertilizzazione dell’oocita (in tal caso il
progesterone è sostituito dall’HCG).
Alla degenerazione del corpo luteo si accompagna dunque il crollo dei livelli di estrogeni, di progesterone e
di inibina A; la caduta di quest’ultima in particolare e degli estrogeni rimuove l’effetto inibitore sulla sintesi
di FSH, ed il calo del progesterone permette l’aumento della secrezione pulsatile del GnRh.
Ne risulta un aumento maggiore dell’FSH rispetto all’LH, cruciale per permettere la selezione di una serie di
follicoli salvati dall’atresia. Il nuovo ciclo mestruale ha inizio.