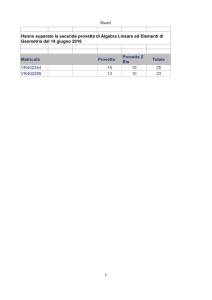
LABORATORIO DI FISICA PER SCIENZE BIOLOGICHE
Esperienza n. 4
Assorbimento della luce: legge di Lambert-Beer
Introduzione
La fotochimica è la scienza che studia gli effetti chimici della luce. In questo caso con il termine
luce s'intende la radiazione elettromagnetica che ha lunghezze d'onda comprese tra 100 e 1000 nm.
S'include pertanto, con la radiazione visibile, l'ultravioletta e l'infrarossa. I quanti di energia (hν)
sono compresi tra 10 e 1 eV*. Queste energie sono comparabili con quelle dei legami chimici.
A queste lunghezze d'onda il quanto di energia non ha quasi mai abbastanza energia da attivare più
di una molecola per volta.
La materia può trasmettere, diffondere o assorbire la luce.
La legge dell'assorbimento è chiamata legge di Lambert e si esprime come:
I = I 0 e − ax
dove I è l'intensità della luce trasmessa I0 è l'intensità della luce incidente a è il coefficiente di
assorbimento o coefficiente di estinzione e x è lo spessore di materia attraversata. Il coefficiente di
estinzione dipende dalla sostanza e dalla lunghezza d'onda.
Se la sostanza attraversata dalla luce è una soluzione il cui solvente è trasparente, cioè non assorbe
luce, a è proporzionale alla concentrazione del soluto e la legge dell'assorbimento prende il nome di
legge di Lambert-Beer e si scrive:
I = I 0 e − εCx
dove ε è il coefficiente di estinzione molare dipendente dal soluto e dalla lunghezza d'onda. Tale
legge è ancora valida nel caso in cui il solvente non sia trasparente. In tal caso però, I0 è la luce
trasmessa dal solo solvente.
Scopo dell'esperienza
Lo scopo dell'esperienza è mostrare la proporzionalità tra l'assorbanza, definita come:
I
A = − ln
I0
e la concentrazione della sostanza assorbente.
Materiali e metodi
Si hanno a disposizione un laser all'elio-neon che emette luce rossa (λ = 633 nm), un filtro
attenuatore, un fotodiodo che fornisce una differenza di potenziale proporzionale all'intensità della
luce incidente su di esso, un multimetro, una provetta, un tubo graduato, una siringa graduata e una
soluzione concentrata di blu di metilene.
Si metta nella provetta una q uantità nota di acqua (2 ml), misurandola con il tubo graduato.
si posizioni la provetta tra il filtro attenuatore e il fotodiodo collegato al multimetro, in modo da
avere il maggior segnale possibile. Aggiungere quantità note della soluzione concentrata di blu di
metilene e misurare la differenza di potenziale dopo aver mescolato con cura, senza far muovere la
provetta. Fare il grafico dell'assorbanza in funzione della concentrazione di blu di metilene e
verificarne la proporzionalità.
Avvertenze
E' possibile che la seconda cifra riportata dal multimetro fluttui, perciò fate più misure (almeno 10)
e riportate il valore medio con l'opportuna incertezza. Attenzione a non modificare l'illuminazione
di fondo durante la misura e a non spostare la provetta. Se la provetta si dovesse spostare
accidentalmente, rimettetela nella posizione per cui il segnale è massimo. L'intensità della luce
trasmessa dipende esponenzialmente dalla concentrazione, per questo, ad alte concentrazioni ci
vogliono incrementi di concentrazione più grandi per avere le stesse variazioni di intensità. E'
consigliabile aggiungere inizialmente piccole quantità di soluzione concentrata (0.1 ml o meno) e
poi aumentare questa quantità se gli aumenti di assorbanza non sono significativi. Poiché si vuole
verificare la proporzionalità tra as sorbanza e concentrazione non è necessario conoscere la reale
concentrazione del blu di metilene, ma solo un valore ad essa proporzionale.
Ricordarsi che ad ogni aggiunta si varia il volume nella provetta, quindi la concentrazione di blu di
metilene nella provetta non è proporzionale al volume di soluzione concentrata aggiunto ma è data
dalla relazione:
cv
C=
v+V
dove C è la concentrazione nella provetta, c è la concentrazione della soluzione concentrata, v è il
volume aggiunto totale di soluzione concentrata e V il volume iniziale di acqua nella provetta.
Dopo aver verificato la proporzionalità tra l'assorbanza e la concentrazione, calcolare la
concentrazione della soluzione madre di blu di metilene (c) sapendo che lo spessore interno della
provetta è 10.0 ± 0.5 mm e il coefficiente di estinzione molare del blu di metilene a 633 nm è
53000 ± 10 litri·moli-1cm-1