Programma svolto
Materia: Scienze della materia
Insegnante : Marangoni Laura
Classe : 2 B
Ore sett. : 4 h
A.S. : 2009/10
Gli argomenti trattati sono stati i seguenti:
Modulo 1 : Energia , lavoro ,calore
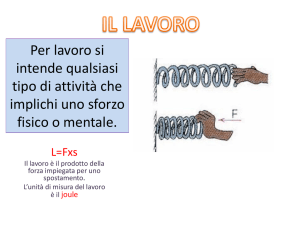
U.D. 1 : Energia , lavoro e potenza : concetto di energia ( E potenziale e E cinetica e
loro trasformazioni ) . Lavoro e sua unità di misura : il Joule. La potenza e sua unità
di misura : il Watt. Conservazione dell’E e degradazione dell’E.
U.D.2 : Il calore e la sua propagazione: calore e temperatura. L’equilibrio termico.
La misura del calore ( la caloria e il Joule ) e la misura della temperatura ( la scala
centigrada , quella Kelvin e quella Fahrenheit. ). La trasmissione del calore:
convezione, conduzione e irraggiamento. Le leggi della termologia : la capacità
termica e il calore specifico.
U.D.3 : Gli effetti del calore sulla materia : le variazioni di volume e la dilatazione
termica. Il coefficiente di dilatazione termica. La dilatazione nei solidi, nei liquidi e
nei gas. I passaggi di stato : fusione , solidificazione , vaporizzazione e
solidificazione.
Modulo 2 : I fenomeni elettrici
U.D. 1 : I fenomeni elettrici nella materia: la carica elettrica e i fenomeni
elettrostatici. La legge di Colulomb. I materiali in un campo elettrico : il potenziale
elettrico ( il Volt ) . Equilibrio elettrostatico e scarica elettrica. Conduttori e isolanti .
U.D. 2 : I circuiti in corrente continua : il generatore di corrente ( pila , accumulatore,
dinamo) . I circuiti elettrici. L’intensità di corrente e l’Ampere. La resistenza di un
circuito e le leggi di Ohm. Circuito in serie e in parallelo.
U.D.3: L’effetto del calore : la legge di Joule.
U.D.4: Elettromagnetismo e correnti indotte: i fenomeni magnetici e le cariche
elettriche. Induzione e corrente alternata. Il trasformatore. Produzione e trasporto di
energia. I pericoli della corrente elettrica.
Modulo 3 : Le trasformazioni chimiche
U.D. 1: Le reazioni chimiche: sintesi , decomposizione , scambio semplice e doppio
scambio. I calcoli stechiometrici. Acidità e basicità delle soluzioni: gli indicatori.
U.D. 2 : Dagli elementi ai Sali: dai metalli agli idrossidi. Dai non metalli agli acidi.
La formazione dei Sali.
U.D 3 : I legami chimici : energia di legame ed elettronegatività. Il legame ionico , il
legame covalente e il legame dativo. Legami intermolecolari : il legame ad idrogeno.
U.D.4: L’energia nelle reazioni e la velocità di reazione. L’equilibrio chimico.
Il prodotto di solubilità : dissociazione e ionizzazione. Il prodotto ionico dell’acqua e
il significato del PH. Una nuova definizione di acido e di base: teoria di Arrhenius ,
teoria di Bronsted e Lowry e teoria di Lewis. La costante di acidità e di basicità.
L’idrolisi salina.
Esperienze di laboratorio:
Costruzione di un circuito elettrico.
Elettrolisi dell ‘acqua.
Saggio alla fiamma.
Esperimento sulla legge di Lavoiser: reazione tra nitrato di piombo e ioduro di
potassio. Calcolo del Ph della soluzione.
Albinia , lì 8/06/10
Gli alunni
L’insegnante