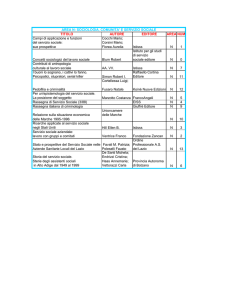
MODULO C
IMPARIAMO A RICONOSCERE I
COMPONENTI DI UN IMPIANTO
Lezione 50
Cenni di fisica per la pneumatica
Copyright © Ulrico Hoepli Editore S.p.A. 2014
Gli impianti pneumatici (pneumatica dal greco pneumatikos,
“proveniente dal vento”, è una branca della fisica e della tecnica che
studia il trasferimento di forze mediante l’utilizzo di gas in pressione),
sono impiegati per la gestione automatizzata dei processi
produttivi, utilizzano l’aria compressa per l’azionamento di vari
elementi.
L’aria è una miscela di gas: i componenti principali sono azoto
(78%) e ossigeno (21%); la percentuale restante è formata da altri
gas come anidride carbonica, argon, elio, neon ecc.
È presente anche una piccola percentuale di vapore acqueo, che
varia a seconda delle condizioni ambientali: maggiore è la
temperatura dell’aria, maggiore sarà la sua capacità di contenere
acqua allo stato di vapore e quindi maggiore sarà l’umidità.
Lez.50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
Per comprendere meglio il funzionamento degli impianti pneumatici è
necessario conoscere il concetto di pressione, definita come il
rapporto tra una forza e la superficie o area su cui essa agisce
(P = F/A).
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
L’unità di misura della pressione nel SI (si veda nell’unità 1 la lezione
1) è il pascal (Pa), ovvero newton/metro quadrato (N/m2); tuttavia,
poiché il pascal è un’unità di misura è troppo piccola, si utilizza un
suo multiplo, il bar (1 bar = 105 pascal).
0 bar relativi
1 bar assoluti
- 0,5 bar
relativi
0,5 bar assoluti
0 bar assoluti
Lez. 50
1,5 bar relativi
Vuoto
assoluto
Pressione
atmosferica
Pressione assoluta
2,5 bar assoluti
Pressione
relativa
Come mostrato in figura la pressione si può distinguere in:
- 1,013 bar
relativi
Copyright © Ulrico Hoepli Editore S.p.A. 2014
•
pressione atmosferica. È esercitata sui corpi dall’aria che
circonda la Terra e varia a seconda dell’altezza, del clima e della
temperatura.
A 20 °C e a livello del mare vale circa 1,013 bar;
• pressione relativa o effettiva. È esercitata da un gas sulle pareti
del recipiente o del circuito che lo contiene e viene misurata con
strumenti utilizzati comunemente, detti manometri;
• pressione assoluta. È data dalla somma della pressione
atmosferica e di quella relativa.
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
Allo scopo di studiare il comportamento dei gas si introduce il
concetto di gas perfetto il quale soddisfa le seguenti condizioni:
• le particelle che costituiscono il gas hanno volume proprio nullo;
• fra le particelle non esistono attrazioni a distanza;
• gli urti tra le particelle sono elastici.
Esistono specifiche leggi fisiche che spiegano il comportamento dei
gas perfetti1, prendendo in considerazione tre parametri fondamentali,
quali pressione (P misurata in Pa), volume (V misurato in m3) e
temperatura (T misurata in gradi Kelvin).
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
Nelle equazioni che seguono (Pi, Vi, Ti) con i = 1,2,3,…, si indicano
gli stati termodinamici del gas, cioè la terna di valori che
caratterizza la condizione termodinamica del gas. La variazione
dello stato avviene attraverso trasformazioni termodinamiche, che
di seguito illustriamo attraverso le loro equazioni: isoterma (legge di
Boyle e Mariotte), isobara e isovolumica (legge Gay-Lussac).
•
Equazione di stato dei gas perfetti: PV = RT
• Legge di Boyle e Mariotte:
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
• Legge di Gay-Lussac:
È interessante notare che le ultime tre leggi dipendono dalla prima:
infatti, se consideriamo una trasformazione isoterma (cioè a
temperatura costante), l’equazione di stato dei gas si trasforma
nella legge di Boyle e Mariotte; mentre, se consideriamo
trasformazioni isobare o isovolumiche (rispettivamente a pressione
costante e a volume costante).
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
Rappresentazione schematica dell’andamento delle variabili
fondamentali nella legge di Boyle-Mariotte.
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
l’equazione di stato si trasforma nelle due leggi di Gay-Lussac
Rappresentazione schematica dell’andamento delle variabili fondamentali nella
legge di Gay-Lussac.
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014
Diagrammi cartesiani delle principali trasformazioni termodinamiche.
Lez. 50
Copyright © Ulrico Hoepli Editore S.p.A. 2014