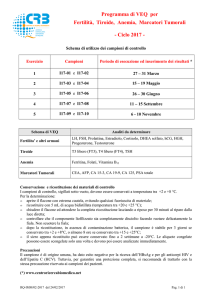
Determinazione
immunoenzimatica quantitativa
dell’estrone nel siero umano
Ref. E-43
10. Il substrato (TMB) è sensibile alla luce; se correttamente
conservato deve essere incolore. In caso di contaminazione o di
instabilità si sviluppa un colore blu; in questo caso il substrato non
deve essere utilizzato.
11. Per la dispensazione di substrato e soluzione di stop non
utilizzare pipette con parti di metallo che potrebbero venire a
contatto con i liquidi.
12. Cambiare sempre il puntale della micropipetta per ogni reattivo,
campione, standard o controllo da dispensare.
13. Non reattivi di lotto diverso e non utilizzarli oltre la data di
scadenza riportata sulle rispettive etichette.
14. I reattivi contenuti nel kit devono essere considerati materiale
pericoloso ed eliminati secondo le normative esistenti.
USO DEL KIT
LIMITI DEL METODO
Per la determinazione quantitativa diretta dell’estrone nel siero
umano con metodo immunoenzimatico.
Solo per uso diagnostico in vitro.
1. Tutti i reattivi contenuti nel kit sono tarati per il dosaggio diretto
dell’estrone nel siero umano. Il kit non è tarato per la
determinazione dell’estrone in saliva, plasma o in altri campioni di
origine umana o animale.
2. Non utilizzare campioni fortemente emolizzati, lipemici o itterici o
non conservati come consigliato.
3. Campioni o sieri di controllo contenenti sodio azide o thimerosal
non possono essere dosati con questo kit, in quanto fornirebbero
risultati errati.
4. Utilizzare lo Standard A per diluire campioni di siero ad elevata
concentrazione di estrone. L’uso di diluenti diversi può fornire
risultati errati.
5. Non utilizzare i risultati ottenuti con questo dosaggio per
formulare una diagnosi clinica. Infatti, soggetti esposti ad animali o
a prodotti derivati da animali possono sviluppare anticorpi eterofili
che interferiscono nel dosaggio. Ogni diagnosi clinica deve tenere
conto di tutti i dati disponibili sul paziente; se si sospettano falsi
risultati considerare le pregresse esposizioni ad animali o a prodotti
derivati da animali.
PRINCIPIO DEL METODO
Questo metodica immunoenzimatica applica il classico metodo
competitivo. L’antigene presente in standard, controlli e campioni
compete con lo stesso antigene legato ad un enzima (coniugato)
per un numero limitato di siti di un anticorpo specifico adsorbito sui
pozzetti di una micropiastra. Dopo l’incubazione l’antigene non
legato all’anticorpo viene allontanato mediante lavaggio. Si
aggiunge quindi un cromogeno e, dopo l’incubazione, si arresta la
reazione enzimatica con l’aggiunta della soluzione di stop. Si
misura con un lettore di micropiastre l’assorbanza dei pozzetti.
L’intensità del colore formato è inversamente proporzionale alla
concentrazione di estrone in standard, controlli e campioni. Si
traccia quindi una curva di taratura, dalla quale, per interpolazione,
è possibile ricavare la concentrazione di estrone presente in
controlli e campioni.
APPLICAZIONI CLINICHE
L’estrone è uno steroide che, assieme ad estriolo ed estradiolo,
appartiene alle classe degli estrogeni. Gli estrogeni sono coinvolti
nello sviluppo degli organi sessuali femminili e dei caratteri sessuali
secondari del sesso femminile. Prima della fecondazione dell’ovulo,
gli estrogeni agiscono sulla crescita e il trofismo del tratto
riproduttivo per prepararlo ad accogliere l’ovulo fecondato. Durante
la fase follicolare del ciclo mestruale, l’estrone mostra un lieve
incremento fino ad un picco che si verifica di solito in tredicesima
giornata. Il picco è di breve durata e, di solito, in sedicesima
giornata, l’estrone ritorna a livelli basali. Si verifica un secondo
picco intorno alla ventunesima giornata, e, se non avviene la
fecondazione, la produzione di estrone decresce.
PRECAUZIONI PER L’USO
1. Gli utilizzatori devono prendere attenta visione di questo
protocollo per poter utilizzare con successo il kit. Si ottengono
risultati corretti solo attenendosi strettamente alle istruzioni fornite.
2. Inserire in ogni esperimento sieri di controllo o pool di sieri a
livello basso ed elevato per verificare la correttezza dei risultati.
3. Quando richiesto utilizzare acqua deionizzata o distillata per la
diluizione o la ricostituzione dei reattivi.
4. Indossare sempre guanti monouso quando si manipolano reattivi
e campioni.
5. Prima dell’uso portare a temperatura ambiente reattivi e
campioni e agitarli con cura. Evitare di sottoporre a ripetuti cicli di
congelamento e scongelamento reattivi e campioni.
6. Inserire la curva standard in ogni dosaggio.
7. Inserire il controllo in ogni dosaggio; il valore del controllo deve
essere compreso nei limiti indicati dal produttore.
8. Valori del controllo esterni ai limiti indicati possono essere
provocati da tecniche procedurali improprie, imprecisione nelle fasi
di pipettamento, lavaggi incompleti e conservazione errata dei
reattivi.
9. La presenza di bollicine nei pozzetti può modificare le densità
ottiche (OD) di standard, controlli e campioni; prima della lettura
agitare brevemente la micropiastra per allontanare eventuali
bollicine.
PRECAUZIONI PER L’USO
MATERIALE BIOLOGICO POTENZIALMENTE
PERICOLOSO
Il siero umano utilizzato per la preparazione di standard e controlli
è stato dosato e trovato non reattivo per l’antigene di superficie del
virus dell’epatite B e trovato negativo per la presenza di anticorpi
contro il virus dell’epatite C e anti HIV. Non sono disponibili metodi
in grado di offrire la certezza assoluta che questi o altri agenti
infettivi siano assenti. Manipolare questi reattivi e i campioni dei
pazienti come potenziali fonti di infezione.
PRODOTTI CHIMICI PERICOLOSI
Evitare il contatto con reattivi contenenti TMB, perossido di
idrogeno e acido solforico. In caso di contatto con questi reattivi,
lavare abbondantemente con acqua la zona colpita. Il TMB è un
sospetto agente cancerogeno.
RACCOLTA E CONSERVAZIONE DEI CAMPIONI
Per li dosaggio in duplicato sono necessari 200 µL di siero.
Prelevare 4-5 mL di sangue periferico, trasferirli in una provetta
senza anticoagulante e lasciar coagulare. Centrifugare e trasferire
il siero. I campioni possono essere conservati fino a 24 ore a 2-8°C
o, suddivisi in aliquote, a –20°C o a temperature inferiori per
periodi più lunghi. Evitare ripetuti cicli di congelamento –
scongelamento dei campioni.
Manipolare i campioni biologici come possibili fonti di infezione.
PRETRATTAMENTO DEI CAMPIONI
Non è necessario il pretrattamento dei campioni.
REATTIVI E MATERIALE RICHIESTO MA NON FORNITO
1. Micropipette di precisione per dispensare 50, 100, 150 e 300 µL
2. Puntali monouso
3. Acqua distillata o deionizzata
4. Agitatore per micropiastre
5. Lettore per micropiastre con filtro per 450nm e linearità di 3,0 OD
o superiore* (vedi paragrafo 10).
REATTIVI FORNITI
6. Substrato (TMB) - Pronto per l’uso.
1. Micropiastra con pozzetti separabili sensibilizzata
con anticorpo anti estrone da coniglio – Pronta per
l’uso.
Contenuto: Un flacone contenente tetrametilbenzidina e perossido
di idrogeno in tampone privo di DMF o DMSO.
Volume: 16 mL/flacone
Conservazione: 2-8oC
Stabilità: 12 mesi o fino alla data di scadenza indicata
sull’etichetta.
Contenuto: Una micropiastra da 96 pozzetti (12x8) sensibilizzata
con anticorpo policlonale in una busta richiudibile con disseccante.
Conservazione: 2-8oC
Stabilità: 12 mesi o fino alla data di scadenza indicata
sull’etichetta.
2. Coniugato Estrone-perossidasi di rafano (HRP)Pronto all’uso
Volume: 14 mL/flacone
Conservazione: 2-8oC
Stabilità: 12 mesi o fino alla data di scadenza indicata
sull’etichetta.
3. Standard di estrone – Pronti per l’uso.
Contenuto: Sei flaconi contenenti estrone in tampone proteico e un
conservante privo di mercurio. Preparati aggiungendo quantità
definite di estrone ad un tampone.
*Le concentrazioni degli standard riportate qui sotto sono
approssimate. Fare riferimento alle concentrazioni riportate
sull’etichetta di ciascun flacone.
Standard
Standard A
Standard B
Standard C
Standard D
Standard E
Standard F
Concentrazione
0 pg/mL
10 pg/mL
25 pg/mL
100 pg/mL
400 pg/mL
2000 pg/mL
Volume/Flacone
2,0 mL
0,5 mL
0,5 mL
0,5 mL
0,5 mL
0,5 mL
o
Conservazione: 2-8 C
Stabilità: 12 mesi o fino alla data di scadenza indicata sull’etichetta
per gli standard non ancora utilizzati. Dopo l’apertura gli standard
possono essere conservati 14 giorni a 2-8°C o, suddivisi in
aliquote, a –20°C o a temperature inferiori per periodi più lunghi.
Evitare ripetuti cicli di congelamento – scongelamento degli
standard.
4. Controllo – Pronto per l’uso.
Contenuto: Un flacone contenente estrone in tampone proteico e
un conservante privo di mercurio. Preparato aggiungendo una
quantità definita di estrone ad un tampone. Il valore atteso con i
limiti di accettabilità è riportato sull’ etichetta del flacone.
Volume: 0,5 mL/flacone
Conservazione: 2-8oC
Stabilità: 12 mesi o fino alla data di scadenza indicata sull’etichetta
per il controllo non ancora utilizzato. Dopo l’apertura il controllo può
essere conservato 14 giorni a 2-8°C o, suddiviso in aliquote, a –
20°C o a temperature inferiori per periodi più lunghi. Evitare ripetuti
cicli di congelamento – scongelamento del controllo.
5. Tampone per il lavaggio concentrato - X10
Contenuto: Un flacone contenente tampone con un detergente non
ionico e un conservante privo di mercurio.
Volume: 50 mL/flacone
Conservazione: 2-8oC
Stabilità: 12 mesi o fino alla data di scadenza indicata
sull’etichetta.
Preparazione: Prima dell’uso diluire 1:10 con acqua distillata o
deionizzata. Se si utilizza l’intera piastra, diluire 50 mL di tampone
di lavaggio concentrato con 450 mL di acqua distillata o
deionizzata.
ESTRONE Rev. 0 05/2016
7. Soluzione di stop - Pronta per l’uso.
Contenuto: Un flacone contenente acido solforico 1M.
Volume: 6 mL/flacone
Conservazione: 2-8oC
Stabilità: 12 mesi o fino alla data di scadenza indicata
sull’etichetta.
PRINCIPIO DEL METODO
Pre trattamento dei campioni: Nessuno.
Prima dell’uso portare tutti i reattivi a temperatura ambiente.
Dosare standard, controlli e campioni in duplicato. Eseguire il
dosaggio completando tutti i passaggi senza interruzioni.
1.Togliere dalla busta il numero di strip necessario per il dosaggio.
Richiudere la busta e conservare le strip inutilizzate a 2-8°C.
2.Pipettare in duplicato 50 µL di standard, controlli e campioni nei
rispettivi pozzetti.
3.Pipettare 100 µL del coniugato ESTRONE-HRP in tutti i
pozzetti, utilizzando preferibilmente una pipetta multicanale.
5.Incubare su un agitatore per micro piastre (a 200 rpm) 1 ora a
temperatura ambiente.
6.Lavare 3 volte i pozzetti con 300 µL di tampone di lavaggio
diluito. Aspirare con cura il liquido di lavaggio e lasciare la
micropiastra capovolta su carta assorbente per eliminare le
gocce residue. Si raccomanda l’uso di un lavatore per
micropiastre.
7. Pipettare 150 µL di TMB in ciascun pozzetto Prendere nota
della sequenza di pipettamento e del tempo utilizzato.
8.Incubare su un agitatore per micropiastre 15-20 minuti a
temperatura ambiente (o fino al momento in cui lo standard A
presenti la colorazione blu corrispondente alle OD desiderate).
9.Pipettare 50 µL di soluzione di stop in tutti i pozzetti ripetendo la
sequenza e i tempi del punto 7.
10.Leggere le assorbanze su un lettore per micropiastre con filtro a
450nm entro 20 minuti dall’aggiunta della soluzione di stop.
* Se le OD superano il limite superiore di linearità dello strumento o
non è disponibile un filtro di 450 nm, è possibile utilizzare un filtro
da 405 o 415 nm. Si otterrano densità ottiche inferiori senza
variazioni dei risultati per pazienti e controlli.
CALCOLO DEI RISULTATI
1. Calcolare la media delle densità ottiche per ogni duplicato degli
standard.
2. Tracciare una curva di taratura su carta semi-log ponendo in
ordinata (asse delle Y) la media delle densità ottiche per ciascuno
standard e in ascissa (asse delle X) le rispettive concentrazioni. Se
si dispone di un programma computerizzato per l’elaborazione dei
dati, utilizzare l’interpolazione a 4 parametri.
3. Calcolare la media delle densità ottiche per ogni duplicato dei
campioni.
4. Ricavare le concentrazioni per i campioni direttamente dalla
curva standard.
5. Diluire con lo standard A, fino ad un massimo di 1:8, i campioni
con concentrazione di estrone superiore a 2000 pg/mL e ridosarli.
Moltiplicare i risultati ottenuti per il rispettivo fattore di diluizione.
DATI TIPICI OTTENUTI CON IL KIT
Standard
Media OD
A
B
C
D
E
F
Campione
2.530
1.969
1.646
1.072
0.724
0.373
1.183
Valore
(pg/mL)
0
10
25
100
400
2000
82.6
CURVA STANDARD TIPICA
La curva è riportata solo come esempio e non deve essere
utilizzata per calcolare i risultati dei campioni.
PRECISIONE INTRA-SAGGIO
Tre campioni sono stati dosati 20 volte nello stesso esperimento
con i seguenti risultati ( espressi in pg/mL):
Campione
Media
1
2
3
SD
58.1
239.8
601.3
CV%
4.76
20.1
48.7
8.2
8.4
8.1
PRECISIONE INTER-SAGGIO
Tre campioni sono stati dosati 10 voltecon i seguenti risultati
( espressi in pg/mL):
Campione
Media
1
2
3
24.46
78.69
505.13
SD
CV%
2.18
7.85
38.32
8.9
10.0
7.6
RECUPERO
A tre campioni di siero sono state aggiunte quantità definite di
estrone; il dosaggio ha dato i seguenti risultati ( espressi in pg/mL):
Campione
Osservato
1 Unspiked
+200
+400
+1000
2 Unspiked
+375
+750
+1500
3 Unspiked
+200
+400
+1000
52
315
557
1235
75
493
505.23
712.44
720.11
758.13
856.46
1013.61
Atteso
252
452
1052
450
559.81
794.88
837.64
955.17
1190.24
Recupero%
125
120
117
110
90.3
89.6
90.5
89.7
85.1
Gruppo
Uomini
Donne pre-menopausa
Donne post-menopausa
Range (pg/mL)
13-149
21-319
11-95
BIBLIOGRAFIA
1. Hauptmann. H. et al: Concepts for the synthesis ofbiotinylated
steroids. Part 2: 17β-estradiol derivatives as immunochemical
probes. Bioconjugate Chem. 11(2000) 537-548
2. Dressendorfer R.A. et al: Synthesis of a cortisol-biotin conjugate
and evalution as atracer in an immunoassay for salivary cortisol
measurement. J. Steroid Biochem. Molec.Biol.: 43 (1992) 683-692
3. Mayer H.H.D. et al: Immunoaffinity chromatography and a biotinstreptavidin amplified immunoassay for sensitive and specific
estimation of estradiol-17β. J. Steroid Biochem. 35 (1990) 263-269
4. Folan J. et al: Solid-phase Enzymoimmunoassay of estrone in
serum. Clin. Chem. 34(1988) 1843-1846
5. Folan J. et al: Solid-Phase Enzymoimmunoassay of estrone in
saliva. Clin. Chem. 35:4(1989)569-572
6. Speroff L. et al: Hormone biosynthesis, metabolism, and
mechanism of action. In: Clinical gynecologic endocrinology &
infertility, 3rd ed. Willanms & Wilkins. 1983: 1-41
7. Kim M.H. et al: Plasma levels of estrogen, androgens and
progesterone during normal and dexamethasone- treated cycles.
J. Clin. Endocrinol. Metab.. 39(1974)706-712
8. Speight A.C. et al; Non-protein bound oestrgens in plasma and
urinary excretion of unconjugated oestrogens in non-pregnant
women. J. Endocrino 83(1979) 385-391
9.Kricka, L.J., Human anti-animal antibody interferences in
immunological assays. Clin. Chemistry 45:7, 1999.
10.Check, J.H., et al, Falsely elevated steroidal assay levels related
to heterophile antibodies against various animal species. Gynecol
Obstet Invest 40:139-140, 1995.
Simboli usati
Kit diagnostico in vitro
LINEARITA’
CARATTERISTICHE DEL METODO
SENSIBILITA’
Tre campioni di siero sono stati diluiti con lo Standard A; il
dosaggio ha dato i seguenti risultati ( espressi in pg/mL):
Il limite di rilevamento (LoD) è stata determinata dall'analisi di 60
campioni del bianco e un campione valore basso ed è stato
calcolato come segue:
LoD = µB + 1.645σB + 1.645σS, dove σB e σS sono la deviazione
standard del campione valore del bianco e basso e µB è il valore
medio del bianco.
Il limite di rilevamento (LOD) è stato determinato in 3 pg/mL.
Campione
1
1:2
1:4
1:8
2
1:2
1:4
1:8
3
1:2
1:4
1:8
SPECIFICITA’ (CROSS REATTIVITA’)
Sono stati dosati i seguenti composti per verificare la loro cross
reattività con l’anticorpo utilizzato nel kit Direct Estrone ELISA.
L’estrone ha una cross reazione del 100%.
Steroide
Cross reattività %
Estrone
100
Estrone-3-sofato
4,9
2,2
17β estradiolo
Estrone-3-glicuronide
1,2
0,14
17β estradiolo-3-glicuronide
I seguenti steroidi hanno mostrato una cross reattività < 0,1%:
Androstenedione, Colesterolo, Corticosterone, Cortisolo,
Cortisone, DHEAS, Dietilstilbestrolo, Estriolo, Estradiolo
solfato, Progesterone, 17-OH progesterone e Testosterone.
Osservato
340,67
165,35
95,39
48,47
1086,01
508,58
232,11
114,95
1313,21
612,98
318,63
134,98
Atteso
170,34
85,17
42,58
543,00
271,50
135,75
656,61
328,30
164,15
Contenuto
Recupero%
97,1
112,0
113,8
93,7
85,5
84,7
93,4
97,1
82,2
numero di lotto
Non esporre alla luce del sole
Data di scadenza
Temperatura di conservazione
Leggere attentamente le istruzioni
CONFRONTO FRA METODI
Contatti:
Il kit Estrone ELISA (y) è stato confrontato con LC / MS (x). Il
confronto di 19 campioni di siero ha dato i seguenti risultati di
regressione lineare:
y=1.134x –7,014
2
r =0,99
VALORI ATTESI
InterMedical S.r.l. Via A.Genovesi,13 80010 Villaricca (NA)
ITALY Tel. +39 81 330 27 05 Fax +39 81 330 14 53
P. IVA 03426331215
e-mail product specialist [email protected]
Come per qualsiasi altro dosaggio ciascun laboratorio deve
stabilire i propri limiti di normalità.
Fabbricante
ESTRONE Rev. 0 05/2016
INTERMEDICAL s.r.l.
Via A. Genovesi,13
80010 Villaricca(Na)-ITALY