L'ENTROPIA
Lezioni d'Autore
Un video :
Clic
Un altro video :
Clic
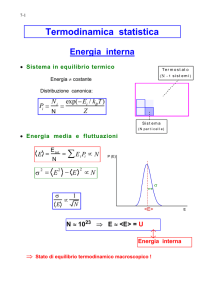
La funzione di distribuzione delle velocità (I)
Nel grafico accanto sono
riportati i numeri delle molecole
di un gas, suddivise a seconda
del valore delle loro velocità. Il
gas è mantenuto alla
temperatura di 900 K e,
tramite alcuni tecniche
sperimentali, si dividono le
molecole nei diversi gruppi in
funzione delle velocità
misurate.
La curva continua è la
previsione teorica delle
velocità, calcolata per questa
temperatura, ottenuta per la
prima volta da Maxwell nel
1859.
La funzione di distribuzione delle velocità (II)
La funzione ricorda la curva della distribuzione
degli errori (misure ripetute intorno al valore
centrale più probabile), ma a differenza di
questa non è simmetrica. L’area delimitata dalla
funzione e dall’asse delle ascisse è uguale al
numero N delle molecole che compongono il
gas.
La funzione di distribuzione delle velocità (III)
L’espressione analitica della funzione di
distribuzione dipende dalla temperatura assoluta
in modo tale che all’aumentare di T la curva si
schiaccia e si allarga (il numero delle molecole è
costante, quindi l’area rimane la stessa).
La funzione di distribuzione delle velocità (IV)
Per basse temperature, i valori sono assai
concentrati e possono assumere un ristretto
valore di velocità. Viceversa, all’aumentare della
temperatura, i valori possibili per le velocità
aumentano e il valore massimo ha una
frequenza inferiore ai casi precedenti.
Entropia e probabilità (I)
Consideriamo il solito gas perfetto
monoatomico contenuto in un recipiente A
avente pareti rigide e conduttrici, immerso in
un bagno termico. Tramite una valvola esso
è collegato a un recipiente B, identico ad A,
inizialmente vuoto.
Entropia e probabilità (II)
Aprendo la valvola il gas diffonde e,
aspettando un tempo sufficientemente lungo,
la densità è uniforme nei due recipienti. Il
termometro nel bagno termico non registra
variazioni di temperatura. La trasformazione
è isoterma quindi l’energia interna del gas
non può essere variata. Cosa si può dire
dell’entropia?
Entropia e probabilità (III)
Se essa dipendesse solo dall’energia non
subirebbe variazioni. Invece, come abbiamo
ripetuto più volte, in una trasformazione
irreversibile senza scambi con l’ambiente
l’entropia aumenta. La grandezza estensiva
che cambia nella diffusione del gas è il
volume che passa dal valore
Vi = V A
a
Vf = VA+ VB
=2 VA,
quindi è probabile che l’entropia sia una
funzione del volume.
Entropia e probabilità (IV)
In effetti la formula dell’entropia di un gas
perfetto monoatomico, non considerando la
dipendenza dalla temperatura, assume la forma:
S = R ln V + costante
(con R costante dei gas)
Dunque la variazione di entropia nella
trasformazione isoterma risulta:
DS = R ln 2VA- R ln VA= R ln (2VA/VA) = R ln 2.
Entropia e probabilità (V)
Andiamo a visualizzare la situazione dal punto di vista
microscopico. Le sferette sono gli atomi di gas. Fra tutte
le situazioni possibili, in accordo alle considerazioni di
Boltzmann, il gas evolve fino a raggiungere la densità
uniforme nei due recipienti che corrisponde allo stato
più probabile fra tutte le configurazioni possibili.
Entropia e probabilità (VI)
Ma come si può calcolare la molteplicità delle
configurazioni corrispondenti al particolare macrostato?
La situazione iniziale (la possibilità che il gas rimanga
solo nel recipiente A) è quella meno probabile.
Si dice, in questo caso, che essa ha molteplicità 1
(vedremo tra poco come si valuta la molteplicità). Tutte
le particelle sono in un solo recipiente. Diciamo anche
che la sua entropia vale zero.
Entropia e probabilità (VII)
La configurazione più probabile è invece quella in
cui metà degli atomi si trova nel primo e l’altra
metà nel secondo volume. Il valore dell’entropia è,
per le considerazioni precedenti, R ln 2.
Entropia e probabilità (VIII)
Per capire il modo di contare la molteplicità dei
microstati iniziamo con una situazione molto diversa dal
gas. Due urne A e B con una sola pallina numerata. I
casi possibili sono solo 2 (la pallina è in A oppure in B).
Con due palline i casi diventano 4. Con 3 otto e così via.
Entropia e probabilità (IX)
Con N particelle abbiamo perciò 2N possibilità.
Accettiamo per l’entropia l’espressione di PlanckBoltzmann S = k ln W, con W numero di
microstati equivalenti (molteplicità) che
corrispondono allo stato più probabile.
Approssimiamo quindi:
Wfinale=2N e
Winiziale=1.
Da cui:
DS = k ln Wfinale=2N - 0 = kN ln 2.
Ricordando infine che il gas è monoatomico, N è
uguale al numero di Avogadro, si può infine
scrivere per la variazione di entropia
dell’espansione isoterma dei gas: DS = R ln 2.
Altri video:
Video 1 Illustrating entropy (modello di
diffusione di un gas) Clic
Video 2 L’entropia Clic
Video 3 Maxwell’s demon and perpetuum mobile
Clic
Video 4 Macchine termiche ed entropia Clic
Video 5 Secondo principio della termodinamica
(PSSC parte prima) Clic
Video 6 Secondo principio della termodinamica
(PSSC parte seconda) Clic
Video 7 Secondo principio della termodinamica
(PSSC parte terza) Clic