Farmaforesi elettrodica: innovazione nei sistemi di veicolazione transdermica di farmaci
A cura del Dott. Antonino d’Africa
INDICE
L’UTILIZZO DELLA CORRENTE ELETTRICA IN MEDICINA
pag.1
CONSIDERAZIONI GENERALI
pag.1
BIOFISICA DELL’ENERGIA ELETTRICA
pag.2
BASI FISICHE DEI POTENZIALI DI MEMBRANA
pag.8
CIRCUITO ELETTRICO EQUIVALENTE DI MEMBRANA
pag13
CIRCUITO ELETTRICO EQUIVALENTE DI UNA MEMBRANA REALE
pag15
PASSAGGIO DI IONI
pag16
LASCIAPASSARE ALL’INGRESSO DELLE MOLECOLE ATTRAVERSO I RECETTORI E CANALI IONICI DI
I RECETTORI: STRUTTURE DI MEDIAZIONE TRA I PRIMI ED I SECONDI MESSAGGERI
MEMBRANA
pag17
pag17
LA NATURA DEI RECETTORI.
pag17
RECETTORI CITOPLASMATICI.
pag18
RECETTORI DELLA MEMBRANA PLASMATICA.
pag19
LE VARIAZIONI QUANTITATIVE DEI RECETTORI
pag22
SEGNALI INTRACELLULARI: SECONDI MESSAGGERI
pag23
ECCITABILITÀ DELLA MEMBRANA.
pag26
COME VENGONO GENERATI I POTENZIALI D’AZIONE
MODELLI IN FISIOLOGIA Flusso di massa e di calore
LE PROTEINE DEI CANALI IONICI ED IL LORO GATING.
pag29
pag30
pag33
IL PASSAGGIO DI FARMACO ATTRAVERSO LO STRATO CORNEO:
VIA TRANS-EPIDERMICA – TRANSDERMICA
pag34
VANTAGGI DEL PASSAGGIO TRANSDERMICO DEI FARMACI:
FARMAFORESI ELETTRODICA PER “BIO-ELECTRODIC REPTATION”
RICERCA MEDICA-TECNOLOGICA
2°parte
SEGNALE SELEZIONATO PER DURATA, TASSO DI RIPETIZIONE, FORMA E CONTENUTO ARMONICO
SISTEMA DI ABBATTIMENTO DELLE BARRIERE NATURALI A BASSO POTERE ENERGETICO
pag43
pag44
pag45
SISTEMA DI VALUTAZIONE DELLO STATO DELLA CUTE
pag45
SISTEMA DI SICUREZZA CON MONITORAGGIO
pag46
RECETTORI LEGATI AD ENZIMI.
pag46
LA RIMOZIONE DEI SECONDI MESSAGGER
pag47
1
RECETTORE ESPRESSO SULLE CELLULE BERSAGLIO DELLA SOSTANZA ATTIVA
pag49
L'ASPETTO PIÙ IMPORTANTE E VANTAGGIOSO DEL SISTEMA TERAPEUTICO
pag52
BIBLIOGRAFIA
pag53
L’UTILIZZO DELLA CORRENTE ELETTRICA IN MEDICINA
Ben conosciute fin dall’inizio del ‘900 sono le influenze fisiche, chimiche e
biologiche che la corrente elettrica può esercitare sui tessuti viventi. Questi
fenomeni sono basati su meccanismi notevolmente complessi dato il loro
legame con modificazioni del metabolismo cellulare e modificazioni nella
ripartizione delle cariche elettriche sulla superficie delle membrane cellulari.
Il sistema di segnali di origine elettrochimica, detti potenziali d'azione, con
cui gli organismi superiori scambiano informazione con i propri organi di
comunicazione verso l'esterno, sono veri e propri segnali elettrici e chimici
che si propagano. Nell'ultimo decennio il loro studio è andato crescendo,
assumendo negli ultimi anni un ritmo vertiginoso.
Le applicazioni cliniche realizzate in campo ortopedico e quelle che si
profilano in altri campi sono sufficienti a giustificare la dinamica espansione
del settore e le grandi speranze in esso riposte. Prima di entrare nel vivo del
problema, conviene esaminare gli aspetti elementari dei fondamenti fisici su
cui si basano le interazioni menzionate. Essi consentiranno di valutare nella
giusta luce i fatti sperimentali esposti nel seguito, chiarendo il ruolo
fondamentale che hanno le forze elettriche in molti processi cellulari.
La densità di flusso di una popolazione molecolare, cioè il flusso di molecole
per unità di superficie, è dovuto alla somma di due contributi. Il primo è il
prodotto della concentrazione delle molecole per la velocità (elettroforetica o
dielettroforetica) raggiunta sotto l'azione di trascinamento della forza
elettrica. Il secondo è la diffusione dovuta al gradiente spaziale di
concentrazione. Risulta così evidente che il movimento delle molecole in
soluzione può dipendere da variabili di tipo elettrico e di tipo chimico.
Se le molecole sono cariche, il prodotto della densità di flusso per la loro
carica fornisce la corrispondente densità di corrente. La densità di corrente
2
risultante in soluzione, J, è la somma delle densità di corrente di tutte le
specie molecolari cariche. Un esempio elementare è fornito dalla interazione
tra campo elettrico e alcuni tipi di recettori della membrana cellulare. Tali
recettori sono costituiti da glicoproteine immerse nella membrana, che
protrudono nel mezzo esterno catene molecolari dotate di carica, ad esempio,
negativa. I recettori possono diffondere lateralmente. scorrendo sulla
membrana, in risposta alle forze esercitate su di essi. Se due o più
glicoproteine si avvicinano a sufficienza, formano un complesso proteico che
può costituire un canale preferenziale per lo scambio di particolari ioni tra
cellula e ambiente esterno. Le variazioni di tali flussi ionici possono costituire
il segnale che innesca profonde alterazioni nella cellula.
Ciò premesso, si consideri la cellula in sospensione in un mezzo, ove un
opportuno generatore esterno induce un campo elettrico costante nel tempo.
Dato che il mezzo presenta di solito una resistività elettrica relativamente
bassa, la corrente elettrica tende a scorrere, in buona parte, intorno alla
cellula. In altre parole, la frazione di corrente elettrica che interessa
direttamente la cellula è piccola, poiché la membrana cellulare offre una
resistenza abbastanza elevata rispetto al mezzo circostante.
I recettori di membrana, se la loro carica è negativa, tendono ad accumularsi
all'anodo, formando vasti aggregati, sotto l'azione di trascinamento del
campo elettrico. La probabilità di incontro tra due recettori e la conseguente
formazione di aggregati risultano così notevolmente aumentate per l'azione
elettroforetica del campo elettrico e potrebbero dar luogo all'innesco di quei
processi cellulari che dipendono dall'esistenza dei suddetti aggregati.
Nell'ultimo decennio il loro studio è andato crescendo, assumendo negli
ultimi anni un ritmo vertiginoso.
Le applicazioni cliniche realizzate soprattutto in campo ortopedico e quelle
che si profilano in altri campi (genetica,oncologia) sono sufficienti a
giustificare la dinamica espansione del settore e le grandi speranze in esso
riposte.
3
CONSIDERAZIONI GENERALI
Prima di entrare nel vivo del problema, conviene esaminare gli aspetti
elementari dei fondamenti fisici su cui si basano le interazioni menzionate.
Essi chiariranno il ruolo fondamentale che hanno le forze elettriche in molti
processi cellulari.
I tessuti del corpo umano sono in condizione di condurre una corrente
elettrica in quanto i fluidi di cui sono per lo più composti contengono ioni che
quindi si comportano da elettroliti. Come in una soluzione salina, gli effetti
sui tessuti viventi sono molto simili, essendo il corpo umano un perfetto
conduttore o “un grande elettrolita”, cioè un corpo imbevuto in acqua salata.
Così, quando un corpo umano viene inserito in un circuito in cui passa
corrente elettrica, anioni e cationi che saturano i liquidi del corpo, si spostano
rispettivamente verso l’anodo o verso il catodo. Questo flusso ionico
4
comporta alterazioni nella normale omeostasi fisico-chimica dei tessuti, con
notevoli ripercussioni sullo stato biologico e fisiologico dell’organismo.
L’acquisizione di nozioni sulle strutture cellulari e sui meccanismi preposti
ad un adeguato equilibrio elettrico, sono il presupposto per ogni ulteriore
approfondimento sull’uso dell’energia elettrica a scopo terapeutico.
BIOFISICA DELL’ENERGIA ELETTRICA
Il tessuto umano può essere quindi considerato un dielettrico in cui
l’incremento
della
frequenza
elettrica
comporta
un
decremento
dell’impedenza,
ed essere rappresentato come un condensatore con capacità C con una
conduttanza G in parallelo
C= ε0 εr A/x capacità
G= σA/x conduttanza
5
ε=permittività
σ=conduttività
6
In questo dielettrico, se la frequenza è ω, la caduta di impedenza è espressa
da :
σ=conduttività
permittività ε” =-------------------ωε0
Quando la frequenza è bassa, il tessuto subisce una dispersione elettrica da
polarizzazione dei contro-ioni in prossimità della superficie carica e da
polarizzazione delle membrane come evidenziato dai valori di conduttività.
7
La correlazione tra σ=conduttività, ε=permittività e ω=frequenza, viene
rappresentata da diversi modelli che portano ai medesimi risultati, tra cui si
La barriera principale al passaggio transdermico è rappresentata dallo strato
corneo (S.C.) della pelle che misura 10-15 micrometri di spessore e consiste in
diversi strati di cellule non attraversabili.
I costituenti strutturali della membrana danno origine alle proprietà elettriche
che generano POTENZIALI ELETTRICI.
Le cellule nervose e muscolari, sono particolarmente "eccitabili", cioè capaci
di trasmettere impulsi elettrochimici lungo la loro membrana. Anche nelle
cellule ghiandolari, nei macrofagi e nelle cellule ciliate, le variazioni del
potenziale di membrana giocano un ruolo significativo nel controllo di molte
funzioni cellulari.
Innanzitutto si deve considerare che i liquidi che si trovano all'interno ed
all'esterno delle cellule sono soluzioni di elettroliti contenenti circa 155 mEq
litro di anioni ed una uguale quantità di cationi.
In genere, lungo la superficie interna della membrana cellulare, si accumula
un lievissimo eccesso di ioni negativi (anioni) mentre ioni positivi (cationi) si
accumulano all'esterno della membrana. Conseguentemente si instaura
attraverso
la
membrana”.
8
membrana
un
potenziale
denominato
“potenziale
di
BASI FISICHE DEI POTENZIALI DI MEMBRANA
I due meccanismi fondamentali mediante i quali i potenziali di membrana
possono essere generati sono: trasporto attivo di ioni, attraverso la
membrana, che provoca uno sbilanciamento tra cariche negative e positive
presenti ai due lati della membrana e la diffusione di ioni attraverso la
membrana stessa, per differenza di concentrazione tra le due facce della
membrana che contribuisce allo squilibrio delle cariche.
Questa differenza di potenziale elettrico possiede una densità di carica
negativa dal lato citosolico ed ha valori variabili che raggiungono i 100 mV
che possono essere misurati inserendo un elettrodo all’interno e uno
all’esterno della cellula.
La corrente fluisce nel circuito costituito da:fili, soluzione salina del bagno, elettrodi e membrana cellulare;la resistenza inserita
sull’elettrodo portatore di corrente ha un valore molto elevato, relativamente alla resistenza degli altri componenti del circuito
stimolatore, così da mantenere costante la corrente stimolante.L’amplificatore del circuito di registrazione ha una resistenza d’ingresso
molto alta, in modo da evitare che anche una minima corrente possa sfuggire dalla cellula attraverso l’elettrodo registratore.
9
Potenziale di riposo delle cellule
Alla base del potenziale di riposo, è possibile individuare altri tre tipi di
potenziali :
• Potenziale di equilibrio
• Potenziale di diffusione
• Equilibrio di Gibbs-Donnan
Il potenziale di equilibrio
10
E’ dovuto, come già visto, ad un potenziale elettrochimico creato da gradienti
di concentrazione di una sostanza carica elettricamente, attraverso una
membrana: un gradiente chimico spinge in una direzione e l’altro gradiente
nell’altra; quando le due forze si equivalgono, si instaura un POTENZIALE
DI EQUILIBRIO (PER QUELLO IONE).
I potenziali di equilibrio non tendono ad estinguersi ma si mantengono nel
tempo.
E’ sufficiente considerare una vaschetta divisa in due compartimenti, da una
membrana permeabile solo al K+, contenenti una soluzione salina di KCl
differentemente concentrata tra i due lati.
11
Questo flusso esisterà fino a quando i valori dell’intensità delle forze chimica
ed elettrica non saranno equivalenti.
Il potenziale di equilibrio può essere calcolato grazie all’equazione di Nerst
RT
[i]2
E=
ln
Zi F
[i]1
Dove: R=costante dei gas ; T=temperatura;
F=costante di Faraday ; Z= valenza ione
(RT/ZF)ln= 61 log
Siccome Z=1, F,T e R sono delle costanti, l’equazione di Nerst può anche
essere scritta come:
Ei= 61 log ([i]2/[i]1)
L’equazione di Nerst esprime il potenziale di equilibrio di uno ione e
stabilisce “quale deve essere la differenza di potenziale ai lati di una
membrana, permeabile ad un solo ione concentrato in modo differente ai lati
di essa, affinchè quello ione, con quella differenza di concentrazione, sia
all’equilibrio”.
Potenziale di diffusione:
Ai lati di una membrana, permeabile a tutte le specie ioniche ma in maniera
diversa, esiste un potenziale di diffusione. Il flusso generato dalla forza
chimica non è uguale a quello generato dalla forza elettrica per cui esistono
dei flussi netti.
Questi potenziali sono anche detti “equilibranti” in quanto tendono ad
annullare tutti i gradienti che li hanno generati, quindi non si mantengono
nel tempo poiché tendono ad estinguersi!
12
La membrana, per l’“equilibrio di Gibbs-Donnan” è permeabile a più specie
ioniche ma impermeabile almeno ad una delle specie ioniche presenti. Ciò ha
importanti conseguenze a livello fisiologico: gli anioni proteici spostano gli
anioni diffusibili fuori dalla membrana e trattengono ioni di segno opposto
come, ad esempio, K+ o anche H+.
Questa differente concentrazione degli ioni crea una pressione osmotica
maggiore nell’ambiente intracellulare.
Lo spostamento degli ioni diffusibili provoca, appunto, quel po-tenziale
elettrico di equilibrio espresso dall’equazione di Nerst.
Equazione di Goldman
Esperimento su un assone:
il potenziale di equilibrio dello ione, registrato mediante elettrodi, a
concentrazioni esterne del K+ maggiori di 10 mM, era uguale a quello
calcolato con l’equazione di Nerst, mentre a concentrazioni esterne di K+
minori di 10 mM, ciò non si verificava. Quindi, il rapporto di proporzionalità
diretta veniva a mancare proprio dove la [K+] era vicina a quella fisiologica (4
mM).
Ciò confutava che si potesse trattare di un potenziale di equilibrio. Per cui,
supponendo che la membrana sia diversamente permeabile alle diverse
specie ioniche, si è formulata una relazione, evoluzione dell’ equazione di
Nerst.
L’ equazione di Goldman, tiene conto anche del “fattore di permeabilità”:
PK+[K+]0+PNa+[Na+]0+PCl-[Cl-]i
Em=61 log
PK+[K+]i+Pna+[Na+]i+PCl-[Cl-]0
13
in cui il Cloro è invertito perché ha carica negativa.
Posto che il Cl- si distribuisce in base al potenziale determinato dagli
spostamenti degli ioni Na+ e K+, ai quali la membrana è più permeabile, il suo
apporto è da considerare trascurabile.
Ponendo PK+>100 PNa+ si può dividere ciascun termine dell’equazione per PK+
ottenendo così:
[K+]0 + ß [Na+]0
Pna+
Em= 61log
dove ß=
[K+]i + ß [Na+]i
PK+
=0,01
Ad elevate concentrazioni di K+ diminuisce il valore di β per cui è un fattore
irrilevante.
Il potenziale di riposo è, quindi, un potenziale di diffusione spiegabile con
l’equazione di Goldman e mantenuto stabile mediante un meccanismo
attivo, detto “POMPA SODIO-POTASSIO”.
Non si tratta, pertanto, di un potenziale di equilibrio ma di uno “stato
stazionario”, come tutte le condizioni fisiologiche.
CIRCUITO ELETTRICO EQUIVALENTE DI MEMBRANA
Serve a comprendere cosa succede quando stimoliamo una membrana con un
generatore di forza elettromotrice.
Il circuito è costituito da:
-un condensatore (separare cariche);
-generatore di forza elettromotrice (caricare la membrana);
14
-resistenza o conduttanza (=1/R) perché esiste un flusso di elettroni. (La
conduttanza è l’analogo elettrico della permeabilità, cioè la facilità con cui gli
ioni possono attraversare un canale ed è in relazione inversa alla resistenza di
membrana: la conduttanza è il reciproco della resistenza g=1/R)
→Più è elevata R, più piccola è la conduttanza.
Poniamo, per esempio che questo circuito sia costituito da un condensatore
(membrana) permeabile solo al potassio.
Quando il circuito viene chiuso, il condensatore (la membrana) comincia a
caricarsi perché Em= Eb: le cariche positive e negative si dispongono ai lati del
condensatore ma non lo attraversano mai in quanto le piastre che lo
costituiscono sono separate da un “dielettrico”.
Il flusso di elettroni continuerà ad esserci fino a quando non si avrà che Em =
Eb.
Quindi, tenendo presente la legge di Ohm (per la quale, il flusso di uno ione
attraverso un canale è direttamente proporzionale alla conduttanza del canale
e all’ampiezza del potenziale elettrico:I=gxE. Più grandi sono il potenziale
elettrico e la conduttanza,maggiore è il flusso di ioni attraverso la membrana,
analogamente al flusso d’acqua in un tubo: più elevata è la pressione e più il
tubo è grosso, maggiore è la quantità di acqua che passa).
( “L’intensità di corrente è direttamente proporzionale alla differenza di
potenziale esistente tra i capi di un conduttore”), si deduce che la corrente nel
circuito, carica il condensatore in quanto esiste una differenza di potenziale
lungo il circuito.
La batteria presente nel circuito non è altro che la differenza di potenziale
chimico esistente ai lati di una membrana.
Per rappresentare, però, un circuito elettrico che si riferisca ad una membrana
reale, bisogna aggiungere:
15
-la resistenza al sodio in quanto in una membrana reale non è presente solo
una specie ionica;
-le diverse concentrazioni delle diverse specie ioniche;
-le relative forze spingenti;
-i relativi potenziali chimici;
Un concetto è fondamentale:
“Quando ci sono più ioni a cui la membrana è permeabile, essa tende a
caricarsi ad un valore più prossimo al potenziale di equilibrio dello ione a cui
è più permeabile”.
In un circuito elettrico ciò significa che il valore del potenziale del
condensatore sarà più prossimo al valore del potenziale di equilibrio dello
ione che presenta minore resistenza.
Quindi, il condensatore si caricherà come lo carica la batteria presente nel
circuito, con potenziale EK+.
CIRCUITO ELETTRICO EQUIVALENTE DI UNA MEMBRANA REALE
16
Na+/K+
In virtù dell’esistenza di questi potenziali elettrici ai due lati della membrana
e, in alcune cellule, la capacità di modificare questi potenziali, alcune cellule
nervose e muscolari, generando impulsi elettrici, inviano messaggi biologici.
Difatti, se da un lato della membrana la concentrazione degli ioni aumenta,
anche il loro flusso passivo attraverso il canale specifico aumenta fino a una
velocità massima su cui si livella (il flusso si satura). L’afflusso passivo di ioni
attraverso i canali ionici viene continuamente contrastato dall’espulsione
attiva e specifica di ioni attraverso le pompe ioniche che funzionano grazie
all’energia cellulare.
Il numero delle cariche elettriche positive in entrata, infatti va bilanciato con
l’espulsione di un eguale numero di cariche elettriche. L’ineguale
distribuzione degli ioni sui due lati della membrana, equivale a una
differenza di concentrazione ionica fra dentro e fuori la cellula, manifesta la
forza elettrica che tende a far entrare ioni K+ nella cellula, e il suo valore di
equilibrio può essere calcolato, dall’intensità del gradiente di concentrazione
degli ioni K+.
La conduttanza della membrana per ciascuna specie ionica dipende dal
numero di canali specifici presenti sulla membrana.
17
ricordano quelli di Debye e Cole-Cole.
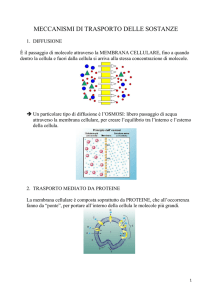
PASSAGGIO DI IONI
Nel modello di membrana sopra riprodotto, un gruppo di sostanze in
soluzione (ioni, zuccheri, aminoacidi) si trovano in concentrazioni diverse
all’esterno e all’interno della cellula :
A. L’esterno a sinistra, ha una concentrazione maggiore.
18
B. Legandosi a specifici siti dei canali ionici alcune molecole (chiodini)
attivano la pompa di scambio del sodio e del potassio : gli ioni Na sono
attivamente pompati fuori dalla cellula mentre contemporaneamente gli ioni
potassio K
sono pompati all’interno.
LASCIAPASSARE ALL’INGRESSO DELLE MOLECOLE ATTRAVERSO I
RECETTORI E CANALI IONICI DI MEMBRANA
I RECETTORI: STRUTTURE DI MEDIAZIONE TRA I PRIMI ED I SECONDI
MESSAGGERI
Quando un segnale chimico perviene a una cellula bersaglio, modifica diversi
processi: reazioni catalizzate da enzimi, trasporto di ìoni, trascrizione di geni.
Questa interazione con i recettori specifici localizzati sulla superficie della
cellula bersaglio o dentro il suo citoplasma, è l’espressione di come la cellula
bersaglio risponde o meno al segnale chimico.
19
LA NATURA DEI RECETTORI.
Il recettore è una proteina alla quale la molecola può legarsi con elevata
specificità data dalla conformazione peculiare della molecola segnaletica.
E’ciò che facilita il legame con il suo recettore. Le altre molecole, anche solo
leggermente diverse, possono non essere in grado di occupare i siti di legame
del recettore.
Segnale chimico A---- Segnale chimico B----Segnale chimico C
Le molecole dei recettori hanno configurazioni specifiche destinate a selezionare i diversi segnali chimici. Sebbene i segnali chimici A,B e C abbiano
configurazioni molto affini tra di loro, B calza esattamente la conformazione del recettore, per cui solo B si lega al recettore e influenza la cellula
bersaglio.
La molecola si lega al suo recettore anche con elevata affinità, cioè con un
legame forte.
Quindi solo la molecola segnaletica si può legare e restare adesa al recettore.
20
Ciò riguarda sopratutto i recettori ormonali, perché gli ormoni che
pervengono alle cellule bersaglio attraverso il flusso sanguigno sono per lo
più presenti in concentrazioni ridotte (10 nmol/L o meno).
L’instaurarsi di un legame tra un ormone ed il suo recettore su una cellula
bersaglio provoca una sequenza di eventi, che induce un insieme di
mutamenti che sono la risposta cellulare all’ormone .
RECETTORI CITOPLASMATICI.
I recettori per tutti gli ormoni steroidei, per la vitamina D (uno sterolo) e per
gli ormoni tiroidei sono proteine localizzate all’interno delle cellule bersaglio.
recettore per molecole idrosolubili (ad es.polipeptidi) posto sulla
membrana plasmatica
recettore citoplasmatico per molecole liposolubili (ad es. steroidi) di una cellula bersaglio
Gli ormoni devono diffondere attraverso la membrana cellulare per accedere
ai loro recettori, facilitati dalla propria liposolubilità.
Al legame tra steroidi o vitamina D e i loro recettori presenti nel citosol fa
seguito lo spostamento del complesso recettore-ormone (HR) nel nucleo,
dove si lega ai siti accettori specifici del DNA regolando in tal modo la
trascrizione di geni specifici. Anche gli ormoni tiroidei esercitano i loro effetti
21
tramite un meccanismo simile, ma i recettori di questi ormoni sono
concentrati nel nucleo anche in assenza degli ormoni stessi.
RECETTORI DELLA MEMBRANA PLASMATICA.
Gli ormoni polipeptidici e le catecolamine, quando si legano ai recettori della
membrana plasmatica delle cellule bersaglio provocano una serie di eventi
all’interno della cellula senza penetrarvi.
Quando gli ormoni si legano ai loro recettori, gli effetti sono mediati da
secondi messaggeri generati dentro la cellula.
I recettori disposti sulla membrana plasmatica sono costituiti da proteine (l%
della massa totale delle proteine presenti).
Il recettore opera in modo simile a un trasduttore, cioè converte un evento
extra cellulare — il legame con la molecola segnaletica — in una risposta
intracellulare che modifica il comportamento della cellula bersaglio.
La famiglia più numerosa di recettori della membrana è quella dei recettori
legati a proteine G, cioè proteine legate ad un nucleotide guaninico, il GTP o
il GDP. Le proteine G sono situati sulla superficie interna della membrana
22
plasmatica e stabiliscono un collegamento tra il recettore e la sua proteina
effettrice.
Lo stabilirsi di un legame tra un primo messaggero ed il suo recettore
modifica la forma del recettore stesso, cosicché esso può interagire con una
proteina G specifica. Questa interazione porta alla perdita del GDP dalla
subunità a e all’attacco di un GTP. Il legame con il GTP attiva la subunità a in
modo da farla staccare dal complesso beta-y per farla muovere lungo la
superficie interna della membrana plasmatica finchè non raggiunge la
proteina effettrice.
Quando un primo messaggero si lega ad un recettore accoppiato ad una proteina G, il recettore modifica la sua conformazione e attiva
diverse sub unità alfa della proteina G e attiva una singola proteina effettrice che, a sua volta, genera molte molecole intracellulari di
secondi messaggeri, ciascuno dei quali attiva molti enzimi, i quali possono regolare molte proteine bersaglio.
L’effettore è un enzima o un canale ionico.
L’interazione con la subunità a attiva o inibisce un enzima specifico oppure
apre o chiude uno specifico canale ionico. Il risultato dipende dal primo
messaggero.
23
Sono un migliaio circa i recettori accoppiati alle proteine G: comprendono i
recettori per ormoni peptidici, neurotrasmettitori e neuropeptidi.
Questo grande numero di recettori diversi enfatizza la circostanza che il
recettore sulla cellula bersaglio ed i meccanismi con questo associati
determinano la risposta specifica della cellula all’ormone.
Ligandi: agonisti ed antagonisti.
Qualsiasi molecola segnaletica, che si lega con elevata specificità a un
recettore, viene denominato ligando. Ogni ligando in grado di legarsi ad un
recettore sulla membrana plasmatica e di indurre una risposta fisiologica
viene definito agonista.
I ligandi che si legano con un’elevata affinità ad un recettore ma non evocano
alcuna risposta vengono denominati antagonisti perché, occupando i
recettori, interferiscono con l’azione di un agonista o vi “si oppongono”.
Gli antagonisti dei recettori ormonali possono avere una grande importanza
terapeutica in medicina. Le catecolammine circolanti aumentano molto la
frequenza dei battiti e il volume di sangue con ciascuna contrazione cardiaca,
attività che può elevare la pressione arteriosa. Un antagonista delle
catecolammine: propranololo, viene impiegato per bloccare questi effetti
indesiderati delle catecolammine.Così lo spironolattone, antagonista del
recettore dell’aldosterone che è un ormone steroideo che accresce la
ritenzione renale del Na+ e anche una ritenzione di acqua. Il trattamento con
spironolattone blocca l’azione dell’aldosterone e produce un aumento
24
dell’escrezione d’acqua, molto importante nei casi di grave ritenzione idrica
e di edemi.
LE VARIAZIONI QUANTITATIVE DEI RECETTORI
Gli studi quantitativi sul numero dei recettori, effettuati mediante ligandi
radiomarcati hanno rivelato che la concentrazione endocellulare di molti
recettori può essere regolata. Per esempio, l’incremento della concentrazione
di un agonista in circolo, può portare ad una diminuzione del numero dei
recettori presenti nelle cellule bersaglio.
Questo fenomeno è definito col termine regolazione verso il basso (o downregulation) del numero dei recettori e si accompagna con una attenuazione
della risposta fisiologica (desensibilizzazione delle cellule all’agonista
circolante). Quando la concentrazione dell’agonista si riduce, il numero dei
recettori aumenta di nuovo. Questo fenomeno rende molte cellule
particolarmente sensibili ad un cambiamento della normale concentrazione di
un segnale chimico, in contrapposizione alla sua concentrazione assoluta.
Sovente il numero dei recettori sulla membrana plasmatica diminuisce perché
il legame con molecole agoniste provoca l’internalizzazione nella cellula di
complessi recettori-agonisti per opera di processi endocitosici, seguita dal
loro trasferimento ai lisosomi e dalla loro degradazione.
Il meccanismo down-regulation non è molto chiaro per i recettori
citoplasmatici: potrebbero essere coinvolti numerosi eventi: inattivazione dei
recettori, modificazioni della velocità di sintesi o della velocità di
degradazione delle proteine recettoriali.
25
SEGNALI INTRACELLULARI: SECONDI MESSAGGERI
Ruolo dei secondi messaggeri nel determinare la risposta cellulare ad un
segnale extracellulare (interazione tra ligando e recettore)
La conformazione (forma tridimensionale) di una molecola recettoriale viene
modificata quando una molecola segnaletica extracellulare (primo
messaggero) si lega ad essa.
Tale cambiamento della conformazione del recettore genera un secondo
messaggero, ma serve ad aumentare o amplificare il segnale.
L’amplificazione ha luogo perché molte proteine G (fino a 100) vengono
attivate per ciascuna molecola segnaletica extracellulare che si lega ad un
recettore. Sebbene ciascuna proteina G attivata mette in azione una sola
proteina effettrice, ogni effettore genera molte molecole di secondi
messaggeri.
Un’amplificazione aggiuntiva avviene in ciascuna delle fasi lungo tutto il
percorso segnaletico.
Per esempio:
•
ogni molecola del secondo messaggero può attivare molte molecole
enzimatiche, ogni enzima attivato può regolare molte proteine bersaglio,
•
i vari bersagli collaborano per mediare la risposta cellulare specifica.
Questa cascata di eventi intracellulari amplifica molto il segnale extracellulare
originario.
L’AMP CICLICO (cAMP).
26
Una proteina effettrice della membrana è l’enzima adenilato ciclasi.
•
Questo enzima catalizza una reazione che sfrutta l’ATP per generare
molte molecole di un secondo messaggero conosciuto come AMPciclico
(cAMP).
•
L’adenilato ciclasi viene stimolata dalla subunità a della proteina G che
viene attivata dalla molecola che si è legata al recettore.
•
L’AMP ciclico modifica il comportamento della cellula tramite
l’attivazione dell’enzima protein chinasi A (o chinasi A o PKA).
•
Questa chinasi attivata catalizza la fosforilazione (l’aggiunta di gruppi
fosforici) di specifiche molecole proteiche che di solito, modificano l’attività
biologica. Se tale proteina è un enzima, potrebbe risultare attivata o inattivata
la propria capacità enzimatica.
INOSITOL TRIFOSFATO, DIACILGLICEROLO E IONI CALCIO.
Un’altra proteina effettrice nella membrana plasmatica è la fosfolipasi C,
forma fosforilata di un fosfolipide di membrana: fosfatidilinositolo bisfosfato
(PIP2).
Quando è attivata dalla subunità a della proteina G, la fosfolipasi C catalizza
la demolizione del PIP2 a inositol trifosfato e diacilglicerolo, due secondi
messaggeri intracellulari.
L’inositol trifosfato (IP3) libera ioni Ca2 dai depositi intracellulari, come
quelli del reticolo endoplasmatico (ER).
27
Tale effetto è transitorio, ma attiva un aumento più sostenuto del livello di
tali ioni per afflusso di ioni Ca2± extracellulari attraverso i canali per il Ca2+
della membrana plasmatica.
Quando i canali sono aperti si stabilisce un gradiente elettrochimico molto
favorevole ad un afflusso passivo di ioni Ca2+ extracellulari con incremento
della concentrazione citosolica di ioni Ca2+ liberi.
L’aumentato livello degli ioni Ca2 disponibili consente a tale catione di
legarsi con un’elevata affinità a proteine calcioleganti e di produrre dei
cambiamenti della conformazione di queste proteine e, pertanto, delle
modificazioni delle loro funzioni.
Alcune proteine calcioleganti non possiedono alcuna attività enzimatica ma,
appena si legano agli ioni Ca2+, modificano altre proteine.
Esempi di proteine Ca2- leganti sono: troponina C, rinvenibile nelle cellule
muscolari scheletriche e cardiache, e calmodulina (CaM), che si ritrova in
quasi tutte le cellule.
Lo stabilirsi di un legame tra un complesso Ca2+caImodulina ed una protein
chinasi calmodulino-dipendente (CaM Chinasi) attiverà la chinasi e porterà
alla fosforilazione di altre proteine con meccanismo simile a quello
determinato dall’attivazione della protein chinasi A (PKA).
Il sistema Ca2- calmodulina è più versatile del sistema del cAMP perché, oltre
a produrre delle modificazioni fisiologiche per il tramite della fosforilazione
di proteine, il complesso Ca2+calmodulina può attivare direttamente enzimi
28
come l’adenilato ciclasi e la fosfodiesterasi delI’AMP ciclico, cioè gli enzimi
che producono e demoliscono l’AMP ciclico.
Chiaramente, questo permette delle interazioni tra le vie segnaletiche
intracellulari mediate dal cAMP e dal Ca2.
Il diacilglicerolo (DAG), insieme con il Ca2, attiva le protein chinasi C (o
chinasi C o PKC). La protein chinasi C citosolica non viene influenzata dal
Ca2+,ma in presenza di diacilglicerolo, si lega alla membrana, dove viene
attivata dai fosfolipidi.
Attivata, la PKC è estremamente sensibile alla stimolazione da parte degli
ioni Ca2±che aumenta la sua concentrazione citosolica.
La PKC attivata fosforila proteine specifiche tra cui le proteine coinvolte nel
controllo della divisione cellulare.
ECCITABILITÀ DELLA MEMBRANA.
In certi tipi di cellule, i recettori accoppiati alle proteine G regolano una
proteina effettrice che è un CANALE IONICO DELLA MEMBRANA
PLASMATICA
Canale ionico chiuso
29
Canale ionico aperto
c)Canali ligando
Tipi di canale ionico (a) I canali passivi sono specifici per singoli ioni (b) I canali voltaggio-dipendenti si aprono o si chiudono quando
avvertono una variazione specifica del potenziale di membrana (c).I canali attivati chimicamente sono regolati da un trasmettitore
chimico.
Ciò modifica la permeabilità ionica e quindi l’eccitabilità elettrica della
membrana.
Un esempio è l’acetilcolina che riduce sia la velocità che la forza contrattile
del muscolo cardiaco. Da ciò l’azione inibitoria dell’acetilcolina sul cuore.
Alcuni recettori di membrana plasmatica sono anche dei canali ionici, e la
modificazione della loro conformazione che si verifica nel recettore quando
ad esso si lega il ligando determina l’apertura del canale ionico. Molti
neurotrasmettitori operano in tal modo.
Il recettore per l’acetilcolina situato in corrispondenza delle giunzioni
neuromuscolari (sinapsi o placche motrici) è un esempio.
L’acetilcolina, rilasciata dalla cellula nervosa, attraversa l’intervallo sinaptico
per legarsi al proprio recettore sulla cellula muscolare scheletrica.
Tale recettore forma un canale ionico che si apre in modo transitorio quando
ad esso si lega l’acetilcolina.
Il Na+ penetra nella cellula muscolare attraverso questo canale, rendendo
meno negativo il potenziale della membrana e quest’ultima più eccitabile in
un’area localizzata. Questo attiva un potenziale d’azione, che si diffonde
rapidamente a tutta la membrana della cellula muscolare scheletrica e segnala
al muscolo di contrarsi.
30
Differenti risposte all’acetilcolina:
Il recettore del miocardio è connesso con una proteina G, mentre quello del
muscolo scheletrico è un canale ionico regolato dal ligando.
Recettori differenti mediano risposte diverse allo stesso ligando
extracellulare.
IL GMP CICLICO (cGMP). Un altro secondo messaggero di grande
importanza per le cellule animali è il GMP ciclico (cGMP) formato dal GTP
grazie alla guanilato ciclasi.
Pare che il suo ruolo nella dilatazione dei vasi sanguigni, coinvolga
l’attivazione di specifiche protein chinasi cGMP-dipendenti. Il ruolo meglio
caratterizzato del GMP ciclico si svolge nell’occhio dei vertebrati, dove esso è
il secondo messaggero responsabile della conversione dei segnali visivi
ricevuti come input luminosi in impulsi nervosi.
31
COME VENGONO GENERATI I POTENZIALI D’AZIONE
32
Una differenza di potenziale si forma per squilibrio di cariche elettriche fra citosol e il liquido extracellulare, dovuto a movimenti ionici
secondo gradienti di concentrazione. (a) Gli ioni K+ escono dalla cellula seguendo il proprio gradiente di concentrazione, mentre gli
anioni sono trattenuti all’interno perché la membrana cellulare non li fa passare. Iniziano ad accumularsi cariche negative sulla
superficie interna della membrana. Gli ioni K+ usciti vengono attratti dalle cariche negative all’interno della cellula e iniziano ad
accumularsi sulla superficie esterna, ma in parte rientrano nella cellula perché sono attratti dalla carica negativa del citosol, mentre altri
ioni K+ continuano ad uscire per gradiente di concentrazione. (b) Raggiunto l’equilibrio elettrochimico, la forza chimica (gradiente di
concentrazione) che favorisce la fuoriuscita del K+ è uguale alla forza elettrica (potenziale di membrana) che favorisce l’ingresso. Dato
che (in questo esempio) l’unico ione che attraversa la membrana è il K+ , il potenziale di membrana all’equilibrio elettrochimico è uguale
al potenziale d’equilibrio per il K+.
33
MODELLI IN FISIOLOGIA
Flusso di massa e di calore
Le variazioni durante il potenziale d’azione sono dovute a movimenti ionici,
cioè all’apertura e alla chiusura di canali voltaggio-dipendenti che
controllano l’ingresso del Na+ e l’uscita del K+.
Le alterazioni del potenziale di membrana provocano modificazioni della
conformazione dei canali proteici, nei quali si aprono le porte che controllano
il passaggio degli ioni attraverso i canali.
Il canale Na+ ha due porte: una di attivazione e una di inattivazione. Queste
porte, secondo il loro stato di apertura o chiusura, determinano tre
condizioni: (1)di riposo, (2) di attivazione e (3) di inattivazione.
Canale ionico voltaggio dipendente per il sodio
Canale ionico voltaggio dipendente per il potassio
34
Il canale K ha una sola porta, e consente quindi due stati: apertura e chiusura.
Quando la cellula nervosa è a riposo, i canali Na+ dell’assone sono nello stato
di riposo;
le porte di inattivazione sono aperte,
quelle di attivazione sono chiuse e impediscono il passaggio degli ioni Na+.
Le fasi del potenziale d’azione, corrispondenti ai diversi stati funzionali dei canali voltaggio-dipendenti per il Na+ e per il K+.
Applicando uno stimolo positivo all’assone,
35
i canali Na+ di attivazione si aprono e passano dallo stato di riposo a quello
di attivazione.
Gli ioni sodio, attraverso i canali aperti, depolarizzano gradualmente la
membrana verso il valore soglia, quindi si attivano molti canali Na+
voltaggio-dipendenti e l’ingresso di sodio diventa molto rapido. Ciò
depolarizza ulteriormente la membrana e apre sempre più canali di
attivazione di sodio e quindi maggiore depolarizzazione per aumento locale
della conduttanza al sodio (gNa).
Alla fine della depolarizzazione, tuttavia, non viene raggiunto ENa, perché le
porte di inattivazione chiudono i canali Na+, limitando l’uscita di questo
ione.
Anche il gradiente elettrico diventato opposto, limita l’afflusso di sodio,
mentre l’aumento della corrente in uscita di K+, impedisce ulteriori
spostamenti del potenziale di membrana verso ENa.
Le porte di inattivazione rimangono chiuse per un certo tempo, dopodiché
entrambe le porte tornano allo stato di riposo.
Nella fase di depolarizzazione rapida, la conduttanza al potassio (gK)
aumenta gradualmente, per l’apertura canali K+ lenti, voltaggio-dipendenti:
l’uscita del po tassio accelera quando lo spostamento verso l’interno di Na+
inverte il potenziale di membrana.
L’uscita del K+ è dovuta alla stessa ragione che provoca l’ingresso del Na+;
gradienti elettrico e chimico favorevoli, insieme con un aumento della
permeabilità di membrana.
36
L’uscita più rapida del K+ provoca una perdita netta di rispetto al valore di
riposo: questo fenomeno si chiama iperpolarizzazione postuma.
Finita questa fase, si ristabilisce il potenziale di riposo della membrana, le
conduttanze ioniche ritornano ai valori di riposo e la pompa Na+/K+
mantiene i normali rapporti di concentrazione di questi ioni fra l’interno e
l’esterno.
L’insieme dei meccanismi che riportano la membrana al potenziale di riposo
dopo la depolarizzazione costituisce il fenomeno della ripolarizzazione. La
prima causa della ripolarizzazione è l’aumento della conduttanza al potassio
(gK) verso l’esterno.
LE PROTEINE DEI CANALI IONICI ED IL LORO GATING.
I meccanismi a canale sono particolarmente importanti per il rapido
spostamento transmembrana di ioni come l'Na+ ed il K+. Molte differenti
strutture a canale e disposizioni delle subunità relative sono state
caratterizzate per quanto attiene alle proteine canale. I canali per il K+
consistono in quattro subunità identiche, ciascuna delle quali contiene sei
segmenti transmembrana. I canali per il Na+ consistono di una singola catena
polipeptidica che contiene quattro "domini" ripetuti che corrispondono alle
quattro subunità del canale per il K+. In generale un canale idrofilo od un
poro attraversante la membrana viene formato quando i segmenti o le
subunità della proteina che attraversano da parte a parte la membrana si
raggruppano,
in
modo
generalmente
simile
a
quello
discusso
precedentemente per i canali per l'acqua formati dalle acquaporine. Il canale
permette, se aperto, una velocità di trasporto maggiore di quella consentita
da un vettore. Per esempio, alcuni canali consentono agli ioni di transitare
attraverso di essi ad una velocità di 108 ioni/sec, mentre i vettori più veloci
37
spostano i soluti attraverso le membrane a velocità non maggiori di 105
molecole/sec.
Lo ione va incontro ad interazioni specifiche con gruppi dotati di cariche,
posti lungo i lati del canale. Queste reazioni favoriscono il transito degli ioni
attraverso il canale. I tipi di gruppi con cariche elettriche presenti entro il
canale potrebbero essere importanti anche per la determinazione della
specificità di quel canale per un dato tipo di ione. Per esempio, i canali per il
K+ sono 100 volte più permeabili al K+ che non al Na+.
Ciò che differenzia i canali dai vettori, oltre alla velocità globale di trasporto,
è che un canale può essere tenuto chiuso da parte di un "cancello". Un canale
chiuso non permetterà alcuno spostamento di ioni, anche se il gradiente
elettrochimico potrebbe favorirlo. Tra i meccanismi adoperati per regolare
l'apertura e la chiusura ("gating") dei canali ionici si includono sia i
cambiamenti del potenziale di membrana (canali regolati dal voltaggio) che i
legami tra molecole specifiche e la proteina dei canali (canali regolati dal
ligando).
E’ grazie al Nobel Peter Agre della Johns Hopkins University che oggi
sappiamo del lasciapassare all’ingresso delle molecole attraverso questo filtro
particolarmente selettivo (canale ionico di membrana),costituito da proteine
che formano la membrana cellulare, che rappresenta
l’ultimo baluardo
(fenomeno del gating cioè apertura e chiusura delle molecole) e che funge da
cancello dopo opportuna identificazione (tra lo spazio intra ed extracellulare) per mantenere la cellula in equilibrio con l’ambiente. Per catturare
gli “ioni giusti”la cellula crea all’interno del canale una struttura uguale alla
molecola in cui si trova quel determinato ione nell’ambiente esterno. Lo ione
va incontro ad interazioni specifiche con gruppi dotati di cariche, posti lungo
i lati del canale, che ne favoriscono il transito. I tipi di gruppi con cariche
elettriche presenti entro il canale potrebbero essere importanti anche per la
determinazione della specificità di quel canale per un dato tipo di ione (per
esempio, i canali per il K+ sono 100 volte più permeabili al K+ che non al
38
Na+). Un canale può essere tenuto chiuso da parte di un "cancello". Ciò non
permetterà alcuno spostamento di ioni, anche se il gradiente elettrochimico
potrebbe favorirlo. Con la cristallografia ai raggi X, oggi è possibile studiare i
dettagli atomici di una molecola. E’ stata identificata come una sorta di tubo
molecolare altamente selettivo, un filtro le cui pareti presentano atomi di
ossigeno disposti in modo simile a quello degli ossigeni delle molecole di
acqua che normalmente coordinano il potassio. Il lasciapassare è dato solo
allo ione potassio poiché esso è l’unico che si trova alla stessa distanza dagli
ossigeni della proteina, dopo aver subito un processo di deidratazione
all’entrata del canale. In questa fase di identificazione, il sodio, essendo più
piccolo, non viene quindi riconosciuto.
IL PASSAGGIO DI FARMACO ATTRAVERSO LO STRATO CORNEO:
VIA TRANS-EPIDERMICA-TRANSDERMICA
Lo S.C. consiste di corneociti morti, ricchi di cheratina e permeati in una
matrice extracellulare; gli interspazi tra corneociti sono riempiti da diversi
strati lipidici il cui complesso di elementi è simile ad una struttura a mattoni.
Questa barriera è interrotta da dotti ghiandolari e follicoli piliferi.
39
Strutture della pelle coinvolte nell’assorbimento percutaneo.
Siti di assorbimento percutaneo:A,trans cellulare;B,diffusione attraverso le giunzioni intercellulari;C,attraverso i dotti sebacei;D,trans
follicolare;E,attraverso i dotti sudoriferi
40
Il passaggio di farmaco attraverso lo strato corneo può avvenire attraverso tre
vie: 1) intracellulare attraverso i corneociti, 2) intercellulare attraverso la
matrice extracellulare, 3) annessiale attraverso i follicoli piliferi e i dotti delle
ghiandole sudoripare e sebacee. La via annessiale è la via d’elezione per i
farmaci idrofili avendo i pori caratteristiche polari.
Solo in alcune condizioni specifiche, come l’applicazione della ionoforesi,
diventa predominante la via annessiale. Quindi la via transepidermica,
comprendente le vie intra e intercellulari, è quella che offre le maggiori
41
possibilità di penetrazione e il passaggio si svolge con un processo di
diffusione passiva. La via intracellulare prevede il passaggio attraverso la
matrice extracellulare ed è da preferire per i farmaci lipofili. L’importanza
della via di penetrazione intracellulare è confermata dall’esistenza di una
relazione tra lipofilia di un composto e il suo coefficiente di permeabilità
attraverso la pelle. Quindi, la fase limitante la permeazione di una sostanza è
rappresentata da una barriera di natura idrofobica, come la matrice lipidica
extracellulare. Una eccessiva lipofilia del farmaco però, da un lato favorisce il
suo accumulo nello strato corneo, dall’altro ne ostacola la penetrazione negli
strati più profondi di natura più polare. Infine la via intracellulare,
presuppone il passaggio della molecola attraverso la parete cellulare del
corneocita e poi, superata la membrana, le molecole polari si orientano verso
le zone acquose del corneocita, mentre quelle lipofile si dispongono verso le
zone a maggior contenuto lipidico. Superato lo strato corneo le molecole
diffondono rapidamente attraverso gli strati dell’epidermide e nel derma
dove possono avvenire fenomeni di metabolizzazione, di inattivazione e, nel
caso di profarmaci, di attivazione.
Modificazioni nella permeabilità dello strato corneo si riflettono sulla
capacità di penetrazione delle sostanze applicate sulla pelle.
Il disordine nello strato lipidico aumenta il passaggio transdermico.
L’applicazione di un campo elettrico aumenta il trasferimento molecolare
attraverso la pelle. A basso voltaggio < 1 V le molecole vengono guidate
attraverso la barriera costituita dalla pelle (Oh et al. 1993 ; Cullander 1992)
La differenza di concentrazione ionica provoca, come già visto, una
diffusione attraverso una membrana, determinata dalla differente tendenza
che gli ioni hanno a diffondere da un lato all'altro, e viceversa.
Cosi, quando la concentrazione degli ioni da un lato della membrana è 10
volte più alta di quella del lato opposto, essendo il logaritmo di 10 uguale a 1,
la differenza di potenziale può essere calcolata come uguale a 61 millivolts.
42
Il potenziale di membrana, viene determinato quasi interamente dalla
differenza di concentrazione del potassio ai due lati della membrana, cioè tra
dentro e fuori la cellula, secondo la nota equazione di Nerst :
Questo potenziale viene determinato mediante la seguente formula (alla
temperatura corporea di 38°C):
FEM (in millivolts) = 61 log C1Conc. interna
C2Conc. esterna
Dove FEM rappresenta la d.d.p. esiste tra i due lati della membrana e C1 e
C2, rispettivamente la concentrazione del potassio-ione all’interno e
all’esterno della cellula. Il valore della d.d.p. trans-membrana a riposo varia
notevolmente, in un ambito compreso tra -40 e – 100 mV, con negatività
all’interno.
In ogni caso, due condizioni devono verificarsi perché si possa generare un
potenziale di membrana per effetto di una diffusione:
l) la membrana deve essere semi-permeabile, in modo da consentire agli ioni
di un segno di diffondere attraverso i pori più rapidamente degli ioni di segno opposto; e 2) la concentrazione degli ioni diffusibili, da un lato della
membrana, deve essere maggiore che nel lato opposto.
In assenza di gradiente di concentrazione la dipendenza corrente-voltaggio
della pelle è lineare (potenziale stazionario o di riposo).
Con un voltaggio più alto la dipendenza corrente-voltaggio non è più lineare
(Kastin, Bowman 1990-Inada 1994) ed il comportamento non può più essere
espresso dalla teoria dell’elettrodiffusione.
Lo S.C. che rappresenta la barriera più importante al trasporto, consiste in
una matrice corneocito-lipidica attraversata da follicoli piliferi e dotti
ghiandolari.
La matrice lipidica è formata da 70-100 doppi strati in sequenza, per cui un
voltaggio transdermico di 1 volt provoca una caduta della differenza di
potenziale (d.d.p.) attraverso ogni singolo doppio strato di circa 10 mV.
43
Cullander (1992) e Scott (1993) hanno dimostrato che dotti e bulbi piliferi
sono regioni dotate di alta densità di corrente.
I bordi dei dotti sono in linea con i due strati di cellule epiteliali. (Odland
1983).
Voltaggi di circa 1 V provocano una caduta della d.d.p attraverso ogni
membrana delle cellule epiteliali allineate al dotto o al bulbo di circa 250 mV.
Il campo elettrico crea pertanto nuove vie nelle pareti dei canali dei bulbi e
dei dotti.
Un potenziale di diverse centinaia di volts applicato alla pelle provoca, in un
breve intervallo di tempo, una diminuizione di 1000 volte della d.d.p.
(Prausnitz1993, Pliquett 1995).
La caduta della resistenza (depolarizzazione) avviene inizialmente a voltaggi
inferiori a 70 V per variazioni del doppio strato lamellare dello S.C.
La Farmaforesi elettrodica utilizza una corrente pulsata modulata a bassa
frequenza e moderato voltaggio per veicolare per via transdermica le
molecole dei farmaci.
Con l’uso di questi voltaggi, fondamentale è la via di veicolazione
rappresentata dai dotti e dai follicoli.
Chidmadzhev (2000), per spiegare i dati sperimentali, ha corredato una
propria teoria quantitativa del passaggio transdermico attraverso dotti e
bulbi piliferi: se viene immerso un campione di pelle in una soluzione di
elettroliti, dopo l’applicazione di un voltaggio pulsato rettangolare tra due
elettrodi posti sui due lati della pelle, la corrente elettrica fluisce
attraversando la matrice corneocito-lipidica dello S.C. e degli annessi.
Lo schema elettrico dello strato più esterno della pelle viene così descritto:
Rm e Cm rappresentano la resistenza e le capacità dello strato di matrice
corneocito-lipidica.
44
Resistori in parallelo e capacitori in serie nello S.C. rappresentano il campo
lipidico.
In media 15-20 strati di corneociti si trovano nello S.C. e ciascuno è separato
da uno strato di lipidi dello spessore di 0.05 micrometri.
Lo strato ha un effettivo spessore di 1 micrometro con una costante dielettrica
di 15-20.
Si può osservare che questo valore è intermedio tra i lipidi (2-3) e l’acqua
(circa 80).
Le fluttuazioni termiche laterali prodotte dalla corrente negli strati lipidici,
provocano nella pelle la formazione naturale di canali idrofobici.
Per trasferire molecole deve essere superato lo sbarramento di energia
esistente in un canale con raggio circa 0.4 nm.
La via più importante per il trasporto di molecole, mediante il sistema della
Farmaforesi, è rappresentata dai dotti e dai bulbi piliferi.
45
Kuzmin (1996) ha dimostrato che la permeabilità subisce un incremento,
durante l’applicazione di una corrente elettrica, prodotta dalle deformazioni
indotte nei bulbi piliferi e nei dotti.
Da un punto di vista fisico, i dotti possono essere considerati come dei tubi
lungo la lunghezza dei quali sono distribuiti parametri elettrici.
L’ aspetto che caratterizza i dotti è che la conduttività dispersa delle loro
pareti non è costante ma è in funzione della densità del campo elettrico che
induce i canali nella membrana plasmatica.
Questo modello può essere rappresentato da un sistema di equazioni
differenziali non lineari che mettono in relazione campo elettrico e parete
conducente, col tempo e con le coordinate lungo il tubo.(Chizmadzhev 1999)
Vicino alla zona di ingresso di un canale e particolarmente in caso di follicoli
piliferi, lo strato lipidico oscilla lungo l’asse x.
La lunghezza della regione di ingresso può essere calcolata in 40-100
micrometri circa.
Chizmadzhev et al.(1997), mediante un semplice modello geometrico degli
annessi cutanei con circuito elettrico equivalente, hanno calcolato la d.d.p.
lungo il tubo in un data frazione di tempo dall’inizio dell’impulso elettrico,
dimostrando una diminuizione della resistenza elettrica a cui corrisponde un
aumento della permeabilità. I calcoli e i dati sperimentali forniti
rappresentano il valido supporto al sistema.
46
Quando la corrente elettrica entra nell’ambiente acquoso dei dotti, si osserva
una fusione dei doppi strati lipidici di membrane, come dimostrato da
V.S.Markin e J.Albanesi (2002) mediante l’utilizzazione del cosiddetto “Stalk
model”.
Tale teoria chiarirebbe il perché della fusione e della dilatazione dei canali.
La Farmaforesi elettrodica utilizza questo effetto per il trasferimento di
molecole terapeutiche.
Il campo elettrico e la fusione dei canali non rappresentano comunque l’unico
mezzo per la veicolazione delle molecole, il calore e la presenza di composti
chimici possono influirne il passaggio.
Pliquett (2002) ha dimostrato che il calore struttura localmente i dotti ed i
corneociti.
Il flusso di corrente, attraversando la pelle, provoca un aumento di
temperatura che può influenzare le cellule, i lipidi e perfino le molecole
terapeutiche.
L’aumento di temperatura dipende dal voltaggio e dalla durata dell’impulso.
Con la Farmaforesi elettrodica e con il tipo di campo elettrico utilizzato,
queste modifiche sono sempre e costantemente reversibili.
Diversi dati sperimentali dimostrano che i campi elettrici e i composti chimici
(eparina per esempio) assieme, creano un ampliamento del cammino acquoso
che consente a un grosso numero di macromolecole di essere veicolate
attraverso la pelle. (Zewert and Vanbever-1999)
T. Kotnik et al. ( febbraio 2003 ) mediante l’uso di vari tipi di onde:
monopolari, bipolari pulsate, bipolari continue e modulate pulsate dimostra
il ruolo dell’ampiezza, della durata e della forma dell’onda elettrica
sull’elettro-permeabilizzazione.
47
La
figura
documenta
la
comparazione
dell’efficienza
della
permeabilizzazione cellulare in funzione del potenziale in volts/cm di un
impulso mono-polare che subisce un incremento da 2 a 100 microsecondi,
facendo osservare che non esiste differenza significativa in termini statistici.
La Farmaforesi elettrodica in effetti usa particolari forma d’onda modulate
per aumentare il flusso di molecole come è dimostrato dalle ricerche di
Kotnik.
B.R.Loke (2003) ha dimostrato mediante risonanza magnetica, che la mobilità
dell’acqua nei follicoli piliferi, sotto campo elettrico pulsato, è più alta che nel
resto della pelle.
Loke ha dimostrato inoltre che i pori idrogelizzati aumentano maggiormente
il passaggio transdermico.
In linea generale, la permeabilizzazione ad un farmaco può essere valutata in
base al campo elettrico applicato, ma assume un aspetto determinante anche
la forma dell’elettrodo.
In conclusione, la Farmaforesi elettronica fa uso di una caratteristica corrente
pulsata modulata che agisce non soltanto a livello della pelle, ma anche sulla
48
polarizzabilità delle molecole, per cui è possibile trasferire anche molecole
non ionizzate
VANTAGGI DEL PASSAGGIO TRANSDERMICO DEI FARMACI:
•
effettuare terapie con farmaci con breve emivita biologica
•
evitare condizioni di aggressività chimica nei confronti del
tratto intestinale
•
evitare l’effetto del primo passo epatico
•
minore quantità di farmaco necessario alla terapia;
•
maggiore concentrazione locale;
•
assoluta certezza che il farmaco arrivi alla zona d'interesse
•
maggiore rapidità d'azione;
•
assenza di rischio per le parti non interessate dall'evento
morboso;
•
assoluta assenza di controindicazioni;
•
assoluta assenza di effetti collaterali.
FARMAFORESI ELETTRODICA PER “BIO-ELECTRODIC REPTATION”
RICERCA MEDICA-TECNOLOGICA 2°parte
49
I dispositivi transdermici di manifattura precedente e il loro metodo di
veicolazione, mediante l’uso di corrente elettrica per condurre farmaci
attraverso la pelle, hanno un’efficacia insufficiente nella durata, per cui il
tasso di trasporto del farmaco e l’effetto terapeutico diminuisce quando la
corrente viene continuamente applicata per periodi estesi di tempo.
Il sistema della farmaforesi elettrodica per “bioelectrodic reptation”, utilizza
una componentistica elettronica innovativa in termini di potenza e
affidabilità ed una gestione software avanzata per la sicurezza durante
l’impiego.
Particolare attenzione è stata prestata all’applicazione dell’impulso elettrico.
SEGNALE SELEZIONATO PER DURATA, TASSO DI RIPETIZIONE,
FORMA E CONTENUTO ARMONICO, CON FORME D’ONDA VALUTATE
PER TIPO DI PATOLOGIA E FARMACO. LETTURA IN SEQUENZA
SOTTO CONTROLLO DI MICROPROCESSORE. TRASFORMAZIONE IN
SEGNALI ANALOGHI POI APPLICATI AI TERMINALI.
Selezionati i segnali per ogni tipo di patologia e di farmaco prescelto e
conferita una speciale “armonia”, specie in caso di protocollo terapeutico
complesso, questi vengono letti in sequenza sotto il controllo di un
microprocessore e trasformati in segnali analoghi poi applicati ai terminali.
Il lavoro sperimentale nell’ ”adattare” i farmaci per l’uso transdermico è stato
determinante per ottenere prestazioni ottimali.
Ciò è reso possibile da varie sequenze di segnali generati e gestiti dal
dispositivo in funzione delle sostanze medicamentose in protocollo, delle
specifiche di trattamento impostate e delle condizioni di salute del paziente
in esame, in modo che ogni trattamento sia specifico e mirato alla risoluzione
del problema da trattare.
I diversi farmaci possono essere veicolati uno per volta o essere trasportati
simultaneamente ( con effetti anche validi di minore importanza).
50
Il nuovo dispositivo ha la capacità di attuare più trattamenti terapeutici
contemporaneamente e di diverso genere confermando così la sua
molteplicità d’uso in diversi campi, non attuabile con altri apparecchi.
Ciascun segnale deve quindi essere selezionato per durata, tasso di
ripetizione, forma e contenuto armonico, applicando forme d’onda valutate
con particolare attenzione anche per frequenza e durata.
SISTEMA DI ABBATTIMENTO DELLE BARRIERE NATURALI A BASSO
POTERE ENERGETICO
La farmaforesi elettrodica adotta un sistema di generazione e polarizzazione
dei principi attivi che consente l’abbattimento delle barriere naturali alla
veicolazione trans-dermica a basso potere energetico in modo da non eccitare
eccessivamente le parti trattate e permettere così una modalità di
applicazione idonea, a favore dei risultati ottenibili.
SISTEMA DI VALUTAZIONE DELLO STATO DELLA CUTE
Un sistema di monitoraggio valuta lo stato della cute : raggiunta una
condizione di polarizzazione momentanea del derma e delle parti lese,
permette il trasferimento delle sostanze attive.
Un ciclo di depolarizzazione della parte trattata abbatte le cariche formatesi
durante il trasporto e resetta lo stato energetico del derma, eliminando così
anche il principio dell’arrossamento indotto dalle altre metodiche .
I segnali generati dall’unità logica e di processo digitale del dispositivo sono
segnali che, seguendo alcune regole tratte per via sperimentale, e studiate in
corso di progettazione, attribuiscono al dispositivo l’unicita’ nel suo genere.
SISTEMA DI SICUREZZA CON MONITORAGGIO
Si è prestata molta attenzione alla progettazione della sezione di sicurezza
affinché Farma t.e.b.® potesse essere definito un dispositivo sicuro sotto
aspetto. Infatti è equipaggiato con un sistema di monitoraggio di tutti i
51
parametri funzionali, terapeutici, elettrici e di sistema. Ciò consente il
controllo continuo dello stato dei trattamenti, bloccando o editando gli stessi
in caso di riscontro di errore o pericolo e il monitoraggio dello stato del
sistema, avvisando l’utente in caso di problemi o pericolo e intervenendo in
maniera autonoma alla gestione dell’energia, come ad esempio l’accesso
all’unità di backup interna, qualora si riscontri un’anomalia nel sistema di
alimentazione e la continua analisi dello stato dei trattamenti in atto, al fine di
verificare che gli stessi avvengano secondo quanto prefissato dal dispositivo e
dal team di sviluppo.
RECETTORI LEGATI AD ENZIMI.
A differenza dei recettori legati alle proteine G, che regolano indirettamente
l’attività di una proteina bersaglio della membrana plasmatica, i recettori
legati ad enzimi funzionano direttamente come enzimi o sono congiunti ad
enzimi senza intermediari.
Il dominio che lega il ligando è posto sulla superficie extracellulare della
membrana plasmatica. Il dominio citosolico o possiede un’attività enzimatica
intrinseca o si associa direttamente con una proteina enzimatica piuttosto che
con una proteina G.
La maggioranza di questi recettori ha un’attività protein chinasica e fosforila
specifiche proteine intracellulari.
Il gruppo più rilevante è composto dalle tirosin chinasi recettoriali, che
costituiscono vie segnaletiche chiave nelle risposte cellulari agli stimoli
portati dai fattori di crescita. Il ligando che si lega al recettore attiva la sua
attività tirosin chinasica, per cui il recettore fosforila le catene laterali delle
tirosine situate su proteine cellulari specifiche.
Tra i fattori di crescita che operano per mezzo delle tirosin chinasi recettoriali
si elencano l’insulina, il fattore di crescita epidermico e il fattore di crescita
nervoso.
LA RIMOZIONE DEI SECONDI MESSAGGERI
52
Nel citosol di una cellula non stimolata le concentrazioni dei secondi
messaggeri sono di solito molto basse perché queste molecole vengono di
continuo rapidamente distrutte o rimosse dal citosol. Tale concentrazione
viene modificata sopratutto dalle variazioni della loro velocità di sintesi o
d’entrata all’interno della cellula. Ciò accresce la concentrazione citosolica del
messaggero, permettendo alla cellula bersaglio di rispondere sollecitamente
al segnale extracellulare.
53
Quando una molecola del primo messaggero (segnale extracellulare) si lega al suo recettore, viene
sintetizzato un secondo messaggero. Se il segnale extracellulare viene rimosso, il secondo messaggero va
incontro a rapida distruzione o rimozione dalla cellula, quindi deve essere risintetizzato quando un nuovo
segnale si lega al recettore.
La concentrazione di AMP ciclico si può quintuplicare in qualche secondo
quando un ormone si lega al suo recettore sulla membrana plasmatica e
stimola l’adenilato ciclasi.
La sintesi o l’entrata del secondo messaggero cade a zero quando il segnale
extracellulare viene “spento”.
Il messaggero distrutto o rimosso, fa declinare celermente la concentrazione
citosolica delle molecole portatrici di messaggi sino al punto in cui la cellula
cesserà di rispondere.
L’AMP ciclico, per esempio, viene degradato molto rapidamente ad
adenosina 5’-monofosfato (5’-AMP) grazie ad una reazione catalizzata dalla
fosfodiesterasi dell’AMP ciclico. Il GMP ciclico è degradato a GMP dalla
fosfodiesterasi del cGMP. In modo consimile, l’inositol trifosfato ed il
diacilglicerolo vengono subito degradati da enzimi specifici.
Altro esempio: il Ca2+ viene rimosso dal citosol grazie a vari meccanismi che
agiscono contemporaneamente.
Ca2+extracellulare=1000 micromol/L
54
Un secondo messaggero viene rimosso da una cellula. Gli ioni calcio che operano nel citosol come secondi
messaggeri possono essere rimossi mediante meccanismi di trasporto attivo, di antiport, di sequestrazione
all’interno di certi organuli citoplastici,e/o di legame con speciali molecole. Questi meccanismi riducono il
livello del Ca2+intracellulare nelle cellule non stimolate a 0,1 micro mol/L
Un meccanismo pompa il Ca2+ fuori dalla cellula, spostando lo ione contro il
suo gradiente elettrochimico mediante un trasporto attivo primario. Ciò,
grazie alla Ca2+ATPasi che utilizza energia chimica (come quella dell’ATP)
per pompare il Ca2 fuori della cellula.
Un altro meccanismo coinvolge un trasporto attivo secondario: l’entrata nella
cellula dell’Na, che diffonde lungo un gradiente favorevole, contribuisce a
spingere il Ca2+ all’esterno della cellula.
Il Ca2+ libero viene rimosso anche grazie ai legami con le proteine ed altre
molecole citosoliche calcioleganti e mediante sequestro all’interno dei
mitocondri e del reticolo endoplasmatico (ER). Il numero rilevante di
meccanismi vari che regolano i livelli citosolici del Ca2+, potrebbe costituire,
un sistema di difesa contro i possibili effetti tossici di concentrazioni non
controllate di questo ione.
55
RECETTORE
SOSTANZA
ESPRESSO
ATTIVA
SULLE
(CELLULE
CELLULE
BERSAGLIO
ENDOTELIALI,
DELLA
FIBROCELLULE
MUSCOLARI LISCE VASCOLARI, MONOCITI, MACROFAGI, CELLULE
DENDRITICHE ECC.)
Rappresentazione schematica della dinamica molecolare del recettore H1
Rappresentazione schematica della dinamica molecolare del concetto di
occupazione recettoriale (OR)
Il recettore H1 espresso sulle cellule bersaglio della sostanza attiva (cellule
endoteliali, fibrocellule muscolari lisce vascolari, monociti, macrofagi, cellule
dendritiche ecc.) può essere up-regolato da diverse citochine o fattori di
crescita e dalla differenziazione e maturazione cellulare.
56
Ogni sostanza attiva medicamentosa è in grado di modulare, (direttamente o
indirettamente), il recettore specifico del tessuto sede di lesione. Tale
recettore, up-regolato può essere a sua volta coinvolto nella modulazione di
altre strutture attraverso la normalizzazione del release dei fattori trofici
alterati a seguito del danno prodotto alle cellule del tessuto interessato
dall’evento lesivo.
Un principio attivo con elevata capacità di occupazione recettoriale, è in
grado di bloccare il recettore H1 up-regolato con maggiore efficacia rispetto
ad un altro a bassa occupazione recettoriale.
Il dispositivo medico per veicolare farmaci (farma t.e.b.), tramite le frequenze
elettriche descritte, crea le condizioni che provocano l’apertura e la chiusura
delle molecole (gating) per cui la cellula può anche aprire e chiudere il canale
secondo le esigenze.
Rappresentazione semplificata del meccanismo di gating per la regolazione del trasporto degli ioni
attraverso una proteina canale di membrana.
Il supporto tecnologico mediante somministrazione per via transdermica
fornisce la soluzione poichè consente che le molecole, polarizzate
dall’impulso (ricoperte virtualmente da una sfera di elettroni), sotto l'azione
di trascinamento della forza elettrica, possono essere trasportate dal flusso di
corrente e veicolate fino a raggiungere istantaneamente i recettori specifici
delle cellule dei tessuti sede del danno: partendo dalla pelle, il principio
attivo raggiunge, infatti, attraverso i vari strati di tessuto,“a bolo” (per
57
rendere l’idea, comparabile con la somministrazione endovenosa) il bersaglio
cellulare deputato a modulare localmente i vari fenomeni .
Lunghi cavi molecolari si snodano, dunque, a loro modo attraverso i pori
(con molecole che seguono lo stesso cammino in “fila indiana” di larghi
complessi (molecolari) la cui mobilità diventa indipendente dalla misura.
Il
Medico
può
indurre
quindi
tempestivamente
la
modulazione
farmacologica delle cellule dei tessuti lesi.
Questo corrisponde a ridurre drasticamente il ritardo temporale tra la
risposta ad una noxa patogena e l’intervento terapeutico prescelto.
Il farmaco veicolato con la tecnica della farmaforesi ellettrodica sfugge alla
tappa digestiva e plasmatica e ciò permette di evitare le biotrasformazioni
dovute all’idrolisi gastrointestinale, alle azioni enzimatiche della parete
intestinale e del fegato per presentarsi quasi esclusivamente in forma libera
all’organo bersaglio. Inoltre si evita così la saturazione medicamentosa
dell’intero organismo con gli effetti secondari che ne risulterebbero.
Nuove conferme sulla capacità di queste straordinarie molecole determinano
effetti farmacologici ( per es. anti-edema) comparabili, come intensità e come
tempo di insorgenza, sia con quelli ottenibili con un corticosteroide come il
desametasone, che con un FANS non selettivo (media selettività per COX-2)
come il diclofenac, senza, peraltro, determinare alcuna intolleranza nè alcun
danno a livello sistemico.
L'ASPETTO
PIÙ IMPORTANTE E VANTAGGIOSO
DEL SISTEMA
TERAPEUTICO
Una dose terapeutica minima ma efficace, trasportata sul focolaio della
lesione, può svolgere la propria azione, piuttosto che una massiccia dose
di farmaci per le vie classiche lontano dalla sede del danno e talora privi
di effetti terapeutici in presenza di turbe microvasculo-tissutali (sindrome
58
post-flebitica , adiposità circoscritta , lesioni traumatiche ) o di processi
fibro-sclerotici (aterosclerosi, esiti cicatriziali).
Ciò comporterebbe un impiego notevole di volume e di concentrazione del
farmaco, perché arrivi alla zona alterata in modo utile e sufficiente per
esplicare la sua attività terapeutica.
L’utilizzo di una corrente pulsante permette alla cute di depolarizzarsi, prima
che cominci di nuovo il ciclo. In tal modo, inoltre, a parità di efficacia
terapeutica rispetto all’utilizzo di una corrente continua, se ne eroga una
quantità inferiore, riducendo il rischio di ustioni. La presenza del picco
negativo della corrente serve ad evitare la formazione dell’acido cloridrico e
dell’idrossido di sodio, o meglio, si formano durante la fase positiva ma si
decompongono immediatamente.
I processi di rilassamento della pelle osservati sono associati al rilassamento
dei contro-ioni e all’acqua legata alle proteine della pelle con modalità del
tutto “simili al ghiaccio”.
La frequenza impiegata dipende dal peso molecolare del farmaco da
veicolare e dalla profondità alla quale è necessario che penetri. Gli ioni o le
molecole del farmaco o del principio attivo, non incontrando ostacoli nel loro
percorso guidato dagli elettroni, all’interno dell’organismo, che possano
rallentare
o
interrompere
il
flusso,
raggiungono
l’organo-bersaglio
prestabilito, sede di lesione e, penetrano all’interno delle cellule che li
utilizzano senza alcun fenomeno allergico, nè effetti collaterali.
E’ un modo di pensare nuovo, un approccio scientifico per un significativo
cambiamento nel modo di affrontare le patologie.
E’ il primo ed unico sistema terapeutico non invasivo che può somministrare
selettivamente farmaci e cosmeceutici anche di alto peso molecolare
(ac.nucleici, elastina, ac. jaluronico, collagene)e in grado di dimostrare la
propria efficacia in medicina estetica, in medicina umana e veterinaria e di
supporto alla radiologia, determinante soprattutto nel ringiovanire le cellule
59
riportando indietro l’orologio biologico, o nel rigenerare qualsiasi tessuto leso
o degenerato (medicina rigenerativa).
Il sistema, modificando i processi di invecchiamento e delle malattie
associate,
risolve
definitivamente
tutte
le
forme
loco-regionalizzate
aggredibili dall’esterno: inestetismi: smagliature, cicatrici, invecchiamento
viso,
ma anche le patologie degenerative o lesioni parziali dei tessuti
cartilaginei, ossei e muscolari (per es.: artrosi, dolore cronico, lesioni di
menisco, dito a scatto, tunnel carpale, osteoporosi, fratture, stenosi vertebrali,
lussazioni), aprendo delle prospettive del tutto nuove nel modo di trattare
patologie senza cura, estendendo la durata della vita in buona salute.
I diversi protocolli sviluppati, di farmaci della farmacopea ufficiale,
attraverso catene di reazioni e trasmissione di segnali chimici dalla superficie
cellulare verso i bersagli intracellulari, regolano i processi metabolici
responsabili, integrandosi perfettamente all’interno delle cellule e del suo
DNA, fino alla completa risoluzione del processo patologico.
Il Sistema, quindi, mediante la somministrazione di piccole dosi di farmaco
che attiva direttamente i recettori
specifici del tessuto leso,
dimostra
un’efficacia terapeutica in grado di produrre effetti notevolmente maggiori
rispetto alla somministrazione sistemica, con un impatto quasi nullo (0,04%)
sul
circolo, quindi senza controindicazioni o effetti collaterali e con un
notevole contenimento della spesa sanitaria.
60
BIBLIOGRAFIA
1)Chien et al. In vivo transdermal delivery of insulin. Annals of New York
Academy of Sciences (1987), pag. 38-47.
2)Hadgraft J, Guy RH. Transdermal drug delivery. Vol 35, Drugs and the
Pharmaceutica. Sciences, Marcel Dekker, 1998.
4) Guyton. Editore Piccin Trattato di fisiologia medica
5) Montgomery Editore.Biochimica. Aspetti medico biologici
6) Cantor, Schimmel Editore.Physical Biochemistry
Ionic channels of excitable membranes Hill Bertil
Biophysical chemistry
7) F . Baldiserra Editore. Fisiologia e biofisica medica
8)Manuale di intradermoterapia distrettuale La mesoterapia in Italia
Edizione mediche scientifiche internazionali – Roma
9) Giunti Industrie Grafiche-Prato Atlante di fisiologia umana
10)M. Materia, A. Aloisi, G. Mangano, N. Longo:
"Studio valutativo del trasporto transdermico di principi
61
attivi ionizzabili mediante crioelettroforesi"
11)D'Africa A, Sartori M. Jason Ed. 2001.
Hydroelettroforesi. Reggio Calabria,
12)Marting.t. Pliquett U.F.“Theoretical analysis of localized
heating in human skin
” Bioelectrochemistry 57(1)
55-64 2002
13)Pliquett U.F. “Kinetics of the temperature rise within human s. c. “
Bioelectrochemistry 57(1): 65-72
14)Y. Chizmadhzev et al. “Electrical properties of skin at moderate voltage”
Biophysical Journal vol. 74 843-856
15)Kuzmin
P.I.
et
al.“Mechanism
of
skin
appendage
macropores
electroactivation during ionthophoresis “Membr Cell .Biol. 10:699- 706
16) R.Rhoades-R.Pflanzer. 2004 Piccin Nuova Libraria S.p.A Padova pag.114147 Fisiologia Generale e Umana II Edizione italiana su IV Americana
17) Paul L.Munson-Robert A.Mueller-George R.Breese.1999 Piccin Nuova
Libraria S.p.A Padova pag.21-31 Principi di Farmacologia
18) B.G.Katzung
1997 Piccin Nuova Libraria S.p.A Padova pag.5-22. Farmacologia Generale e
Clinica III Edizione Italiana sulla IV Edizione Americana
19)Kenji Mori et al.“Effect electric field on the enhanced skin permeation”
Biophysical Journal vol.76 1999
20)Pliquett U.F. et al “Nonlinearity of molecular transport trough human
skin due to electrical stimulus” J. of Controlled Release 68(3):373-386 2000
62
21)Vanvever et al
“Comparison of the effects of short H.V. and long-
medium voltage pulses on skin and transport properties” J. of Contr. Release
60(1) 35-47 1999
22)Y. Chizmadhzev et. al. “Lipid flow trough fusion pores” Biophys J. vol.762951-2965
23)Martin V.S. Albanesi J. P.
“Membrane fusion stalk model revisited”
Biophys. J. 82:693-712 2002
24)Prausnitz M.R. et al “Transdermal transport during ionthophoresis” J. of
Controlled Release 382-3) 205-217
25)Weaver J.C. et al. » Heparin alters transdermal trans-port” Biochem.
Biophys. Res. Commun. 29 637-640
26)Kuzmin P.J.“ A quantitative model for membrane fusion based on lowenergy intermediates” Proc. Natl. Acad. Sci. USA 7235-7240 (2001)
27)Loke“Molecular transport of biological macromolecules in Hydrogels and
tissue with applications to drug delivery” J. Contr. Release 74 (2003)
28) C.Menarini M.Menarini.Aulo Gaggi Editore Bologna 81-87.Manuale di
Terapia Fisica
29) Alice Dautry-Varsat e Harvey F. Lodish. Rivista Le Scienze - Proteine e
particelle immesse dai recettori nelle cellule
30) Alessandro Chiabrera, Massimo Grattarola, Giancarlo Parodi e Massimo
Marcer. Interazione tra campo elettromagnetico e cellule
31) De Felice Maurilio et al. Agosto 1975 n°84 Rivista Le Scienze -La
permeabilità delle membrane cellulari
32) Langer Robert.Maggio 2003 n°417 Rivista Le Scienze Dove una pillola non
arriva
33) Allen Robert Day. Aprile 1987 n°224 Rivista Le Scienze -Il microtubulo
come motore intracellulare
63
34) Quagliariello Ernesto,Saccone Cecilia.Febbraio 1980 n°138 Rivista Le
Scienze -Trasporto di proteine attraverso membrane biologiche
35)Misefari M, d’Africa A, Sartori M, Morabito F. Transdermal transport by
hydroelectrophoresis:a novel method for delivering molecole. J Biol Regul
Homeost Agents 20091 Oct-Dec Wichting Editore 2001;15(4):381-2
36)Niscola P, Arcuri E, Giovannini M, Romani C, Scaramucci L, Morabito F Il
Dolore nelle neoplasie ematologiche . Orizzonti Anno 2-
1 gennaio-
marzo/2004 pagg.39-40 Edizioni Internazionali srl EDIMES Edizioni Medico
Scientifiche-Pavia
37).Il Fisioterapista“Dolore cronico: effetti del trasporto transdermico
mediante idroelettroforesi” N° 3 Maggio-Giugno 2003
38)A.Savini,R.G.Bellomo,S.De Laurentis, R.Lerza,G.Affaitati. La spalla
dolorosa effetti antalgici dell’applicazione di hydroelettroforesi .
39)A.Savini,R.G.Bellomo,S.De Laurentis, R.Lerza,O.Affaitati, V.D
Bonaventura ,F.Carbone . Atti Congresso Nazionale ANaSMeS Ud’A
“Attività fisico-sportiva e apparato muscolo-scheletrico”, Chieti, 22-25 giugno
2003, pp. 534-539“Effetti del trattamento con hydroelettroforesi (hydrofor) di
patologie algiche distrettuali sulla sintomatologia dolorosa diffusa di pazienti
fibromialgici”
40)Moschini Vincenzo Iorno Vittorio,Dabroska Dominique . Istituti clinici di
perfezionamento Milano servizio di anestesia,rianimazione e terapia del
dolore 2005“Trattamento del dolore scapolo omerale: metodi a confronto”
41)Angela Salvino, Fortunato Morabito,Pierfrancesco Tassone,Piersandro
Chair of Medical ncology, Catanzaro, Italy,HematologyDepartment, Bone
Marrow Transplant Unit, Reggio Calabria, ItalyDicembre Sunday December 9
2001 1000 AM Poster Session: Health Services and Outcomes Research
(10:00AM-6:00 PM) Hall C Poster Board Number 909 “Successful control of
localized oppioid resistant acute incidental pain by hydroelectrophoresis in
cancer patients with bone metastates”
64
43)V. lorno, M. Sartori, A. D'Africa, G. Donarini.Centro di Terapia del dolore
2002 Istituti Clinici di Perfezionamento Milano “Effetti del trasporto
transdermico mediante hydroelettroforesi sul dolore cronico”
44)A.Brizzi ,A.Giusti P.Giacchetti settembre 2004 Europa medicophysica
“Scuole di specializzazione: vantaggi di un approccio riabilitativo integrato di
hydroelettrofosesi e ginnastica vertebrale nella lombagia acuta”
45)A.Brizzi,A.Giusti,P.Giacchetti, S.Stefanelli,L.Provinciali,M.G. Ceravolo
2004 Europa medicophysica “A randomised controlled trial on the efficacy of
hydroelectrophoresis in acute relapsing episodes in chronic low back pain
patients”
46) Joaquin García Sorando ( neurologia, neurocirugía),Luisa García Solana
(laserterapia), Ana García Solana (medicina de familia,
laserterapia)2001.Aplicaciones de hydrofor en el tratamiento del dolor 2001
47)Patrizia GIacchetti,Marzia Millevolte;Alessandro Brinzi Alessandre
Giusti,Laura Schiavon, M.Gabriella Ceravolo. XXXII congresso simfer chieti
21-25 settembre 2004 “Efficacia comparata della terapia fisica mediante
hydroelettroforesi e della terapia manuale multimodale nel paziente con
cervicalgia cronica riacutizzata”
48)Francesca Cancelli, Anna De Antoni, Silvana De Laurentis*, Rosa Bellomo
Scuola di Specializzazione in Medicina Fisica e Riabilitazione e * Scuola di
Specializzazione in Medicina dello Sport, Università "G. D'Annunzio" –
Chieti 2004 “Effetti antalgici dell’applicazione di hydroelettroforesi
(hydrofor) nella patologia artrosica del rachide”
49)R.Saggini, F.Cancelli,V.Romano, V.Di Bonaventura Europa medicophysica
2004“La paratenotite achillea per traumatismo da sport della caviglia trattata
mediante hydroelettroforesi”
50)Michele Rosa. Specialista in Medicina dello Sport Direttore dell’Unità
Operativa di Medicina dello Sport – Sport Clinic Ragusa 2004“Metodologia
ecografica nella traumatologia dello sport”
65
51)Manuela Arcidiaco Gaetano Iachelli Michele Rosa. Il trauma sportivo:
classificazione patogenesi e semeiotica ecografica delle lesioni muscolari e
tendinee
52)Manuela Arcidiaco Gaetano Iachelli Michele Rosa. Metodica hydrofor
nella tendinopatia rotulea (jumper’s knee)
53)P.Buselli,P.G. Spaggiari Europa medicophysica: mediterranean journal of
physical and rehabilitation medicine s.i.m.f.e.r 2004“La terapia
transdermica:studio dell’efficacia di un sistema di somminastrazione
farmacologica con campi elettromagnetici pulsanti”
54)F.Battistella, M.Verga. Approccio alle lesioni muscolari mediante
hydroelettroforesi
55)F.Battistella, M.Verga, P.Berlanda .EMSC euro medical sport center 2004
“trattamento della patologia muscolare traumatica dell’atleta con hydrofor”
56)F.Battistella, F. Zelioli, M.Rinaldi .Sport e Medicina maggio giugno
2004“Idroelettroforesi e traumi di caviglia Efficacia di un protocollo clinico
sperimentale nel trattamento delle lesioni capsulo legamentose dovute a
traumi distorsioni di caviglia”
57)Medicina e traumatologia informazione hi-tech volle Trattamento della
patologia muscolare traumatica dell’atleta 2003
58)M. Parabita . VII congresso nazionale gibis bologna, 18-19 maggio 2009: un
“caso di pseudoatrosi di tibia trattato incruntemente con hydroform e
neridronato”
59)GR Editrice 2007, pg. 244-250. Aggiornamenti per fisioterapista:
riconversione creditizia in fisioterapia
60)Garagnani L., Addonisio T.*Benessere & Salute. 2003; I; 1; 7-16, C.E.S.I. srl,
Roma “L’idroelettroforesi: applicazioni e Meccanismo d’azione”
61)M.Ribuffo, D.Sordi, M.T. Viviano, C. Ventrice P. Piazza. Abstracts idi 78°
congresso nazionale della società italiana dermatologica e venerelogia ROMA
66
giugno 2003 “Tecniche non invasive nella terapia dell’invecchiamento
cutaneo e del melasma mediante idroelettroforesi”
62)F.R.Perego, L. Spreafico . Abstract“Nuove correnti di trasporto
transdermico in Medicina e Chirurgia Estetica”
63)Dott.Biagio F. Santagati. Metodica :idroelettroforesi .Caso clinico S.S.
Adiposità localizzata addome 2002
64)Dott.Biagio F. Santagati .Metodica :idroelettroforesi caso clinico
C.B.Cellulite localizzata alla regione laterale delle cosce 2002
65)S.Cominiti M.S. Tarico , P.Siragò Univ. degli Studi di Catania U.O. di Ch.
Plastica Az.Ospedaliera Cannizzaro-Catania Lavoro sulle smagliature con
tecnica di hydroelettroforesi
66)Insufficienza venosa e linfatica.A d’Africa esperienze e metodi terapeutici
67)Francesco Paolo Bonina Università di Catania. “Valutazione dell’efficacia
d’uso della Hydroelettroforesi in cosmetica e nella terapia topica.”
68)Michele Rosa . Alfawassermann news e views “Medicina
69)V international congress Pisa 24-270marzo 2003. “Therapy in andrology
“felice editore medicina “
70)P.F.Palego ,A.Bertozzi , P.Rossi A., Ponzano, S.Voliani, G. Todeschini , e
F.Menchini. Università degli studi di pisa scuola di specializzazione in
endocrinologia e malattie andrologiche “Nuove possibilità terapeutiche nel
trattamento della Induratio penis plastica”
71)XXXII Congresso nazionale Simfer Chieti settembre 2004. Vantaggi di un
approccio riabilitativo integrato di hydroelettroforesi e ginnastica vertebrale
nella lombalgia acuta
72)A.Savini,R.G.Bellomo,S.De Laurentis, R.Lerza,G.Affaita .Atti Congresso
Nazionale ANaSMeS Ud’A “Attività fisico-sportiva e patologia
neuromuscolare”, Chieti, 19-22 giugno 2005, Abstracts Book, pp.387-391“La
67
spalla dolorosa: effetti della terapia con idroelettroforesi sul dolore spontaneo
e sulla sensibilità algogena muscolare.”
73)
M. Misefari, A. D’Africa, F. Morabito Journal Of Biological Regulators &
Homeostatic Agents 2001, 15:381-2, “Transdermal Transport by
hydroelectrophoresis: a novel method for delivering molecules”
74)
A.Savini,R.G.Bellomo,S.De Laurentis, R.Lerza,O.Affaitati, V.D
Bonaventura,F.Carbone “Effetti del trattamento con hydroelettroforesi
(hydrofor) di patologie algiche distrettuali sulla sintomatologia dolorosa
diffusa di pazienti fibromialgici” Istituti clinici di perfezionamento Milano
servizio di anestesia ,rianimazione e terapia del dolore 2005
75)“Trattamento del dolore scapolo omerale: metodi a confronto”
Moschini Vincenzo Iorno Vittorio,Dabroska Dominique
76)Sunday December 9 2001 1000 AM Poster Session: Health Services and
Outcomes Research (10:00AM-6:00 PM) Hall C Poster Board Number 909
77)Centro di terapia del dolore “M. Tiengo” istituti clinici di
perfezionamento 2002“Trattamento del dolore neuropatico periferico:una
nuova metodica, la via transdermica”: dott. V. Iorno, dott. V. Moschini
78)Europa medicophysica“Scuole di specializzazione: vantaggi di un
approccio riabilitativo integrato di hydroelettroforesi e ginnastica vertebrale
nella lombagia acuta” A.Brizzi ,A.Giusti P:Giacchetti settembre 2004
79)
XIX Congresso Nazionale III Corso di aggiornamento
Centro Universitario di Medicina dello Sport
Universita’ G.D’Annunzio Chieti 2003
“Ass. Nazionale Specialisti in Medicina dello Sport
Attivita’ fisico-sportiva e apparato muscolo-scheletrico”
80)
68
XXXII Congresso Simfer chieti 21-25 settembre 2004
“Efficacia comparata della terapia fisica mediante hydroelettroforesi e della
terapia manuale multimodale nel paziente con cervicalgia cronica
riacutizzata”
81)
Scuola di Specializzazione in Medicina Fisica e Riabilitazione e * Scuola
di Specializzazione in Medicina dello Sport, Università "G. D'Annunzio" –
Chieti 2004 “Effetti antalgici dell’applicazione di hydroelettroforesi
(hydrofor) nella patologia artrosica del rachide”
82)
Europa medicophysica 2004 “La paratenotite achillea per traumatismo
da sport della caviglia trattata mediante hydroelettroforesi”
83)
Europa medicophysica mediterranean journal of physical and
rehabilitation medicine s.i.m.f.e.r 2004 “La terapia transdermica:studio
dell’efficacia di un sistema di somministrazione farmacologica con campi
elettromagnetici pulsanti”
84)Approccio alle lesioni muscolari mediante hydroelettroforesi (Venturoli
Medico Sportivo – Coverciano)
85)
EMSC Euro Medical Sport Center 2004 “Trattamento della patologia
muscolare traumatica dell’atleta con hydrofor”
86)
EMSC: euro medical sport center 2004 “trattamento delle lesioni acute
capsulo-legamentose della caviglia con hydrofor”
87)
Aggiornamenti per fisioterapista: riconversione creditizia in fisioterapia
GR Editrice 2007, pg. 244-250
88)
Abstracts
IDI
78°
congresso
nazionale
della
società
italiana
dermatologica e venerelogia ROMA giugno 2003
89)“Tecniche non invasive nella terapia dell’invecchiamento cutaneo e del
melasma mediante idroelettroforesi”
Ventrice P. Piazza
69
M.Ribuffo, D.Sordi, M.T. Viviano, C.
90)Univ. Degli Studi di Catania U.O. di Ch. Plastica
Cannizzaro-
Catania
Lavoro
sulle
smagliature
Az.Ospedaliera
con
tecnica
di
hydroelettroforesi S.Cominiti M.S. Tarico , P.Siragò
91)
Università
di
Catania
“Valutazione
dell’efficacia
Hydroelettroforesi in cosmetica e nella terapia topica.”
d’uso
Francesco
della
Paolo
Bonina
92)Induratio penis plastica
Esperienze e metodi terapeutici
V international congress Pisa 24-270marzo 2003
“Therapy in andrology
“felice editore medicina “
93)Università degli Studi di Pisa Scuola di Specializzazione in endocrinologia
e malattie andrologiche “Nuove possibilità terapeutiche nel trattamento
della Induratio penis plastica”
P.F.Palego ,A.Bertozzi , P.Rossi A.Ponzano,
S.Voliani, G. Todeschini , e F.Menchini
94)
XXXII Congresso nazionale simfer Chieti settembre 2004 Vantaggi di un
approccio riabilitativo integrato di hydroelettroforesi e ginnastica vertebrale
nella lombalgia acuta
95)Atti Congresso Nazionale ANaSMeS Ud’A “Attività fisico-sportiva e
patologia neuromuscolare”, Chieti, 19-22 giugno 2005, Abstracts Book, pp.
387-391
96)Hamill O. P., Marty A., Neher E., Sakmann B. e Sigworth F. J., Improved
Patch-Clamp Techniques for High-Resolution Current Recording from Cells
and Celi-Free Membrane Patches in «Pfltigers Archiv: European Journal of
Physiology», 391, n. 2, agosto 1981.
97)Penner Reinhold E Neher Erwin, The Patch-Clamp Technique in the Study
of Secretion in «Trends in Neurosciences», 12, n. 4, aprile 1989.
70
98)Edwards F. A., Konnerth A., Sakmann B. E Takahashi T., A Thin Slice
Preparation for Patch Clamp Recordings from Neurones of the Mammalian
Central Nervous System in «Pfliigers Archiv: European Journal of Physiology
», 414, n. 5, settembre 1989.
98)Unwin Nigel, The Structure of lon Channels in Membranes of Excitable
Cells in «Neuron», 3, n. 6, dicembre 1989.
99)Stohmer W., Structure-Function Studies of Voltage-Gated lon Channels in
«Annual Review of Biophysics and Biophysical Chemistry», 20, pp. 65-78,
1991.
99)Colombini Marco, A Candidate for the Permeability Pathway of the Outer
Mitochondrial Membrane in «Nature», 279, pp. 643-645, 1979.
100)Benz Roland, Porin from Bacterial and Mitochondrial Outer Membranes
in «CRC Criticai Review in Biochemistry », 19, pp. 145-190, 1985.
101)De Pinto Vito, Ludwig Otto, Krause Jurgen, Benz Roland E Palmieri
Ferdinando, Porin Pores of Mitochondrial Outer Membranes from High and
Low Eukaryotic Cells: Biochemical and Biophysical Characterization in
«Biochimica et Biophysica Acta», 894, pp. 109--119, 1987.
102)Benz Roland E Bauer Katharina, Permeation of Hydrophilic Molecules
through the Outer Membrane of Gram -Negative Bacteria in «European
Journal of Biochemistry», 176, pp. 1-19, 1988.
103)De Pinto Vito, Benz Roland E Palmieri Ferdinando, Interaction of Ionclassical Detergents with the Mitochondrial Porin. A New Purification
Procedure and Characterization of the Pore-Forming Unit in «European
Journal of Biochemistry», 183, pp. 179-187, 1989.
104)Palmieri Ferdinando E De Pinto Vito, Purification and Properties of the
Voltage-dependent Anion Channel of the Outer Mitochondrial Membrane in
«Journal of Bioenergetics and Biomembranes », 21, pp. 417-425, 1989.
71
Dott.Antonino d’Africa
72