RASSEGNA
Ruolo della risonanza magnetica cardiaca
nella diagnosi differenziale delle cardiomiopatie
Giancarlo Casolo1, Jacopo Del Meglio1, Alessio Lilli1, Massimo Magnacca1, Carlo Tessa2
1
U.O.C. di Cardiologia, 2U.O.C. di Radiodiagnostica, Ospedale Versilia, Lido di Camaiore (LU)
Cardiovascular magnetic resonance (CMR) is a unique diagnostic imaging tool for the assessment of cardiomyopathies, allowing a non-invasive detection of the most common diseases of the heart muscle. In the
real world, patients with suspected cardiomyopathies who show signs and symptoms of heart failure should
undergo a thorough diagnostic evaluation. Besides clinical and echocardiographic assessment, coronary
angiography is the most important and common examination performed to detect or rule out coronary artery disease. This approach is relevant for the clinical decision-making, as it may obviate the need for further diagnostic evaluation of the heart structure and muscle function. CMR can reliably detect a variety of
heart muscle diseases without requiring bioptic confirmation of the diagnosis. In addition, CMR provides
anatomo-functional information that possesses incremental and independent prognostic value. This represents a new paradigm shift as it moves the attention from the coronary arteries to the heart muscle.
CMR is useful in establishing the correct diagnosis of several clinical conditions and cardiomyopathies, thus
guiding therapeutic strategies and influencing patient prognosis.
Key words. Cardiac imaging; Cardiomyopathies; Cardiovascular magnetic resonance; Heart failure.
G Ital Cardiol 2012;13(10):635-644
INTRODUZIONE
All’inizio degli anni ’80 nel novero delle tecniche diagnostiche
è stata introdotta per usi clinici la risonanza magnetica cardiaca o cardiovascolare (RMC). Nel volgere di pochi anni,
questa metodica ha assunto un ruolo di grande importanza
in alcuni quadri patologici e in particolare per lo studio della
cardiomiopatia (CMP) sia su base ischemica che non ischemica e nella valutazione del paziente con insufficienza cardiaca1-5.
Lo sviluppo tecnologico della RMC, la sua diffusione e il
progressivo riconoscimento del suo importante ruolo diagnostico hanno determinato il suo crescente utilizzo nell’arena clinica contemporanea e, in tempi recenti, sono stati definiti dalle maggiori Società Scientifiche i criteri per un uso appropriato
di questa tecnica6,7.
Nell’ambito delle CMP, la RMC costituisce oggi uno strumento preciso ed affidabile per la diagnosi e la stratificazione
prognostica quando riconducibili ad un danno strutturale8. Le
numerose informazioni raccolte in questo specifico impiego
hanno permesso di sviluppare nuove modalità assistenziali e di
modificare la pratica clinica cardiologica. Scopo di questa rassegna è quello di descrivere le principali caratteristiche rilevabili dalla RMC nelle diverse CMP allo scopo di evidenziarne il suo
ruolo nella diagnosi differenziale.
© 2012 Il Pensiero Scientifico Editore
Ricevuto 05.12.2011; nuova stesura 20.12.2011; accettato 22.12.2011.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Giancarlo Casolo U.O.C. di Cardiologia, Ospedale Versilia,
USL12, Lido di Camaiore (LU)
e-mail: [email protected]
LE POSSIBILITÀ DIAGNOSTICHE DELLA RISONANZA
MAGNETICA CARDIACA
Con la sola eccezione dello studio delle arterie coronarie, la
RMC ha conosciuto un’evoluzione inarrestabile nelle sue capacità di studio anatomico, funzionale e strutturale grazie allo sviluppo di sequenze di immagine specifiche, l’impiego dei mezzi di contrasto e l’implementazione di soluzioni innovative sia
hardware che di ricostruzione dell’immagine. Con gli attuali apparecchi l’anatomia e la funzione del cuore, la perfusione del
miocardico, come anche aspetti quali l’edema, la fibrosi,
l’emorragia, il contenuto di ferro del muscolo cardiaco, sono
oggi a disposizione del clinico.
Il prototipo classico dello scanner RMC prevede un campo di
1.5-3T, una bobina dedicata per lo studio del cuore a più canali5-32 ed un software specifico che include sequenze per lo studio del cuore, oltre che algoritmi di calcolo adeguati. Segnatamente i moderni scanner sono tutti utilizzabili per lo studio del
cuore e dei vasi purché venga reso disponibile l’hardware e il
software per la derivazione del segnale elettrocardiografico (necessario a sincronizzare l’acquisizione ai movimenti del cuore),
sequenze idonee alla valutazione morfo-funzionale e delle variazioni di segnale indotte da flusso e mezzi di contrasto.
L’esame standard, condotto sincronizzando l’acquisizione all’ECG del paziente, inizia in genere con sequenze a sangue scuro per la valutazione anatomica classica, seguite da più sequenze cine con frame rate adeguato (almeno 30 fps) a sangue
chiaro per l’analisi di volume e cinetica delle camere cardiache
e degli apparati valvolari. La somministrazione di mezzo di contrasto (chelati di gadolinio) consente di influenzare le proprietà
magnetiche del miocardio. L’analisi delle variazioni dell’intensità di segnale nel tempo al primo passaggio permette di valutare eventuali disomogeneità di perfusione, mentre quella eseG ITAL CARDIOL | VOL 13 | OTTOBRE 2012
635
G CASOLO ET AL
CHIAVE DI LETTURA
Ragionevoli certezze. La risonanza magnetica
cardiaca (RMC) permette in molti casi di
identificare con accuratezza e in modo
completamente non invasivo l’etiologia di una
cardiomiopatia altrimenti non riconoscibile senza
impiegare metodiche cruente. Attraverso la
documentazione di aree cicatriziali specifiche, la
RMC consente di confermare od escludere la
presenza di una malattia coronarica in pazienti
con disfunzione ventricolare sinistra ad etiologia
sconosciuta. Accanto al riconoscimento
etiologico, la RMC permette di raccogliere
informazioni morfo-funzionali molto accurate,
necessarie spesso a scelte di trattamento o per il
follow-up della terapia medica. Infine, con la
RMC è possibile raccogliere aspetti quali la
presenza di aree di fibrosi, di aree cicatriziali, di
depositi di amiloide o di ferro che posseggono
valore prognostico. In alcuni casi il riscontro di
aree di delayed enhancement può essere di ausilio
nell’identificare i soggetti a maggior rischio su cui
concentrare maggiori risorse o terapie specifiche.
Questioni aperte. La grande diffusione degli
scanner di risonanza non si è accompagnata ad
una crescita di pari rilevanza di competenze e
organizzazioni che rendono di fatto disponibile
alla gran massa di pazienti questa possibilità
diagnostica. La valutazione della fibrosi
miocardica è ancora largamente semiquantitativa
e può rendere meno accurata la misurazione del
contenuto di collagene miocardico. Questo
aspetto, oggetto di intensa ricerca, potrebbe
consentire una precisa caratterizzazione tissutale
ed ampliare le possibilità diagnostiche e
prognostiche della RMC in molte condizioni
patologiche.
Le ipotesi. L’allargamento delle competenze
nell’impiego della RMC e soprattutto delle sue
potenzialità nella clinica cardiologica può
costituire il cardine di un cambiamento culturale
con ricadute cliniche importanti. Così, nel paziente
con sospetta cardiomiopatia, l’esecuzione della
RMC prima dell’angiografia coronarica può
orientare immediatamente verso diagnosi
specifiche, oppure rendere ininfluente il contributo
dell’anatomia coronarica di fronte ad una
cardiomiopatia ischemica con grave estensione
cicatriziale. La scelta di impiegare un dispositivo, la
sede del ventricolo da stimolare, oppure le più o
meno realistiche aspettative di una terapia medica
con o senza resincronizzazione cardiaca, possono
essere significativamente modificate da una
informazione accurata e precisa quale quella che
può essere ottenuta mediante RMC. La
contemporanea raccolta di informazioni precise
circa lo stato dell’emodinamica cardiopolmonare,
636
G ITAL CARDIOL | VOL 13 | OTTOBRE 2012
della geometria ventricolare, della funzione delle
valvole e dello stato del ventricolo, oltre a orientare
una diagnosi, può modificare significativamente la
strategia di trattamento e le ulteriori eventuali
scelte diagnostiche. La possibilità di avviare un
paziente con sospetta cardiomiopatia alla RMC è
oggi più che una scelta una vera e propria
necessità. Oltre ad una diagnosi più precisa, è
possibile valutare più correttamente la prognosi ed
attendersi più o meno eventi sulla base di elementi
specifici quali la presenza/assenza di aree
cicatriziali e la loro estensione.
guita tardivamente permette di verificare la presenza o meno di
accumuli extravascolari, in genere riconducili a fibrosi. Ulteriori
sequenze possono valutare quantitativamente la velocità del
sangue o dei tessuti, la sincronia della contrazione e l’ispessimento di parete, di evidenziare l’edema o l’emorragia, come anche di quantificare il contenuto di ferro presente. In genere, uno
studio completo di anatomia, funzione, perfusione a riposo e
da stress, oltre che il delayed enhancement, può essere completato in 40-50 min. Tempi minori sono possibili limitando l’esame alla sola valutazione morfo-funzionale o dopo contrasto.
Ormai da molti anni sono disponibili sequenze che consentono di esplorare le arterie coronarie. Questa applicazione tuttavia richiede lunghe sessioni di esame, necessita di accorgimenti tecnici particolari, offre risultati incostanti nei diversi individui e, rispetto alla tomografia computerizzata multistrato, possiede un peso diagnostico minore. Tuttavia l’assenza di radiazioni ionizzanti e la ricchezza di informazioni che si possono ottenere in un solo esame rendono la RMC complessivamente una
tecnica di grande interesse clinico. Il progresso tecnologico dovrebbe favorire nel prossimo futuro la soluzione di problemi quali i costi di esame, i tempi di esame ed analisi relativamente lunghi, l’esclusione dall’esame dei pazienti portatori di pacemaker
o dispositivi di resincronizzazione cardiaca/defibrillatori impiantabili, e la variabilità di studio delle arterie coronarie.
Le apparecchiature per risonanza magnetica oggi disponibili sono di norma tutte in grado di eseguire esami del cuore.
Occorre tener presente che per la maggior parte delle necessità (studio di morfologia, funzione e delayed enhancement) la
dotazione hardware/software in effetti non è considerata molto sofisticata ed è alla portata della totalità dei Centri. Il fattore limitante resta l’expertise e l’accesso allo scanner. Un discorso a parte merita l’organizzazione di un servizio che consenta
un’attività ordinaria in ambito ospedaliero. Nella nostra organizzazione esiste un team cardioradiologico che opera in stretta collaborazione e del quale fanno parte due cardiologi e due
radiologi che assicurano una seduta settimanale ed eventuali
necessità urgenti anche al di fuori della seduta programmata.
Tale equipe opera ormai senza interruzioni da 5 anni.
DELAYED ENHANCEMENT
Una breve trattazione a parte lo merita il significato delle aree
di delayed enhancement che la RMC può evidenziare anche nelle CMP. Ormai da molti anni è stato chiarito come il fenomeno
del delayed enhancement sia legato alla particolare distribuzio-
RISONANZA MAGNETICA CARDIACA NELLE CARDIOMIOPATIE
ne tissutale e cellulare del chelato di gadolinio, generalmente
impiegato nelle sequenze T1 pesate necessarie a consentire questa applicazione9. Il delayed enhancement si realizza quando,
dopo alcuni minuti dalla somministrazione del contrasto ferromagnetico, si evidenzia un aumento di segnale rispetto al miocardio circostante attribuibile alle modificazioni della magnetizzazione indotte nel tessuto in esame. Nel caso di un infarto acuto, il gadolinio penetra nelle cellule e produce il tipico aumento
di segnale al delayed enhancement già dopo pochi minuti dalla lesione. Successivamente, ed è ciò che si evidenzia nella fase
di riparazione, il gadolinio occupa lo spazio extracellulare lasciato libero dalle cellule. In tal modo la presenza di aree di delayed enhancement semplicemente riflette la fibrosi riparativa.
Pertanto la presenza di aree di delayed enhancement non può
essere a priori attribuita alla fibrosi, ma questa relazione dipende dalla malattia in esame e anche dal suo stadio. Tuttavia, come si vedrà successivamente, il delayed enhancement costituisce un fenomeno di enorme rilevanza ai fini della diagnosi, del
trattamento e della prognosi di molte CMP (Figure 1 e 2).
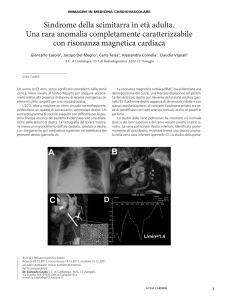
Figura 1. Paziente con cardiomiopatia dilatativa non ischemica. A sinistra: immagini true-FISP ottenute in diastole (in alto) e sistole (in basso) su un piano passante per l’apice ventricolare sinistro, la valvola mitrale e la radice aortica. A destra: immagini ottenute sul piano asse corto del ventricolo sinistro dopo mezzo di contrasto con tecnica del delayed enhancement. Non si documentano aree di hyperenhancement
nel contesto del miocardio.
Figura 2. Paziente con pregresso infarto miocardico antero-settale. A
sinistra: immagine su un piano passante per l’apice ventricolare sinistro, la valvola mitrale e la radice aortica. A destra: immagine ottenuta
sul piano asse corto. Tecnica delayed enhancement. Dopo mezzo di
contrasto si evidenziano aree transmurali di enhancement indicative di
fibrosi a tutto spessore nel territorio dell’arteria interventricolare anteriore.
LA RISONANZA MAGNETICA CARDIACA
E LE CARDIOMIOPATIE
Le CMP costituiscono una famiglia di malattie del miocardio assai diverse tra loro. Nella classificazione dell’American Heart Association (AHA) del 2006 si distinguono le classiche forme primitive e secondarie10. Tra le forme primitive sono comprese
quelle acquisite, geneticamente trasmesse e le forme miste. Assai più utile ai fini della presente trattazione è la sistemizzazione proposta dalla Società Europea di Cardiologia nel 2008 che
differenzia le CMP prevalentemente, ed almeno inizialmente,
sull’aspetto morfologico e funzionale11.
La RMC è in grado di caratterizzare dal punto di vista morfo-funzionale la stragrande maggioranza delle CMP di interesse clinico. Nessun singolo strumento diagnostico possiede la
versatilità, la robustezza, la semplicità, l’immediatezza dell’informazione, la precisione e soprattutto l’applicabilità clinica della RMC. In un recente documento di consenso sulla RMC, l’impiego nelle CMP è considerato appropriato sia per identificare
l’etiologia di una cardiopatia da causa sconosciuta associata a
scompenso cardiaco sia per meglio valutare pazienti con cardiopatie sospette ma non caratterizzate7.
L’etiologia ischemica o comunque legata ad aterosclerosi
coronarica risulta generalmente agevole in quanto caratterizzata da una o più lesioni cicatriziali del ventricolo sinistro12,13.
Sebbene, assai di rado, la CMP ischemica possa presentarsi anche in assenza di aree necrotiche pregresse, in genere si rilevano una o più ampie aree di pregresso infarto. La lesione
ischemica appare sia transmurale che subendocardica con grado variabile di interessamento dello spessore di parete, in genere con massima estensione subendocardica (regione più suscettibile all’ischemia) e progressivamente minore verso l’epicardio. Tale distribuzione della necrosi riflette e conferma
l’aspetto della necrosi miocardica su base ischemica ormai stabilizzata, rilevabile su preparati autoptici con appropriate colorazioni specifiche per il tessuto connettivo. La RMC, unica
metodica non invasiva, consente di visualizzare presenza,
estensione e transmuralità di una pregressa lesione infartuale
(Figura 2). La presenza di una o più lesioni con queste caratteristiche identifica l’etiologia “ischemica” della CMP con elevata accuratezza14,15.
Al di fuori dell’etiologia ischemica, la RMC può identificare
l’etiologia di una cardiopatia, in presenza di una disfunzione
ventricolare sinistra di origine incerta. Grazie alla combinazione di aspetti morfo-funzionali e, soprattutto, della presenza di
specifici pattern di delayed enhancement dopo mezzo di contrasto, la RMC può individuare con elevato grado di accuratezza la CMP dilatativa primitiva, la CMP ipertrofica, l’amiloidosi ed
altre forme restrittive, la CMP del ventricolo destro, ed altre malattie che possono determinare un danno miocardico non ischemico.
Accanto alla diagnosi delle cardiopatie, nel corso degli anni la RMC ha dimostrato di possedere un significativo ruolo prognostico8. Accanto alla riconosciuta rilevanza di marker e fattori identificabili anche con altre metodiche, è stata soprattutto la possibilità di dimostrare la presenza e misurare l’estensione dello scarring miocardico a sancire il ruolo prognostico della RMC16.
Di particolare rilevanza risulta la presenza e l’entità di fibrosi
miocardica, non solo valutata tradizionalmente, che occupa
ampia parte della ricerca clinica. L’utilizzo di nuove sequenze
ed accorgimenti tecnici specifici è orientato alla raccolta di miG ITAL CARDIOL | VOL 13 | OTTOBRE 2012
637
G CASOLO ET AL
sure quantitative e precise di patologiche quantità di collagene
in modo da ampliare sia il valore diagnostico che prognostico
della RMC in molte condizioni patologiche e nella fattispecie
nelle CMP17. Per tutte le caratteristiche sopra esposte la RMC è
oggi considerata un esame sicuramente appropriato in presenza di molte CMP accertate o sospette per definirne sia l’etiologia che la prognosi.
Cardiomiopatia dilatativa
Nella forma dilatativa primitiva, la RMC offre una valutazione di
volumi, massa e cinetica ventricolare che non risente delle modificazioni geometriche del cuore. Questa applicazione, ancorché in genere sottovalutata, in realtà consente di misurare con
precisione parametri che possono far optare per un impianto o
meno di un dispositivo, offrire elementi prognostici precisi, evidenziare opportunità di stratificazione prognostica ancora non
esplorate. In ogni caso una precisa valutazione di volume e funzione costituisce un valido strumento per monitorizzare l’effetto della terapia sui parametri morfo-funzionali e per avere un
follow-up affidabile in soggetti con grandi volumi ventricolari e
valori di frazione di eiezione ridotti.
Sicuramente però l’elemento più interessante è senz’altro
la possibilità di escludere con buona accuratezza l’etiologia
ischemica di una CMP. Quest’ultima, infatti, è in genere il risultato di una o più necrosi del miocardio che determinano cicatrici identificabili con la tecnica del delayed enhancement.
Nelle forme cosiddette “primitive” è possibile documentare cicatrici prevalentemente intramiocardiche (Figura 3), ma talora
anche di aspetto “ischemico” e cioè compatibili con la fisiopatologia ischemica dell’infarto14,15. In altre parole, la presenza di cicatrici non consente di escludere con certezza la genesi ischemica della lesione, ma l’assenza di aree di delayed enhancement subendocardiche o transmurali esclude virtualmente la presenza di una cardiopatia ischemica. La presenza e
l’entità delle cicatrici comportano una prognosi peggiore rispetto all’assenza di aree patologiche al delayed enhancement18,19. I target diagnostici della RMC nelle forme dilatative
sono dunque la documentazione o meno di una progressiva
Figura 3. Delayed enhancement ottenuto su più livelli
del piano asse corto del ventricolo sinistro in un paziente con cardiomiopatia dilatativa. In questo paziente il delayed enhancement mostra l’aspetto cosiddetto
“midwall” (frecce) cioè un enhancement confinato entro lo spessore miocardico, indicativo di genesi non coronarica della cardiomiopatia.
638
G ITAL CARDIOL | VOL 13 | OTTOBRE 2012
dilatazione del ventricolo sinistro, le modificazioni della funzione sistolica e la presenza di fibrosi miocardica. Quest’ultima, oltre ad evidenziare una prognosi peggiore, è stata correlata alla presenza di aritmie ventricolari maligne e conseguente probabilità di scarica efficace dei defibrillatori impiantabili
impiegati in prevenzione primaria20. Del tutto recentemente è
stato dimostrato come la presenza di ampie aree cicatriziali alla RMC nella CMP dilatativa identifichi i soggetti con scarsa risposta alla terapia medica, oltre ai parametri ottenibili con
l’ecocardiografia21.
Nell’ambito delle CMP acquisiste una forma dilatativa nella quale la RMC è di grande importanza è la CMP infiammatoria. Ormai da diversi anni la RMC ha dimostrato di possedere un ruolo rilevante nel riconoscere i segni di infiammazione e di interessamento miocardico nelle miocarditi22. La
RMC può evidenziare, localizzare e quantificare sia l’edema
che l’iperemia, nonché la fibrosi che si manifesta in questa
condizione. Attraverso l’impiego di sequenze specifiche T1 e
T2 pesate è possibile nell’80% dei casi porre diagnosi di miocardite con la sola RMC23. Il delayed enhancement di questa
condizione nella fase acuta non rappresenta ovviamente evidenza di fibrosi. La sede tipica ma non esclusiva della parete
laterale, l’espressione prevalente subepicardica, la transitorietà spesso completa del delayed enhancement, costituiscono manifestazioni dell’infiammazione in cui edema, iperemia
e cellularità partecipano a determinarne l’espressione. Tali caratteristiche possono in casi selezionati permettere la diagnosi, evitando manovre invasive quali la biopsia endomiocardica24,25.
Cardiomiopatia ipertrofica
La CMP ipertrofica viene in genere facilmente riconosciuta con
l’ecocardiografia e non pone problemi significativi relativamente alla sua valutazione fisiopatologica. Presenza ed entità
dell’ostruzione, interessamento dell’atrio sinistro, aree asinergiche si possono facilmente evidenziare con l’esame ecocardiografico standard. La RMC nel corso degli anni ha dimostrato una superiore capacità nel riconoscere aree di ipertrofia presenti anche in segmenti miocardici diversamente mal esplorabili26,27, misurare con precisione la massa miocardica, ma soprattutto ha aiutato a ridefinire l’espressione fenotipica delle
diverse varianti di CMP28 (Figure 4 e 5).
Con l’utilizzo del delayed enhancement già da alcuni anni
è stato possibile documentare la presenza di aree cicatriziali
nel contesto del ventricolo sinistro di molti pazienti con CMP
ipertrofica29 (Figura 6). Tali aree cicatriziali sono presenti anche
in soggetti minimamente asintomatici e rivestono significato
clinico indicando una propensione alle aritmie ventricolari e allo sviluppo di scompenso cardiaco30. Accanto a ciò, il riscontro
di scarring è stato associato alla presenza di aritmie ventricolari31. Specifici pattern cicatriziali sono stati così associati ad
outcome differenti. Più recentemente la presenza e l’entità delle aree cicatriziali sono state dimostrate associarsi alla mortalità per tutte le cause e cardiaca, indipendentemente dai parametri clinici e strumentali già disponibili32. In particolare, la
presenza di scarring identifica pazienti a maggior rischio di
ospedalizzazione per scompenso cardiaco e deterioramento
funzionale33.
Grazie alla possibilità di misurare quantitativamente aspetti diversi rispetto alla fibrosi, anche misure tradizionali, quali la
massa miocardica, si sono dimostrati utili nella stratificazione
prognostica dei pazienti34.
RISONANZA MAGNETICA CARDIACA NELLE CARDIOMIOPATIE
Figura 4. Paziente con cardiomiopatia ipertrofica. La serie nella colonna a sinistra rappresenta le immagini sul piano orizzontale ottenute con tecnica spinecho-like (sangue scuro) che mostrano una patologica ipertrofia del setto interventricolare. Le due colonne a destra ottenute con tecnica cine-risonanza trueFISP si riferiscono al piano 4 camere (a sinistra) e 2 camere (a destra) durante il
ciclo cardiaco. I diversi frame mostrano la progressione della contrazione ventricolare sinistra.
gnostica, assegnando di fatto un ruolo al riscontro di aree di
scarring ventricolare35.
La RMC è stata impiegata nella malattia di Fabry, malattia
d’accumulo lisosomiale legata al cromosoma X causata dalla
deficienza dell’enzima alfa-galattosidasi. In un recente registro
lo 0.5% dei pazienti con sospetta CMP ipertrofica ha in realtà
questa entità nosologica36. L’aspetto morfologico può ricordare quello della CMP ipertrofica, ma il delayed enhancement dimostra un pattern di segnale differente e non specifico per la
forma ipertrofica37.
Figura 5. Cardiomiopatia ipertrofica. Cine-risonanza true-FISP, piano
asse lungo del ventricolo sinistro. Nell’immagine 1 si osserva la diastole. Nell’immagine 2 si rileva movimento anteriore sistolico della valvola mitrale ed ostruzione all’efflusso ventricolare sinistro durante le fasi
iniziali della sistole. Nelle immagini 3 e 4 si osserva come con l’avanzare della sistole compaia insufficienza mitralica su base funzionale.
Le recenti linee guida American College of Cardiology
Foundation (ACCF)/AHA per la diagnosi e trattamento della
CMP ipertrofica hanno introdotto per la prima volta la RMC tra
le tecniche che posseggono un rilevante ruolo sia nella diagnosi
differenziale di questa patologia che nella stratificazione pro-
Cardiomiopatia aritmogena del ventricolo destro
La prima descrizione in letteratura della diagnosi resa possibile
solo dalla RMC di un caso di cardiomiopatia aritmogena del
ventricolo destro (CAVD) è del 198738. Da allora è stata prodotta una ricca letteratura che ha evidenziato numerosi elementi semeiologici alla malattia; infatti la RMC può evidenziare alterazioni morfo-funzionali più accurate di quelle ottenibili
con l’ecocardiografia. Tra questi elementi rientrano le alterazioni del profilo endocardico, le aree di bulging diastolico, i microaneurismi, l’accentuata trabecolatura. Analogamente sono
facilmente rilevabili modificazioni del volume e della cinetica
del ventricolo destro39-42. Da sottolineare infatti come la RMC
costituisca a tutt’oggi la tecnica più affidabile ed accurata per
lo studio del ventricolo destro.
La RMC può evidenziare aree di ridotto ispessimento sistolico di parete ed aree di alterata cinetica regionale, che possono riguardare nei casi avanzati anche il ventricolo sinistro. Una
specifica attenzione è stata attribuita in passato al segnale di
G ITAL CARDIOL | VOL 13 | OTTOBRE 2012
639
G CASOLO ET AL
Figura 7. Cardiomiopatia aritmogena del ventricolo destro. I pannelli A
(diastole) e B (sistole) si riferiscono a immagini true-FISP sul ventricolo destro. Le frecce indicano aree di assente ispessimento sistolico in sistole.
I pannelli C e D sono immagini di delayed enhancement del medesimo
paziente sul piano orizzontale 4 camere. Si evidenziano numerose aree
di hyperenhancement patologico del ventricolo destro (frecce tratteggiate) suggestive di aree di fibrosi, e interessamento con segnale alterato
del versante destro del ventricolo sinistro (frecce bianche).
640
Figura 6. Paziente con cardiomiopatia ipertrofica. Asse corto su più livelli. Delayed enhancement dopo 0.2 mM/kg e.v. di Gd-DTPA. Si evidenziano aree cicatriziali miocardiche quasi a tutto spessore della parete antero-settale. Le frecce indicano le giunzioni tra i due ventricoli
dove si concentrano la maggior parte delle aree di hyperenhancement
nei pazienti con cardiomiopatia ipertrofica.
Altre cardiomiopatie
Nel corso degli ultimi anni tutte le principali CMP sono state
esaminate con RMC permettendo di descriverne le principali
caratteristiche. Tra queste, la CMP non-compaction, la miocardiopatia amiloidotica, oltre a numerose altre patologie primitive o secondarie del miocardio.
parete laddove un suo aumento è stato attribuito alla presenza di grasso epicardico. Quest’ultimo è stato considerato specifico per la diagnosi generando confusione e molti falsi-positivi43,44. Il significato di un aumentato segnale di parete è stato
oggi molto ridimensionato, essendo rilevabile in molte condizioni e persino nei soggetti normali.
Accanto alle alterazioni della cinetica regionale e globale del
ventricolo destro in assenza di cause note, i pazienti con CAVD
possono mostrare alterazioni del segnale di parete dopo somministrazione del mezzo di contrasto45 (Figura 7). Queste aree di
scarring sarebbero più specifiche di altri elementi nella diagnosi,
sebbene non siano evidenziabili che in una minoranza dei casi.
Il ruolo clinico della risonanza magnetica nel caso di CAVD
sospetta o confermata è ancora incerto; si ricorre in genere a
questa metodica in modo piuttosto liberale nonostante le scarse evidenze della letteratura46.
Il livello di appropriatezza attribuito dall’ACC/AHA per questa applicazione è uno dei più alti e una rivisitazione dei criteri
diagnostici della malattia da parte di un’apposita Commissione
della Società Europea di Cardiologia ne esalta l’impiego seppure con elementi molto contenuti47. In particolare, nonostante l’ampia letteratura e prassi legata allo studio e al rilievo del
grasso epicardico, a questo non viene attribuito alcun valore;
nello stesso tempo vengono valorizzate con riferimenti quantitativi le valutazioni della funzione sia globale che regionale e
delle dimensioni ventricolari destre.
Non compattazione
La CMP non-compaction è un’entità nosologica di riscontro recente e crescente sia nell’età infantile che nell’età adulta48. È caratterizzata dalla presenza di aree di marcata e inusuale trabecolatura in genere dei segmenti medi ed apicali del ventricolo sinistro, talora associata a disfunzione e dilatazione49 (Figura 8).
Spesso coesistono alterazioni segmentarie della cinetica, trombosi endoventricolare e aspetti suggestivi per CMP ipertrofica50.
Nel corso degli anni aree di non compattazione del ventricolo sinistro sono state documentate in pazienti senza disfunzione ventricolare e non è chiaro se, oltre la vera e propria CMP, esistano
aspetti di non compattazione anche in altre condizioni patologiche o addirittura talora possa costituire una variante normale.
La diagnosi necessita del riconoscimento della non compattazione. Utilizzando la RMC, uno studio indica come la diagnosi sia accurata quando si documenti un rapporto tra lo spessore di parete non compatta con quella compatta in telediastole >2.349. Recentemente è stato dimostrato come l’estensione delle aree di non compattazione correli con l’entità della
disfunzione ventricolare sinistra51.
G ITAL CARDIOL | VOL 13 | OTTOBRE 2012
Amiloidosi cardiaca
L’amiloidosi costituisce di gran lunga la principale causa di CMP
restrittiva. È causa di significativa morbilità ed è in generale fatale.
Non tutti i tipi di amiloidosi interessano il cuore, ma nel tipo a catene leggere (AL) la deposizione si verifica nel 90% dei casi52.
RISONANZA MAGNETICA CARDIACA NELLE CARDIOMIOPATIE
Figura 8. Paziente con cardiomiopatia non-compaction. A destra le immagini sistoliche, a sinistra le immagini diastoliche orientate nei principali piani intrinseci del ventricolo sinistro. Sia in diastole che in sistole
si apprezzano ampie aree di non compattazione ventricolare.
In presenza di amiloidosi cardiaca, la RMC può evidenziare
un aumento degli spessori di parete del miocardio, un alterato
rilasciamento diastolico, dilatazione biatriale, versamento pericardico o pleuropericardico, oltre ad un caratteristico diffuso
segnale dai tessuti caratterizzato da scarsa profondità del contrasto spontaneo. Tali reperti, talora specifici, non sono però in
grado di identificare in modo affidabile l’amiloidosi cardiaca.
Assai più importante è invece il contributo delle immagini ottenute al delayed enhancement dopo mezzo di contrasto. La
deposizione miocardica di amiloide causa infatti un’espansione
dello spazio interstiziale che costituisce il presupposto per l’alterato comportamento del segnale miocardico dopo somministrazione di mezzo di contrasto. Infatti, l’aumentata presenza di
mezzo di contrasto nell’interstizio, oltre alla riduzione del T1 e
T2 causata dall’amiloide, produce un pattern caratteristico53,54
(Figura 9). Poiché l’amiloide inizia a deporsi a livello subendocardico, è questo strato miocardico quello che mostra le maggiori alterazioni di segnale.
La RMC è stata impiegata nello studio dell’interessamento
cardiaco in corso di amiloidosi. In un recente studio è stato
possibile documentare nel 97% dei pazienti con biopsia cardiaca positiva per amiloide, la presenza di un delayed enhancement prevalentemente transmurale o subendocardico55. Nel
46% dei pazienti con ecocardiografia non suggestiva per amiloidosi, la RMC ha evidenziato depositi di amiloide miocardico.
Accanto a questo importante elemento diagnostico, la presenza di aumento di segnale all’enhancement tardivo possiede un valore prognostico indipendente e più potente di mortalità ad 1 anno rispetto ai parametri ecocardiografici e clinici
più comuni56.
Sarcoidosi
Fino al 50% dei pazienti con sarcoidosi polmonare ha un interessamento cardiaco e solo il 5% ha disturbi cardiaci. Pertanto,
pur essendo la principale causa di morte in questi pazienti, l’interessamento cardiaco è di difficile esplorazione. La RMC può
Figura 9. Paziente con amiloidosi confermata alla biopsia miocardica. A sinistra si osserva la diastole (A) e la sistole (B) sul piano orizzontale (4 camere). Si noti l’aumentato spessore di parete, la funzione sistolica ancora
apparentemente normale, la dilatazione biatriale, l’ampio versamento pleurico destro e, in minor misura, sinistro. A destra, delayed enhancement in 4 camere (DE1),
2 camere (DE2) ed asse corto (DE3). Accanto all’inusuale assenza di segnale intracavitario (***), si evidenzia tenue captazione subendocardica diffusa del miocardio
ventricolare (frecce). Tale aspetto è patognomonico per
l’interessamento amiloidotico del cuore.
evidenziare l’interessamento infiammatorio miocardico o gli esiti di questo con il delayed enhancement. In un ampio studio
condotto su 81 pazienti con diagnosi confermata alla biopsia,
circa un quarto dei pazienti era identificabile alla RMC con pattern di enhancement eterogeneo57. Inoltre, la presenza di delayed enhancement sembra offrire informazioni prognostiche
peculiari in questa condizione.
Emocromatosi
Il sovraccarico cardiaco di ferro, quale quello che si verifica
nella talassemia, può condurre a dilatazione, ipertrofia e disfunzione cardiaca. La RMC può identificare in modo preciso
ed accurato il contenuto di ferro, sfruttando le proprietà magnetiche della materia58. Attraverso la quantificazione del T2*
miocardico è possibile monitorizzare l’effetto della terapia con
i farmaci chelanti il ferro. Il T2* cardiaco non correla con il
contenuto di ferro epatico e, indicando con precisione l’interessamento cardiaco, può costituire un marker più efficace
delle biopsie epatiche nel guidare le scelte cliniche e terapeutiche59.
Diagnosi differenziale delle cardiomiopatie
La diagnosi clinica di CMP non ischemica è spesso legata all’esclusione della coronaropatia. A sua volta l’esame standard
utilizzato per escludere la malattia coronarica è l’angiografia
coronarica. Come è noto, questo esame offre una visione luminografica dei vasi arteriosi coronarici, permettendo di evidenziare con elevata accuratezza la presenza di lesioni ostruttive coronariche. È ormai assodato invece che la coronarografia convenzionale non è in grado di descrivere con precisione la presenza o meno dell’aterosclerosi coronarica non
ostruttiva; quest’ultima è assai più efficacemente descritta
dall’ecografia intravascolare o dalla tomografia computerizG ITAL CARDIOL | VOL 13 | OTTOBRE 2012
641
G CASOLO ET AL
zata multistrato coronarica60,61. Pertanto l’angiografia convenzionale non è strumento sufficiente ad escludere l’etiologia aterosclerotica di un’eventuale patologia del miocardio,
sebbene nella maggior parte dei casi una disfunzione deve
essere in qualche modo correlabile a lesioni estese e significative.
Peraltro, la sola informazione relativa al lume coronarico
non offre alcun dettaglio circa la qualità del miocardio servito
da quel circolo coronarico, malato o meno all’angiografia14. In
realtà, come è intuibile, è possibile la coesistenza di una CMP
e di una malattia coronarica come rilevato da più studi sia in vivo che post-mortem14,15,62,63. Grazie all’impiego crescente della tomografia computerizzata multistrato coronarica è oggi
possibile escludere la malattia coronarica in presenza di disfunzione ventricolare di natura sconosciuta virtualmente in tutti i pazienti64.
Partendo dalla constatazione che nell’identificazione dell’etiologia di una disfunzione ventricolare la valutazione del
miocardio è assai rilevante e merita un’attenzione particolare65,
un recente studio ha esplorato questo aspetto specifico dimostrando come l’implementazione della RMC prima della coronarografia costituisca un approccio prudente, clinicamente appropriato e costo-efficace rispetto al comportamento usuale
basato sull’utilizzo sistematico ed in prima battuta della coronarografia66.
RICADUTE PRATICHE DELLE INDICAZIONI ALL’ESAME
CON RISONANZA MAGNETICA CARDIACA
Sebbene considerata una metodica di grande rilevanza nella
diagnosi e stratificazione prognostica, non è chiaro nella gestione clinica delle CMP quando eseguire l’esame e con quale
frequenza ripeterlo. Al momento non vi sono indicazioni precise né dalle linee guida o di consenso, né evidenze da studi condotti ad hoc.
Appare evidente come la RMC possa e debba essere eseguita quanto prima possibile nei casi in cui la diagnosi etiologica
sia ignota o dubbia. Tale comportamento può generare risultati potenzialmente in grado di modificare l’iter diagnostico-terapeutico.
Al di fuori della necessità diagnostica, l’esame può essere richiesto per quantificare con accuratezza volumi e funzione ventricolare sia ai fini terapeutici che di follow-up. Il timing e la frequenza di ripetizione dell’esame divengono così funzione delle scelte terapeutiche.
Nel considerare aspetti specifici, quali la presenza di scarring
od aree di delayed enhancement, esistono segnalazioni esclusivamente relative alle miocarditi e alle malattie da accumulo
di ferro dove nel tempo è possibile monitorizzare cambiamenti dei parametri utili ai fini prognostici. Nel caso della CMP da
sovraccarico di ferro, è stata suggerita una RMC ogni 2 anni
nei casi di sospetta malattia e ad intervalli ≤1 anno nei casi di
malattia conclamata nella quale monitorizzare la terapia chelante67.
CONCLUSIONI
La RMC costituisce una metodica diagnostica non invasiva,
poliparametrica, quantitativa, ripetibile particolarmente utile
nella diagnosi, follow-up e stratificazione prognostica dei pazienti con CMP. Nei limiti delle classificazioni eziologiche, la
642
G ITAL CARDIOL | VOL 13 | OTTOBRE 2012
RMC è in grado di riconoscere la maggior parte delle CMP attraverso la documentazione di caratteri peculiari basati su
aspetti anatomici, funzionali e strutturali altrimenti non ottenibili. In alcune condizioni può costituire una valida alternativa alla biopsia miocardica, soprattutto laddove gli aspetti diagnostici della RMC sono particolarmente specifici. Nell’iter diagnostico delle CMP, laddove attualmente l’angiografia coronarica riveste un ruolo fondamentale e spesso esclusivo, la
RMC amplia le possibilità di gestione del paziente, individua in
molti casi l’etiologia della CMP e consente di ottimizzare i percorsi clinici attraverso una valutazione prognostica altrimenti
impossibile.
Per molte CMP la RMC evidenzia aspetti morfo-funzionali
caratteristici, in questo offrendo una visione più nitida e meno
influenzata da fattori individuali che possono limitare la presenza di una buona finestra acustica. Ancora una volta però il
vero valore aggiunto è costituito dalla possibilità di evidenziare uno specifico pattern di delayed enhancement. La presenza e la localizzazione di aree di delayed enhancement, siano
esse espressione di aree cicatriziali, di esiti infiammatori, di
scarring o di ampliamento dell’interstizio, permettono di identificare con elevata accuratezza molte CMP specifiche. Come
per tutte le malattie cardiache, la presenza di aree cicatriziali
identifica soggetti a maggior rischio di eventi aritmici, oltre che
di possibile progressivo peggioramento della funzione ventricolare.
Nonostante il ruolo fondamentale delle altre metodiche diagnostiche, in primis dell’ecocardiografia, la RMC costituisce oggi uno strumento che permette una visione clinica senza precedenti sia sul versante diagnostico che nella scelta terapeutica e nell’identificazione sempre più accurata del rischio di eventi del paziente con CMP sospetta od accertata.
RIASSUNTO
La risonanza magnetica cardiaca (RMC) rappresenta una tecnica
diagnostica ormai considerata insostituibile nella diagnosi differenziale delle cardiomiopatie. Attraverso le informazioni anatomo-funzionali, ma soprattutto quelle relative alla composizione
dei tessuti, la RMC permette di caratterizzare non invasivamente
molte delle cardiomiopatie di riscontro clinico più comune. Nel
mondo reale il paziente accede alla diagnostica per segni o sintomi
di scompenso cardiaco. Dopo la valutazione clinica e la valutazione
ecocardiografica, l’esame principale ad essere effettuato è la coronarografia, eseguita allo scopo di escludere o dimostrare una
malattia coronarica. Questo approccio può, nella pratica, costituire
uno snodo decisivo del procedimento diagnostico. La dimostrazione di malattia coronarica da un lato e la sua esclusione dall’altro
di fatto dipendono da questo approccio “coronarocentrico”.
Questo approccio pragmatico può escludere indagini successive,
quali quelle che invece tengono conto del miocardio e della sua
struttura e qualità. La RMC ha ormai dimostrato di poter identificare correttamente senza necessità di conferma bioptica molte
cardiomiopatie di comune osservazione. Inoltre molte delle informazioni che oggi la RMC può offrire posseggono valore prognostico indipendente. È oggi quindi possibile disporre di un approccio “miocardiocentrico”. La disponibilità di informazioni
anatomo-funzionali più precise può costituire un passo ridondante
ma, al contrario, orientare la diagnosi o addirittura identificare correttamente l’etiologia di una cardiomiopatia può modificare sostanzialmente l’iter terapeutico e la stratificazione prognostica dei
pazienti.
Parole chiave. Cardiomiopatie; Imaging cardiaco; Risonanza magnetica cardiaca; Scompenso cardiaco.
RISONANZA MAGNETICA CARDIACA NELLE CARDIOMIOPATIE
BIBLIOGRAFIA
1. Bandettini WP, Arai AE. Advances in
clinical applications of cardiovascular magnetic resonance imaging. Heart 2008;94:
1485-95.
2. Pennell DJ. Cardiovascular magnetic
resonance. Circulation 2010;121:692-705.
Approfondita rassegna circa le potenzialità diagnostiche della risonanza magnetica cardiaca nelle principali malattie
cardiovascolari.
3. Beek AM, van Rossum AC. Use of cardiovascular magnetic resonance imaging in
the assessment of left ventricular function,
scar and viability in patients with ischaemic
cardiomyopathy and chronic myocardial infarction. Heart 2010;96:1494-501.
4. Karamitsos TD, Francis JM, Myerson S,
Selvanayagam JB, Neubauer S. The role of
cardiovascular magnetic resonance imaging
in heart failure. J Am Coll Cardiol 2009;54:
1407-24.
5. Mahrholdt H, Wagner A, Judd RM,
Sechtem U, Kim RJ. Delayed enhancement cardiovascular magnetic resonance assessment of non-ischaemic cardiomyopathies. Eur Heart J 2005;26:
1461-74.
Descrizione dei fondamenti della diagnosi delle cardiomiopatie mediante
delayed enhancement. Sono descritti i
principali motivi per cui si evidenzia
l’enhancement ed i diversi pattern rilevabili nelle principali cardiomiopatie.
6. Pennell DJ, Sechtem UP, Higgins CB, et
al.; Society for Cardiovascular Magnetic Resonance; Working Group on Cardiovascular
Magnetic Resonance of the European Society of Cardiology. Clinical indications for
cardiovascular magnetic resonance (CMR):
Consensus Panel report. Eur Heart J 2004;
25:1940-65.
7. Hundley WG, Bluemke DA, Finn JP, et al.
ACCF/ACR/AHA/NASCI/SCMR 2010 expert
consensus document on cardiovascular
magnetic resonance: a report of the American College of Cardiology Foundation Task
Force on Expert Consensus Documents. J
Am Coll Cardiol 2010;55:2614-62.
8. Flett AS, Westwood MA, Davies LC,
Mathur A, Moon JC. The prognostic implications of cardiovascular magnetic
resonance. Circ Cardiovasc Imaging
2009;2:243-50.
Rassegna approfondita sul ruolo prognostico che possiede la risonanza magnetica cardiaca ed in particolar modo il
significato delle aree di delayed enhancement per l’outcome.
9. Ordovas KG, Higgins CB. Delayed contrast enhancement on MR images of myocardium: past, present, future. Radiology
2011;261:358-74.
10. Maron BJ, Towbin JA, Thiene G, et al.
Contemporary definitions and classification
of the cardiomyopathies: an American Heart
Association Scientific Statement from the
Council on Clinical Cardiology, Heart Failure
and Transplantation Committee; Quality of
Care and Outcomes Research and Functional Genomics and Translational Biology
Interdisciplinary Working Groups; and
Council on Epidemiology and Prevention.
Circulation 2006;113:1807-16.
11. Elliott P, Andersson B, Arbustini E, et al.
Classification of the cardiomyopathies: a
position statement from the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart
J 2008;29:270-6.
12. Wu E, Judd RM, Vargas JD, Klocke FJ,
Bonow RO, Kim RJ. Visualisation of presence, location, and transmural extent of
healed Q-wave and non-Q-wave myocardial infarction. Lancet 2001;357:21-8.
13. Mahrholdt H, Wagner A, Judd RM,
Sechtem U. Assessment of myocardial viability by cardiovascular magnetic resonance
imaging. Eur Heart J 2002;23:602-19.
14. McCrohon JA, Moon JC, Prasad SK,
et al. Differentiation of heart failure
related to dilated cardiomyopathy and
coronary artery disease using gadolinium-enhanced cardiovascular magnetic
resonance. Circulation 2003;108:54-9.
Questo importante studio ha evidenziato la possibilità di differenziare la
cardiomiopatia ischemica da quella dilatativa primitiva. Ha inoltre documentato come in casi di cardiomiopatia a coronarie indenni siano possibili
aree di enhancement analoghe a
quelle di pazienti con malattia coronarica.
15. Casolo G, Minneci S, Manta R, et al.
Identification of the ischemic etiology of
heart failure by cardiovascular magnetic resonance imaging: diagnostic accuracy of late
gadolinium enhancement. Am Heart J 2006;
151:101-8.
16. Leong DP, Madsen PL, Selvanayagam
JB. Non-invasive evaluation of myocardial
fibrosis: implications for the clinician. Heart
2010;96:2016-24.
17. Iles L, Pfluger H, Phrommintikul A, et al.
Evaluation of diffuse myocardial fibrosis in
heart failure with cardiac magnetic resonance contrast-enhanced T1 mapping. J Am
Coll Cardiol 2008;52:1574-80.
18. Assomull RG, Prasad SK, Lyne J, et al.
Cardiovascular magnetic resonance, fibrosis,
and prognosis in dilated cardiomyopathy. J
Am Coll Cardiol 2006;48:1977-85.
19. Wu KC, Weiss RG, Thiemann DR, et al.
Late gadolinium enhancement by cardiovascular magnetic resonance heralds an
adverse prognosis in nonischemic cardiomyopathy. J Am Coll Cardiol 2008;51:
2414-21.
20. Iles L, Pfluger H, Lefkovits L, et al. Myocardial fibrosis predicts appropriate device
therapy in patients with implantable cardioverter-defibrillators for primary preven-
tion of sudden cardiac death. J Am Coll
Cardiol 2011;57:821-8.
21. Leong DP, Chakrabarty A, Shipp N, et al.
Effects of myocardial fibrosis and ventricular
dyssynchrony on response to therapy in
new-presentation idiopathic dilated cardiomyopathy: insights from cardiovascular
magnetic resonance and echocardiography.
Eur Heart J 2012;33:640-8.
22. Friedrich MG, Sechtem U, SchulzMenger J, et al.; International Consensus
Group on Cardiovascular Magnetic Resonance in Myocarditis. Cardiovascular magnetic resonance in myocarditis: a JACC
White Paper. J Am Coll Cardiol 2009;53:
1475-87.
23. Baccouche H, Mahrholdt H, Meinhardt
G, et al. Diagnostic synergy of non-invasive
cardiovascular magnetic resonance and invasive endomyocardial biopsy in troponinpositive patients without coronary artery
disease. Eur Heart J 2009;30:2869-79.
24. Lombardi M. La risonanza magnetica
cardiaca integra o sostituisce la biopsia endomiocardica nella diagnosi di miocardite?
Nell’era della risonanza magnetica cardiaca,
le indicazioni alla biopsia endomiocardica
sono limitate. G Ital Cardiol 2011;12:84650.
25. De Cobelli F, Pieroni M, Esposito A, et al.
Delayed gadolinium-enhanced cardiac magnetic resonance in patients with chronic myocarditis presenting with heart failure or recurrent arrhythmias. J Am Coll Cardiol 2006;
47:1649-54.
26. Rickers C, Wilke NM, Jerosch-Herold M,
et al. Utility of cardiac magnetic resonance
imaging in the diagnosis of hypertrophic
cardiomyopathy. Circulation 2005;112:85561.
27. Moon JC, Fisher NG, McKenna WJ,
Pennell DJ. Detection of apical hypertrophic
cardiomyopathy by cardiovascular magnetic resonance in patients with non-diagnostic echocardiography. Heart 2004;90:
645-9.
28. Maron MS, Maron BJ, Harrigan C, et al.
Hypertrophic cardiomyopathy phenotype revisited after 50 years with cardiovascular
magnetic resonance. J Am Coll Cardiol
2009;54:220-8.
29. Choudhury L, Mahrholdt H, Wagner A,
et al. Myocardial scarring in asymptomatic
or mildly symptomatic patients with hypertrophic cardiomyopathy. J Am Coll Cardiol
2002;40:2156-64.
30. Moon JC, McKenna WJ, McCrohon JA,
Elliott PM, Smith GC, Pennell DJ. Toward
clinical risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol
2003;41:1561-7.
31. Adabag AS, Maron BJ, Appelbaum E, et
al. Occurrence and frequency of arrhythmias in hypertrophic cardiomyopathy in relation to delayed enhancement on cardioG ITAL CARDIOL | VOL 13 | OTTOBRE 2012
643
G CASOLO ET AL
vascular magnetic resonance. J Am Coll Cardiol 2008;51:1369-74.
32. Bruder O, Wagner A, Jensen CJ, et al.
Myocardial scar visualized by cardiovascular
magnetic resonance imaging predicts major
adverse events in patients with hypertrophic
cardiomyopathy. J Am Coll Cardiol 2010;56:
875-87.
33. O’Hanlon R, Grasso A, Roughton M, et
al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am
Coll Cardiol 2010;56:867-74.
34. Olivotto I, Maron MS, Autore C, et al.
Assessment and significance of left ventricular mass by cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Am
Coll Cardiol 2008;52:559-66.
35. Gersh BJ, Maron BJ, Bonow RO, et al.
2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American
Heart Association Task Force on Practice
Guidelines. Developed in collaboration With
the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart
Rhythm Society, Society for Cardiovascular
Angiography and Interventions, and Society
of Thoracic Surgeons. J Am Coll Cardiol
2011;58:e212-e260.
36. Elliott P, Baker R, Pasquale F, et al.; ACES
Study Group. Prevalence of Anderson-Fabry
disease in patients with hypertrophic cardiomyopathy: the European Anderson-Fabry
Disease survey. Heart 2011;97:1957-60.
37. Moon JC, Sachdev B, Elkington AG, et
al. Gadolinium enhanced cardiovascular
magnetic resonance in Anderson-Fabry disease: evidence for a disease specific abnormality of the myocardial interstitium. Eur
Heart J 2003;24:2151-5.
38. Casolo G, Poggesi L, Boddi M, et al.
ECG-gated magnetic resonance imaging in
right ventricular dysplasia. Am Heart J
1987;113:1245-8.
39. Casolo G, Di Cesare E, Molinari G, et al.
Diagnostic work-up of arrhythmogenic right
ventricular cardiomyopathy by cardiovascular magnetic resonance. Ital Heart J 2004;5:
69-79.
40. Tandri H, Friedrich MG, Calkins H,
Bluemke DA. MRI of arrhythmogenic right
ventricular cardiomyopathy/dysplasia. J Cardiovasc Magn Reson 2004;6:557-63.
41. Tandri H, Macedo R, Calkins H, et al.;
Multidisciplinary Study of Right Ventricular
Dysplasia Investigators. Role of magnetic
resonance imaging in arrhythmogenic right
ventricular dysplasia: insights from the North
American arrhythmogenic right ventricular
dysplasia (ARVD/C) study. Am Heart J 2008;
155:147-53.
42. Pennell D, Casolo G. Right ventricular arrhythmia: emergence of magnetic resonance imaging as an investigative tool. Eur
Heart J 1997;18:1843-5.
644
G ITAL CARDIOL | VOL 13 | OTTOBRE 2012
43. Bluemke DA, Krupinski EA, Ovitt T, et al.
MR imaging of arrhythmogenic right ventricular cardiomyopathy: morphologic findings and interobserver reliability. Cardiology
2003;99:153-62.
44. Casolo G. Arrhythmogenic dysplasia of
the right ventricle and magnetic resonance:
a happy union or a poor relationship? G Ital
Cardiol 1996;26:495-501.
45. Tandri H, Saranathan M, Rodriguez ER,
et al. Noninvasive detection of myocardial fibrosis in arrhythmogenic right ventricular
cardiomyopathy using delayed-enhancement magnetic resonance imaging. J Am
Coll Cardiol 2005;45:98-103.
46. Sen-Chowdhry S, Prasad SK, Syrris P, et
al. Cardiovascular magnetic resonance in
arrhythmogenic right ventricular cardiomyopathy revisited: comparison with task force
criteria and genotype. J Am Coll Cardiol
2006;48:2132-40.
47. Marcus FI, McKenna WJ, Sherrill D, et al.
Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed
modification of the Task Force Criteria. Eur
Heart J 2010;31:806-14.
48. Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics
of isolated left ventricular non-compaction: a
step towards classification as a distinct cardiomyopathy. Heart 2001;86:666-71.
49. Petersen SE, Selvanayagam JB, Wiesmann F, et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol
2005;46:101-5.
50. Bakera ML, Fong MW, Goldman B. Hypertrophic cardiomyopathy with features of
left ventricular non-compaction: how many
diseases? Int J Cardiol 2011;148:364-6.
51. Dellegrottaglie S, Pedrotti P, Roghi A, Pedretti S, Chiariello M, Perrone-Filardi P. Regional and global ventricular systolic function in isolated ventricular non-compaction.
Pathophysiological insights from magnetic
resonance imaging. Int J Cardiol 2012;158:
394-9.
52. Nihoyannopoulos P, Dawson D. Restrictive cardiomyopathies. Eur J Echocardiogr
2009;10:iii23-33.
53. Maceira AM, Joshi J, Prasad SK, et al.
Cardiovascular magnetic resonance in cardiac amyloidosis. Circulation 2005;111:18693.
54. Vogelsberg H, Mahrholdt H, Deluigi CC,
et al. Cardiovascular magnetic resonance in
clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008;51:
1022-30.
55. Syed IS, Glockner JF, Feng D, et al.
Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis. JACC Cardiovasc Imaging
2010;3:155-64.
Importante lavoro di correlazione tra riscontri alla risonanza magnetica car-
diaca e biopsia miocardica nella diagnosi di amiloidosi cardiaca.
56. Austin BA, Tang WH, Rodriguez ER, et
al. Delayed hyper-enhancement magnetic
resonance imaging provides incremental diagnostic and prognostic utility in suspected
cardiac amyloidosis. JACC Cardiovasc Imaging 2009;2:1369-77.
57. Patel MR, Cawley PJ, Heitner JF, et al.
Detection of myocardial damage in patients
with sarcoidosis. Circulation 2009;120:
1969-77.
58. Gujja P, Rosing DR, Tripodi DJ,
Shizukuda Y. Iron overload cardiomyopathy: better understanding of an increasing
disorder. J Am Coll Cardiol 2010;56:100112.
59. Carpenter JP, He T, Kirk P, et al. On T2*
magnetic resonance and cardiac iron. Circulation 2011;123:1519-28.
60. Mintz GS, Painter JA, Pichard AD, et al.
Atherosclerosis in angiographically “normal” coronary artery reference segments: an
intravascular ultrasound study with clinical
correlations. J Am Coll Cardiol 1995;25:
1479-85.
61. van Velzen JE, Schuijf JD, de Graaf FR, et
al. Diagnostic performance of non-invasive
multidetector computed tomography coronary angiography to detect coronary artery
disease using different endpoints: detection
of significant stenosis vs detection of atherosclerosis. Eur Heart J 2011;32:637-45.
62. Waller TA, Hiser WL, Capehart JE,
Roberts WC. Comparison of clinical and
morphologic cardiac findings in patients
having cardiac transplantation for ischemic
cardiomyopathy, idiopathic dilated cardiomyopathy, and dilated hypertrophic cardiomyopathy. Am J Cardiol 1998;81:88494.
63. Soriano CJ, Ridocci F, Estornell J,
Jimenez J, Martinez V, De Velasco JA. Noninvasive diagnosis of coronary artery disease
in patients with heart failure and systolic
dysfunction of uncertain etiology, using late
gadolinium-enhanced cardiovascular magnetic resonance. J Am Coll Cardiol 2005;45:
743-8.
64. Andreini D, Pontone G, Bartorelli AL, et
al. Sixty-four-slice multidetector computed
tomography: an accurate imaging modality
for the evaluation of coronary arteries in dilated cardiomyopathy of unknown etiology. Circ Cardiovasc Imaging 2009;2:199205.
65. Raman SV. Coronary artery or myocyte:
wherein lies the diagnosis? Circ Cardiovasc
Imaging 2009;2:166-8.
66. Assomull RA, Shakespeare C, Kalra PR,
et al. Role of cardiovascular magnetic resonance as a gatekeeper to invasive coronary
angiography in patients presenting with
heart failure of unknown etiology. Circulation 2011;124:1351-60.
67. Kremastinos DT, Farmakis D. Iron overload cardiomyopathy in clinical practice. Circulation 2011;124:2253-63.