Mente e Sport
Interazioni tra metabolismo muscolare e metabolismo nervoso durante
l’esercizio fisico
Prof. Giancarlo Carli
Dipartimento di Fisiologia
Università degli Studi di Siena
Metabolismo muscolare in condizioni di riposo
In assenza di contrazione il metabolismo basale del muscolo si avvale degli acidi grassi
liberi intramuscolari, che derivano dalla demolizione dei trigliceridi, per la produzione di
ATP tramite la via dell’Acetil-Coenzima A.
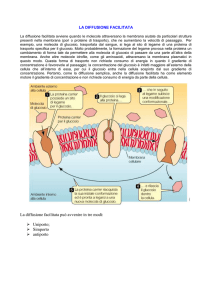
A riposo, il trasporto di glucosio all’interno del tessuto muscolare avviene tramite i GLUT4
la cui attivazione è regolata dall’insulina. In particolare, l’insulina si lega al proprio
recettore sulla membrana muscolare e insieme attivano le vescicole contenenti il
trasportatore GLUT4 spostandole dall’interno e inserendole sulla membrana cellulare; a
questo punto il glucosio viene captato, traslocato all’interno e rapidamente fosforilato
per effetto di enzimi specifici.
La secrezione dell’insulina a sua volta è regolata dalla glicemia e poiché il muscolo a
riposo non consuma glucosio , se non aumenta la glicemia, non cambia la secrezione di
insulina e non c’è attivazione del trasporto di
glucosio.
Metabolismo muscolare durante l’esercizio
Nel muscolo che lavora e consuma ATP, è importante che l’ATP venga risintetizzato alla
stessa velocità con cui è utilizzato. Se il lavoro è effettuato a intensità costante, superata
la fase iniziale di debito di 02 in cui il consumo di 02 aumenta piu’ lentamente della velocità
di scissione
dell’ATP, si raggiunge uno stato stazionario in cui il consumo di 0 2 e la concentrazione
dell’ATP rimangono costanti per un determinato tempo. La contrazione muscolare attiva i
GLUT4 che trasportano all’interno del muscolo il glucosio con meccanismo indipendente
dall’insulina. I principali meccanismi metabolici attivati per mantenere adeguata la
produzione di ATP sono:
a) la liberazione di catecolamine da parte della midollare del surrene che inibiscono la
liberazione di insulina, e che, per esercizi aerobici di bassa intensità(noradrenalina),
attivano la glicolisi e la lipolisi; quest’ultima incrementa l’ utilizzazione degli acidi grassi
liberi per la sintesi di ATP muscolare;
b) la liberazione dei glicorticoidi(cortisolo) da parte della corticale del surrene che riduce
l’utilizzazione del glucosio da parte dei muscoli (azione anti-insulica cioè anti-GAT4) e
stimola la proteolisi muscolare con aumento di aminoacidi circolanti utilizzati dal fegato per
la neoglucogenesi ;questa incrementa il passaggio di glucosio nel plasma;
c) la liberazione da parte dell’adenoipofisi di GH che stimola la lipolisi del tessuto adiposo,
aumenta la glicogenolisi e la gluconeogenesi epatica favorendo la liberazione di glucosio
nel plasma; questo non viene captato dalle fibrocellule muscolari poiché il GH esercita su
di esse un’azione anti-GAT. Sia le catecolamine che i glucocorticoidi e il GH, insomma,
1
promuovono meccanismi atti a evitare che il glucosio venga utilizzato dai muscoli e la
glicemia diminuisca.
Tuttavia, durante un esercizio prolungato ad esaurimento a un’intensità costante di circa il
70% del VO2 max si assiste a una caduta progressiva della glicemia e dell’ossidazione dei
carboidrati associata all’aumento dell’azotemia e all’instaurarsi della fatica che porta
all’interruzione del lavoro dopo circa 90 minuti. La fatica fisica è associata anche a
deplezione di glicogeno muscolare ed è stato suggerito che tale deplezione dia luogo a
incapacità del muscolo a sintetizzare ATP alla velocità richiesta dalla sua degradazione.
Quando l’ATP prodotto tende ad essere minore di quello utilizzato, nel muscolo
aumentano i livelli di ADP e di AMP che sono attivatori rispettivamente delle miochinasi e
delle deaminanasi: queste ,a loro volta, fanno
aumentare
la concentrazione
intramuscolare di IMP, che viene normalmente considerato un marker della degradazione
dell’ATP quando la sua sintesi diviene insufficiente (McConnell et al, 1999). In atleti ben
allenati durante l’esecuzione di un esercizio aerobico la glicemia diminuisce
progressivamente per circa 2 ore fino al momento dell’arresto per fatica. La
somministrazione orale di glucosio ritarda il raggiungimento della fatica,diminuisce
l’iperazotemia e modifica l’andamento della glicemia aumentando nel muscolo la velocità
di cattura del glucosio ematico e sopprimendo la produzione di quello endogeno
(glicolisi). Il glucosio esogeno inoltre fa diminuire l’iperazotemia che viene considerata
critica nello sviluppo della fatica centrale poiché, attraversando la barriera ematocerebrale,
interferisce con la sintesi di glutammato e di GABA. E’ interessante notare che l’ATP
intramuscolare non si modifica durante le 2 prove mentre IMP ha un innalzamento minore
per la somministrazione di glucosio. Inoltre la somministrazione di glucosio riduce
l’abbassamento dell’insulinemia e l’innalzamento dei NEFA. ma non produce differenze
nella diminuzione di PCr ,di glicogeno e negli aumenti del lattato.
In conclusione per lavori prolungati di tale intensità l’ingestione di carboidrati aumenta la
capacità di endurance migliorando, almeno in parte, l’energetica muscolare.
Se invece l’intensità del lavoro supera l’80% del V02 Max (McConell et al, 2000),
l’ingestione di carboidrati non migliora la performance, non modifica la latenza della fatica
muscolare, non ha effetto sull’ossidazione dei carboidrati, sul metabolismo e sul glicogeno
muscolare anche se ci sono degli effetti funzionali significativi. Infatti accentua la risposta
iperglicemica, riduce il decremento dell’insulinemia, aumenta la cattura del glucosio e
sopprime solo parzialmente la produzione di glicogeno endogeno. Comunque non cambia
la diminuzione della PCr nè l’aumento del lattato e di IMP e sono simili le variazioni del
glucagone, dell’adrenalina e della noradrenalina.
Tessuto nervoso
Il tessuto nervoso dell’uomo è costituito da due tipi di cellule, i neuroni e la glia, che
derivano dai precursori delle stesse cellule staminali ma che si differenziano
successivamente a seconda dei fattori di accrescimento e dei programmi di sviluppo. Da
tempo sappiamo che le cellule della glia non hanno cilindrasse e non sviluppano potenziale
d’azione. Esse si suddividono in astrociti, cellule ependimali, che rivestono le cavità interne
del cervello, cellule della microglia, di origine non ectodermica, che hanno funzioni
analoghe ai macrofagi e rispondono a lesioni e a patologie e, infine, oligodendrociti e
cellule di Schwan che costituiscono le guaine mieliniche. Gli astrociti hanno forma a stella
con pedicelli terminali che entrano in contatto con i neuroni e i capillari, formano giunzioni
serrate con altri astrociti o con neuroni, avvolgono e isolano le zone sinaptiche e sono
responsabili della formazione di cicatrici. Hanno funzioni multiple che si deducono dalla
2
presenza di recettori di membrana per i neuromediatori quali il glutammato, l’ATP e il
GABA, i
canali ionici voltaggio dipendenti e liberano neumediatori e fattori di
accrescimento (GDNF). Lo studio del glutammato ha evidenziato che gli astrociti
producono proteine in grado di scindere il complesso recettore-glutamato e di trasportare
poi il glutammato all’interno dell’astrocita stesso.
Gli astrociti inoltre sintetizzano proteine che attaccano il complesso recettore-glutamato
formatosi nella membrana pre- o post sinaptica indi trasportano il glutammato all’interno
dell’astrocita e lo trasformano in glutamina.
Metabolismo cerebrale
Il cervello (2% della massa del corpo umano) consuma il 25% della quantità di glucosio
utilizzato per fini energetici. Il glucosio è il substrato energetico quasi esclusivo del cervello
e il rapporto 02/CO2 (quoziente respiratorio) è uguale a 1. La captazione del glucosio da
parte del tessuto nervoso avviene tramite una famiglia di trasportatori (GLUT). In
particolare il neurone capta direttamente il glucosio trasportato dai GLUT3 e forma ATP
attraverso i meccanismi ossidativi mentre l’astrocita utilizza il glucosio trasportato dai
GLUT1. L’astrocita forma ATP utilizzando soprattutto i meccanismi glicolitici e si libera del
lattato cedendolo al neurone. che lo capta tramite i monocarbossilati (MCTs) oppure
immettendolo nel sangue venoso. Quindi il tessuto nervoso produce continuamente una
piccola quantità di lattato.
Il rapporto metabolico cerebrale (CMR =A-V 02 / glucosio + ½ lattato) è costituito dal
prodotto del flusso ematico cerebrale per la differenza arterovenosa: tale tasso è piu’ alto
di quanto previsto dal tasso del consumo di 02. L’extra glucosio che scompare si trasforma
in lattato senza consumare 02 e può essere immagazzinato come glicogeno, può essere
utilizzato per formare neurotramettitori quali glutammato, GABA, acetilcolina che hanno
funzione vasoattiva.
Un sistema di accoppiamento spazio-temporale tra attività neuronale e metabolismo
energetico fa sì che il flusso ematico cerebrale vari regionalmente secondo il fabbisogno
energetico locale (iperemia funzionale). L’autoregolazione cerebrale è dovuta anche alle
proprietà dei periciti capillari che si contraggono quando la pressione intravasale aumenta
e si rilasciano quando diminuisce. In particolare, l’unità funzionale microvascolare,
costituita da cellule endoteliali, periciti e astrociti, possiede recettori per vari
neurotrasmettitori. Il glutammato, per esempio, che è il principale neurotrasmettitore
corticale, agisce tramite i recettori NMDA che, aprendo i canali del Ca++, stimola
indirettamente la sintesi di NO che è un potente vasodilatatore.
Poiché quando aumenta l’attività il flusso e il consumo di glucosio possono aumentare in
una determinata area della corteccia del 30-40% mentre il consumo di 02 aumenta solo
del 6%, si deduce che il glucosio è utilizzato soprattutto
nella via glicolitica
(disaccoppiamento transitorio tra glicogenolisi e fosforilazione ossidativa), con formazione
di lattato. E’ importante ricordare che il potenziale di membrana dell’astrocita è negativo e
vicino al potenziale di equilibrio del K+ e la membrana dell’astrocita ha un’alta
permeabilità al K+.L’eccitazione del neurone (potenziale di azione) fa uscire K+ che viene
captato dall’astrocita attraverso canali specifici e cioè la pompa Na+/K+ e il cotrasportatore
Na+/K+/Cl- che consumano ATP e attivano la glicolisi astrocitaria a produrre lattato e ad
aumentare la captazione di glucosio da parte dei GLUT1. Ma l’aumento dell’attività del
neurone, cioè della frequenza dei potenziali di azione , libera glutammato che stimola i
trasportatori del glutammato:questi trasportano il glutammato all’interno dell’astrocita con
un meccanismo Na+dipendente. L’aumento intracellulare di Na+ stimola l’attivazione
3
dell’ATPasi Na+/K+ dipendente astrocitaria che, consumando ATP, attiva la glicolisi che
produce lattato. Quindi l’ingresso massiccio di K+ o Na+ fa produrre lattato agli astrociti ed
è responsabile dell’aumento locale di consumo di glucosio. Gli astrociti, principale deposito
di glicogeno cerebrale, sono quindi responsabili della formazione del lattato che soddisfa i
bisogni energetici transitori dei neuroni. Questi bisogni si verificano soprattutto nella zona
pre e post sinaptica del neuropilo circondato dagli astrociti, che costituisce una unità
metabolica in grado di fornire neutrasmettitori, glutamina e substrati energetici quali il
lattato.
Flusso e metabolismo cerebrale durante l’esercizio
A riposo c’è una relazione tra flusso cerebrale, consumo di O2 e utilizzazione di glucosio. Il
flusso cerebrale globale aumenta durante un compito mentale e si riduce al minimo
durante il sonno non-REM. Durante l’esercizio fisico il flusso cerebrale globale aumenta
progressivamente per esercizio lieve e moderato (60% VO2 max) seguendo le alterazioni
della PCO2 arteriosa che rimane ai livelli basali per intensità moderate. Anche se il flusso
globale non cambia per esercizi di moderata intensità, si verificano aumenti di flusso nelle
aree responsabili del controllo motorio e viscerale e ovviamente diminuzione in aree non
coinvolte. In generale il flusso regionale aumenta piu’ del consumo regionale di O 2. Per
esempio durante i movimenti volontari o durante la loro immaginazione si verifica una
iperemia funzionale nella corteccia primaria motrice e in quella sensoriale controlaterale
all’arto interessato e similmente nelle aree premotorie e supplementari in relazione alla
programmazione e all’inizio di sequenze motorie complesse e nella corteccia sinistra
dell’insula responsabile degli aggiustamenti cardiovascolari e respiratori; queste attivazioni
sono compensate da riduzione dell’attività/flusso in altre regioni del cervello.
Il contributo del riflesso cardiaco barocettivo (gittata cardiaca) al flusso cerebrale è del
25% a riposo ma si annulla durante l’esercizio (Ogoh, 2008). Anche l’eccitabilità simpatica
dei vasi cerebrali è nulla a riposo e aumenta durante l’esercizio ma un esercizio di lieve
intensità non cambia l’autoregolazione cerebrale, nonostante l’aumento della frequenza
cardiaca, della pressione arteriosa e la diminuzione di PaCO2 che hanno effetti
vasocostrittori. In compenso la reattività dei vasi cerebrali alla CO2 aumenta durante
l’esercizio e questo effetto è mediato dall’eccitazione dell’ortosimpatico che indirettamente
riduce la vasocostrizione. Un esercizio intenso danneggia l’autoregolazione cerebrale e l’
effetto vasocostrittore simpatico (recettori -1) riduce il flusso cerebrale ma protegge i
vasi cerebrali dall’ipertensione e previene la rottura della barriera emato-cerebrale
Per alte intensità di esercizio aumenta, per aumentata glicogenolisi da parte degli
astrociti, la liberazione di lattato e la captazione di lattato da parte del neurone ma
l’iperventilazione abbassa la PaCO2 e produce vasocostrizione delle arteriole.
L’abbassamento della ossigenazione cerebrale potrebbe
agire
come un fattore
indipendente sulla fatica centrale. Nonostante una riduzione del flusso fino al 50% , il
metabolismo cerebrale totale tuttavia non solo non viene limitato ma addirittura aumenta
aumentando l’estrazione dal sangue arterioso soprattutto di lattato, di glucosio che
nell’esercizio molto intenso sono elevati mentre l’estrazione di O2 subisce minori incrementi
(massimo 6%). In particolare il lattato può arrivare a contribuire a fornire fino al 50%
dell’energia. Di conseguenza si riduce il rapporto della estrazione cerebrale di O 2/glucosio
+1/2 lattato (Rapporto Metabolico Cerebrale CMR) vista la presenza di un forte aumento di
lattato plasmatico (che può superare ampiamente le 4 mM) prodotto dall’esercizio fisico
(Nybo and Secherb, 2004). E’ da sottolineare che il tessuto nervoso durante l’esercizio
utilizza tutto il lattato disponibile cioè non accumula lattato anche se cessa di cedere
4
lattato al sangue e questi meccanismi persistono molti minuti oltre la fine dell’esercizio.
Nell’insieme questi dati dimostrano che la prestazione fisica è caratterizzata da una
complessa interazione tra fattori metabolici periferici e centrali. E’ interessante notare che
la diminuzione del CMR si verifica anche in assenza di modificazioni del lattato come nel
caso di esercizi aerobici prolungati oppure in seguito a intensa attività mentale o a
situazioni stressanti. Poiché questo decremento si può avere in risposta all’adrenalina ed è
bloccato dalla somministrazione di antagonisti 1 e 2, è evidente che il lattato nel tessuto
nervoso in queste condizioni diventa il principale substrato energetico per l’ossidazione
rimpiazzando il ruolo tradizionale del glucosio (Quistorff et al, 2008).
Effetti positivi dell’esercizio moderato sulla funzionalità del sistema
nervoso centrale
Non ci sono dubbi sugli effetti positivi dell’esercizio moderato sulla funzionalità del sistema
nervoso. Tra i piu’ noti ricordiamo il potenziamento della memoria e dell’apprendimento, la
promozione della neurogenesi
e della plasticità, l’aumento della vascolarizzazione
cerebrale, la protezione dagli effetti deleteri di lesioni e malattie degenerative e il
miglioramento della qualità del sonno ,dell’umore, dell’autostima e del senso di
autocontrollo (Lorens-Martin et al, 2008). I meccanismi principali sono attribuiti
soprattutto alle neurotrofine. Per esempio abbiamo molti esperimenti che dimostrano che
l’esercizio aumenta i livelli del mRNA del BDNF(brain derived neurotrophic factor) in vari
tipi di neuroni, aumenta la cattura dal sangue, tramite recettori e trasportatori, di IGF1(insulin-like grow factor) e del VEGF(vascular endothelial grow factor), mentre stanno
aumentando le evidenze sull’importanza del NGF (nerve grow factor) e del FGF-2
(fibroblast grow factor-2).
In particolare il BDNF è fondamentalmente implicato nella neurogenesi dell’ippocampo che
è potenziata dall’esercizio. Il BDNF è sintetizzato da cellule del sistema nervoso
centrale(neuroni dell’ippocampo, soprattutto nel giro dentato, nell’ilo e in CA3, nel midollo
spinale, nel cervelletto e nella corteccia) e periferico, oltre che da altri tessuti (rene,
linfociti ), è presente in alte quantità e ,con il suo recettore trkB, negli stessi neuroni che
secernono CRH(azione paracrina e autocrina), presenta variazioni diurne con picchi
durante l’attività, la restrizione calorica e lo stress e stimola la produzione di serotonina.
L’IGF-1 è un ormone con una struttura simile a quella dell’insulina la cui produzione è
stimolata nel fegato dal GH (grow hormone). In generale stimola la crescita sistemica del
corpo agendo su tutte le cellule specialmente su muscolo scheletrico, cartilagine,osso,
midollo osseo, cute e cellule nervose. I livelli ematici basali di IGF-1 sono correlati con le
abilità mentali e i processi cognitivi. Ha 2 recettori , IGF1R a maggiore affinità e il
recettore dell’insulina ,ed è prodotto per tutta la vita col picco alla pubertà; i sedentari
hanno ridotta cattura di IGF-1 e aumentata suscettibilità a lesioni cerebrali. L’esercizio
fisico aumenta la cattura di IGF-1 dal sangue (barriera ematocerebrale) al cervello con un
meccanismo attivo che coinvolge recettori e trasportatori. Lo IGF-1 è implicato nella
neurogenesi dell’ippocampo e se le sedute di esercizio durano pochi giorni o se blocchiamo
la sua captazione da parte del cervello, la neurogenesi dell’ippocampo, il ricordo e la
produzione di BDNF e di VEGF indotte dall’esercizio sono aboliti anche se i livelli basali di
neurogenesi e l’apprendimento e l’acquisizione in memoria non cambiano. La ripetizione di
un esercizio, sia per pochi che per molti giorni, esercita un buon effetto ansiolitico mediato
da IGF-1.
5
Yanagisawaa et al (2010) hanno cercato di capire se l’esercizio fisico esercita effetti
cognitivi positivi immediatamente dopo la sua cessazione. In effetti un esercizio di
moderata intensità (50%V02 Max) e di breve durata (10 min) migliora le prestazioni al test
di accoppiamento colore-parole di Stroop effettuato dopo la fine dell’esercizio. Inoltre la
functional near-infrared spectroscopy(fNIRS) ha mostrato una aumentata attivazione della
corteccia pre-frontale dorso-laterale sinistra e aumentati livelli di vigilanza. Tuttavia questi
tutti questi effetti peggiorano aumentando o diminuendo l’intensità del lavoro fisico (curva
a U).
Conclusioni
Sia il tessuto muscolare che quello nervoso utilizzano,oltre al glucosio anche il lattato per
le esigenze metaboliche. Nel tessuto nervoso il lattato è prodotto dagli astrociti che lo
cedono ai neuroni che lo ossidano per produrre energia. In condizioni di esercizio
muscolare il metabolismo aumenta in ambo i tessuti e il cervello utilizza il lattato
muscolare in proporzione all’intensità dell’esercizio. Nel tessuto nervoso sono presenti
particolari meccanismi di autoregolazione del flusso ematico che permettono
l’adeguamento delle esigenze metaboliche in numerose condizioni funzionali comprese
quelle collegate all’esercizio fisico. Questo inoltre stimola la produzione di numerose
neurotrofine che, interagendo in numerose reazioni funzionali a cascata, concorrono
all’efficienza funzionale sistema nervoso e potenziano anche
meccanismi cognitivi
essenziali quali l’apprendimento e la memoria,
Referenze
1. McConnell G, Snow R, Hargreaves M. J. Appl. Physiol, 87:1083-1086, 1999.
2. McConell GK, Canny BJ, Daddo MC, Nance MJ, Snow RJ, J Appl Physiol. 89: 1690-8,
2000
3. Ogoh S. Med Sci Sport Exerc,40:2046-2054, 2008
4. Nybo L and Secherb NH, Progress Neurobiol ,72: 223-251, 2004
5. Quistorff B, Secher NH, Lieshout van JJ. FASEB,22: 34-43-3449, 2008
6. Lorens-Martin M, Torres-Aleman I, Trejo JL, Neuromelecular Med 10.1007/s12017008-8026-1
7. Yanagisawaa H, Dand H, Tsuzukib D, Katoa M, Okamoto M, Kyutokub Y, Soya H,
NeuroImage 50:1702-1710, 2010.
6