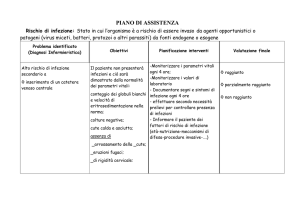
CHIRURGIA
GENERALE
VALUTAZIONE PREOPERATORIA
La valutazione preoperatoria del paziente si basa sull'identificazione della patologia di base per la
quale il paziente è venuto all’osservazione del medico, e anche su una definizione completa delle
condizioni generali, che ha i seguenti scopi:
•
•
•
identificare il paziente a rischio di complicanze anestesiologiche e chirurgiche;
preparare il paziente all’intervento;
prevenire le complicanze postoperatorie.
Una valutazione completa delle condizioni generali richiede:
• Anamnesi. Particolarmente importante è l’indagine anamnestica relativa a: assunzione di
farmaci, coagulazione, allergie, intolleranze farmacologiche (per es. antibiotici),
problemi in occasione di precedenti anestesie.
• Esame obiettivo completo: sistema nervoso centrale e periferico, apparato respiratorio,
apparato cardiocircolatorio, cute e mucose visibili, apparato genito-urinario, fegato.
• Esame RX del torace in due proiezioni (postero-anteriore e laterale).
• ECG.
• Esame delle urine.
• Emocromo completo.
• Determinazioni ematochimiche fondamentali: azotemia, glicemia, elettroliti (sodio,
potassio, calcio, cloro), transaminasi, bilirubina, ALP, creatinina, albumina, proteine totali.
• Prove di coagulazione del sangue (tempo di Quick, INR, PTT, conta piastrine).
• Determinazione della concentrazione delle pseudocolinesterasi plasmatiche (per i
pazienti candidati a ricevere farmaci curarizzanti).
VALUTAZIONE DEI FATTORI DI RISCHIO
E' difficile stabilire il rischio globale per il singolo paziente.
La valutazione complessiva del rischio deve essere differenziata in relazione:
• alle condizioni generali del paziente;
• alla patologia specifica;
• al tipo di intervento chirurgico a cui il paziente è candidato.
La classificazione del rischio anestesiologico più utilizzata è quella della American Society of
Anesthesiologists (ASA) che divide il rischio in 5 classi:
•
Classe I: nessuna alterazione organica, biochimica, psichiatrica ( per esempio un'ernia
inguinale in paziente sano);
•
Classe II: malattia sistemica lieve, che non esita in una compromissione funzionale
(obesità moderata, bronchite cronica, diabete controllato, ipertensione arteriosa moderata,
infarto del miocardio di vecchia data);
•
Classe III: malattia sistemica severa non invalidante, che risulta in compromissione
funzionale (cardiopatia ischemica severa, diabete insulino-dipendente, obesità patologica,
insufficienza respiratoria moderata);
•
Classe IV: malattia sistemica severa con prognosi severa, determina un costante pericolo
di vita e pregiudica la sopravvivenza indipendentemente dall'intervento chirurgico
(insufficienza cardiaca severa, insufficienza respiratoria, renale, epatica ed endocrina,
angina instabile, aritmie refrattarie al trattamento);
•
Classe V: paziente moribondo che non sopravviverà alle successive 24h, che viene
esposto all'intervento chirurgico come ultima possibilità (rottura aneurisma aorta con grave
stato di shock).
Eta
L’età neonatale e l’età geriatrica (> 70 anni) rappresentano condizioni di aumentato rischio
anestesiologico e chirurgico.
Pazienti chirurgici neonati:
• maggiore suscettibilità alle infezioni per l’incompleto sviluppo del sistema immunitario;
• problemi anestesiologici e chirurgici, in relazione alle ridotte dimensioni corporee;
• diminuita tolleranza alle modificazioni dell’omeostasi idroelettrolitica e termica.
Il paziente chirurgico geriatrico presenta 3 categorie distinte di problemi:
• l’aumentata probabilità di patologie concomitanti;
• le naturali alterazioni degenerative dei vari apparati, in particolare di quello
cardiocircolatorio, respiratorio, renale, del sistema nervoso centrale e del fegato;
• uno stato di disidratazione (trattamenti con diuretici, diminuito apporto di liquidi) o di
denutrizione, presentando quindi una aumentata suscettibilità alle infezioni;
Malattie respiratorie e fumo
Valutazione preoperatoria dell’apparato respiratorio:
• presenza di tosse produttiva o secca, di emottisi, d’asma, di dispnea;
• recenti polmoniti;
Il fumo deve essere sospeso 4-6 settimane prima dell’intervento per ridurre la morbilità
postoperatoria.
All’esame obiettivo del torace si ricercheranno rumori patologici e si valuterà il tempo inspiratorio
ed espiratorio. Individuati i pazienti a rischio:
• terapia broncodilatante, mucolitici;
• eradicazione dei processi infettivi acuti e controllo di quelli cronici;
• fisioterapia respiratoria;
Le complicanze polmonari perioperatorie di più frequente riscontro sono:
• l’atelettasia;
• la polmonite
Eseguire di routine l'RX del torace e, se necessario, la spirometria e la emogasanalisi.
Malattie cardiovascolari
Valutazione cardiocircolatoria:
• anamnesi ed esame obiettivo cardiaco
• RX torace nelle due proiezioni, postero-anteriore e laterale;
• ECG
E' necessario in particolare ricercare:
• la presenza di una eventuale cardiopatia ischemica in atto o i suoi esiti (un infarto del
miocardio negli ultimi 6 mesi controindica l’intervento chirurgico di elezione);
• grado di riserva coronarica
• patologia valvolare
• turbe del ritmo e della conduzione.
Una volta accertata la preesistenza di patologia coronarica sono indicati:
• ECG da sforzo
• ECG secondo Holter
• ecocardiografia
• valutazione della frazione di eiezione
I pazienti portatori di patologia cardiovascolare possono essere inquadrati in 4 classi secondo la
classificazione della New York Heart Association (NYHA). Generalmente i pazienti appartenenti
alle classi 1 e 2 tollerano bene l’intervento chirurgico, mentre nelle classi 3 e 4 si ha un aumento
della mortalità postoperatoria.
Terapia farmacologica e igienica del paziente cardiopatico: digitale, diuretici, antiaritmici,
calcioantagonisti, beta-bloccanti, dieta, infusione di liquidi.
Diabete
Complicanza più temibile:
• chetoacidosi per diabete di tipo I
• coma iperosmolare per diabete tipo II
Nella valutazione del paziente andranno puntualizzati:
• il tipo di diabete
• la terapia in atto (dieta, ipoglicemizzanti orali, insulina)
• glicemia, emoglobina glicata
• eventuali episodi pregressi di coma diabetico ed ipoglicemia
•
i segni delle principali complicanze del diabete a livello renale, nervoso e vascolare.
Nei pazienti da sottoporre ad intervento chirurgico minore in trattamento con ipoglicemizzanti orali,
controllare la glicemia e sospendere la terapia in atto in caso di digiuno.
Se l’intervento è di entità maggiore, sostituire l’ipoglicemizzante orale con il trattamento insulinico
alcuni giorni prima dell’intervento.
Occorrerà inoltre prestare attenzione ad evitare episodi di ipoglicemia prolungata, infatti questi
possono determinare sequele ben più gravi per il paziente che non quelle provocate da modiche
iperglicemie. L’obiettivo nel postoperatorio sarà quello di evitare sia il coma ipoglicemico sia il
coma iperglicemico e di mantenere la glicemia tra 80 e 170 mg/dl, evitando quindi glicosuria.
Obesità
Alterazioni fisiopatologiche:
• maggiore incidenza di cardiopatie e di accidenti vascolari cerebrali
• diminuita riserva cardiorespiratoria
• aumentata incidenza di vasculopatia arteriosclerotica e trombosi venose.
Denutrizione
La denutrizione è una condizione patologica che assai spesso si associa alla comparsa di gravi
complicanze postoperatorie ed anche ad una maggiore mortalità. La compromissione dello stato di
nutrizione è caratterizzata dalla deplezione delle riserve energetiche e della massa corporea cellulare
magra, che determina una ridotta efficienza dei meccanismi di difesa aspecifici e specifici. Un calo
ponderale (non volontario) superiore al 10% del peso corporeo abituale, rappresenta un fattore di
rischio per complicanze settiche postoperatorie, specialmente qualora sia associato alla disfunzione
di due o più organi o sistemi.
Altre condizioni patologiche che determinano un aumento del rischio di complicanze
postoperatorie:
• l’insufficienza epatica e quella renale, che compromettono il metabolismo dei farmaci
anestesiologici, il mantenimento dei liquidi nel periodo perioperatorio, l’eliminazione dei
cataboliti;
• le condizioni di shock preoperatorio di vario tipo, sono caratterizzate da un deficit di
perfusione tissutale che si riflette, soprattutto in sede di ferita chirurgica, in una diminuzione
dei meccanismi di difesa (diminuito apporto di ossigeno, proteine ed elementi cellulari
immunologici);
• le neoplasie si associano talora a stati di immunodepressione;
• gli stati di immunodepressione iatrogena (radioterapia, chemioterapia, cortisonici ecc.);
• le infezioni preesistenti costituiscono un fattore facilitante la comparsa di ulteriori infezioni
postoperatorie;
• le coagulopatie costituiscono un rischio elevato di complicanze chirurgiche, ostacolando
l’emostasi intraoperatoria e favorendo l’insorgenza di emorragia postoperatoria.
Allo scopo di selezionare i fattori nutrizionali maggiormente utili per la determinazione del rischio
di complicanze, è stato evidenziato che quelli più importanti e più utili per l’impiego clinico sono:
• calo ponderale recente (non volontario) > 10% del peso corporeo abituale;
• albuminemia < 3,5 g/dl;
• anergia agli “skin tests”;
• diminuzione del conteggio dei linfociti circolanti (< 1500/mm3).
PREPARAZIONE PREOPERATORIA
Preparazione dell’intestino
I pazienti candidati ad interventi chirurgici in anestesia generale devono interrompere l’assunzione
di alimenti solidi per 12 ore e di liquidi per almeno 8 ore prima dell’intervento, al fine di
evitare il ristagno di alimenti nello stomaco e il verificarsi di pericolosi episodi di vomito o rigurgito
al momento dell’anestesia (rischio di polmonite ab ingestis).
Un’accurata preparazione meccanica dell’intestino è indispensabile per gli interventi sul colon
retto. Essa ha lo scopo di allontanare il materiale fecale dall’ultimo tratto del tubo
gastroenterico, in modo da ottenere una riduzione del numero dei batteri presenti e quindi
una diminuzione dell’entità della contaminazione endogena intraoperatoria; alla preparazione
meccanica, si deve associare la preparazione antibiotica dell’intestino. Ciò consente una
significativa riduzione dell’incidenza delle infezioni di ferita, delle deiscenze anastomotiche, degli
ascessi endoaddominali e della mortalità.
Gli schemi di profilassi antibiotica per interventi di chirurgia colorettale più comunemente usati
prevedono l’impiego endovenoso di farmaci attivi contro i germi aerobi ed anaerobi (per es.
aminoglicoside + clindamicina o metronidazolo; ampicillina + sulbactam; amoxicillina + ac.
clavulanico).
Vi sono 3 metodi principali impiegati per la preparazione meccanica intestinale:
•
•
•
Lassativi, clisteri e dieta: dieta a basso residuo di scorie nei due giorni precedenti
all’intervento; purgante energico (solfato di Mg) 24 ore prima dell’intervento e
successivamente dieta idrica; due clisteri rispettivamente 12 ore e 4 ore prima
dell’intervento.
Purganti osmotici: consiste nella somministrazione orale di polietilenglicole (PEG) oppure
di mannitolo al 10%, seguita da abbondante assunzione di acqua, la sera prima
dell’intervento.
Whole gut irrigation: perfusione, attraverso un sondino naso-gastrico, di soluzione
isotonica di cloruro di sodio a velocita elevata (2-4 l/ora). L’infusione viene continuata per
circa 6 ore, comunque fino a quando le scariche alvine diventano chiare come la soluzione
introdotta.
Preparazione igienica
• Lavaggio pre-operatorio del paziente;
• Rasatura nella zona di incisione chirurgica;
• Preparazione del campo operatorio
L’agente ideale per la disinfezione non dovrebbe essere lesivo nei confronti della cute e dovrebbe
essere battericida e attivo in breve tempo dopo l’applicazione. I disinfettanti più usati a scopo di
disinfezione preoperatoria della cute sono: la clorexidina, lo iodiopovidone.
Catetere vescicale
Il posizionamento di un catetere vescicale è una delle più comuni manovre in preparazione
all’intervento chirurgico. Il catetere che solitamente si impiega a tale scopo e del tipo Foley, cioè
con palloncino gonfiabile all’estremità, che ne impedisce la fuoriuscita dalla vescica. Si usa quando:
• in previsione di una ritenzione urinaria post-operatoria;
• per monitorare la diuresi
• svuotare la vescica
Sondino naso-gastrico
Il posizionamento di un sondino naso-gastrico prima dell’intervento chirurgico è indicato nelle
seguenti circostanze:
• negli interventi in cui si prevede la comparsa di un ileo adinamico postoperatorio
prolungato (interventi di chirurgia addominale maggiore);
• nei pazienti che presentano vomito o segni clinici di occlusione intestinale;
• nei pazienti che devono essere sottoposti ad interventi chirurgici d’urgenza in anestesia
generale e sui pazienti traumatizzati candidati a laparatomia esplorativa.
Se hanno assunto alimenti nelle ore immediatamente precedenti è necessario procedere
preoperatoriamente a svuotamento dello stomaco con sondino di ampio calibro, che va mantenuto in
posizione durante l’intervento chirurgico.
COMPLICANZE IN CHIRURGIA
Le complicanze possono essere:
• precoci: emorragie, iperpiressia, complicanze nervose, cardiache, polmonari, gravi
insufficienze epato-renali, ecc;
• immediate: shock, emorragia;
• tardive: embolie polmonari, alterazioni flebitiche, broncopolmoniti, embolia adiposa,
complicanze metaboliche, denutrizione, sequele nervose
Complicanze di ferita
Le complicanze più frequenti che si manifestano a livello della ferita chirurgica sono:
• l’infezione;
• l’ematoma;
• la raccolta sierosa;
• la deiscenza;
• il laparocele (trattato nelle ernie)
Infezione
E' stato riconosciuto che il fattore più importante nel determinare l’insorgenza di infezione di ferita
è il grado di contaminazione del campo operatorio.
L’infezione della ferita chirurgica è causata dalla contaminazione batterica che avviene
intraoperatoriamente; raramente le ferite si infettano per contaminazione che avviene durante il
periodo postoperatorio. Talora (per es. in alcuni reinterventi e in pazienti traumatizzati), la ferita
può
essere già contaminata preoperatoriamente. I segni locali precoci di infezione di ferita sono
l’eritema, la dolorabilità, l’indurimento dei margini, presenza di segni generali di infezione quali
febbre e leucocitosi; segno locale tardivo è la fuoriuscita di pus dalla rima di ferita o dal tramite di
passaggio dei punti di sutura.
In alcuni casi il decorso delle infezioni di ferita si può complicare con la comparsa di:
• disseminazione dell’infezione: locale (flemmone o ascesso) o generalizzata (setticemia);
• deiscenza della ferita (parziale o totale) con possibile eviscerazione;
• laparocele.
Trattamento dell’infezione di ferita:
• si palpano in modo asettico i margini della ferita scoperta, alla ricerca di tumefazioni o di
dolorabilità del sottocutaneo; queste aree vanno spremute delicatamente e ciò può
determinare la fuoriuscita di essudato sieroematico o di pus negli intervalli tra i punti di
sutura. E' allora necessario togliere i punti di sutura in corrispondenza della porzione di
ferita infetta e procedere alla toilette in profondità del sottocute ed eventualmente del piano
fasciale, mediante lavaggio con soluzione fisiologica, allo scopo di eliminare il materiale
essudato e necrotico;
• consentire il massimo drenaggio possibile dell’essudato dalla ferita; nel caso di infezione
estesa a tutta la ferita ciò comporta la rimozione senza indugio di tutti i punti di sutura
cutanei ed eventualmente anche di quelli a livello di aree suppurate del piano fasciale;
• si deve inviare un campione di essudato di ferita al laboratorio di microbiologia per
l’isolamento dei germi patogeni e per determinarne la sensibilità all’antibiogramma. Quando
non si riscontra più la presenza di essudato nella ferita, questa verrà medicata giornalmente
con l’apposizione di garza a piatto.
•
Successivamente si procede al trattamento della ferita in uno dei seguenti modi:
• la soluzione di continuo determinata dal focolaio settico è piccola: si avvicinano i
margini della ferita con cerotti adesivi sterili (steril-strip), per facilitare la riparazione
•
del tessuto di granulazione e la successiva riepitelizzazione superficiale. Tale
modalità di guarigione si definisce "guarigione per seconda intenzione";
la soluzione di continuo della ferita è notevolmente estesa: dopo aver riscontrato che
il fondo della ferita presenta tessuto di granulazione attivamente proliferante, si
procede alla risutura della ferita con punti cutanei staccati; la guarigione che ne segue
viene definita "guarigione per terza intenzione".
Quando la ferita infetta è stata drenata, si sospende la somministrazione degli antibiotici
eventualmente impiegati per il trattamento dell’infezione, tranne nei pazienti gravemente
immunocompromessi e nei casi in cui l’infezione di ferita non ha tendenza a circoscriversi (per es.
flemmone, setticemia).
Ematoma
E' la raccolta di sangue, misto a coaguli, nel contesto della ferita. E' una complicanza meno
frequente dell’infezione. I possibili fattori causali dell’ematoma di ferita sono:
• emostasi incompleta per difetto di tecnica chirurgica;
• terapia anticoagulante (eparina, dicumarolo, ecc.);
• deficit primitivi della coagulazione.
Si presenta come una tumefazione dolente della ferita; la cute sovrastante assume un colorito
bluastro e negli ematomi voluminosi, in accrescimento, vi può essere emorragia dalla ferita. Vi sono
sedi anatomiche dove l’ematoma può determinare un’evoluzione infausta, per compressione di
strutture vitali, come per esempio a livello cerebrale e a livello del collo. Inoltre l’ematoma causa un
aumento del rischio di infezione di ferita. Negli interventi sulle strutture anatomiche profonde del
collo è sempre opportuno posizionare dei drenaggi per sorvegliare l’emostasi e consentire il
deflusso all’esterno di eventuali raccolte di sangue. Gli ematomi profondi del collo possono
rappresentare un pericolo imminente per la vita se esercitano compressione sulla trachea; se si
verifica tale circostanza, si deve immediatamente aprire la ferita ed evacuare l’ematoma. Il
trattamento degli ematomi che non esercitano compressione su strutture vitali è in genere
conservativo. Invece gli ematomi voluminosi ed in accrescimento, come già detto, richiedono la
revisione accurata della ferita.
Raccolta sierosa
E' la raccolta di liquido sterile nella ferita, contenente siero, linfa, liquido trasudato, tessuto adiposo
in necrosi, tracce di sangue. La raccolta sierosa si deve differenziare dall’ematoma (costituito
pressoché totalmente da sangue e coaguli) e dall’infezione di ferita con raccolta liquida (presenza di
pus). La raccolta può essere costituita esclusivamente da linfa (linfocele).
Le raccolte sierose di minime dimensioni tendono a riassorbirsi spontaneamente; quelle voluminose
invece devono essere evacuate, mediante aspirazione con ago o chirurgicamente, perché
costituiscono terreno favorevole alla moltiplicazione di batteri e perché possono determinare
deiscenza parziale della ferita e/o ritardarne il processo di guarigione.
Deiscenza
E' l’apertura spontanea della ferita determinata da cedimento parziale o totale della sutura o della
cicatrice recente. La deiscenza può essere solo a carico dei piani superficiali (cute e sottocute)
oppure può interessare anche i piani profondi (muscolo, fascia, peritoneo). Nelle ferite
laparotomiche, quando vi è deiscenza di tutti i piani di sutura, può avvenire l’eviscerazione, ossia la
fuoriuscita dei visceri dal cavo peritoneale. La deiscenza superficiale di una parte della ferita si
verifica spesso in seguito ad infezione o ad ematoma sottocutaneo.
La deiscenza completa di ferita laparotomica è una complicanza grave, che riconosce i seguenti
fattori causali:
• infezione profonda di ferita;
•
•
•
ritardo di guarigione della ferita (eta avanzata, malnutrizione, diabete, terapia
immunosoppressiva);
difetto di tecnica chirurgica impiegata nella sintesi della laparotomia (materiale di sutura
inadeguato; punti di sutura troppo fitti o troppo radi; legatura inadeguata delle suture);
aumento notevole della pressione endoaddominale (ascite, occlusione intestinale, tosse
violenta).
Essa si manifesta classicamente verso il termine della 1^ settimana postoperatoria, quando cioè la
forza tensile della cicatrice è minima. E' caratterizzata dalla comparsa di sanguinamento per
strappamento dei vasi neoformati e da apertura dei margini della ferita, con possibile eviscerazione
nel caso di deiscenza completa della sutura laparotomica.
La terapia della deiscenza consta della revisione chirurgica e risutura della ferita, se questa non è
infetta; in caso di infezione, la risutura dovrà avvenire solo dopo risoluzione completa
dell’infezione.
Complicanze respiratorie
Sono tra le complicanze postoperatorie più frequenti e potenzialmente più gravi. Infatti la riduzione
degli scambi gassosi che ne consegue diminuisce l’ossigenazione dei tessuti e aumenta il rischio di
ulteriori complicanze a carico di altri organi (per es. infarto miocardico, danno cerebrale).
Le complicanze respiratorie postoperatorie più frequenti sono l’atelettasia, la polmonite, il
versamento pleurico, lo pneumotorace e l’aspirazione di ingesti.
L’atelettasia polmonare e la complicanza respiratoria più frequente in assoluto. Più spesso
l’atelettasia è legata alla ipoventilazione (respiro superficiale per reazione antalgica, azione
depressiva sul centro respiratorio da parte di farmaci anestetici ed analgesici) e cause ostruttive
(abbondanti secrezioni bronchiali, intubazione prolungata, aspirazione di ingesti).
Un’atelettasia di vaste dimensioni (lobare) si manifesta clinicamente con:
• febbre
• tachipnea
• tachicardia
• all’ascoltazione del torace si riscontrano rantoli fini crepitanti ai campi polmonari inferiori.
L’esame radiologico del torace può evidenziare strie atelettasiche, oppure, in caso di atelettasie
maggiori, aree di opacità triangolare con apice ilare.
Queste cause determinano la chiusura dei bronchioli e il collasso degli alveoli polmonari, più
frequentemente a livello delle basi. L’atelettasia insorge precocemente, entro 24-48 ore
postoperatorie, ed è responsabile in molti casi della frequente febbre postoperatoria precoce.
La terapia consiste nella fisioterapia respiratoria, nella somministrazione di farmaci fluidificanti
delle secrezioni bronchiali e broncodilatatori. E' necessario procedere senza indugio all’aspirazione
tracheale con sondino ed eventualmente all’aspirazione endobronchiale diretta in broncoscopia.
Alterazioni della funzionalità gastrointestinale
Ileo paralitico postoperatorio: negli interventi laparotomici, il trauma chirurgico che comporta
l’apertura del peritoneo, la manipolazione dei visceri addominali, la confezione di anastomosi, e la
somministrazione di farmaci anestetici condizionano la scomparsa transitoria dell’attività
peristaltica gastrointestinale. Questo può essere aggravato da uno stato di ipopotassiemia o, più
raramente, dalla somministrazione di farmaci oppiacei e anticolinergici. La durata dell’ileo
paralitico postoperatorio e mediamente di 2-4 giorni.
Gastrectasia acuta, rara, caratterizzata da enorme dilatazione dello stomaco, che è sovradisteso da
secreto gastrico e gas.
Ileo paralitico tardivo: per ascesso addominale; deiscenza di anastomosi;
Occlusione meccanica postoperatoria: per formazione di aderenze e angolazioni intestinali;
invaginazione intestinale.
Sanguinamento a livello di ulcera peptica o di stomia intestinale alta o di anastomosi.
Diarrea postoperatoria: è abbastanza frequente ed è spesso causata da tossicità intestinale da
antibiotici. L’aumento del numero delle scariche alvine è frequente dopo colecistectomia e
interventi sulle vie biliari, ed è dovuto a deflusso incontrollato di bile nell’intestino.
Stipsi postoperatoria prolungata, con formazione di fecaloma a livello rettale. Questa
complicanza può essere dovuta all’uso di farmaci oppiacei o anticolinergici. La terapia consiste
nella digitoclasia del fecaloma, nella somministrazione di purganti o di clistere e nell’idratazione
del paziente.
Insufficienza renale acuta
Si definisce insufficienza renale acuta (IRA) una rapida diminuzione della funzionalità renale,
caratterizzata da riduzione della clearance della creatinina e/o da aumento della concentrazione
sierica della creatinina e dell’urea; nella maggior parte dei casi l’IRA si manifesta clinicamente con
oliguria grave o anuria. L’IRA postoperatoria è solitamente conseguente a ipoperfusione del
parenchima renale, per effetto di una o più delle seguenti cause:
• ipovolemia (emorragie gravi, perdite di liquidi nel terzo spazio);
• riduzione della gettata cardiaca;
• sepsi;
• shock neurogeno;
• occlusione spontanea o iatrogena delle arterie renali (manovre di clampaggio delle arterie
renali o dell’aorta sovrarenale, che privano totalmente il rene dell’afflusso sanguigno);
• aumento del tono arteriolare renale da stimolazione adrenergica (anche iatrogena; l’uso di
farmaci adrenergici per il controllo dell’ipotensione, dello shock e dell’attività cardiaca, può
condurre ad un brusco incremento delle resistenze a livello del microcircolo renale con
grave riduzione della perfusione parenchimale, che si rivela con contrazione della diuresi).
Dal punto di vista pratico, a prescindere dall’eziologia dell’ipoperfusione renale, è importante
ricordare che, se la pressione nell’arteria renale rimane < 80 mmHg per oltre 30 minuti, insorge
solitamente IRA. Esiste normalmente un’autoregolazione renale del tono delle arteriole afferenti in
risposta ad ipotensione; tuttavia, valori di pressione sistolica < 80 mmHg non sono più
adeguatamente compensabili con il meccanismo della vasodilatazione delle arteriole afferenti.
E' importante distinguere tra IRA funzionale, che può essere prontamente reversibile con adeguata
e tempestiva terapia, e IRA organica, caratterizzata da alterazioni istopatologiche renali, di più
difficile soluzione.
La correzione dell’IRA funzionale, caratterizzata da oliguria postoperatoria da ipoperfusione, si
realizza mediante reidratazione precoce e correzione dell’ipoperfusione; l’IRA organica si instaura
quando, nonostante la correzione delle cause di ipoperfusione renale, i parametri di funzionalità
renale non rientrano nella norma.
La causa più frequente di IRA organica è la necrosi tubulare acuta (NTA), secondaria a:
• ischemia renale protratta;
• azione di tossine batteriche liberate in corso di sepsi;
• farmaci nefrotossici: FANS, antibiotici (aminoglicosidi, cefalosporine, vancomicina), alcuni
anestetici, mezzi di contrasto radiologico;
• emoglobinuria/mioglobinuria in esiti di ustioni estese, di politrauma o di rivascolarizzazione
di arti ischemici;
• emoglobinuria massiva da incompatibilità emotrasfusionale.
I parametri da monitorare con attenzione in caso di contrazione postoperatoria della diuresi, per
evidenziare precocemente l’insorgenza di IRA, sono: la diuresi oraria, l’azotemia, la
creatininemia, la velocità di filtrazione glomerulare, l’esame del sedimento urinario, gli
elettroliti sierici ed urinari, il pH arterioso, l’osmolarità plasmatica ed urinaria. L’IRA
esordisce solitamente con una brusca contrazione della diuresi; tuttavia la diuresi giornaliera può
successivamente risultare normale o addirittura aumentata per danno tubulare massivo con perdita
nella capacità di concentrazione delle urine (IRA con diuresi conservata). Un valore di sodio
urinario < 20 mEq/l è indice di IRA prerenale. Per la diagnosi di IRA funzionale è importante
valutare il rapporto Na/K urinari se è < 1, è indice di IRA funzionale.
In caso di NTA, l’osmolarità urinaria (normale: 700-1400 mOsm/l) tende a diminuire, raggiungendo
quella del plasma (circa 300 mOsm/l) per incapacità progressiva del rene di concentrare le urine. Se
si sviluppa NTA, nel sedimento urinario compaiono cellule tubulari e cilindri bruni, che consentono
la diagnosi. Nei casi di contrazione della diuresi da causa prerenale, la somministrazione di liquidi
ed elettroliti è spesso sufficiente a ripristinare la funzione renale. Se la risposta a tale terapia è
inadeguata, o se compare ritenzione idrica, si ricorre alla somministrazione di:
• furosemide;
• mannitolo;
• dopamina;
• dobutamina (al fine di provocare una vasodilatazione del circolo corticale).
L’iperpotassiemia ingravescente nei pazienti con IRA, per la sua potenziale pericolosità (arresto
cardiaco) deve essere rapidamente corretta con trattamento medico o dialitico.
Complicanze urinarie
Le complicanze urinarie postoperatorie più frequenti sono la ritenzione urinaria acuta e le infezioni
dell’apparato urinario.
•
Ritenzione urinaria acuta: l’impossibilita di svuotare in parte o totalmente la vescica
nell’immediato postoperatorio può dipendere da tre cause:
• danno organico delle strutture nervose che controllano la minzione (lesioni S2S3,T9-L4, diencefalo, corteccia);
• alterazioni funzionali dei meccanismi della minzione (da anestetici);
• ostacolo meccanico nell’uretra (ipertrofia prostatica).
Alterazioni di tipo funzionale del meccanismo della minzione si instaurano frequentemente
dopo anestesia generale o spinale, causate dai farmaci anestetici.
Qualunque ne sia la causa, lo sviluppo di ritenzione urinaria acuta è segnalato dalla mancata
emissione spontanea di urina a distanza di qualche ora dall’intervento, con comparsa di
sovradistensione ("globo") vescicale. La diagnosi differenziale va posta con l’oliguria o
l’anuria postoperatoria.
Il trattamento elettivo della ritenzione urinaria acuta postoperatoria consiste nel cateterismo
vescicale estemporaneo.
•
Infezioni
Il principale fattore di rischio è rappresentato dalle manovre invasive a carico delle vie
urinarie, in particolare dal cateterismo vescicale. Nei pazienti affetti da ritenzione urinaria
acuta o cronica l’infezione urinaria è favorita dall’incompleto svuotamento della vescica e
dalle frequenti e concomitanti infezioni subacute della prostata, le quali costituiscono spesso
il meccanismo responsabile del mantenimento di batteriuria e di infezioni urinarie ricorrenti.
La principale fonte di batteri responsabili di infezioni delle vie urinarie è rappresentata
dall’intestino. Infatti il 50% circa delle batteriurie nosocomiali è attribuibile a ceppi di
Escherichia coli; il restante 50% è dovuto in gran parte a bacilli aerobi Gram- (Proteus,
Pseudomonas, Enterobacter, Klebsiella). Tra gli aerobi Gram+ si segnalano per l’elevata
frequenza lo Staphylococcus epidermidis, lo Staphylococcus aureus, l’Enterococcus. Più
raro è il riscontro di infezioni da Candida.
Un ruolo eziologico significativo per le infezioni urinarie nei pazienti chirurgici spetta anche
alle terapie antibiotiche ad ampio spettro, in grado di alterare la flora batterica intestinale e
di consentire la proliferazione di ceppi patogeni resistenti.
Il cateterismo estemporaneo causa significativa contaminazione urinaria solo in circa il 10%
dei casi, ed è quindi il sistema preferibile, qualora il recupero della funzionalità vescicale sia
ritenuto imminente. Una batteriuria grave può essere anche asintomatica. I segni e sintomi
clinici dell’infezione urinaria sono: febbre elevata (38-40 °C, comparsa con brividi),
irritazione uretrale, dolore sovrapubico, ematuria e piuria. La diagnosi di infezione urinaria
viene confermata dalla positività dell’urinocoltura.
L’irradiazione del dolore alla loggia renale, la comparsa di brivido e di febbre > 39 °C
indicano l’estensione dell’infezione urinaria in senso ascendente.
La terapia delle infezioni urinarie è antibiotica, mirata in base all’esame urinocolturale e ai
test di sensibilità antibiotica.
Febbre postoperatoria
Si definisce febbre l’aumento della temperatura corporea conseguente ad un innalzamento del
livello di termoregolazione ipotalamico.
Per ipertermia si intende invece l’eccesso di produzione di calore in rapporto alla possibilità di
termodispersione del corpo, senza che vi sia modificazione dell’attività del centro termoregolatore.
La comparsa di febbre nei pazienti sottoposti ad intervento chirurgico è un evento assai frequente.
Un modico rialzo termico (< 38 °C) nei primi 2-3 giorni postoperatori, non accompagnato da altri
segni o sintomi di complicanze, si deve considerare facente parte della normale risposta
fisiopatologica al trauma chirurgico, tale alterazione è transitoria e reversibile senza alcuna terapia.
Il rialzo della temperatura corporea nel postoperatorio è quasi sempre indotto dall’immissione in
circolo di interleuchina-1. L’IL-1, viene prodotta e liberata dai monociti circolanti, dalle cellule del
SRE epatico e splenico e dai macrofagi, in seguito a stimolazione da parte di microbi, di molecole
di produzione batterica (per es. endotossina) e di immunocomplessi. L’IL-1 raggiunge il centro
termoregolatore e vi induce la sintesi di PGE2, che provoca un aumento dell’attività del centro
stesso.
Quando compare febbre nel periodo postoperatorio è necessario cercarne la causa, allo scopo di
chiarire se si tratta della normale risposta fisiopatologica al trauma chirurgico, oppure se la febbre è
causata da complicanze postoperatorie di tipo settico.
Nel 75% dei pazienti chirurgici che presentano febbre postoperatoria precoce e di breve durata non
è possibile evidenziare alcun focolaio settico, e in questi casi la febbre è attribuibile ad una delle
seguenti cause:
• rilascio di IL-1 in risposta al trauma chirurgico tissutale;
• atelettasia polmonare;
• reazione a farmaci.
Tuttavia se la febbre (> 37,5 °C) si protrae oltre la 4^ o 5^ giornata postoperatoria o se la febbre è
maggiore di 39 °C, è molto probabile che sia secondaria ad infezione.
Gli esami ematochimici ed ematologici solitamente non consentono di precisare la patogenesi della
febbre postoperatoria, poiché le modificazioni rilevabili (leucocitosi neutrofila, aumento della VES,
aumento della proteina C-reattiva, iperglicemia), sono comuni alle varie cause di febbre.
Si devono ricercare i segni locali dell’infiammazione nelle sedi più frequentemente interessate da
infezioni postoperatorie (ferita, apparato respiratorio, vie urinarie, arti).
E' inoltre necessario eseguire gli esami microbiologici in grado di fornire indicazione su possibili
infezioni in atto: emocoltura, urinocoltura, coltura dell’escreato bronchiale, dei liquidi provenienti
dai drenaggi e dell’essudato eventualmente raccolto in sede di ferita. In caso di diarrea si esegue
coprocoltura e ricerca dell’antigene per identificare l’infezione da Clostridium difficile.
Se si attribuisce la febbre ad un’infezione da probabile deiscenza di anastomosi del tubo digerente,
le indagini radiologiche con mezzo di contrasto non andrebbero eseguite prima della 9^-10^
giornata postoperatoria, impiegando comunque mezzo di contrasto idrosolubile poiché gli
spandimenti di mezzo di contrasto baritato sono infatti lesivi dei meccanismi di difesa peritoneale e
sono di difficile eliminazione.
E' utile distinguere la febbre postoperatoria precoce, che si manifesta entro 48 ore dall’intervento,
dalla febbre postoperatoria tardiva, che compare successivamente.
La causa più frequente di febbre postoperatoria precoce è l’atelettasia polmonare, in questo caso
la febbre si manifesta in genere entro 24 ore dall’intervento. L’atelettasia comporta riduzione del
flusso d’aria e della clearance mucociliare, con accumulo di batteri e liberazione di IL-1 da parte dei
macrofagi alveolari e conseguente comparsa di febbre. Le manipolazioni prolungate delle mucose
dei visceri cavi (tubo digerente, vie genitourinarie), la contaminazione massiva della ferita o di
cateteri, possono causare febbre postoperatoria precoce elevata (> 38 °C).
La febbre postoperatoria tardiva compare dopo alcuni giorni dall’intervento, solitamente entro le
prime 2 settimane e in genere è dovuta allo sviluppo di un’infezione.
Le cause di febbre postoperatoria tardiva sono, in ordine decrescente di incidenza: le infezioni di
ferita, quelle polmonari, quelle addominali, quelle urinarie, le flebiti, l’embolia polmonare.
Vi sono alcune caratteristiche della curva termica che possono indirizzare verso la diagnosi
eziologica della febbre postoperatoria:
• la febbre causata da infezione di ferita, da flebite e da infezione di catetere insorge
progressivamente ed è di tipo continuo-remittente, con fluttuazioni solitamente comprese tra
37-38,5 °C;
• la febbre da broncopolmonite postoperatoria è anch’essa di tipo continuo-remittente, però a
livelli più elevati di temperatura;
• la febbre causata da infezione delle vie urinarie e quella legata a setticemia insorge di solito
con brivido e presenta fluttuazioni a livelli molto elevati (38,5-40 °C);
• nei pazienti che sviluppano un ascesso, la febbre e di tipo intermittente, "a dente di sega",
con una o più puntate quotidiane di febbre elevata.
Talora, anziché febbre, i pazienti affetti da gravi infezioni manifestano ipotermia (< 36 °C).
L’ipotermia si verifica nelle fasi terminali delle complicanze settiche, quando compare shock
ipodinamico. Ciò rappresenta un segno prognostico infausto a breve termine.
Ipertermia maligna
L’ipertermia maligna è una malattia caratterizzata da elevato ed improvviso rialzo termico (> 40
°C), in risposta alla somministrazione di farmaci miorilassanti ad azione depolarizzante, in corso di
anestesia. Questa gravissima complicanza si verifica raramente, ma comporta una mortalità assai
elevata. Le manifestazioni cliniche, oltre che da una elevata ipertemia, sono costituite da: tachipnea,
ipotensione ed aritmia. Le alterazioni ematochimiche sono rappresentate da: ipossia, ipercapnia,
acidosi ed iperpotassiemia. La patogenesi è riferibile alla comparsa di elevato e persistente tono
muscolare, che comporta aumento incontrollato della termogenesi. La terapia dell’ipertermia
maligna, oltre alla immediata interruzione dell’anestesia, è sintomatica, mirata a diminuire la
temperatura corporea e a sostenere la funzionalità cardiocircolatoria e respiratoria. Può essere utile
la somministrazione di dantrolene1.
1 Si ritiene che il dantrolene riduca il tono muscolare e il metabolismo prevenendo il rilascio progressivo di calcio dai
siti di deposito muscolare (reticolo sarcoplasmstico). Nella MH, i livelli intracellulari di calcio sono elevati e il
dantrolene quindi, controbilancia questa anormalità.
MOF
La Multiple Organ Failure è una sindrome caratterizzata dall’insorgenza di insufficienza funzionale
progressiva di più apparati.
Le infezioni gravi sono tra le cause più frequentemente responsabili della MOF. Quest’ultima infatti
rappresenta spesso la fase evolutiva finale della sepsi a decorso ingravescente. Nel paziente
chirurgico i focolai settici primitivi responsabili dello scatenamento della MOF sono localizzati nel
70% dei casi a livello intraddominale o polmonare, nei rimanenti casi sono a livello della ferita
chirurgica, delle vie urinarie o in altre sedi.
Poiché le insufficienze funzionali si manifestano a carico di organi e tessuti diversi tra loro, è stato
ipotizzato un meccanismo patogenetico comune, che consiste nell’attivazione massiva dei
meccanismi dell’infiammazione, soprattutto a livello del microcircolo. Infatti la sepsi, l’ipossia
tissutale, le reazioni immunologiche conseguenti a trasfusioni, i traumi gravi sono tutti fattori che
provocano l’attivazione intravascolare del complemento. Questa alterazione determina
l’aggregazione dei granulociti polimorfonucleati (PMN) a livello del microcircolo e la loro
successiva degranulazione, con rilascio a livello dell’endotelio di enzimi lisosomiali e di radicali
liberi dell’ossigeno. Tali sostanze provocano un danno diretto della barriera endoteliale, causano
edema interstiziale e riducono la cessione d’ossigeno ai tessuti. Questa sequenza di alterazioni
causata dall’attivazione del complemento determina un danno dei parenchimi di organi vitali.
Eziologia della MOF:
• Interventi chirurgici
• Traumi multipli
• Ustioni gravi
• Patologie infiammatorie acute
• Infezioni gravi
• Emotrasfusioni multiple
• Shock ipovolemico
Segni clinici, esami di laboratorio, radiologici e strumentali indicativi della MOF.
Segni clinici
• Febbre e presenza di focolaio settico
• Dispnea, tachipnea, crepitii all’auscultazione del torace
• Tachicardia, ipotensione, oliguria, sonnolenza, letargia, confusione mentale
• Diatesi emorragica
• Sanguinamento intestinale
Esami di laboratorio
• Alcalosi respiratoria, acidosi metabolica
• Aumento azotemia e creatininemia
• Iperbilirubinemia, aumento ALT, AST, LDH
• Piastrinopenia, aumento FDP (prodotto di degradazione del fibrinogeno), ipofibrinogenemia
• Leucocitosi, leucopenia
• Esame urine: P.S. < 1010; osmolarità < 400 mOsm/l;
Esami radiologici e strumentali
• RX torace: infiltrati alveolari diffusi bilaterali
• EGDS: gastrite emorragica, ulcere da stress.
L’esordio della MOF è insidioso, quasi sempre caratterizzato inizialmente dal deficit isolato di un
organo/apparato, seguito nelle ore e nei giorni successivi dalla comparsa di insufficienza di altri
organi/apparati. L’insufficienza respiratoria è solitamente la prima a manifestarsi, di solito
seguono l’insufficienza epatica dopo 1-3 giorni, poi quella cardiocircolatoria e quella renale
dopo 1-2 settimane. Le alterazioni emocoagulative, assai gravi per la prognosi, possono esordire
dopo la prima settimana.
La prognosi nei pazienti affetti da MOF è assai grave. La mortalità è correlata al numero di
organi/apparati lesi e alla durata dell’insufficienza.
Il trattamento della MOF è finalizzato alla rimozione delle cause scatenanti e al mantenimento
delle funzioni vitali. I provvedimenti terapeutici essenziali sono:
• il drenaggio o la rimozione chirurgica dei focolai settici;
• il mantenimento di una buona perfusione del microcircolo, mediante controllo
farmacologico e infusionale dello shock;
• la terapia antibiotica, istituita, se possibile, sulla scorta dell’antibiogramma;
• trattamento del sanguinamento di ulcera gastroduodenale da stress;
• il ricorso a trasfusioni di sangue va limitato al minimo poiché peggiora la prognosi;
• per il trattamento dell’insufficienza respiratoria si ricorre alla ventilazione assistita;
• l’insufficienza renale viene trattata con emodialisi extracorporea;
• l’insufficienza epatica ha limitate possibilità di trattamento (dieta iperglicidica, ipoproteica,
lattulosio, neomicina per os);
ARDS
L’Acute Respiratory Distress Syndrome, è caratterizzata da scompenso respiratorio acuto
(dispnea, tachipnea, cianosi ed ipossia) ed è dovuta ad un’insufficienza rapidamente ingravescente
degli scambi gassosi alveolari. L’ARDS rappresenta la ripercussione a livello polmonare di lesioni
acute di vario tipo a carico dell’organismo. La sindrome interessa di solito pazienti senza
preesistenti affezioni polmonari. Il meccanismo patogenetico dell’ARDS è stato identificato
nell’iperattivazione intravascolare dei meccanismi coagulativi e dell’infiammazione.
Un ruolo importante nella patogenesi dell’ARDS spetta all’attivazione del complemento, che
induce l’aggregazione e l’adesione dei leucociti polimorfonucleati all’endotelio, fino a formare
microemboli. Questi aggregati leucocitari si formano soprattutto a livello del microcircolo
polmonare, dove i PMN liberano enzimi lisosomiali, radicali liberi dell’ossigeno, chinine vasoattive
e derivati dell’acido arachidonico (prostaglandine, trombossani). L’azione lesiva delle proteasi e dei
radicali ossidanti, danneggiando le cellule endoteliali e l’integrità delle membrane basali, induce
aumento della permeabilità dell’endotelio, favorendo l’edema interstiziale e la migrazione dei
PMN nell’interstizio polmonare. L’ulteriore rilascio di enzimi lisosomiali e di radicali comporta il
danneggiamento delle strutture interstiziali del polmone e delle membrane basali alveolari,
consentendo un danno diretto dell’epitelio alveolare e il passaggio di liquidi e proteine negli
alveoli. L’attività del surfactante polmonare si riduce per effetto della degradazione delle molecole
tensioattive indotta dalle proteasi e compare atelettasia degli alveoli.
Principali fattori eziologici dell’ARDS.
• Shock
• Sepsi
• Traumi multipli
• Ustioni
• Embolia polmonare
• Pancreatite acuta
• Trasfusioni multiple
• Aspirazione di ingesti
Nella pancreatite acuta emorragica un ruolo significativo nella patogenesi dell’ARDS viene svolto
dal passaggio in circolo della fosfolipasi, enzima in grado di scindere il surfactante. I macrofagi
polmonari partecipano all’induzione del danno parenchimale tramite la liberazione di fattori
procoagulanti, che incrementano la trombosi del microcircolo e la produzione di fattori di crescita
dei fibroblasti, stimolando la deposizione di collagene nell’interstizio polmonare con possibile
evoluzione verso la fibrosi. La stimolazione alla deposizione di collagene sembra favorita anche da
una tensione di ossigeno eccessivamente elevata nell’aria inspirata, ciò impone che la
somministrazione terapeutica di ossigeno avvenga in maniera rigorosamente controllata. L’ARDS
rappresenta il quadro più grave dell’insufficienza respiratoria che può comparire in corso di MOF.
In effetti la sua patogenesi è simile a quella della MOF, di cui costituisce talora il quadro iniziale.
La diagnosi precoce di ARDS si fonda sul rilevamento della comparsa di dispnea in un paziente
senza preesistenti affezioni respiratorie o cardiocircolatorie. L’ARDS si instaura di solito entro 24
ore dall’evento acuto scatenante.
L’esordio della sindrome è caratterizzato da tachipnea e iperventilazione, cianosi reversibile alla
somministrazione di ossigeno. L’esame radiologico del torace dimostra, già dopo poche ore
dall’esordio, infiltrazione alveolare bilaterale evidente come opacità diffusa dei campi polmonari.
L’emogasanalisi indica inizialmente una situazione di alcalosi respiratoria. Se il decorso della
sindrome non viene contrastato, si sviluppa una vera e propria insufficienza respiratoria, con acidosi
respiratoria, ipercapnia, ipossia grave e cianosi che non risponde alla somministrazione di ossigeno.
Se l’ARDS non viene trattata precocemente, il paziente muore per insufficienza respiratoria o per
l’ulteriore insorgenza di complicanze cardiocircolatorie o settiche.
Il trattamento dell’ARDS ha due obiettivi:
• correzione delle alterazioni respiratorie
• terapia dell’affezione di base che ha condotto alla comparsa della sindrome.
Terapia dello shock in corso di ARDS
Ripristino della pressione arteriosa e della diuresi, senza indurre un sovraccarico di volume, per non
incrementare la tendenza allo sviluppo di edema interstiziale. Fondamentale risulta quindi la
rilevazione della PVC, o della pressione in arteria polmonare tramite catetere di Swan-Ganz: per
valori di pressione polmonare > 15 mmHg l’infusione di liquidi è controindicata, mentre è utile il
ricorso a farmaci cardiotonici vasoattivi.
Trattamento della sepsi: drenaggio o rimozione chirurgica dei focolai settici ed un’adeguata terapia
antibiotica.
Trattamento delle alterazioni respiratorie nelle forme lievi di ARDS:
Può essere sufficiente la somministrazione di ossigeno a concentrazioni < 40%; il paziente va
mobilizzato spesso ed invitato a tossire per eliminare le secrezioni. Utile in ogni caso l’istituzione di
fisioterapia respiratoria. Quando diventa necessario somministrare ossigeno a concentrazioni > 50%
per mantenere la PaO2 a valori accettabili, si deve provvedere all’intubazione del paziente e alla
respirazione assistita.
L’esame radiologico del torace va eseguito con frequenza giornaliera, per seguire l’evoluzione della
malattia e soprattutto per evidenziare l’insorgenza di infezioni polmonari.
Embolia adiposa
L’embolia adiposa, contrariamente alla sindrome da embolia adiposa, è relativamente frequente. Il
90% dei pazienti che hanno subito fratture delle ossa lunghe o che sono stati sottoposti ad interventi
di applicazioni di protesi articolari, presentano a livello del microcircolo polmonare particelle
adipose.
La sindrome da embolia adiposa è caratterizzata da alterazioni neurologiche, insufficienza
respiratoria, petecchie in regione ascellare, dorsale.
Complicanze cardiache
L’insorgenza di complicanze cardiache, gravate da un’alta percentuale di mortalità, è correlata sia al
tipo e alla modalità di esecuzione dell’intervento chirurgico, sia all’insorgenza di complicanze non
cardiache postoperatorie.
I più importanti fattori di rischio cardiologico sono comunque legati alle condizioni preoperatorie
del paziente, la cui valutazione, secondo un punteggio variabile, si è dimostrata significativamente
correlata al rischio di complicanze e di mortalità cardiaca postoperatoria.
I quadri clinici più frequenti delle complicanze cardiache sono:
• disturbi del ritmo;
• infarto miocardico acuto;
• scompenso cardiaco.
Le aritmie intraoperatorie presentano un’incidenza del 20%. Circa un terzo degli episodi avviene al
momento dell’induzione dell’anestesia ed è in relazione all’uso di alcuni agenti anestetici (alotano,
ciclopropano), di simpaticomimetici e digitale. Nel periodo postoperatorio sono in genere
dipendenti da alterazioni dell’equilibrio elettrolitico (ipocalcemia) e acido basico (ipossiemia,
alcalosi). Nella maggior parte dei casi le aritmie sono asintomatiche. Occasionalmente possono
segnare l’esordio di un infarto acuto, accompagnandosi a dolore toracico, dispnea, palpitazioni.
Valutazione preoperatoria di rischio cardiaco.
Anamnesi
• Eta > 70 anni
• Infarto miocardico recente
Esame clinico
• Ritmo di galoppo/turgore giugulare
• Stenosi valvolare aortica
ECG
•
•
Extrasistoli sopraventricolari
Extrasistoli ventricolari
Stato generale
• Equilibrio acido-basico
• Equilibrio elettrolitico
• Insufficienza renale
• Insufficienza epatica
Intervento
• Urgenza
• Intraperitoneale/intratoracico/aorta
Emorragie postoperatorie
Nelle emorragie importanti è indispensabile identificare rapidamente la causa per poter instaurare
una terapia adeguata, in grado di correggere tutti quei fenomeni implicati nella genesi del
sanguinamento, che altrimenti porterebbero ad exitus il paziente.
Le emorragie postoperatorie riconoscono diverse cause che possono essere suddivise nei seguenti
gruppi:
• cause preesistenti all’intervento chirurgico;
• cause provocate direttamente dall’intervento chirurgico;
• cause successive all’intervento chirurgico o alle sue complicanze.
Cause preesistenti all’intervento chirurgico:
Sono rappresentate essenzialmente dalle coagulopatie. Può interessare sedi diverse, più
frequentemente l’incisione chirurgica o quella di parete per il posizionamento dei drenaggi. La
causa più frequente è costituita dalla trombocitopenia, dovuta a difetti di produzione di piastrine,
oppure ad eccessiva distruzione (porpora trombocitopenica).
Anche le malattie emofiliche, la malattia di von Willebrand, possono essere responsabili di
sanguinamenti postoperatori. La terapia consiste nel reintegro dello specifico fattore della
coagulazione carente. La somministrazione di pappe piastriniche, di plasma fresco congelato e di
specifici fattori della coagulazione riesce, di solito, a risolvere l’episodio acuto.
Un accurato studio della coagulazione in fase preoperatoria permette di prevenire le complicanze
emorragiche.
Cause provocate direttamente dall’intervento chirurgico:
Si tratta essenzialmente di lesioni vascolari che non riguardano necessariamente un grosso vaso;
infatti, anche perdite da piccole arterie o vene possono creare gravi problemi.
Se l’emorragia non è intensa, si somministrano inizialmente farmaci procoagulanti (ac.
tranexamico). Se l’emorragia è profusa, la terapia consiste nella trasfusione di sangue in rapporto
all’entità del sanguinamento. Se il quadro clinico è drammatico, le misure immediate da adottare
sono il trattamento dello shock ipovolemico e l’eventuale reintervento chirurgico.
Cause successive all’intervento o alle sue complicanze
Le complicanze emorragiche che compaiono più o meno tardivamente dopo un intervento
chirurgico riconoscono cause diverse.
I pazienti sottoposti all’infusione di una grande quantità di sangue sono da considerarsi ad alto
rischio emorragico. Infatti, la diluizione delle piastrine, che si attua quando si trasfonde sangue
conservato per più di 24 ore, l’eventuale e pericolosa attivazione del sistema coagulativo, con
conseguente insorgenza di coagulazione intravascolare disseminata, ed il rischio di reazioni
trasfusionali emolitiche sono gravi complicanze emorragiche che fanno preferire, quando è
possibile, altre modalità per il reintegro della massa sanguigna. Quindi, il predeposito di sangue da
parte del paziente o il recupero previa filtrazione del sangue del paziente stesso durante l’intervento,
sono metodiche da preferire.
Pancreatite acuta
La comparsa in fase postoperatoria di una pancreatite acuta costituisce una delle complicanze più
gravi. Un aumento dell’amilasemia può presentarsi nei pazienti sottoposti ad intervento chirurgico,
ma a questo aumento non corrisponde sempre un processo patologico a carico del pancreas.
Sebbene le cause delle pancreatiti postoperatorie siano poco chiare, talora esse insorgono per
lesione diretta del pancreas. Gli interventi sulla via biliare principale, e soprattutto sulla papilla di
Vater, determinano pancreatite acuta con una frequenza più elevata rispetto ad altri interventi
sull’addome superiore lontani dalla zona biliopancreatica. L’ipotesi più accreditata è che si verifichi
una stasi di secreto pancreatico indotta da uno stato di edema della papilla, con conseguente
aumento della pressione nel sistema canalicolare pancreatico.
La diagnosi di una pancreatite acuta postoperatoria presenta alcune difficoltà, poiché il dolore
all’inizio è mal distinguibile dal comune dolore postoperatorio e inoltre è poco avvertito per la
terapia antalgica eventualmente adottata.
La determinazione dell’amilasemia orienta decisamente verso un processo pancreatitico se gli indici
sono abnormemente elevati, anche se spesso l’amilasemia si eleva modicamente dopo un intervento
sulle vie biliari o sul pancreas, anche in assenza di pancreatite clinicamente rilevante.
La pancreatite acuta postoperatoria insorge generalmente in 3^-4^ giornata; il paziente diventa
irrequieto, lamenta dolori addominali diffusi più intensi, la peristalsi tarda ad attivarsi.
FASI DEL PERIODO POST-OPERATORIO
Il periodo postoperatorio procede attraverso fasi successive che si possono suddividere in:
• periodo postoperatorio immediato, è rappresentato dalle prime 24 ore dopo l´intervento;
•
periodo postoperatorio intermedio, è compreso tra il giorno dopo l´intervento e quello della
dimissione;
•
convalescenza, è il periodo successivo, di durata variabile, necessario per il ritorno alla
normale vita di relazione.
Tali fasi non sono nettamente separabili secondo rigidi criteri di classificazione.
Periodo postoperatorio immediato
Durante questa fase è necessario sorvegliare il paziente con particolare cura, poiché possono
comparire complicanze postoperatorie precoci, di varia natura e gravità, con frequenza direttamente
proporzionale alla gravità delle condizioni cliniche, alla durata dell´anestesia e alla complessità
delle soluzioni chirurgiche adottate.
Risveglio anestesiologico
Per i pazienti che hanno subito interventi chirurgici in anestesia generale o loco-regionale con
sedazione profonda, si distingue, nell´ambito del periodo postoperatorio immediato, una fase
iniziale di risveglio anestesiologico. In tale fase i pazienti devono essere strettamente sorvegliati da
un anestesista-rianimatore. Affinché questa sorveglianza possa svolgersi nel modo migliore, è
opportuno che i pazienti rimangano nelle immediate adiacenze della sala operatoria, nella "sala di
risveglio", dove deve essere costante la presenza di personale per l'osservazione diretta degli operati
e dove devono trovarsi gli strumenti necessari per eventuali interventi di tipo rianimatorio.
I pazienti che sono stati sottoposti ad anestesia generale o loco-regionale devono essere tenuti in
sala di risveglio fino a quando:
• permane il pericolo di complicanze immediate di tipo cardiocircolatorio o respiratorio;
• hanno riacquistato un sufficiente stato di coscienza;
• i principali parametri e segni vitali sono considerati stabili.
Durante questo periodo la responsabilità del controllo della funzionalità cardiocircolatoria,
respiratoria e della diuresi è dell´anestesista, mentre è compito del chirurgo sorvegliare la ferita, i
drenaggi ed eventuali altre manifestazioni patologiche non correlate con l´anestesia.
Successivamente alla fase del risveglio, il paziente viene trasferito nel reparto di degenza e inizia la
fase del monitoraggio e della terapia postoperatoria. Nel caso in cui si ravvisi la necessità di un
monitoraggio intensivo delle funzioni vitali o sia necessaria una terapia rianimatoria prolungata, il
paziente viene trasferito in unità di terapia subintensiva o intensiva.
Periodo postoperatorio intermedio
Il periodo postoperatorio intermedio, inizia per convenzione dopo 24 ore dall'intervento e si protrae
per il resto della degenza postoperatoria. Se il decorso clinico è regolare, nel periodo postoperatorio
intermedio avviene la stabilizzazione definitiva dei parametri vitali e la fase iniziale della
guarigione dal trauma chirurgico. L´evoluzione del processo di guarigione durante il periodo
postoperatorio intermedio deve essere accuratamente sorvegliata mediante il monitoraggio dei
parametri vitali, delle condizioni cliniche, della ferita chirurgica e mediante la determinazione dei
parametri di laboratorio e degli esami strumentali. Durante questo periodo riveste particolare
importanza il monitoraggio e il trattamento della ferita chirurgica e la gestione degli eventuali
drenaggi.
L´organismo umano sottoposto a intervento chirurgico sviluppa una complessa serie di risposte
fisiopatologiche, in reazione al trauma tissutale. Queste risposte coinvolgono numerosi organi e
apparati e comportano modificazioni complesse dell´omeostasi. Dopo un intervento di media
gravità, che si è svolto senza complicanze chirurgiche o anestesiologiche, possiamo distinguere dal
punto di vista clinico tre fasi successive.
•
Nella prima fase, della durata di circa 3 giorni, il paziente accusa astenia, anoressia, dolore
in sede di ferita e presenta modico rialzo termico (37-37,5 °C). Negli interventi addominali
l'intestino è disteso per la comparsa di ileo paralitico, con alvo chiuso ai gas. Il paziente
presenta inoltre modificazioni del tono dell´umore: è chiuso in se stesso, si lamenta per il
dolore e rifiuta di alzarsi.
Dal punto di vista metabolico la prima fase di risposta al trauma chirurgico è caratterizzata
da catabolismo tissutale. Si verificano numerose modificazioni del metabolismo glicidico,
protidico e lipidico; compaiono inoltre variazioni del ricambio idroelettrolitico e
dell'equilibrio acido-base, che hanno lo scopo di riportare il volume e la composizione dei
liquidi extracellulari alla normalità. La ricostituzione e il risparmio dei liquidi extracellulari
spetta essenzialmente al meccanismo di antidiuresi mediato dall´ADH; l´urina diventa
concentrata.
•
La seconda fase del decorso postoperatorio non complicato inizia al terzo-quarto giorno. Il
paziente si sente meglio, la temperatura corporea si normalizza, l´alvo diviene pervio ai gas,
la diuresi torna normale, dopo una breve poliuria. L´operato si alza più volentieri e
incomincia a interessarsi di altre cose che non siano la sua malattia e i suoi dolori. In questa
fase, della durata di pochi giorni, i parametri biologici precedentemente alterati ritornano
progressivamente nella norma.
•
La terza fase, della durata di alcune settimane, è quella della convalescenza, ed è
caratterizzata da un bilancio azotato positivo; è perciò definita anche "fase anabolica".
È inoltre necessario curare la posizione al letto e la mobilizzazione del paziente, sorvegliare e
trattare la ferita chirurgica e gli eventuali drenaggi.
Parametri e segni vitali
Di fondamentale importanza è la raccolta dei principali parametri e segni vitali indicativi delle tre
principali funzioni:
• cardiocircolatoria (polso, pressione arteriosa-PA);
•
respiratoria (frequenza e caratteristiche del respiro);
•
attività del sistema nervoso (caratteristiche dei riflessi e stato di coscienza).
Criteri di ammissione in terapia intensiva
L´Unità di Terapia Intensiva (UTI) è un reparto con strumentazione tecnologicamente avanzata e
con personale specializzato, per il monitoraggio approfondito e continuo delle funzioni
cardiocircolatorie, respiratorie, metaboliche e neurologiche, e per il supporto delle funzioni vitali. È
insito nel concetto di terapia intensiva il presupposto che il sostegno delle funzioni vitali sia solo
transitoriamente necessario e quindi che esista la possibilità di recupero del paziente.
È opportuno individuare già preoperatoriamente i pazienti che, per la gravità delle loro condizioni,
potenzialmente, necessitano di trattamento in UTI nel periodo postoperatorio; in chirurgia
d'elezione tali pazienti devono essere sottoposti a intervento solo dopo adeguata preparazione, per
migliorarne le condizioni generali.
Le malattie che preoperatoriamente devono far prevedere la necessità di un ricovero in terapia
intensiva nel decorso postoperatorio possono essere distinte in:
• alterazioni cardiocircolatorie (miocardiopatie gravi, angina instabile, patologie valvolari
gravi);
•
alterazioni respiratorie (grave insufficienza respiratoria);
•
alterazioni del sistema nervoso centrale e/o periferico (gravi alterazioni dello stato di
coscienza, miopatie, miastenia, ecc.);
•
patologie particolari (per es. insufficienza epatica, insufficienza renale).
In chirurgia d´urgenza è più frequente la necessità di dover ricorrere al trattamento del paziente in
UTI; infatti, spesso si presentano i seguenti problemi:
• gravi condizioni generali del paziente;
•
impossibilità di una sua preparazione ottimale;
Le seguenti alterazioni giustificano l´ammissione in terapia intensiva:
• apparato respiratorio: tachipnea grave, ipossiemia (PaO2 < 60 mmHg), ipercapnia (PaCO2 >
50 mmHg con associata acidosi), alterazioni della meccanica respiratoria, aumento della
quota di shunt, atelettasie gravi;
•
sistema cardiocircolatorio: ipotensione difficilmente trattabile, alterazioni del ritmo
cardiaco, della gettata cardiaca, segni di ipoperfusione distrettuale, di inadeguato trasporto di
O2, oliguria, necessità di sostenere il circolo con farmaci inotropi e vasodilatatori;
•
sistema urinario: incapacità di mantenere un´adeguata omeostasi idroelettrolitica e alterata
funzione emuntoria renale (oliguria, clearance creatinina < 10 ml/min);
•
funzionalità epatica: coma epatico;
•
sistema nervoso centrale: alterazioni della coscienza (scala di Glasgow < 8).
Il trattamento in terapia intensiva permette di poter intervenire in modo ottimale su questi squilibri;
con il monitoraggio completo delle principali funzioni dell´organismo è possibile effettuare il
supporto delle funzioni vitali e un sostegno razionale dell´equilibrio emodinamico e metabolico.
Posizione a letto e mobilizzazione
Il paziente deve assumere nel letto una posizione che diminuisca il rischio di stasi venosa e di
trombosi agli arti inferiori, di comparsa di atelettasia polmonare e di piaghe da decubito.
Nel paziente vigile e cosciente la prevenzione di queste complicanze si esegue invitando il paziente
stesso a cambiare ripetutamente posizione nel letto e a muovere gli arti inferiori; se il paziente non è
collaborante, si deve provvedere a mobilizzarlo passivamente alternando sui due fianchi il decubito
più volte al giorno. Se il paziente non è ipoteso è opportuno sollevare lo schienale del letto di 45°60° per facilitare l´esecuzione di atti respiratori adeguati e per prevenire l´atelettasia polmonare. I
piedi del letto devono essere sollevati di 15°-20° per favorire il ritorno venoso dalle estremità
inferiori.
Un principio fondamentale di prevenzione delle complicanze tromboemboliche e atelettasiche
rimane la mobilizzazione precoce del paziente dal letto; anche dopo interventi chirurgici complessi,
se il paziente è cosciente e collaborante, e non è ipoteso, già dalla prima giornata postoperatoria
deve essere trasferito dal letto alla poltrona almeno per alcuni minuti al giorno, sotto vigile
assistenza del personale infermieristico.
Per i pazienti portatori di fratture del bacino o degli arti inferiori si dovrà procedere alla
mobilizzazione passiva consentita dal caso specifico. L´impiego di gambali pneumatici, che
permette la compressione intermittente degli arti inferiori e che favorisce quindi il ritorno venoso e
linfatico da questi, è indicata in pazienti a elevato rischio di stasi venosa e tromboembolia (pazienti
obesi, impossibilità alla mobilizzazione dal letto, pregresse tromboflebiti profonde).
Sorveglianza e trattamento della ferita chirurgica e dei drenaggi
È responsabilità del chirurgo sorvegliare la ferita chirurgica più volte durante la prima giornata
postoperatoria, per escludere complicanze locali immediate. Nel caso in cui si sospetti l´insorgenza
di tali complicanze, la medicazione della ferita deve essere tolta, per consentire l´esame diretto della
ferita stessa, e successivamente rifatta, con metodo asettico.
Analogamente si devono controllare i drenaggi, verificando, al momento del trasferimento in
reparto del paziente, che i collegamenti dei tubi di drenaggio siano corretti e saldamente connessi,
che i drenaggi in aspirazione (in particolare quelli del cavo pleurico) siano collegati alla depressione
desiderata, e che non vi sia sanguinamento importante o comparsa nel drenaggio di materiale
indicativo dell´insorgenza di complicanze (per es. liquido enterico, bile, pus, sangue, urina, aria,
trasudato, ascite, linfa).
I drenaggi vanno controllati più volte nella prima giornata postoperatoria, allo scopo di
diagnosticare tempestivamente l´insorgenza di complicanze e successivamente al fine di decidere la
loro rimozione se non sono più necessari.
Al termine dell´intervento chirurgico la ferita viene coperta mediante medicazione asettica con
materiale sterile, per proteggerla dalla contaminazione nei primi giorni dopo l´intervento chirurgico.
La protezione con medicazione sterile è indispensabile almeno per i primi 3-4 giorni postoperatori,
periodo durante il quale avviene la fase iniziale della guarigione della ferita.
Nel decorso postoperatorio non complicato, dopo 3 giorni la soluzione di continuo nelle ferite
lineari suturate viene riempita e chiusa dalle cellule infiammatorie, dai fibroblasti e dai loro prodotti
di secrezione; in superficie la soluzione di continuo viene ricoperta da cellule epidermiche
proliferanti dai margini cutanei, che isolano la ferita dall´ambiente esterno.
Anche se dopo 3-4 giorni la ferita è difficilmente contaminabile dall´ambiente esterno, è tuttavia
buona norma tenerla coperta con medicazione asettica fino alla settima giornata postoperatoria.
Nel periodo postoperatorio intermedio almeno una volta al giorno si deve ispezionare la
medicazione e si deve palpare la ferita. Non è necessario togliere la medicazione fino alla quinta
giornata se il processo di guarigione della ferita procede regolarmente, cioè se non ci sono né segni
locali di infezione (medicazione sporca di essudato, dolore spontaneo o alla palpazione della ferita,
tumefazione, arrossamento della cute) né segni generali di infezione (febbre, astenia, anoressia,
leucocitosi).
Di regola nel decorso postoperatorio normale il trattamento della ferita avviene pertanto nel
seguente modo: in quinta giornata postoperatoria si sostituisce la medicazione, disinfettando la
ferita con soluzione antisettica e riapplicando una nuova medicazione sterile; in settima giornata si
esegue analoga medicazione, togliendo una parte dei punti di sutura e rinnovando la medicazione
asettica; i rimanenti punti di sutura vengono asportati in nona-decima giornata, e il paziente può
successivamente lavarsi a livello della ferita.
In casi particolari (suture cutanee in chirurgia plastica; incisioni cervicali o sul volto, o in altre aree
del corpo in cui è importante il risultato estetico) si tolgono più precocemente i punti di sutura
(terza-quinta giornata) e i lembi di ferita vengono tenuti ravvicinati con steril-strip.
Somministrazione di liquidi ed elettroliti
L´acqua dell´organismo rappresenta circa il 50-70% del peso corporeo con variazioni dipendenti da
età, sesso, costituzione, e si distribuisce nei tre compartimenti: intracellulare, extracellulare,
intravascolare. La composizione in soluti di questi compartimenti è diversa. La quantità totale di
acqua e di soluti dell´organismo rimane pressoché invariata grazie all´intervento di meccanismi
neurormonali (ADH, sistema renina-angiotensina-aldosterone, prostaglandine) che utilizzano il rene
come organo effettore.
Il bilancio idrico dell´organismo dipende dall´equilibrio delle entrate e delle uscite. Le entrate sono
rappresentate dalla quota introdotta con i cibi e con le bevande (circa 1,5 l/die) e dall´acqua di
ossidazione metabolica (circa 300 ml/die); le perdite avvengono con le feci (circa 200 ml/die), con
la perspiratio insensibilis (circa 600-800 ml/die) e attraverso il rene (circa 1-1,5 l/die).
Le alterazioni del volume di acqua dell´organismo, associate o meno ad alterazioni della
concentrazione dei vari elettroliti, sono molto frequenti nel paziente chirurgico e danno luogo a
varie sindromi da squilibrio idroelettrolitico. Le manifestazioni cliniche della deplezione idrica sono
rappresentate da ipotensione, polso piccolo e frequente, scarso riempimento del letto venoso,
anelasticità dei tegumenti, mucose asciutte, astenia, oliguria con urine iperstenuriche. Compare
inoltre iperazotemia prerenale, aumento dell´ematocrito e della protidemia. La sindrome da
disidratazione del settore extracellulare è la più frequente. Essa si può manifestare in caso di perdite
dal tubo digerente (aspirazione naso-gastrica continua, diarrea, fistole enteriche, vomito), di
sudorazione profusa, di perdite ematiche e plasmatiche abbondanti, di insufficienza surrenalica. La
sindrome iperosmolare, in cui vi è un deficit preminente di acqua rispetto ai soluti, è rara in forma
pura ed è dovuta a una netta riduzione di introduzione di acqua. Talora peraltro, si può avere un
sovraccarico di volume nel paziente chirurgico si hanno aumento del rilascio di ADH,
vasocostrizione renale, aumento dell´aldosteronemia che può essere aggravato da condizioni
preesistenti quali: insufficienza cardiaca congestizia, epatopatia, insufficienza renale,
ipoalbuminemia.
Il pH del sangue deve essere compreso tra 7,38-7,42 perché possano svolgersi regolarmente i
principali processi metabolici. L´equilibrio acido-base può essere definito dall´equazione di
Henderson-Hasselbach: pH = pk + log (HCO 3)/(H2CO3). Se il rapporto bicarbonato/acido
carbonico viene mantenuto intorno a 20:1, il pH rimane costante. L´equilibrio acido-base viene
solitamente determinato su sangue arterioso sul quale vengono valutati: pH, PCO 2, PO2, BE, HCO3.
Da questi parametri si possono definire quattro sindromi cliniche: acidosi metabolica o
respiratoria, alcalosi metabolica o respiratoria. Nella realtà raramente questi quadri sono isolati,
presentandosi per lo più misti, in quanto entrano in gioco meccanismi di compenso che riducono le
variazioni del pH.
Le principali alterazioni degli elettroliti che si riscontrano nel paziente chirurgico sono le seguenti.
•
Sodio (valori plasmatici normali compresi tra 135-150 mEq/l): l´ipernatriemia è di solito
conseguente a una perdita di acqua (febbre, diuresi osmotica) o a una ridotta introduzione di
acqua, oppure a una eccessiva introduzione di sodio. L´iponatriemia è più frequente e si
verifica per perdite derivanti da vomito, diarrea, sudorazione profusa, per deplezione di
potassio, eccessiva introduzione di soluzioni povere in sodio (per es. insufficiente apporto di
sodio nel decorso postoperatorio).
•
Potassio (valori plasmatici normali compresi tra 3,8-5,0 mEq/l). Le condizioni che possono
determinare un´iperkaliemia sono: insufficienza renale, insufficienza surrenale, condizioni
ipercataboliche come traumi gravi e ustioni estese. Queste alterazioni metaboliche vere
vanno distinte da altre quali l´iperemolisi, la trombocitosi, l´acidosi metabolica, la
riperfusione postischemia, che determinano un´iperkaliemia mediante il rilascio del potassio
dalle cellule. Un´ipokaliemia si ha invece in corso di alcalosi, di cospicue perdite enteriche,
di terapia diuretica, di diabete mellito, di iperaldosteronismo. Le manifestazioni cliniche
comprendono sia sintomi neuromuscolari (ipotonia muscolare, parestesie) sia segni
elettrocardiografici.
•
Calcio (concentrazioni plasmatiche normali comprese tra 4,2-5,2 mEq/l): strette correlazioni
si hanno tra la calcemia e il pH plasmatico, in particolare per la frazione ionizzata del calcio.
Frequenti condizioni in cui si ha ipercalcemia sono: l´iperparatiroidismo, comparsa di
metastasi ossee, ipervitaminosi D, allettamento prolungato, ecc. L´ipocalcemia è invece
frequente in corso di ipoparatiroidismo, ipomagnesemia, pancreatite grave, IRC, IRA, crush
syndrome. In caso di ipercalcemia clinicamente si manifesta una ipoeccitabilità
neuromuscolare; nella ipocalcemia compare ipereccitabilità neuromuscolare.
•
Cloro (concentrazione plasmatica normale: 95-110 mEq/l). Si ha un aumento della cloremia
in seguito ad acidosi metabolica e ipernatriemia. L´alcalosi metabolica e l´iponatriemia
determinano una diminuzione della cloremia.
•
Magnesio: svolge un importante ruolo nel metabolismo energetico della cellula. La
condizione più frequente di ipermagnesemia si ha in corso di insufficienza renale, mentre
l'ipomagnesemia può comparire durante nutrizione artificiale (NPT ed NE) con scarso
apporto di magnesio.
•
Fosforo: è importante nel metabolismo energetico cellulare oltre che come costituente delle
ossa. La carenza di fosforo compare spesso in corso di NPT e dà un quadro di ridotta attività
neuromuscolare. La condizione opposta è asintomatica.
Le richieste giornaliere basali di acqua sono valutabili in circa 1500-2000 ml e sono influenzate da
vari fattori (temperatura dell´ambiente, ustioni, febbre, drenaggi, iperventilazione, perdite
enteriche).
Ripresa dell´alimentazione
Durante il decorso postoperatorio il paziente necessita di un adeguato supporto nutrizionale che
deve mirare a ridurre al minimo il catabolismo, soprattutto proteico, in attesa che l´alimentazione
possa riprendere attraverso la via fisiologica. Tre sono i modi con cui si possono somministrare i
nutrienti al paziente che non può alimentarsi per os: nutrizione parenterale periferica (NPP),
nutrizione parenterale totale (NPT) e nutrizione enterale (NE). Queste due ultime modalità vengono
riservate ai casi in cui si prevede un lungo periodo di nutrizione artificiale. La ripresa
dell'alimentazione per os avviene in tempi variabili, dipendendo dal tipo di intervento (laparotomico
o non, con resezioni gastrointestinali o non); dalle condizioni generali del paziente (per es.
importanti squilibri idroelettrolitici, malnutrizione, malattie infiammatorie intestinali); dalla rapidità
della ripresa della normale funzione gastrointestinale e dalla comparsa di eventuali complicanze
(per es. sepsi).
Dopo un intervento laparotomico la normale attività peristaltica intestinale risulta temporaneamente
depressa (ileo postoperatorio). La peristalsi gastrica ricompare dopo circa 24-48 ore dall´intervento,
mentre l´attività del colon dopo circa 48 ore, iniziando a livello del cieco e proseguendo
distalmente.
Clinicamente l´ileo postoperatorio conduce a modesta distensione del colon e quindi dell´addome. Il
ritorno della peristalsi viene notato dal paziente che riferisce modesti crampi addominali, emissione
di gas dall´alvo, ritorno dell´appetito e infine pervietà dell´alvo alle feci. Negli interventi
laparotomici maggiori la ripresa dell´alimentazione deve compiersi in modo graduale iniziando con
i liquidi e i cibi semisolidi per poi far assumere al paziente anche cibi solidi di crescente
complessità (per ultimi vengono somministrati cibi ricchi di scorie). Tutto questo avviene nel giro
di 3-4 giorni fino ad arrivare a una condizione di alimentazione completa nel corso della seconda
settimana postoperatoria.
Prevenzione delle lesioni ulcerose acute gastroduodenali
L´instaurarsi di emorragie acute gastroduodenali è una evenienza abbastanza comune in pazienti
sottoposti a interventi chirurgici ampiamente demolitivi, nei politraumatizzati, nei pazienti in
terapia intensiva e in quelli con precedenti di gastroduodenite o di lesioni ulcerose peptiche, o in
terapia con farmaci lesivi della barriera mucosa gastroduodenale (FANS, cortisone, antiblastici,
acido acetilsalicilico). In tali categorie di pazienti a rischio è necessario impiegare farmaci per la
profilassi delle lesioni ulcerose acute gastroduodenali, per impedire l´insorgenza di complicanze
gravi e potenzialmente letali quali emorragie incontrollabili e perforazioni gastroduodenali.
I farmaci idonei a proteggere la barriera mucosa gastroduodenale sono i seguenti.
•
Bloccanti dei recettori H2 (ranitidina).
•
L´omeprazolo, l´efficacia è maggiore rispetto ai farmaci anti-H2.
•
Antipepsinici quali il sucralfato. Quest´ultimo riduce di un terzo l´attività pepsinica e
inoltre forma uno strato protettivo sulla mucosa gastroduodenale, proteggendola dall´azione
digestiva della pepsina e dell´acido cloridrico.
•
Metoclopramide e domperidone migliorano la motilità gastrica riducendo il tempo di
contatto tra la mucosa e la secrezione acida.
Tra i provvedimenti di igiene comportamentale e dietetici per la prevenzione delle lesioni acute
gastroduodenali si devono ricordare l´astensione dal fumo e dall´assunzione di alcolici e caffè.
Fisioterapia e riabilitazione
In ogni paziente sottoposto a intervento chirurgico si deve iniziare precocemente la fisioterapia
motoria e respiratoria per prevenire le complicanze respiratorie e circolatorie che, com´è noto,
insorgono con maggiore frequenza nei pazienti immobilizzati al letto.
L´anestesia prolungata e il dolore provocato dal trauma chirurgico, che viene esacerbato spesso
dagli atti respiratori, inducono una diminuzione della profondità degli atti respiratori stessi, degli
scambi gassosi alveolari e della ventilazione di alcuni distretti periferici dell´albero respiratorio;
inoltre la limitazione antalgica degli atti del respiro e il dolore legato ai colpi di tosse, riducono la
capacità del paziente di espellere le secrezioni.
Ciò favorisce la formazione di atelettasie clinicamente rilevanti. La prevenzione di queste ultime e
della insufficienza respiratoria postoperatoria in generale è di fondamentale importanza soprattutto
nei pazienti obesi, in quelli astenici o francamente anergici, nei forti fumatori, nei pneumopatici
cronici. Tale opera è svolta nella maniera migliore da personale specializzato in fisioterapia e
riabilitazione.
Ai fini della prevenzione delle complicanze respiratorie dopo intervento chirurgico, si devono
pertanto effettuare le seguenti manovre fisioterapiche e riabilitative:
• mobilizzazione precoce dal letto, frequente cambio di posizione nel letto e sistemazione
dello schienale del letto in posizione semiseduta; ciò limita il ristagno di secrezioni nelle
parti posteriori più declivi dell´albero respiratorio e pone il paziente nelle migliori
condizioni per effettuare atti respiratori adeguatamente profondi ed efficaci;
•
impiego di semplici strumenti monouso per esercitare il paziente a compiere atti respiratori
profondi (per es. soffiare per gonfiare un guanto di lattice);
L´impiego di dosi appropriate di farmaci antalgici è indispensabile per diminuire il dolore
postoperatorio legato ai movimenti e agli atti respiratori e favorisce la fisioterapia e la prevenzione
delle complicanze respiratorie e tromboemboliche.
Al fine di prevenire le complicanze tromboemboliche, il paziente deve essere adeguatamente
mobilizzato dal letto più volte al giorno. Nei pazienti non collaboranti o non mobilizzabili è
necessario far compiere movimenti di ginnastica passiva sotto il controllo del fisioterapista e
compatibilmente con le condizioni locali e generali di ciascun specifico paziente; ciò allo scopo di
migliorare la circolazione periferica del sangue e di attenuare l´ipotrofia muscoloscheletrica e
articolare da immobilizzazione.
Il dolore postoperatorio
Il dolore postoperatorio è una spiacevole esperienza associata con un attuale o potenziale danno
tissutale.
Il dolore postoperatorio (DPO) può anche essere definito come un dolore acuto che inizia col
trauma chirurgico e termina, generalmente, con la guarigione dei tessuti. Tale sintomatologia,
transitoria, con remissione spontanea, è ancor oggi accettata e subita come un evento ineluttabile,
collocata in un rapporto di causa-effetto con l´intervento chirurgico. Fattori che incidono sulla
rielaborazione cosciente del dolore sono l´ansia, le aspettative (chirurgia plastica, chirurgia
palliativa per cancro), nonché il trattamento anestesiologico e chirurgico ed eventuali complicanze
postoperatorie.
Il DPO, se non adeguatamente trattato, può portare a risposte psicologiche ed emozionali negative,
complicanze respiratorie, cardiovascolari, gastrointestinali, urinarie, metaboliche, ormonali e
immunitarie. Soggetti emotivi tendono a sovrastimare il dolore amplificandone i contenuti.
Fattori che influenzano incidenza, intensità e
durata del DPO.
•
Sede, natura e durata dell´intervento
•
Tipo di incisione ed entità del danno
tissutale
•
Stato fisico e psichico del paziente
•
Complicanze postoperatorie
•
Trattamento anestesiologico
Fisiopatologia
Il DPO è considerato una vera e propria sindrome da deafferentazione iatrogena conseguente alla
lesione chirurgica della rete nervosa sensitiva; le successive modificazioni fisiopatologiche a livello
spinale determinano una ipersensibilità dolorosa post-traumatica. A seguito del danno tissutale e
neuronale si innesca un´alterazione funzionale delle fibre C e A con diminuzione della soglia di
eccitazione sia nella zona danneggiata (iperalgesia primaria) sia nella zona circostante (iperalgesia
secondaria). La lesione tissutale porta alla liberazione di sostanze algogene: K+, H+, acetilcolina,
acido lattico, serotonina, bradichinina, prostaglandine, istamina, sostanza P, ecc.
In presenza di questi mediatori della flogosi consegue un reclutamento di popolazioni neuronali
normalmente inattive che diventano sensibili a stimoli minimali. Le fibre veicolanti questi stimoli,
attraverso le radici posteriori, raggiungono il midollo spinale e, strutturate nella via spinotalamica e
spinoreticolare, ascendono ai centri integratori del talamo (II neurone) e alle aree somatosensoriali
della corteccia (III neurone), dove avviene l´integrazione delle afferenze e la percezione cosciente.
La modulazione degli stimoli algogeni utilizza una serie di neurotrasmettitori, i più importanti dei
quali sono: oppioidi endogeni (-endorfina, enkefaline, dinorfina), acido glutammico, sostanza P,
VIP (Vasoactive Intestinal Polypeptide), somatostatina, noradrenalina.
Fattori che influiscono sul dolore postoperatorio
• Intervento chirurgico: il trauma tissutale è il fattore principale del DPO. Interventi sul
torace o sull´addome alto risultano più dolorosi di altri. Le zone con più marcata
rappresentazione a livello corticale (viso, dita, mani, ecc.) appaiono più sensibili di quelle
con una limitata rappresentazione (dorso, segmenti prossimali degli arti). La grandezza e la
direzione dell´incisione sono importanti per le conseguenze sui tessuti danneggiati a causa
della distribuzione delle terminazioni nervose coinvolte. Una colecistectomia effettuata per
via laparoscopica o con incisione laparotomica sottocostale o mediana evoca DPO
differente. L´incisione verticale determina un trauma maggiore rispetto a quella trasversale,
che provoca la lesione di un minor numero di fibre nervose; così la separazione delle fibre
muscolari piuttosto che il loro taglio determina un minore input nocicettivo.
Il DPO non deriva solo da strutture somatiche, ma anche da organi viscerali: la contrazione
di organi a muscolatura liscia o la loro distensione può risultare estremamente dolorosa.
Importante è anche l´accuratezza nell´esecuzione dell´intervento: un uso forzato dei
divaricatori può causare fratture costali e necrosi dei tessuti muscolari. Una buona emostasi
evita la formazione di ematomi, causa di dolori; importanti sono anche i materiali di sutura e
i drenaggi (preferibili quelli morbidi in silicone).
•
Anestesia: con le tecniche o le manovre connesse alla sua pratica può essere causa di DPO;
faringodinia da intubazione, cefalea da puntura spinale.
•
Età: l´anziano tollera meglio il dolore; anche il bambino, senza esperienze precedenti,
affronta l´avvenimento senza il circolo vizioso "paura-ansia-dolore".
•
Patologia di base: prospettive di guarigione o interventi mutilanti condizionano
l'apprezzamento soggettivo del dolore.
•
Personalità: ansietà e depressione incidono negativamente sul DPO.
•
Preparazione all´intervento: lo stress da ricovero può essere opportunamente affrontato
con adeguate notizie esplicative sulle procedure riguardanti gli esami preoperatori e
l'intervento. Il paziente deve essere edotto sulla possibile insorgenza del dolore e sulla
possibilità di poterlo controllare ricordandogli che è un errore attendere che il dolore sia
diventato intenso prima di chiedere un analgesico.
Conseguenze
• Complicanze polmonari: il DPO non è solo causa di sofferenza per il paziente: è anche
responsabile di variazioni dell´omeostasi respiratoria che possono rivelarsi anche letali.
Il paziente che non si muove per il dolore, che non respira profondamente, che non espettora
perché la tosse gli provoca dolore, è un paziente che andrà facilmente incontro a
complicanze respiratorie. Il dolore successivo all´incisione addominale e all´infiammazione
peritoneale è accompagnato da spasmo della parete muscolare dell´addome. La contrazione
dei muscoli che controllano l'espirazione forzata aumenta la pressione addominale,
diminuendo le escursioni diaframmatiche con conseguente riduzione dei volumi polmonari.
Ne deriva una sindrome restrittiva con collasso delle vie aeree, atelettasie, alterazione del
rapporto ventilazione/perfusione con aumento della quota di shunt e infezioni polmonari.
Segni della sindrome sono: tachicardia, dispnea, dolore toracico, sputo purulento,
modificazioni ascoltatorie e radiologiche, ipossia, ipercapnia;
•
Complicanze cardiovascolari: il dolore stimola il sistema simpatico con conseguente
tachicardia, aumento del lavoro cardiaco e del consumo miocardico di ossigeno; ciò
comporta un aumentato rischio di ischemia e infarto, nonché di trombosi venose profonde a
causa della diminuita attività fisica, della stasi venosa.
•
Complicanze gastrointestinali e urinarie: ileo, nausea e vomito sono conseguenti a
impulsi nocicettivi di origine viscerale o somatica. Il dolore causa ipomotilità vescicale con
conseguente difficoltà urinaria.
•
Conseguenze metaboliche e ormonali: le risposte soprasegmentali al dolore aumentano il
tono simpatico e la stimolazione ipotalamica che instaurano una situazione catabolica. Ne
conseguono modificazioni nel metabolismo dei carboidrati con neoglucogenesi, ridotta
utilizzazione periferica del glucosio, iperglicemia. Il bilancio azotato negativo che si osserva
per alcuni giorni è condizionato dall´aumento della secrezione di ormoni catabolici
(catecolamine, cortisolo, ACTH, ADH, prolattina, glucagone, aldosterone) e dalla
contemporanea diminuzione degli ormoni anabolici (testosterone, insulina).
•
Risposta immunitaria: il DPO causa una diminuzione non specifica dei poteri immunitari
del paziente.
TERAPIA
Analgesia bilanciata: tutti i farmaci analgesici provocano effetti secondari. Gli oppiacei danno
sedazione, atonia intestinale, stipsi, ritenzione urinaria, depressione respiratoria; gli anestetici locali
provocano ipotensione e parestesie; i FANS sono nefrotossici, gastrolesivi e alterano i processi della
coagulazione. Attualmente si tende ad associare farmaci a differente meccanismo d´azione (la
trasmissione nocicettiva può essere bloccata a diversi livelli: recettori periferici, radici e tronchi
nervosi, corna posteriori del midollo, tronco) per rinforzare l´effetto analgesico richiesto, con
dosaggi ridotti dei singoli farmaci al fine di contenere i possibili effetti collaterali.
Terapia preventiva: l´analgesia preventiva si basa sui presupposti neurofisiologici che hanno
messo in evidenza che uno stimolo nocicettivo può indurre a livello centrale una ipereccitabilità
neuronale prolungata. Questa plasticità del sistema nervoso sembra poter essere più prevenuta che
trattata. A tal fine si è dimostrata efficace l´anestesia loco-regionale che, bloccando la via periferica
all´input nocicettivo, elimina l´iperalgesia secondaria e facilita un buon trattamento antalgico
postoperatorio. In maniera analoga sembrano agire le infiltrazioni con anestetici locali nella sede di
incisione chirurgica, gli oppiacei ad alte dosi e altri trattamenti antalgici effettuati prima che
avvenga l´incisione chirurgica.
Vie di somministrazione dei farmaci analgesici
Endovenosa: è la via con assorbimento più diretto e con effetto più rapido. A fronte di un picco
rapido, si ha anche una rapida metabolizzazione e una durata di effetti più breve con maggior
incidenza di effetti collaterali. Modalità di somministrazione: a bolo su domanda, a boli a tempi
prefissati, in infusione continua con sistemi computerizzati, mediante PCA (Patient Controlled
Analgesia), cioè con sistemi a domanda controllati dal paziente stesso. Farmaci impiegati: oppiacei,
FANS.
Intramuscolare: è la via più comunemente usata; tempo di assorbimento medio; durata degli effetti
più lunga rispetto alla via endovenosa. La velocità di assorbimento dipende dal flusso ematico del
muscolo; l´iniezione può essere dolorosa, si può pungere accidentalmente un vaso o un nervo.
Modalità di somministrazione: a domanda o a intervalli regolari. Farmaci impiegati: oppiacei,
FANS.
Sottocutanea: assorbimento lento anche se diretto, effetti più prolungati rispetto alla via
intramuscolare; la velocità di assorbimento dipende dal flusso cutaneo (rallentato in caso di shock o
di ipotensione). Farmaci utilizzati: oppiacei in somministrazione continua.
Transdermica: assorbimento lento e variabile; ha il vantaggio della somministrazione indolore e
non invasiva; applicazioni a intervalli regolari con cerotto. Farmaco utilizzato: fentanil.
Orale: assorbimento variabile e insorgenza lenta dell´effetto. Ha il vantaggio di non essere
invasiva, ma è poco indicata nei pazienti chirurgici: rischio di inalazione in pazienti che non hanno
completamente recuperato i riflessi, nausea, vomito, irritazione delle mucose digestive.
Sublinguale: assorbimento variabile, velocità di assorbimento media, salta il filtro epatico passando
direttamente nel circolo sistemico; ha le stesse problematiche della via orale. Somministrazione a
domanda o a intervalli regolari. Farmaco utilizzato: buprenorfina.
Rettale: assorbimento variabile e incostante; possibilità di somministrazione sia a pazienti consci
che non ancora autonomi; può provocare evacuazione e risultare pertanto inefficace.
Somministrazione a domanda o a periodi fissi. Farmaci utilizzati: FANS e oppiacei.
Spinale: assorbimento immediato e completo; rapida insorgenza di effetti e lunga durata d´azione
(8-24 ore); inizialmente sono stati impiegati gli anestetici locali; con l´identificazione dei recettori
midollari specifici sono stati impiegati gli oppiacei e successivamente gli agonisti 2-adrenergici:
clonidina. Somministrazione a domanda, a intervalli fissi, continua.
Peridurale: con l´impiego delle pompe elastomeriche (palloncini di materiale plastico caricabili
con oppiacei e/o anestetici locali e collegabili ad un catetere peridurale) è possibile effettuare una
somministrazione continua che assicura livelli stabili di analgesia per 24-72 ore.
Qualunque sia l´analgesico scelto, la via di somministrazione o la modalità della stessa (a domanda,
continua, a boli, a orari fissi, ecc.), il fine di una adeguata terapia antalgica è quello di mantenere le
concentrazioni del farmaco a un livello ematico costante e adeguato (finestra terapeutica). Uscire
dalla finestra verso l´alto (sovradosaggio) implica l´insorgenza di effetti collaterali: nausea,
depressione respiratoria, ecc.; scendere al di sotto vuol dire non effettuare un´adeguata copertura
analgesica.
Farmaci
• FANS (farmaci antinfiammatori non steroidei): agiscono bloccando la ciclossigenasi con
inibizione delle prostaglandine che normalmente sensibilizzano i nocicettori alle sostanze
algogene. Recentemente si è evidenziata anche un´azione centrale (midollare e sovraspinale)
con aumento della produzione ipotalamica di -endorfine e/o con sensibilizzazione dei
recettori endorfinici. Sono considerati farmaci di elezione per i dolori di piccola e media
entità, soprattutto con componente edematosa o infiammatoria. Hanno aumentato il loro
potenziale terapeutico con l´introduzione in commercio di formulazioni somministrabili per
via endovenosa. L´associazione con gli oppiacei, nell´ottica dell´analgesia bilanciata, è in
grado di risolvere i dolori più importanti con riduzione dei dosaggi degli analgesici
maggiori.
Effetti collaterali: la loro lesività (stomaco, piastrine, rene, ecc.) è legata all´inibizione della
ciclo-ossigenasi. Crisi di asma si osservano nei pazienti allergici e asmatici perché
l'inibizione della ciclossigenasi favorisce la via lipossigenasica con aumento dei leucotrieni
ad azione broncocostrittrice.
•
Oppiacei: in virtù della loro azione sui recettori specifici (, , ) spinali e sovraspinali,
questi farmaci mimano e rinforzano l´azione fisiologica delle endorfine. Sono i farmaci di
elezione per dolori importanti, sia viscerali che somatici. Gli agonisti di uso più comune
sono morfina, meperidina, fentanile. Tra gli agonisti parziali ricordiamo la buprenorfina.
Anche se la via intramuscolare e la sottocutanea continuano a essere le più usate,
nonostante i loro svantaggi, la via endovenosa o la via intraspinale sono quelle
razionalmente più idonee al controllo del DPO. Il criterio terapeutico di base, anche con
questi farmaci, è quello di raggiungere con una dose di carico un´adeguata concentrazione
plasmatica e di mantenerla poi con somministrazioni regolari. Effetti collaterali: depressione
respiratoria, vomito, riduzione della motilità intestinale, stipsi, sedazione, effetti psicotropi,
miosi, effetto antitosse, spasmo dello sfintere di Oddi.
•
Anestetici locali: sono impiegati per effettuare blocchi periferici, plessici e spinali
(peridurale, subaracnoideo) con possibilità di un controllo continuo del dolore mediante
posizionamento di un cateterino a permanenza. Un blocco peridurale può essere praticato
con anestetici locali, con oppiacei o con l´associazione dei due farmaci a dosi più basse e
con minor incidenza di effetti collaterali.
•
PCA (Patient Controlled Analgesia). Le prescrizioni sistematiche di posologie standard non
consentono di adattarsi alle variazioni individuali dei bisogni dei pazienti né all´evoluzione
del dolore nel tempo. Con l´analgesia controllata dal paziente attraverso l´impiego di pompe
programmabili, si consente di personalizzare la terapia: il paziente, al bisogno, preme un
bottone che, tramite una siringa, introduce in vena un bolo prefissato di analgesico; la
metodica assicura un´analgesia immediata in rapporto con la soglia di sensibilità del
soggetto, riduce il lavoro infermieristico, diminuisce l´incidenza degli effetti collaterali
grazie anche a un periodo refrattario programmabile che separa i boli con intervalli minimi
obbligatori
INFEZIONI CHIRURGICHE
Nei pazienti sottoposti ad intervento chirurgico una delle complicanze più frequenti è l’insorgenza
di infezioni:
• di ferita (1-40% a seconda del tipo di intervento chirurgico e del grado di contaminazione);
• delle vie respiratorie (5%, fattori di rischio: la lunga durata dell’anestesia con intubazione
tracheale ed una ridotta meccanica ventilatoria);
• delle vie urinarie (5-10%, importante il cateterismo vescicale)
Si riscontrano, con frequenza minore, setticemie e infezioni delle vie biliari, infezioni di cateteri
venosi o arteriosi, ascessi profondi in sede d’intervento (toracici, addominali, pelvici, ecc.), ascessi
dei tessuti molli superficiali, ulcere da decubito infette, tromboflebiti settiche.
Con una frequenza del 5-10% il paziente operato presenta segni generali di infezione (febbre
elevata, leucocitosi, aumento della VES), ma non è possibile localizzare il focolaio di infezione.
Tra le cause più probabili di tali febbri postoperatorie di origine non identificata si ritiene vi
siano l’atelettasia polmonare e l’infezione delle prime vie respiratorie.
Le infezioni gravi postoperatorie possono, talora, avere esito letale.
PATOGENESI
Nel prendere in esame la patogenesi delle infezioni chirurgiche, si deve far riferimento alle
interrelazioni esistenti fra tre fattori:
• agente patogeno infettante
• difese dell’organismo
• ambiente nel quale si sviluppa l’infezione
Agente patogeno infettante: la contaminazione batterica (in particolare da batteri della flora
endogena presente nel tubo digerente, nell’apparato genito-urinario e respiratorio e da parte dei
germi patogeni dell’ambiente nosocomiale) rappresenta uno dei fattori più importanti nella
patogenesi delle infezioni chirurgiche, ed in particolare delle infezioni della ferita. Numerose sono
le specie batteriche che possono causare infezioni chirurgiche; tra i germi Gram+ gli Stafilococchi
sono spesso responsabili delle infezioni di ferita, degli ascessi e delle infezioni da corpo estraneo.
Tra i germi Gram-, particolarmente frequente è il riscontro di Escherichia coli, seguito da
Klebsiella e Pseudomonas. Tra i patogeni anaerobi si incontrano con maggior frequenza i
Bacteroides e, meno frequentemente, i Clostridi. Nella maggioranza dei casi le infezioni
chirurgiche sono polimicrobiche. Le infezioni nelle quali si isolano prevalentemente germi anaerobi
sono gli ascessi polmonari, gli ascessi pelvici e le infezioni endoaddominali.
Il meccanismo patogenetico che spiegherebbe la particolare frequenza con cui i germi intestinali si
possono riscontrare in focolai settici a distanza dal tubo gastroenterico è definito traslocazione
batterica e consiste in una aumentata permeabilità della barriera mucosa intestinale, che permette la
fuoriuscita dei batteri e delle endotossine dal lume intestinale.
Vi sono germi comunemente presenti sulla cute e sulle mucose dell’organismo che di norma non
provocano infezioni. Tra questi vi sono: Pseudomonas, Staphylococcus epidermidis ed anche alcuni
funghi, quali Candida ed Aspergillus; essi possono però diventare patogeni e provocare le
cosiddette "infezioni opportunistiche", in seguito a situazioni che comportano diminuzione delle
difese dell’organismo. Le infezioni opportunistiche si manifestano prevalentemente in pazienti
sottoposti a trattamenti immunosoppressivi o nel corso di malattie che causano immunodepressione,
quali per esempio le neoplasie in fase avanzata, l’AIDS, i gravi traumi.
Difese dell’organismo
I meccanismi di difesa dalle infezioni sono numerosi. Essi sono costituiti dalle barriere anatomiche,
dalle cellule fagocitarie circolanti, dal sistema reticoloendoteliale, dai fattori immunitari umorali,
dall’immunità cellulare, dal sistema del complemento e dalle proteine di fase acuta.
Spesso nel periodo postoperatorio compare una immunodepressione transitoria, secondaria a vari
fattori:
• trauma chirurgico
• farmaci anestetici
• emotrasfusioni
• stress psicologico
In ogni caso, la diminuzione della efficienza dei meccanismi di difesa porta ad un’aumentata
incidenza di infezioni postoperatorie.
Per anergia agli skintest si intende l’assenza di risposta infiammatoria alla somministrazione
intradermica di antigeni; la risposta agli skin test costituisce una valutazione globale dell’efficienza
di numerosi meccanismi immunologici.
Le cause più comuni di anergia sono: la presenza di neoplasie in stadio avanzato, gli stati di
denutrizione grave, le terapie immunosoppressive e l’AIDS.
Ambiente nel quale si sviluppa l’infezione: le caratteristiche anatomiche e funzionali dei tessuti
sono importanti nel condizionare la suscettibilità alla comparsa di infezioni. Le superfici rivestite da
epitelio costituiscono barriere di tipo meccanico e chimico che si oppongono alla colonizzazione
batterica e al successivo sviluppo di infezioni. Vi sono numerose cause responsabili delle
alterazioni delle barriere anatomiche nei pazienti chirurgici, quali le manovre strumentali
invasive ripetute, la presenza di sondino naso-gastrico, di tubo endotracheale o di
tracheostomia, di drenaggi transcutanei o di catetere urinario. E' necessario ridurre al minimo
la permanenza di cateteri, drenaggi e strumenti invasivi, al fine di limitare il danneggiamento delle
barriere mucocutanee e di diminuire la possibilità di colonizzazione batterica dovuta alla presenza
degli strumenti invasivi. Agli effetti biologici delle interleuchine, in particolare dell’IL-1, si
attribuisce la comparsa dei segni generali di infezione: febbre, leucocitosi, aumento della VES,
astenia, anoressia, mialgie, cefalea.
Modalità di diffusione delle infezioni chirurgiche
Grazie all’efficienza dei meccanismi di difesa la maggior parte delle infezioni sono localizzate e la
loro evoluzione è verso la risoluzione spontanea o verso la formazione di un ascesso. Talora invece
l’entità della carica batterica e uno stato di immunodepressione determinano l’evoluzione
dell’infezione locale verso la formazione di un flemmone (infezione locale rapidamente invasiva,
senza tendenza alla demarcazione da parte di una parete di tessuto infiammatorio), o di un’infezione
necrotizzante.
La diffusione dell’infezione a distanza può avvenire attraverso le vie linfatiche o attraverso i
vasi ematici; caratteristica e la comparsa di linfoadenite e linfangite satellite ai focolai settici.
La linfangite superficiale è caratterizzata dalla comparsa di striature cutanee rossastre in
corrispondenza dei vasi linfatici sottocutanei flogistici.
L’invasione del sangue da parte di microrganismi può portare alla comparsa di:
• batteriemia, cioè presenza di batteri nel sangue, transitoria e solitamente di breve durata se i
meccanismi di difesa antibatterica sono efficienti;
• setticemia, cioè presenza nel sangue di batteri patogeni virulenti che si moltiplicano
attivamente, liberando tossine, se i meccanismi di difesa sono compromessi;
• sepsi, un’infezione che ha determinato la comparsa di uno "stato settico", cioè di una
importante reazione di fase acuta dell´organismo, caratterizzata da alterazioni
emodinamiche, metaboliche, immunologiche e nutrizionali, indotte dai mediatori delle
risposte biologiche.
Altre complicanze delle infezioni: oltre allo shock settico, si ricorda la possibile comparsa di
insufficienze multiple di organi (Multiple Organ Failure, MOF).
Inoltre si possono manifestare: gravi alterazioni del sistema della coagulazione (CID), depressione
midollare con piastrinopenia e leucopenia, microembolie settiche, con possibile sviluppo in
gangrena settica.
Metodi diagnostici
• infezioni di ferita: vi sono segni locali che vanno dalla comparsa di eritema, dolore ed
indurimento, fino alla comparsa di raccolta purulenta e possibilità di deiscenza della ferita
stessa.
• infezione postoperatoria delle vie respiratorie: segni di infezione all’esame obiettivo del
torace, unitamente alla documentazione di addensamento polmonare all’esame radiologico,
eventualmente confermato dalla positività dell’esame colturale dell’espettorato.
• infezioni delle vie urinarie: il criterio diagnostico è quello dell’urinocoltura positiva.
• altre infezioni meno frequenti: il criterio diagnostico di certezza è dato dalla positività degli
esami colturali degli essudati o delle colture dei liquidi biologici raccolti nella sospetta sede
di infezione, o dalla positività dell’emocoltura. Per la localizzazione degli ascessi
addominali è assai utile l’esecuzione dell’ecografia. L’esame TC è utile e talvolta
indispensabile per la diagnosi di ascessi profondi: a livello cerebrale, toracico,
addominale e degli arti.
• infezione sostenuta da germi anaerobi: raccolta in sede di infezione di materiale di odore
fetido; presenza di tessuto necrotico; formazione di pseudomembrane o di gangrena;
presenza di gas nei tessuti (evidenziabile all’es. Rx o alla TC o alla palpazione) e nelle
secrezioni; infezione successiva ad intervento chirurgico sul colon-retto.
I metodi consigliati per la raccolta di materiale per colture microbiologiche in corso di infezioni
chirurgiche variano in rapporto agli organi interessati dall’infezione.
Per le infezioni delle vie respiratorie si esegue abitualmente l’esame dell’escreato bronchiale; più
attendibile è il brushing bronchiale in broncoscopia o puntura diretta polmonare. La coltura del
liquido di toracentesi è indicata nelle infezioni del cavo pleurico.
Per le gravi infezioni delle vie urinarie, si esegue abitualmente l’urinocoltura, con l’avvertenza di
evitare di contaminare l’urina durante la minzione. Quando si vuole assolutamente escludere la
contaminazione dell’urina durante il prelievo, e indicata l’aspirazione endovescicale percutanea
per via sovrapubica.
L’esame colturale delle raccolte ascessuali si può fare mediante aspirazione dell’essudato con
siringa. E' opportuno procedere ad un esame batterioscopico con la colorazione di Gram.
Terapia
I criteri generali di terapia delle infezioni chirurgiche si possono suddividere in:
• misure generali di supporto
• trattamento locale
• chemioterapia antibiotica
Fanno parte delle misure generali di supporto:
• il controllo delle alterazioni volemiche, idroelettrolitiche, della crasi ematica e
metaboliche;
• il supporto nutrizionale (durante le infezioni la presenza di alterazioni quali l’anoressia, la
nausea, il vomito, la diarrea, l’ileo paralitico impediscono un’alimentazione orale
sufficiente);
• la fisioterapia (ha lo scopo di migliorare la ventilazione e la perfusione polmonare, nonché
le condizioni emodinamiche, consente l’eliminazione delle aree di atelettasia polmonare)
I principi generali del trattamento locale sono: incisione, drenaggio, detersione, sutura (a parità
di impermeabilità e tenuta, la sutura più fisiologica e con minore incidenza di complicanze è
quella monostrato a punti staccati sottili).
Chemioterapia antibiotica
La scelta dei farmaci da impiegare per il trattamento delle infezioni sensibili agli antibiotici può
essere decisa secondo i seguenti criteri:
• scelta empirica, sulla base di una valutazione clinica;
• scelta mirata, sulla scorta dei test di sensibilità agli antibiotici.
L’efficacia dell’antibioticoterapia è direttamente proporzionale alla tempestività di impiego dei
farmaci. Molto spesso il chirurgo deve fondare la propria decisione circa l’inizio
dell’antibioticoterapia senza disporre dei test di sensibilità in vitro. La decisione clinica in tali
circostanze si deve cosi articolare:
• valutazione della sintomatologia legata all’infezione, con formulazione di ipotesi
diagnostiche sul tipo di infezione e sul probabile agente patogeno;
• scelta dell’antibiotico o della combinazione antibiotica che più probabilmente è efficace
contro i microrganismi sospetti responsabili dell’infezione;
• raccolta e coltura di adeguati campioni biologici (sangue, escreato, essudato, urina, ecc.)
prima d’iniziare l’antibioticoterapia, cosi da ottenere successivamente una diagnosi
microbiologica.
Esami di laboratorio per la scelta degli antibiotici
Il test di sensibilità in vitro dei microrganismi agli antibiotici fornisce informazioni circa la MIC
(Minimal Inhibitory Concentration) dei farmaci.
La durata della terapia antibiotica dipende dalla risposta clinica, valutabile come risoluzione
dell’infezione. L’attenuazione significativa o la scomparsa dei segni generali di infezione da più di
48 ore, associata a significativa diminuzione dei segni locali di infezione, rappresentano i criteri
fondamentali che consigliano la sospensione della terapia.
In particolare per gli antibiotici (la maggioranza) che vengono escreti per via urinaria, è da
ricordare la necessità di diminuzione del dosaggio nei pazienti affetti da insufficienza renale.
Nei pazienti con infezioni gravi e in quelli con alterazioni della funzionalità gastrointestinale, si
darà la preferenza agli antibiotici per via parenterale, che consentono di ottenere con certezza livelli
ematici terapeutici. Talora può essere necessario impiegare antibiotici in combinazione. Ciò
diventa necessario nel caso di infezioni polimicrobiche con sensibilità diverse e impiego sinergico
di farmaci per ottenere un effetto terapeutico superiore (per es. amoxicillina e acido clavulanico;
ampicillina e sulbactam; trimethoprim e sulfametossazolo).
Tra gli effetti secondari, che possono variare a seconda dei farmaci impiegati, va segnalata la
frequente comparsa di candidiasi orale; inoltre è da valutare con particolare cura nel paziente
chirurgico la comparsa di diarrea. La patogenesi della diarrea da antibiotici è a volte legata a
superinfezione da Clostridium difficile, che elabora una tossina in grado di provocare colite
pseudomembranosa grave. Il C. difficile è solitamente sensibile alla vancomicina.
Profilassi e controllo delle infezioni nosocomiali
Per prevenire l’insorgenza delle infezioni chirurgiche è possibile agire a due livelli:
• aumentando le capacità di difesa dell’organismo;
• riducendo o abolendo la contaminazione batterica.
Per la profilassi delle infezioni è importante il riequilibrio metabolico dei pazienti dismetabolici
(per es. diabete, insufficienza epatica o renale). E' importante a tale fine perseguire il ripristino
dell’omeostasi glicemica, dell’equilibrio acido-base e, per quanto possibile, della funzionalità renale
ed epatica. Il ripristino dello stato nutrizionale rappresenta un obiettivo di primaria importanza nella
preparazione del paziente all’intervento chirurgico; parimenti importante è evitare l’eccessiva
deplezione nutrizionale durante il periodo catabolico postoperatorio o post-traumatico. E' possibile
raggiungere questi obiettivi mediante l’impiego di tecniche nutrizionali artificiali, quali la
nutrizione parenterale totale e la nutrizione enterale specializzata. Una meticolosa antisepsi è da
perseguire sia in fase di preparazione che di esecuzione dell’atto operatorio.
Un’adeguata profilassi antinfettiva in chirurgia comporta i seguenti provvedimenti:
• antisepsi pre ed intraoperatoria e cura delle ferite chirurgiche;
• accurata manutenzione e rimozione precoce dei cateteri infusionali, dei drenaggi e degli
strumenti invasivi;
• somministrazione profilattica di antibiotici.
I principi generali della chemioprofilassi antibiotica si basano anzitutto sulla distinzione degli
interventi in: puliti, puliti-contaminati, contaminati e sporchi. La chemioprofilassi va sempre
attuata prima dell’esecuzione di interventi, puliti-contaminati, contaminati e sporchi, avendo cura
che l’antibiotico raggiunga, al momento dell’inizio dell’atto chirurgico, la concentrazione
plasmatica efficace.
La chemioprofilassi non dovrebbe essere eseguita negli interventi puliti, ad eccezione di quegli
interventi che prevedono l’impianto di materiali protesici ed in quelli che si prevedono
particolarmente lunghi. E' stata infatti osservata una maggior incidenza di complicanze infettive
dopo interventi chirurgici puliti che si protraggono per oltre 3 ore. La scelta dell’antibiotico o della
combinazione di antibiotici da somministrare a scopo di profilassi antinfettiva deve essere fatta
conoscendo la composizione della flora batterica, che presumibilmente contaminerà il campo
operatorio al momento della sezione chirurgica del viscere su cui si opera.
Grado di
contaminazione
Tipo di intervento
Pulito
Nessun focolaio settico in vicinanza del campo; nessun errore tecnico;
nessuna interruzione della continuità del tubo digerente, respiratorio o
genito-urinario.
Pulito - contaminato
Sezione del tubo gastroenterico senza eccessiva contaminazione del campo
operatorio; apertura delle vie genito-urinarie o delle vie biliari in assenza
di infezioni urinarie o biliari; per es. colecistectomia.
Contaminato
Abbondante contaminazione per apertura del tubo gastro-enterico; apertura
delle vie urinarie o biliari in presenza di urina o bile infetta; per es.
appendicite flemmonosa; interventi sul grosso intestino.
Sporco
Contaminazione diffusa del campo operatorio; per es. peritonite
stercoracea.
Fattori di rischio:
• Legati al paziente
• Eta avanzata
• Diabete
• Fumo di sigaretta
• Infezioni in altre sedi
• Obesità
• Malnutrizione
• Uso concomitante di steroidi
• Degenza pre-op. prolungata
• Immunodepressione
•
Legati alle procedure
• Assenza di doccia pre-op.
• Rasatura con rasoio a lama
• Impropria preparazione della cute
• Misuso della profilassi antib.
• Assenza della dose i.o. di richiamo
• Assenza dei flussi laminari in s.o.
• Sovraffollamento della s.o.
• Errori nelle tecniche antisettiche
• Errori di tecnica chirurgica (trauma tissitale)
La profilassi antibiotica delle infezioni chirurgiche può essere locale oppure sistemica.
• Profilassi antibiotica locale a livello della ferita chirurgica: è indicata raramente, solo in
casi particolari di interventi molto contaminati o sporchi. L’impiego di neomicina,
kanamicina e cefalosporine su ferite potenzialmente contaminate o sicuramente contaminate
permette di ridurre in modo significativo l’incidenza di infezioni; la profilassi antibiotica
locale non è indicata negli interventi puliti, salvo che sia programmato l’impiego di
materiale protesico (protesi vascolari, articolari, ecc.).
•
Profilassi antibiotica sistemica: lo scopo della profilassi sistemica è di realizzare una
difesa antibatterica efficace, ottenendo la massima concentrazione di antibiotico a livello dei
tessuti al momento della loro sezione chirurgica. Le indicazioni all’impiego
dell’antibioticoprofilassi sistemica sono:
• Interventi pulito-contaminati e contaminati;
• Interventi sul tubo gastroenterico;
• Interventi sulle vie biliari;
• Isterectomia per via vaginale;
• Interventi puliti che prevedono impianti protesici;
• Interventi puliti che si prevedono di lunga durata (> 2 ore);
• Interventi settici o sporchi
La chemioprofilassi è particolarmente efficace solo se viene eseguita poco prima del momento in
cui presumibilmente avverrà la contaminazione.
La maggior parte dei chemioterapici raggiunge la massima concentrazione tissutale a distanza di
60-90 minuti dalla somministrazione endovenosa; in pratica, quindi, la somministrazione
dell’antibiotico deve avvenire al momento della preanestesia, cioè a pochi minuti dall’intervento2.
Quando l’intervento chirurgico si prolunga (oltre 4-5 ore), è opportuno somministrare
intraoperatoriamente una seconda dose di antibiotico, ad eccezione del caso in cui il chemioterapico
sia dotato di emivita sierica prolungata.
2 Esiste anche una che si effettua al momento dell'anestesia.
Nella scelta dell’antibiotico o di un’associazione di antibiotici si deve tener conto della popolazione
batterica che presumibilmente contaminerà il campo operatorio in quel particolare tipo di
intervento. Per esempio, nel caso di intervento sul grosso intestino, la scelta degli antibiotici per la
profilassi delle infezioni dovrà indirizzarsi verso farmaci che agiscono elettivamente e
contemporaneamente sui germi Gram-aerobi e sugli anaerobi. La durata complessiva della profilassi
antibiotica è oggetto di pareri non univoci. La maggior parte dei chirurghi sostiene l’efficacia di
un’unica somministrazione di antibiotico poco prima dell’intervento chirurgico; altri ritengono, al
contrario, che la somministrazione profilattica degli antibiotici debba essere ripetuta 2 o 3 volte
nelle prime 24 ore dopo l’intervento.
PROFILASSI ANTITROMBOTICA
La trombosi venosa rappresenta una delle complicanze potenzialmente più gravi nei pazienti
sottoposti ad interventi chirurgici, nei politraumatizzati e nei pazienti anziani costretti a letto. La
gravità di questa complicanza consiste nel rischio di possibile embolia polmonare.
I distretti venosi più frequentemente interessati sono le vene superficiali e profonde degli arti
inferiori (vene safene, tibiali, poplitea e femorale), e le vene pelviche maggiori (vena iliaca interna,
esterna e comune).
I fattori patogenetici delle flebotrombosi sono riassunti dalla triade di Virchow:
• rallentamento del flusso venoso
• alterazione della parete venosa
• aumento della coagulabilità del sangue
Le malattie che determinano la comparsa di uno o più di questi tre fattori comportano un elevato
rischio di trombosi venosa. Il rischio di insorgenza di trombosi venosa profonda (TVP), può
essere ridotto identificando i pazienti a rischio maggiore e adottando per essi opportune misure di
profilassi.
I fattori di rischio di TVP sono:
• il tipo di intervento chirurgico (in particolare gli interventi ortopedici e quelli sulla
pelvi) e i traumi gravi;
• la gravidanza e il puerperio;
• l’infarto del miocardio;
• l’insufficienza cardiaca congestizia;
• la presenza di neoplasie;
• l’eta > 40 anni;
• la presenza di vene varicose;
• pregressi episodi di tromboembolia venosa;
• l’immobilizzazione prolungata;
• l’uso di contraccettivi orali.
Tra le misure più semplici intese ad evitare un rallentamento del flusso sanguigno, che rappresenta
uno dei fattori patogenetici primari della TVP, vanno considerati:
• la mobilizzazione precoce del paziente a partire dalla prima giornata postoperatoria;
• il sollevamento degli arti inferiori dal piano del letto;
• la fisioterapia pre e postoperatoria, di tipo motorio e respiratorio;
• l’elastocompressione con benda elastica e la compressione pneumatica intermittente
dell’arto inferiore, mediante gambali gonfiabili;
• la somministrazione di preparazioni di eparina a basso peso molecolare per via
sottocutanea, subito dopo l’intervento. In caso di somministrazione di eparina, sia
sottocutanea che endovenosa, è necessario controllare accuratamente la coagulazione del
sangue. I test di laboratorio per il monitoraggio della coagulazione del sangue durante
trattamento eparinico sono: il tempo di Quick e il PTT.
CHIRURGIA MININVASIVA
La chirurgia mininvasiva comprende interventi attuati per via laparoscopica e toracoscopica ed
interventi attuati all´interno di organi cavi, come la chirurgia transanale, transesofagea e
transgastrica.
Da tecnica puramente diagnostica l´endoscopia è divenuta tecnica operativa grazie all´avvento di
microtelecamere ad alta definizione che montate sull´ottica permettono la visione del campo
operatorio su uno o più monitor televisivi. La visione del campo operatorio è spesso
anatomicamente più definita e chiara di quanto si ottenga a "cielo aperto" ed il chirurgo è libero di
operare a due mani, tramite strumenti chirurgici che attraversano la parete addominale o toracica.
L´esperienza acquisita in questo tipo di chirurgia ha messo in risalto come in molti interventi il
decorso postoperatorio sia soprattutto influenzato dal trauma legato alla via di accesso all´organo,
spesso necessariamente sproporzionata alla relativa semplicità dell´intervento da eseguire
sull'organo stesso.
È proprio la rapida ripresa del paziente nel decorso postoperatorio che ha reso questa tecnica così
ben accetta dal chirurgo e dal paziente stesso. L'assenza della ferita laparotomica o toracotomica e
la ridotta manipolazione di parete e dei tessuti durante l´intervento si traducono in una drastica
riduzione delle complicanze di ferita (ernie, infezioni), nella netta riduzione del dolore
postoperatorio e nella rapida ripresa delle funzioni respiratorie ed intestinali. Tutto ciò si traduce in
una precoce dimissione dall´ospedale del paziente che può riprendere in breve tempo l´attività
lavorativa.
A fronte di questo entusiasmo iniziale si sono anche messe in luce le problematiche legate alla
nuova tecnica, che hanno portato a complicanze intraoperatorie, alcune molto gravi, legate ad
un'iniziale inesperienza ed alla curva di apprendimento di ogni nuova tecnica. Il chirurgo opera con
una visione bidimensionale che appiattisce la profondità del campo operatorio e senza la sensazione
tattile caratteristica del gesto operatorio. Queste limitazioni sono superate attraverso un´attività di
allenamento sui simulatori e attraverso l´aiuto di colleghi esperti in questa chirurgia.
Chirurgia endoscopica transanale
La chirurgia transanale (TEM, Transanal Endoscopic Microsurgery) rappresenta un classico
esempio di come le tecniche endoscopiche possano essere attuate all´interno di organi cavi con
l'intento, in casi selezionati, di evitare interventi altamente demolitivi, come per esempio
un'amputazione di retto per via addominoperineale con confezionamento di colostomia terminale.
L´accurata selezione dei pazienti da sottoporre a questo tipo di trattamento è essenziale:
l'esplorazione digitale (che permette di apprezzare la sede e la mobilità della lesione), la rettoscopia
con strumento rigido (distanza della lesione dalla rima anale, biopsie multiple), l´ecografia
endorettale e la TC della regione perirettale (grado e profondità di infiltrazione nelle pareti del retto,
infiltrazione del grasso perirettale e presenza di linfonodi patologici) sono gli esami diagnostici
necessari ad una accurata stadiazione della malattia e quindi alla valutazione della fattibilità della
TEM.
Sono aggredibili con la TEM lesioni del retto extraperitoneale situate entro i 15 cm di distanza dalla
rima anale, che non occupino più dei 2/3 della circonferenza del viscere.
In anestesia generale, il paziente viene posizionato a seconda della sede della lesione in modo che la
stessa giaccia su di un piano inferiore rispetto alla posizione dell´operatore. Viene introdotto nel
retto un apposito rettoscopio operatore, a tenuta stagna, per poter mantenere una distensione del
retto tramite CO2 a bassa pressione. Al suo interno è presente un´ottica stereoscopica collegata ad
una fonte luminosa ed ad una telecamera che permette la visione sul monitor esterno. È possibile
inserire sino a 4 strumenti operatori tramite delle valvole a tenuta. L´operatore esegue l´intervento
di resezione scollando i piani sottomucosi e muscolari con l´elettrobisturi, mentre un secondo
operatore provvede all´aspirazione del sangue e al lavaggio del campo operatorio. Terminata la
resezione è possibile eseguire la sutura diretta del margine mucoso onde prevenire una possibile
emorragia o la comparsa di stenosi secondaria ad una guarigione per seconda intenzione.
Indicazioni alla chirurgia endoscopica transanale.
•
Resezione di adenomi villosi
•
Resezioni di carcinomi rettali allo stadio T1
•
Resezioni palliative di carcinomi rettali allo
•
Asportazione di ulcera solitaria del retto
•
Rettopessia per prolasso
stadio T3
Il decorso operatorio è generalmente rapido e ben tollerato se si esclude una possibile transitoria
difficoltà minzionale e di incontinenza fecale, peraltro completamente reversibile, legata alle
dimensioni del rettoscopio operatore.
SHOCK
Tradizionalmente lo shock è stato identificato con un quadro di ipotensione grave e di collasso
cardiocircolatorio; oggi si parla di shock indipendentemente dalla presenza di ipotensione se, sulla
base di rilevazioni dirette o indirette, viene riconosciuta un’alterazione del trasporto e/o
utilizzazione dell’ossigeno e dei substrati da parte dei tessuti. Lo shock può essere definito come
una sindrome dovuta all’alterazione dei processi di produzione energetica cellulare da diminuzione
della disponibilità o dell’utilizzazione dell’ossigeno e ai meccanismi fisiopatologici di compenso
che ne derivano. L'’alterazione del metabolismo cellulare appare essere un momento patogenetico
fondamentale il quale si automantiene e che, a sua volta, interessando tutti gli organi e tessuti, ne
può provocare alterazione sino all’insufficienza e allo scompenso. Sotto questa angolazione è
possibile concepire lo shock come un’entità patologica unitaria, anche se i fattori eziologici e i
meccanismi che concorrono a realizzarne il quadro possono essere differenti.
Sul piano nosografico lo shock contempla fenomeni plurieziologici (per es. cardiogeno,
ipovolemico, traumatico, settico, neurologico, anafilattico), a ripercussione pluriviscerale ed
evoluzione in complicanze di organi vitali (cuore, polmoni, reni, fegato, SNC).
Sul piano clinico si tratta di una condizione che, senza predilezione di sesso o eta, ha le
caratteristiche di insorgere più o meno acutamente, di compromettere la stabilità cardiocircolatoria,
di produrre a carico di organi vitali una perfusione inadeguata ai livelli di funzionalità richiesti in
queste circostanze.
RISPOSTA NEUROENDOCRINA AL TRAUMA CHIRUGICO
Per stress, in medicina, si definisce una qualsiasi aggressione che perturba l’omeostasi di un
organismo vivente e l’insieme di reazioni biologiche che l’organismo mette in atto.
Benché i tipi di stress siano molti e molto diversi tra loro (traumatico, chirurgico, infettivo,
dolorifico ecc.), la risposta dell’organismo e, nei suoi tratti essenziali, univoca, stereotipata e
aspecifica. Tale reazione coinvolge, in vario grado:
• il sistema nervoso
• endocrino
• metabolico
• immunologico
Fasi della risposta neuroimmunoendocrina
Sistema microendocrino. Il primum movens sembra essere l’attivazione dell’infiammazione
tramite il cosiddetto "sistema microendocrino" costituito da interleuchine e prostaglandine,
sostanze ormono-simili che sono i principali mediatori della risposta infiammatoria. Le
interleuchine e le prostaglandine si liberano a livello della sede lesionata, e sono prodotte dai
macrofagi e dai neutrofili attivati e dagli stessi tessuti lesionati. Il sistema microendocrino, a sua
volta, è in grado di attivare il sistema macroendocrino e di indurre a livello epatico la cosiddetta
"risposta di fase acuta". La sensazione del dolore contribuisce in vario grado e in via riflessa
all’attivazione del sistema macroendocrino.
Sistema macroendocrino. L’attivazione del sistema macroendocrino comporta:
• ipertono simpatico, con liberazione di catecolamine;
• iperincrezione di ACTH, aldosterone, ADH e GH;
• aumento del glucagone e inibizione del rilascio di insulina, dovuto all’iperincrezione di
catecolamine. Successivamente, però, l’insulinemia tende a riaumentare per azione diretta
dell’interleuchina-1 e per l’iperglicemia che si è instaurata per un difetto di utilizzo da parte
dei tessuti periferici;
• insulino-resistenza: deriva dall’iperincrezione di GH e dall’aumento della cortisolemia;
Fenomeni metabolici. Sul piano metabolico, la reazione ormonale si traduce in quattro effetti
principali:
• ridotto utilizzo periferico del glucosio e iperglicemia;
• aumento della neoglucogenesi epatica;
• aumento del catabolismo proteico a livello periferico (muscoli, intestino);
• aumento della captazione degli aminoacidi e incremento della proteino-sintesi epatica.
Risposta di fase acuta. Gli ultimi due effetti sono in gran parte ascrivibili all’azione
dell’interleuchina-1 che:
• induce la proteolisi muscolare;
• a livello epatico stimola la sintesi delle proteine di fase acuta (proteina C-reattiva,
fibrinogeno, ceruloplasmina).
Nel complesso, la risposta ormonale modifica l’assetto metabolico allo scopo di:
• aumentare i substrati disponibili per le cellule che costituiscono il "tessuto di riparazione",
che utilizzano come unico substrato il glucosio;
• aumentare i substrati disponibili per il fegato, che nella fase di stress è l’organo centrale
della risposta della fase acuta.
Fenomeni immunologici
Il cortisolo e le catecolamine sembrano avere effetti inibitori sull’immunita cellulomediata e,
soprattutto, su alcune popolazioni linfocitarie, quali i linfociti T-helper, provocando una linfopenia
con inversione del rapporti T-helper/T-suppressor.
Alcune proteine di fase acuta sembra possano avere funzioni immunodepressive o di
immunoregolazione.
Nell’insieme la risposta neuroendocrina allo stress ha lo scopo di fornire all’organismo aggredito i
mezzi per far fronte all’aggressione. Tuttavia essa risulta utile quando è limitata nel tempo. La
persistenza dei fenomeni neuroendocrini, metabolici e immunologici conduce l’organismo,
soprattutto se defedato, a un rapido esaurimento delle risorse e delle difese. D’altra parte,
un’abnorme amplificazione dell’attività e degli effetti del microsistema endocrino è in grado di
determinare essa stessa un danno strutturale irreparabile a vari organi e sistemi, con conseguente
esaurimento delle funzioni vitali dell’organismo.
Quadro clinico. La reazione a uno stress rappresenta una "reazione di allarme". I sintomi
caratteristici sono prevalentemente quelli ricollegabili all’attivazione ortosimpatica:
• tachicardia, ipertensione, aumento della contrattilità cardiaca, vasocostrizione periferica,
pelle sudata e fredda, ecc. Bisogna notare come tali sintomi possano rappresentare, per un
paziente con cardiopatia ischemica, un pericolo piuttosto che un vantaggio.
Stress da dolore chirurgico
Il dolore intra e postoperatorio rappresenta uno dei principali stress per l’organismo sottoposto a
intervento chirurgico. La lesione tissutale, conseguente all’intervento effettuato, determina
l’attivazione di tutta la risposta neuroimmunoendocrina precedentemente descritta. Un dolore non
ben controllato può, quindi, portare a un rapido esaurimento delle capacita di difesa e di reazione
dell’organismo del paziente, peggiorando la prognosi postoperatoria.
Per tutti questi motivi viene posta sempre maggiore attenzione al controllo del dolore intra e
postoperatorio.
Un miglior controllo del dolore intra e postoperatorio riduce l’attivazione della risposta
neuroimmunoendocrina allo stress e riesce a migliorare l’outcome del paziente (minor tempo di
ospedalizzazione, minori complicanze polmonari, minor tempo di recupero delle funzioni
biologiche, minor tempo di immobilizzazione).
FERITE
Si intende per ferita una soluzione di continuo della cute.
Esistono tre modalità di guarigione delle ferite:
• per prima intenzione, quando i margini di una ferita sono contrapposti così da essere
separati solo da uno spazio virtuale. E' la condizione ideale che si verifica nella ferita
suturata chirurgicamente. In tali circostanze, il tessuto cicatriziale neoformato è di minima
entità;
•
per seconda intenzione, quando tra i margini della ferita si costituisce un intervallo reale
destinato a essere colmato prima dal tessuto di granulazione e successivamente da una
massa cicatriziale;
•
per terza intenzione, questo tipo di guarigione riguarda le ferite chirurgiche andate
incontro, nel decorso post-operatorio, a una deiscenza parziale o totale. Il trattamento di
questa complicazione prevede di norma la riapertura completa della ferita, la sua accurata
detersione, l'asportazione delle aree mortificate, un adeguato zaffaggio. In un secondo
momento, valutata la situazione locale e dopo aver escluso la presenza di focolai di
infezione, si può procedere a una nuova sutura dei lembi.
Le fasi del processo di riparazione: FIPRO
•
formazione del coagulo: rete di fibrina, nelle cui maglie sono incluse emazie, piastrine e
altri elementi figurati del sangue. L’avvicinamento dei margini della ferita è iniziato dalla
retrazione del coagulo, mediato dalla trombostenina piastrinica;
•
invasione dei fagociti: dapprima granulociti neutrofili, rapidamente sostituiti poi dai
macrofagi; detergono la ferita, fagocitando la fibrina e i detriti cellulari e riversando in sede
extracellulare numerosi enzimi litici. Inoltre liberano fattori di crescita per i fibroblasti e le
cellule endoteliali;
•
proliferazione dei tessuti connettivali (componente cellulare ed extracellulare): il
tessuto di granulazione è un tessuto connettivale scarsamente differenziato e molto
vascolarizzato che compare tra il II e il III giorno del processo di riparazione della ferita.
Clinicamente appare come una massa di colorito rosso acceso, facilmente sanguinante, a
superficie più o meno bernoccoluta per cui si parla di "bottoni di granulazione". La
componente cellulare è rappresentata soprattutto dai fibroblasti, ma sono presenti anche
altre cellule connettivali: macrofagi, leucociti, mastociti. I filamenti di fibrina rappresentano
l’impalcatura e la guida per la loro proliferazione. Una parte dei fibroblasti assume
caratteristiche microstrutturali e funzionali tipiche delle cellule muscolari lisce ed è per
questo definita "miofibroblasti": questi sono ritenuti il fattore più importante nella
contrazione della ferita. Tali cellule normalmente scompaiono per apoptosi subito dopo il
completamento della chiusura della ferita stessa attorno alla X-XII giornata. Sono
abnormemente
presenti
in
condizioni
di
cicatrizzazione
ipertrofica.
Contemporaneamente ai fibroblasti, tra il II e il III giorno proliferano gli abbozzi vascolari,
stimolati essenzialmente dal VEGF (Vascular Endothelial Growth Factor) e dal FGF. Sui
margini della lesione, a partenza dai periciti (cellule mesenchimali adiacenti alle cellule
endoteliali dei capillari residui), originano delle protuberanze solide, che si allungano poi in
cordoni diretti verso il centro; questi cordoni si anastomizzano fino a formare una fitta rete;
successivamente si cavitano e vi si stabilisce il flusso ematico. Più tardi rispetto ai capillari
ematici, rigenerano i capillari linfatici, anch’essi a partire da vasi preesistenti. La
componente extracellulare, costituita da una parte amorfa e da una fibrillare, è elaborata dai
fibroblasti. Essi secernono acido ialuronico e altri glucosaminoglicani, i quali rappresentano
il substrato della cosiddetta sostanza fondamentale amorfa extracellulare. Compito dei
fibroblasti è anche l’elaborazione e la secrezione del procollagene, che viene trasformato in
ambiente extracellulare in tropocollagene. Dal tropocollagene originano le microfibrille, e
infine le fibre collagene vere e proprie;
•
riepitelizzazione: la fase di riepitelizzazione inizia molto precocemente: entro le 24 ore
infatti i cheratinociti tendono a migrare dai margini verso il centro della lesione e in III
giornata nell’epidermide dei labbri della ferita è osservabile un’intensa attività mitotica non
limitata allo strato basale. La riepitelizzazione si realizza però solo quando, grazie alla
proliferazione del tessuto di granulazione, si colma l’eventuale dislivello tra il fondo e i
bordi della lesione. Un tessuto di granulazione esuberante, tuttavia, ostacola la
riepitelizzazione;
•
organizzazione della cicatrice: le fibre collagene aumentano di numero e spessore;
diminuisce il numero dei fibroblasti, che vanno assumendo l’aspetto di cellule quiescenti: i
fibrociti; diminuiscono i capillari. Si viene cosi a formare la cicatrice: un tessuto
connettivale definitivo, poco irrorato, poco innervato, anelastico, prevalentemente costituito
da fibre collagene dense, con rari elementi cellulari in riposo funzionale (fibrociti), rivestito
da una cute fragile, traslucida, di colorito alterato, inestensibile, priva di annessi, spesso sede
di iper- e parestesie. L’organizzazione del tessuto di riparazione a opera delle fibre collagene
determina un aumento della sua "resistenza alla trazione" (tensile strength).
Il tessuto cicatriziale subisce nel tempo uno spontaneo processo di retrazione, nel quale
distinguiamo due componenti:
•
•
contrazione: si conclude nell’arco di circa 12 giorni dal trauma: è determinata dalla
contrazione dei miofibroblasti presenti nel tessuto di granulazione;
retrazione: la retrazione della cicatrice già costituita, associata anche al suo aumento di
spessore, si prolunga per diversi mesi: è determinata dall’aggregazione delle fibrille di
tropocollagene, per polimerizzazione e formazione di legami crociati (crosslinks), con
perdita di acqua.
Una cicatrice può essere considerata solida dopo 2 settimane. La sua organizzazione si completa
in circa 6 mesi, trascorsi i quali si avvia lentamente ad assumere il suo aspetto definitivo, che
consegue in circa 2 anni.
I diversi tipi di ferita
A seconda della profondità cui giunge la soluzione di continuo dei tessuti, si distinguono:
• ferite superficiali: interessano la cute e il sottocutaneo fino alla fascia superficiale
esclusa;
• ferite profonde: interessano anche la fascia e le diverse strutture sottofasciali.
In base alle caratteristiche dei margini della ferita, si distinguono:
• ferite lineari: determinate da strumenti taglienti e affilati, sono caratterizzate da bordi netti e
continui, senza segni di sofferenza tissutale. Rappresentano la condizione ideale per lo
svolgimento dei processi di riparazione;
• ferite contuse: determinate da strumenti taglienti, ma in associazione a una pressione
superiore a quella endovascolare. Ne consegue la sofferenza ischemica dei tessuti adiacenti
alla ferita, per cui i bordi appaiono ecchimotici e perciò destinati, a seconda della gravità
della contusione, a necrosi diffusa o parcellare. La sutura di tali ferite deve essere
preceduta dalla accurata eliminazione meccanica dei margini sofferenti.
•
ferite lacere: determinate dagli agenti lesivi più disparati. I bordi sono variamente
conformati e di spessore irregolare. La sutura deve essere preceduta da un’accurata
detersione dei bordi, con eliminazione delle porzioni verosimilmente destinate alla necrosi.
Le ferite lacere il più delle volte presentano i bordi variamente contusi realizzando cosi il
quadro della ferita lacerocontusa.
PATOLOGIA DELLE FERITE
Cicatrizzazione ipoplastica: è indotta da turbe dei fattori che condizionano la guarigione delle
ferite e si manifesta con una deficiente produzione di tessuto di granulazione e una epitelizzazione
ritardata. La cicatrice ipotrofica appare depressa, traslucida, ipopigmentata, spesso marezzata in
periferia per la presenza di teleangectasie, facilmente ulcerabile.
Fattori inibenti la guarigione delle ferite.
Esogeni
Denutrizione
Infezioni
Corpi estranei
Compressione
Radiazioni
Endogeni
Turbe circolatorie
Malattie metaboliche
Malattie cutanee
Deficit immunitari
Cicatrizzazione iperplastica: può essere indotta da un trattamento inadeguato delle ferite, nonché
da una certa predisposizione soggettiva. La cicatrice appare fin dalla II settimana dal trauma come
un cordone rilevato, eritematoso, dolente, espressione clinica di un aumento quantitativo delle
fibre collagene, che comprimono le terminazioni nervose; l’epidermide è sottile e atrofica. Col
tempo la cicatrice ipertrofica mostra una certa tendenza alla regressione spontanea, che può essere
favorita da trattamenti locali con corticosteroidi. Dopo almeno 6 mesi, la cicatrice ipertrofica può
essere corretta chirurgicamente mediante escissione del cordone, eliminazione dell’eventuale
tensione e corretta sutura.
Cicatrizzazione metaplastica: tale patologia cicatriziale porta alla costituzione del cheloide. Il
cheloide è caratterizzato da un’inesorabile capacita di recidiva locale, che lo diversifica dalle banali
forme ipertrofiche, pur non essendo in grado di dare metastasi, a differenza delle neoplasie.
L’eziopatogenesi del cheloide è ancora in gran parte oscura. Si ipotizza una predisposizione
familiare e razziale. Nell’ambito dei fattori esogeni, si elencano le medesime cause che inducono la
cicatrizzazione ipertrofica e in particolare: l’eccessiva tensione sui margini della ferita, la presenza
di materiale estraneo, tutte le condizioni che rallentano il processo di guarigione (lesioni guarite per
seconda intenzione). Clinicamente il cheloide appare come una tumefazione di colorito rosso
acceso, di forma spesso diversa da quella della lesione di partenza e di dimensioni superiori: la
dolorabilità, spontanea o indotta dalla pressione, è spesso notevole. Sedi predilette sono, in ordine,
la regione presternale, la regione deltoide, la regione dorsale, le regioni cervicali anteriore e laterale.
La terapia del cheloide, tuttora sperimentale, è praticabile solo sulle forme recenti (non più di 6
mesi dalla lesione primitiva). Tra le proposte più attuali ed efficaci ricordiamo: il bendaggio
elasticocompressivo (per almeno 6 mesi); la laserterapia all’infrarosso.
Studi ancora sperimentali sembrano dimostrare l’efficacia del mannosio 6-fosfato nel controllo
della cicatrizzazione ipertrofica e cheloidea, attraverso un meccanismo di inibizione dell’attivazione
della famiglia dei Transforming Growth Factors.
Il cheloide inveterato è ribelle a qualsiasi trattamento.
Risultati moderatamente incoraggianti si stanno ottenendo associando all’asportazione chirurgica
una contestuale singola seduta di radioterapia, seguita dalla elastocompressione con lamine in gel di
dimetilpolisilossano.
Cicatrizzazione neoplastica: la trasformazione cancerosa delle cicatrici (ulcera di Marjolin) è un
evento non frequente. Insorge tipicamente, dopo una latenza media da 10 a 30 anni, su cicatrici
caratterizzate da una storia di guarigione lenta e difficoltosa (cicatrici da ustione, ferite da arma da
fuoco, ecc.); istologicamente è in genere un carcinoma spinocellulare altamente invasivo.
ULCERE
Si intende per ulcera una perdita di sostanza interessante i tessuti a varia profondità, priva di
tendenza alla guarigione spontanea. Particolarmente frequenti sono le ulcere a carico degli arti
inferiori, specie dopo la sesta decade di vita e nel sesso femminile.
L’eziopatogenesi di tale condizione si identifica in un deficit circolatorio locale, il quale può essere:
• primitivo, direttamente connesso a una patologia vascolare (arteriopatie, flebopatie,
linfopatie);
• secondario a malattie, che si estrinsecano mediante fenomeni vasculitici.
La terapia si basa, per quanto possibile, sulla rimozione dell’agente eziologico.
La chirurgia delle ulcere consiste nell’accurata pulizia del fondo e dei bordi della lesione ulcerosa,
al fine di convertire una perdita di sostanza contaminata in una ferita chirurgica, con fondo e
margini netti ed in grado di consentire l’attecchimento di un innesto cutaneo sottile.
Lesioni da pressione
La lesione da pressione (o "ulcera da decubito") si costituisce nei soggetti costretti a un decubito
obbligato (paraplegici, traumatizzati agli arti inferiori posti in trazione ecc.). L’eziologia è da
ricondurre alla confluenza di elementi diversi: compressione locale superiore alla pressione media
nei capillari; insufficiente spessore dei tessuti molli soprastanti le corrispondenti sporgenze ossee;
ristagno di deiezioni. Sedi elettive, in ordine decrescente di frequenza e corrispondenti alle sedi di
decubito abituale: regioni ischiatiche, regione sacrale, regioni pretrocanteriche, malleoli esterni,
regioni pretibiali, regioni iliache. La profilassi si basa sulla cura del trofismo generale e, a livello
locale, sull’accurata pulizia e sull’attenuazione dello stimolo pressorio mediante frequenti cambi di
posizione, bendaggi soffici, appositi materassi (con imbottitura d’aria, d’acqua, di microsfere, ecc.).
Il trattamento è medico finchè la lesione è localizzata alla cute e agli strati sottocutanei più
superficiali ed è basato su: detersione del fondo dell’ulcera tramite ioni argento, iodio povidone,
ecc; controllo della crescita del tessuto di granulazione; stimolazione della proliferazione
dell’epitelio. Quando l’ulcerazione interessa od oltrepassa il piano fasciale, la terapia è chirurgica
ed è schematizzabile in: escissione dell’area ulcerata e del tessuto cicatriziale circostante;
spianamento o rimozione della sporgenza ossea sottostante; riparazione della soluzione di continuo
mediante trasferimento di un lembo fasciocutaneo o miocutaneo.
NUTRIZIONE ARTIFICIALE
La nutrizione nel paziente chirurgico è un aspetto di fondamentale importanza.
Perché uno stato di denutrizione comporta:
• diminuzione delle capacità di difesa sia aspecifiche che specifiche, con aumento della
suscettibilità alle infezioni;
• diminuzione della capacità di riparazione dei tessuti.
La denutrizione si osserva frequentemente nei pazienti chirurgici con malattie gastroenterologiche e
oncologiche.
Due sono i tipi principali di malnutrizione:
•
Marasma: è la deplezione delle riserve di tessuto adiposo e delle masse muscolari fino alla
cachessia. C’è relativa conservazione delle proteine viscerali. Il marasma è frequente in
pazienti con malattie croniche. E’ dovuta a un insufficiente apporto alimentare sia di
proteine che di carboidrati e grassi. E’ la forma di malnutrizione più frequente in chirurgia.
•
Kwashiorkor: è la deplezione massiva delle proteine viscerali, con grave ipoalbuminemia
ed edema. E’ causata da un importante deficit dell’apporto alimentare di proteine. Si
osserva in pazienti con stress catabolico, solitamente settico, i quali mantengono stabili i
parametri nutrizionali antropometrici ma presentano un deficit della risposta immunitaria e
squilibri elettrolitici.
•
Forme miste: sono tipiche dei pazienti ipercatabolici e con un apporto calorico-proteico
insufficiente. Clinicamente si osservano caratteristiche comuni sia al marasma che al
kwashiorkor.
Valutazione dello stato nutrizionale
E’ sempre necessaria per identificare pazienti con malnutrizione. Una volta stabilito che un paziente
è malnutrito bisogna stabilire l’entità della sua malnutrizione, per stabilire quale sia la terapia
nutrizionale più idonea.
Parametri clinici
Anamnesi con raccolta delle abitudini alimentari e se ci sono state variazioni di peso.
Esame obiettivo: ricerca di edemi, ittero, alterazioni a livello orofaringeo e delle mucose visibili,
valutazione della riduzione del grasso sottocutaneo, valutazione della riduzione delle masse
muscolari
Parametri antropometrici
Peso, altezza, BMI, rapporto peso attuale/peso abituale (correlato con il tempo di dimagrimento)
circonferenza muscolare del braccio, spessore plica adiposa cutanea tricipitale.
Calo ponderale %: è il parametro più importante, un calo ponderale involontario avvenuto negli
ultimi 6 mesi che è maggiore del 10% del peso abituale del paziente, indica già da solo una
denutrizione medio-grave.
Parametri bioumorali
Il compartimento delle proteine viscerali rappresenta il 10% della massa corporea di un individuo.
Per valutare l’entità di una perdita in tale compartimento, bisogna fare riferimento alle proteine
plasmatiche: albuminemia g/dl (≥ 3.5 normale, 3.5-3.2 denutrizione moderata, <3.2 denutrizione
severa).
Un’albuminemia ridotta in un paziente denutrito è dovuta a una sua ridotta sintesi, più che a un
aumento del suo catabolismo. Tuttavia la valutazione dell’albuminemia non è utile per stabilire se la
denutrizione è recente, perché l’albumina ha una emivita di 21 giorni. Per evidenziare un deficit
nutrizionale acuto vanno valutate proteine plasmatiche a bassa emivita quali RBP, transferrina.
Parametri immunologici
La malnutrizione comporta immunodepressione. Linfociti totali nel sangue < 1500/mm 3 è indice di
denutrizione. Riduzione della risposta agli skin test con antigeni cutanei (tubercolina, candidina)
Indici prognostici nutrizionali
Consentono di valutare il rischio chirurgico legato allo stato di denutrizione.
•
PINI (Prognostic Inflammatory and Nutritional Index)
α1 glicoproteina acida x PCR / albumina x prealbumina,
<1 normale, 1-10 basso, 11-20 intermedio, 21-30 elevato, > 30 minaccia di morte
•
Indice Prognostico-Nutrizionale di Seltzer: si basa su albuminemia e conta linfocitaria tot.
ESIGENZE NUTRIZIONALI
Fabbisogno Energetico Giornaliero: metabolismo basale + calorie necessarie per svolgere
l’attività fisica + calorie necessarie per l’azione dinamico-specifica degli alimenti (ADS, 10% del
fabbisogno).
BMR (basal metabolic rate – metabolismo basale)
E' il consumo energetico di un individuo a riposo, al mattino, a digiuno e in condizioni ambientali di
neutralità termica.
REE (resting energy expenditure – consumo energetico a riposo)
In un soggetto normale corrisponde al BMR aumentato del 10%. In un soggetto malnutrito
diminuisce del 10-40% per la perdita di massa proteica che è quella più attiva dal punto di vista
metabolico.
In un soggetto ipercatabolico (dopo intervento chirurgico, trauma o ustione) aumenta del 120150%, cui bisogna aggiungere la spesa energetica dell’ADS, trascurabile solo se il paziente viene
nutrito artificialmente per via parenterale.
Fabbisogno Proteico Giornaliero varia in rapporto all’entità dei processi di sintesi e catabolismo
azotato, dipendente a sua volta rispettivamente dalla fase di accrescimento del soggetto e dalla sua
condizione metabolica.
In un soggetto adulto e sano il fabbisogno giornaliero proteico è 1g/Kg/die.
In un soggetto sottoposto a stress moderato (intervento non complicato, neoplasia, malnutrizione)
è 1.2-1.8.
In un soggetto ipercatabolico (politraumatizzato, sepsi, ustione) è 3.1.
Per valutare il fabbisogno proteico giornaliero del paziente bisogna misurare il bilancio azotato
giornaliero: è la differenza tra l’apporto di azoto (dieta, nutrizione atificiale) e la perdita di azoto
(urine, feci, desquamazione, caduta di peli e capelli).
Bilancio azotato positivo, indica anabolismo;
Bilancio azotato negativo, indica o scarso apporto o aumentata perdita delle proteine oppure
entrambe le cose.
Substrati nutrizionali disponibili per la nutrizione artificiale
Glucidi: glucosio, levulosio, sorbitolo, xilitolo, fruttosio; sono glucidi che vengono rapidamente
metabolizzati nel fegato a prescindere dall’insulina e sarebbero indicati in pazienti diabetici o
epatopatici, tuttavia se in eccesso causano acidosi metabolica per accumulo di ac. lattico.
Lipidi: si somministrano particelle formanti emulsioni lipidiche simili a chilomicroni, composte da
trigliceridi all’interno, assenza di apolipoproteine, elevato contenuto in fosfolipidi, elevata % di
acido linoleico e linolenico (ac. grassi essenziali). Le miscele di LCT (trigliceridi long chain)
provocano effetti immunodeprimenti. Le miscele di MCT vengono ossidate e metabolizzate
rapidamente, ma provocano acidosi metabolica. Di recente introduzione sono miscele miste in cui il
glicerolo veicola sia LCT che MCT, che sembrano meno tossiche.
Protidi: sono indispensabili per la crescita dell’organismo, riparazione delle ferite e conservazione
delle strutture cellulari e del patrimonio enzimatico. Si somministrano per e.v. come soluzione di aa
levogiri pronti ad essere metabolizzati. Inoltre a seconda della patologia in atto, si somministrano
miscele arricchite di determinati amminoacidi (ramificati per epatopatie, stati settici o politraumi,
essenziali per nefropatie, glutamina per enteropatie). La glutamina ha anche un effetto trofico sulla
mucosa intestinale e riduce la traslocazione batterica.
PATOGENESI DELLA DENUTRIZIONE
Digiuno
Graduale perdita di tessuto adiposo, il muscolo è relativamente risparmiato.
Durante il digiuno si ha una diminuzione dell’insulinemia con lipolisi e mobilizzazione delle riserve
lipidiche di acidi grassi liberi, glicogenolisi, liberazione di amminoacidi muscolari. L’alanina che
proviene dal catabolismo muscolare è il principale substrato per la gluconeogenesi epatica. In
contemporanea si incrementa il release di glucagone che potenzia la lipolisi e la gluconeogenesi,
fino a consumare le riserve di glicogeno epatico per garantire la copertura del fabbisogno energetico
immediato (in meno di 24 ore le riserve epatiche di glicogeno si esauriscono). Se il digiuno si
protrae si ha chetogenesi con produzione di corpi chetonici utilizzabili da cervello e rene come
fonte energetica. Ciò comporta riduzione del catabolismo proteico muscolare (perciò il muscolo è
solo relativamente intaccato).
Trauma, sepsi, ustione: la massa muscolare diminuisce.
Vi è una accelerazione del catabolismo proteico e della gluconeogenesi. Dunque un incremento
della richiesta di energia e della mobilizzazione e utilizzazione dei substrati proteici, lipidici,
glucidici.
L’aumento della richiesta di energia e substrati è dovuto alla produzione abnorme di proteine della
fase acuta quali PCR, ceruloplasmina, α1 glicoproteina acida, fibrinogeno, aptoglobina. Una
richiesta che viene soddisfatta a spese della massa proteica.
NUTRIZIONE PARENTERALE
La nutrizione parenterale consiste nella somministrazione di nutrienti direttamente per via venosa,
scavalcando l'apparato digerente.
Indicazioni: quando l’alimentazione per os o la nutrizione artificiale enterale non sono
possibili.
1. Pazienti che non possono alimentarsi per os:
•
•
•
•
ostruzioni del primo tratto del tubo digerente che impediscono il transito alimentare quali
stenosi neoplastiche, infiammatorie, traumatiche o funzionali;
occlusione intestinale distale non immediatamente operabile;
gravi malformazioni del tubo digerente (pancreas anulare, atresia intestinale);
coma protratto.
2. Paziente che non devono alimentarsi per os
•
•
•
•
Crohn o RCU, per ottenere un riposo intestinale che contribuisce al superamento
dell’episodio acuto;
pancreatite acuta, per ridurre la secrezione esocrina e la stimolazione pancreatica indotta
dalla distensione gastrica;
fistole entero-cutanee e pancreatiche, si elimina il transito intestinale e si diminuisce la
produzione dei succhi digestivi, consentendo di ottenere la guarigione della fistola se la
fistola non è neoplastica;
gastroenterite acuta e cronica dell’infanzia con diarrea intrattabile.
3. Pazienti che non vogliono alimentarsi
• anoressia mentale;
• anoressia secondaria a radioterapia o chemioterapia;
4. Pazienti che non si alimentano a sufficienza
•
•
•
sindrome da intestino corto (che consegue a una resezione intestinale massiva), il paziente
ha una scarsa capacità di assorbimento che non riesce a soddisfare il suo fabbisogno
calorico-proteico giornaliero;
ipercatabolismo intenso (trauma, sepsi, ustione), rifornisce energia e substrati contrastando
l’ipercatabolismo;
MICI croniche;
La nutrizione parenterale può essere parziale o totale.
La nutrizione parenterale totale è la somministrazione per ev. di tutti i principi nutritivi (calorie,
amminoacidi, vitamine, elettroliti, oligoelementi), in quantità sufficienti a sopperire al fabbisogno
per un periodo di tempo prolungato.
Per la somministrazione della nutrizione parenterale sono utilizzabili 3 vie di infusione:
•
catetere venoso centrale diretto:
l’accesso è attraverso la v. giugulare interna o la v. succlavia e l’estremità del catetere
deve raggiungere la v.cava superiore. L’infusione venosa centrale permette di
somministrare una nutrizione parenterale formata da una soluzione iperosmolare a elevato
contenuto calorico. Infatti queste soluzioni per essere tollerate devono essere infuse in una
vena ad alto flusso, che ne permetta la rapida diluizione nel sangue in modo da evitare
lesioni endoteliali.
Nel caso in cui è necessaria una NPT a lungo termine (più di 2-3 mesi) si utilizza un
catetere venoso centrale a permanenza tipo Broviac, che va tunnelizzato nel sottocute
oppure un port (sistema infusivo totalmente impiantato in sottocute collegato a un catetere
tunnelizzato);
•
catetere venoso centrale con accesso periferico.
•
via venosa periferica:
l’accesso è attraverso una vena superficiale del braccio ma non permette l’infusione di
soluzioni fortemente ipertoniche, tuttavia c’è un escamotage e cioè quello di utilizzare
soluzioni glucosate al 10% (moderatamente ipertoniche) unitamente ad emulsioni lipidiche
isotoniche al 10% e questo permette di arrivare fino a più di 1000 Kcal/die cambiando
accesso venoso ogni 2-3 gg.
La nutrizione parenterale periferica è indicata nel periodo postoperatorio e consente di
coprire parzialmente il fabbisogno calorico per 1-2 settimane. Qualora sia necessaria una
nutrizione parenterale per tempi più lunghi, si utilizza l’accesso venoso centrale.
Complicanze tecniche della nutrizione parenterale (sono quelle degli accessi venosi):
•
•
•
•
•
•
•
•
•
pneumotorace, per una puntura accidentale della cupola pleurica in vicinanza della v.
succlavia;
malposizionamento, se il catetere non giunga alla sede di posizionamento ma rimanga
in v. giugulare interna (edema faringe o collo), o imbocchi la v. ascellare controlaterale o
la v. succlavia controlaterale;
puntura arteria succlavia, comparsa di sangue a getto e intermittente, in genere è una
piccola breccia che può essere dominata dalla compressione esterna;
emotorace, in caso di lesione vascolare;
idrotorace;
idromediastino;
embolia gassosa, durante la fase di incannulamento della vena centrale o se dovessero
disconnettersi i raccordi lungo la linea infusionale.
trombosi venosa, è dovuta a: stasi venosa, ipercoagulabilità, lesioni della parete vasale
per ripetuti tentativi di incannulamento.
lesioni vasi linfatici, plesso brachiale, nervo frenico.
Complicanze da malfunzionamento o cattiva manutenzione del catetere venoso centrale:
• sfilamento accidentale;
• ostruzione da coaguli di fibrina o lipidi;
• rottura;
• annodamento intravascolare
;
• sepsi, è molto frequente e i germi possono colonizzare il catetere per via
endoluminale in caso di contaminazione dei contenitori o delle soluzioni infuse, per
via transcutanea in caso di migrazione al punto di inserzione del catetere, per via
ematica in caso di setticemia. Va sospettata quando compare febbre intermittente
dopo aver escluso altri possibili focolai di infezione.
Complicanze metaboliche
Glucidi
In eccesso: iperglicemia, glicosuria, diuresi osmotica, disidratazione, acidosi metabolica con chetosi
e coma iperosmolare.
In caso di somministrazione di quantità che superano il fabbisogno ma non eccessivamente →
steatosi epatica, ittero.
In caso di interruzione improvvisa di un’infusione protratta di glucosio (provocano iperinsulinismo)
→ ipoglicemia.
Amminoacidi
In caso di sovraccarico → aumento della loro escrezione urinaria e aumento della secrezione acida
gastrica.
Lipidi
Reazioni di ipersensibilità (ipertermia, vomito, brivido)
In caso di eccesso prolungato → alterazione degli indici funzione epatica e ittero reversibili dopo
sospensione.
NUTRIZIONE ENTERALE
Indicazione della nutrizione enterale:
•
•
•
patologia ostruttiva del primo tratto del tubo digerente (orofaringe, esofago, stomaco)
che sia superabile da sondino;
supporto nutrizionale pre-operatorio del paziente denutrito;
supporto post-operatorio di complicanze (deiscenza di anastomosi del tubo digerente,
sindrome intestino corto, fistole digestive, stenosi intestinali postoperatorie, neoplasie
addominali;
E' sempre preferibile alla NP perché la via enterale è più sicura. E' necessario che il tubo digerente
sia funzionalmente integro nel tratto a valle dell’estremità del sondino.
Vie di infusione
1. Sondino naso-gastrico: quando il tubo digerente a valle dell’esofago è integro dal punto di
vista anatomo-funzionale e in caso di neoplasie stenosanti di testa-collo o esofago che
possono essere valicate dal sondino, disturbi gravi di masticazione o deglutizione,
malnutrizione, pazienti in coma, ustionati gravi e politraumatizzati.
2. Sondino naso-digiunale: paziente in coma in cui vi è rischio di aspirazione della dieta dallo
stomaco e polmonite ab ingestis, gastroresecati, gastrodigiunoanastomosi.
3. Faringostomia: introduzione del sondino nel faringe attraverso una incisione cutanea
cervicale, quindi la punta va fatta arrivare nello stomaco.
4. Gastrostomia: stenosi serrata (faringea o esofagea) che non consente il passaggio del
sondino.
5. Digiunostomia: gastrectomia totale o duodenocefalopancreasectomia, malattie gastriche o
duodenali che non permettono di utilizzare tali sedi per infondere una dieta enterale.
Lo stomaco è un reservoir ideale perché è in grado di sostenere flussi elevati (fino a 60-100 ml
/ora) senza determinare dispepsia, diarrea, dolore addominale.
Le diete sono preconfezionate in sacche sterili e dal piccolo volume (< 1 Lt) per prevenire la
crescita batterica.
Le pompe di infusione hanno un sistema di allarme per segnalare ostruzione / esaurimento della
dieta
DIETE ENTERALI
•
polimeriche, miscele in sospensione, contenenti molecole polimeriche integre e allo stato
naturale. Sono indicate nei normometabolici.
•
elementari, miscele contente i principi nutritivi nella forma molecolare più semplice e
direttamente assorbibili. Sono indicate nei paziente con deficit di assorbimento intestinale o
per ridurre al minimo la produzione di scorie come in caso di Crohn ed enteriti
•
carboidrati: tutta la gamma dei glucidi, mono-,di-,oligo-,polisaccaridi in maltodestrine che
permettono una dieta più liquida e ad attività osmotica non eccessiva.
•
LCT: acidi grassi essenziali (linoleico, arachidonico), per il trasporto di vit. liposolubili
ADEK
•
MCT: da 6C a 12C, possono essere assorbiti direttamente dagli enterociti, anche in assenza
di lipasi pancreatica.
•
vitamine e oligoelementi
•
acqua : nell’adulto max 1,5 – 2 Lt/die tenendo conto che il fabbisogno di acqua aumenta in
caso di febbre, vomito, diarrea, sudorazione e fistole ad alta gittata.
Fase di induzione: per evitare le complicanze gastrointestinali si deve procedere in modo
progressivo, iniziando a somministrare al giorno 1 il 25% del fabbisogno giornaliero, e aumentando
poi la velocità di infusione in maniera progressiva, fino a raggiungere il pieno regime calorico al 24° giorno.
COMPLICANZE DELLA NUTRIZIONE ENTERALE:
•
•
•
•
•
•
•
•
diarrea, è la più frequente e può essere dovuta a un'eccessiva velocità di infusione, a un
eccessivo carico osmolare, intolleranza al lattosio, contaminazione delle dieta;
nausea, sovradistensione intestinale, dolore addominale, si presentano nella fase di
induzione per poi attenuarsi;
rigurgito e vomito, possono provocare polmonite ab ingestis;
occlusione della via, in caso di dieta che solidifica per mancato lavaggio del sondino
(almeno 2 vv die);
fuoriuscita del sondino dallo stomaco o dalla via intestinale;
infiammazione della via nasale, faringea o esofagea dovute alla presenza del sondino;
iperglicemia;
iperazotemia e disidratazione, si verificano in caso di dieta ad elevato contenuto proteico,
perché le proteine vengono scisse formando una grande quantità di urea e se il carico
osmolare del rene è elevato si può arrivare alla disidratazione.
Giovanni De Carlo
Luca Formicola
Francesco Di Girolamo
ACCESSI VENOSI E SISTEMI IMPIANTABILI
ACCESSI VASCOLARI
Per accesso vascolare s’intende qualsiasi forma di cateterismo di vasi (sia venosi che arteriosi)
eseguito al fine di introdurre sostanze nel circolo ematico o per effettuare prelievi o indagini
strumentali.
Gli accessi venosi possono essere sia periferici che centrali:
- periferici (vene del braccio, mani, gambe, piedi)
- centrali (vene di calibro maggiore in succlavia, giugulare, ascellare, femorale).
L’indicazione ad utilizzare l’uno o l’altro accesso dipende da vari fattori:
• conformazione anatomica del paziente (adiposità, fragilità vasale);
• situazione d’urgenza;
• tipo di terapia da somministrare (sostentamento post-operatorio, chemioterapia,
nutrizione parenterale totale in pazienti defedati).
Le vene periferiche possono essere punte tramite:
• aghi normali
• aghi a “farfalla” (Butterfly)
• agocannule
Questi sistemi sono sicuramente poco traumatici, ma non permettono di essere utilizzati per molto
tempo per la probabilità di infettarsi e per quella di “uscire fuori vena”.
Le vene centrali vengono punte con aghi normali di calibro più grosso.
ACCESSI VENOSI CENTRALI
L’accesso venoso centrale implica la puntura di una vena di grosso calibro, non visibile, e non
palpabile, ma localizzabile attraverso reperi anatomici ossei, vascolari o muscolari reputati costanti
in tutti gli individui.
In pratica sono accessibili 4 grossi vasi:
•
•
•
•
vene giugulari
vene succlavie
vene ascellari
vene femorali
La tecnica più usata, utilizza il metodo di SELDINGER con un introduttore metallico che fa da
guida al catetere.
Indicazioni dell'accesso venoso centrale
• Impossibilità di accesso venoso periferico o perdita dello stesso
• Somministrazione di soluzioni irritanti per via venosa periferica
• Nutrizione parenterale totale
• Monitoraggio emodinamico o stimolazione cardiaca temporanea
• Emodialisi (in caso di urgenza)
Controindicazioni assolute: infezione nella sede di puntura.
SEDE D'ACCESSO E CONTROINDICAZIONI SPECIFICHE
V. giugulare interna, salvo se sede d'intervento, di trombosi, in pazienti con collo tozzo, in
mancanza di riferimenti topografici, coagulopatia.
V. succlavia, salvo in caso di deformità, trombosi venosa.
V. femorale, salvo in obesità, trombosi, incontinenza urinaria.
V. ascellare, salvo in caso di lunga permanenza (maggiore 48 ore).
ACCESSO VENOSO GIUGULARE INTERNO
La giugulare interna è la vena principale del collo esce dal cranio attraverso il foro lacero posteriore
dietro la carotide interna, decorre lateralmente alla carotide (vago medialmente) termina dietro
l’articolazione sternoclavicolare con la confluenza con la succlavia, nel tratto terminale decorre in
mezzo al triangolo di Sedillot (i cui lati sono rappresentati dai capi sternale e clavicolare del
muscolo sterno-cleido-mastoideo e la cui base è la clavicola).
Tecniche:
•
Vie posteriori:
• Via di Jernigan.
•
Vie assiali denominate tali perché l’incannulazione avviene secondo l’asse del vaso:
• Via di Daily.
• Via di Miller variante della precedente ma molto usata: testa ruotata
controlateralmente, la puntura si effettua all’apice del triangolo di Sedillot e l’ago si
dirige verso il capezzolo omolaterale seguendo marginalmente il capo sternale del m.
sternocleidomastoideo, la vena si raggiunge 2-3 cm di profondità.
•
Vie anteriori
• Via di Mostert
ACCESSO VENOSO SUCCLAVIO
Anatomia: nasce dalla vena ascellare al margine esterno della prima costa e termina dietro
l’articolazione sterno-claveare unendosi alla giugulare interna per formare il tronco venoso
brachiocefalico o anonimo.
Tecniche:
•
Accessi sottoclaveari:
• Via di Aubaniac o interna: è la più usata, pz supino con le braccia parallele al
corpo, dopo aver eventualmente posizionato sotto la spalla (omolaterale alla vena
prescelta) un cuscino che permetta di aprire l’angolo costo-clavicolare l’operatore si
posiziona a lato del paziente l’indice della mano libera si posiziona nella forchetta
sternale mentre il pollice si posiziona sul margine inferiore del terzo medio della
clavicola cosi da apprezzare il punto d’introduzione (1 cm sotto il margine inferiore
del III° medio della clavicola), la direzione e la profondità dell’articolazione sternoclavicolare. L’ago diretto verso l’interno mirando a passare tra il margine inferiore
della clavicola e quello superiore della prima costa dirigendolo verso il giugulo entra
nella vena tra i 2 e 5 cm;
• Accesso di Testart o via esterna.
• Accesso di Wilson o via mediana.
•
Vie sopraclaveari
• Via di Yoffa.
ACCESSO VENOSO ASCELLARE
Anatomia: nasce dalla vene basilica e si estende dal bordo inferiore del m. grande dentato al bordo
esterno della prima costa dove si continua con la vena succlavia.
Tecniche
• Via ascellare
Paziente supino con braccio in abduzione ed in rotazione esterna testa girata
omolateralmente, l’operatore (posizionato omolateralmente) reperta l’arteria ascellare, punta
l’ago nel solco ascellare seguendo il decorso della vena 1 cm sotto l’arteria;
• Via sotto-coraco-clavicolare
Paziente supino in trendelenburg di 15°, braccio omolaterale in abduzione di 45° e
avambraccio in estensione; 2 punti di repere, il primo 5 cm sotto l’apofisi coracoide, il
secondo 4° interno della clavicola il sito da pungere si trova all’intersezione dei due punti e
il bordo mediale del muscolo piccolo pettorale, la direzione verso l’intero all’indietro e in
alto (verso il 2° punto) a 2-3 cm di profondità si reperta la vena.
VANTAGGI E SVANTAGGI SECONDO LA SEDE D’IMPIANTO
VENA GIUGULARE INTERNA
Vantaggi:
1. Facile reperibilità
2. La posizione anatomica della vena permette al catetere di scendere più facilmente (sbocca subito
in cava superiore).
3. In caso di puntura accidentale dell’arteria carotide è più facile eseguire la compressione.
4. Minore rischio di stenosi e trombosi venosa rispetto alla succlavia.
Svantaggi / Complicanze
1. Possibiltà di puntura accidentale dell’arteria carotide.
2. La gestione della medicazione (adesione dei cerotti) è più scomoda per la presenza dei capelli o
della barba.
3. E’ meno accettata dal paziente perché meno bene si nasconde la medicazione sotto i vestiti.
VENA SUCCLAVIA
Vantaggi
• Facile reperibilità
• Permette una incannulazione a lungo termine
• Maggiore comfort per il paziente:
- risulta più comoda la gestione della medicazione
- la medicazione risulterà meno visibile perché coperta dai vestiti
Svantaggi
• Pneumotorace da puntura della cupola pleurica e conseguente introduzione di aria
• Emotorace per la lacerazione dell’arteria o della vena succlavia
• Embolia gassosa per aspirazione di aria nella vena
•
Aumentato rischio di stenosi e trombosi venosa.
VENA FEMORALE
Vantaggi
• E’ di largo calibro e superficiale
• Facilmente reperibile anche in un paziente in stato di shock.
• Assenza di complicanze mortali
Svantaggi
• Rischio aumentato di infezione per la presenza del catetere nell’area inguinale
maggiormente esposta alla crescita batterica.
• Notevole rischio di trombosi venosa profonda (TVP)
• Scarsa possibilità di mobilizzare il paziente.
• Poco gradita dal paziente
VENE DEGLI ARTI SUPERIORI
Vantaggi
• Assenza di complicanze gravi.
• Possibilità di posizionamento a letto del paziente anche da parte di un infermiere.
Svantaggi
• Necessità di patrimonio venoso integro.
• Maggiore rischio di mal posizionamento e di insuccesso al momento del posizionamento.
• Maggiore rischio di trombosi venosa.
TECNICA GENERALE
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
identificazione dei riferimenti anatomici
adeguata preparazione dell'operatore
preparazione del vassoio sterile con set dedicato, preparazione del kit CVC scelto
eventuale rasatura del sito d'iniezione, a cura di un collaboratore
disinfezione ampia della zona d'accesso prescelta
preparazione del campo sterile
anestesia locale del punto d'inserzione, con Lidocaina 1%
puntura con siringa montata ed aspirazione libera di sangue
rimozione della siringa, avendo cura di chiudere il cono dell'ago in sito per prevenire una
eventuale embolia gassosa
inserzione del filo a J nell'ago e progressione, che deve essere facile, nel lume venoso
all'avanzamento dell'ago, il paziente deve essere controllato per la presenza di eventuali
aritmie cardiache, nel qual caso ritireremo il filo a J di qualche centimetro
rimozione dell'ago, lasciando in sede il filo a J
inserimento del dilatatore venoso, avendo cura eventualmente di lubrificarlo con una goccia
di sol.fisiologica o d'anestetico residuo, con delicato movimento rotatorio, fino alla
profondità del sottocute
rimozione del dilatatore
inserzione del catetere venoso sul filo guida (verificare la fuoriuscita del filo guida
dall’estremità del catetere prima di introdurre lo stesso) ed introduzione fino alla profondità
prescelta
rimozione del filo guida prestando attenzione di tenere ben saldo il catetere in situ
•
•
•
•
•
raccordo del catetere con l'infusione (salina) e verifica del flusso libero
eventuale retrazione od approfondimento del catetere in caso di flusso ridotto
prova di reflusso, con recipiente infusore posto più in basso del vaso cannulato
fissaggio del catetere con punto e copertura sterile
richiesta di radiografia del torace per verificare il corretto posizionamento
Note tecniche
• In caso di tentativo infruttuoso ritirare l'ago completamente per reintrodurlo in altra
direzione.
• Dopo tentativi infruttuosi con un tipo d'approccio ritentare in altra sede preferibilmente
omolaterale, per evitare eventuale PNX bilaterale o ematomi da puntura arteriosa.
CONTROLLO RADIOLOGICO DEL POSIZIONAMENTO
Non si deve mai e per nessun motivo iniziare l'infusione di soluzioni iperosmolari senza aver
previamente controllato il posizionamento del catetere con una radiografia standard anteroposteriore e con una radiografia laterale del torace.
Nel radiogramma antero-posteriore si scorge facilmente il catetere nella sua parte esterna che si
proietta contro l'ambito polmonare. Non è necessario che la punta penetri nell'atrio in quanto è
sufficiente un posizionamento in vena cava per avere l'assicurazione che il flusso 'vorticoso' del
sangue permetta una diluizione istantanea delle soluzioni iperosmolari senza rischio di trombosi.
Il radiogramma laterale permette una più accurata delimitazione della punta del catetere che si vede
come una sottile traccia rettilinea che si disegna subito al davanti degli ili polmonari.
Il controllo laterale è particolarmente utile per evidenziare un eventuale posizionamento del catetere
nella vena toracica di dx.
COMPLICANZE DELLA CATETERIZZAZIONE VENOSA CENTRALE
Fallimento
Condizione rara ma esistente, non conviene mai ritentare per più di due volte sulla stessa sede se si
è punta un’arteria, in particolare, se è la carotide. Non pungere mai controlateralmente poiché
potrebbero insorgere gravi conseguenze se si pungessero entrambe le arterie.
Punture arteriose
Sono relativamente benigne in pazienti con una buona emostasi (cosa da verificare sempre prima di
effettuare la CVC) e quando si producono in una sede dove sia possibile effettuare una buona
compressione. In genere provocano un modesto ematoma. La puntura dell’arteria carotide se questa
è aterosclerotica con placche diffuse, è pericolosa.
Pneumotorace
Generalmente conseguente alla CV della succlavia e in minore frequenza alla CV della giugulare
interna, varia in base alle tecniche, aumenta nei soggetti con morfologia atipica (pz. cachettici,
obesi, enfisematosi), spesso compare in ritardo comparendo sul RX del giorno dopo in caso di
accessi problematici; di solito quando è di piccole dimensioni è ben tollerato e si autolimita, mentre
se di grosse dimensioni in paziente con insufficienza respiratoria o in paziente assistito con
respirazione meccanica può dare grossi problemi per cui va drenato. Importante in caso di
fallimento per la CV succlavia non si dovrebbe pungere controlateralmente prima che siano
trascorse alcune ore (e dopo avere effettuato un RX di controllo) a causa del rischio di
pneumotorace bilaterale.
Lesioni dei dotti linfatici
Generalmente ad essere interessato è il dotto toracico nella CV giugulare e succlavia soprattutto in
caso di ipertensione portale. La gravità è elevata per cui in tali casi bisogna ricorrere alla legatura
chirurgica.
Lesioni nervose
Sono benigne nel senso che oltre al forte dolore non lasciano postumi frequenti sia nella CV
giugulare che succlavia o ascellare, rare nella femorale.
Falsa via
E' una condizione frequente che però può essere facilmente e precocemente identificata prima
dell’incannulazione per la difficoltà all’aspirazione del sangue (che indica il reperimento del lume
vascolare) o difficoltà ad introdurre il mandrino metallico, in ogni caso dopo controllo RX si
evidenzia immediatamente.
Perforazione venosa
Altra condizione clinica grave, può presentarsi dopo apparente reperimento del lume vascolare, il
catetere può terminare in: tessuti molli, cavità naturali (versamento pleurico, mediastinico,
addominale), importante:
• non forzare mai l’introduzione del mandrino o del catetere se questi non penetra dolcemente
onde evitare appunto danni disastrosi alle strutture vascolari o vicine poiché probabilmente è
andato fuori lume o si è inginocchiato;
• verificare sempre prima del fissaggio la pervietà del cateterino con aspirazione mediante
siringa.
Perforazione cardiaca
Può avvenire nel decorso immediato o a distanza dal posizionamento di un CVC rigido sia perché
sia stato introdotto troppo profondamente o perché si sia rotto ed è migrato in posizione
intracardiaca. La complicanza è gravissima e spesso i segni ECG precedono l’arresto cardiaco
per cui bisogna fare molta attenzione
Embolia del catetere
E' una complicanza oramai scongiurata con l’avvento del metodo di Seldinger poiché oggigiorno
difficilmente il cateterino si può forare in superficie, tranne nei casi di ostruzione dello stesso e
tentativo di disostruzione a pressione effettuato da un inesperto operatore.
Embolia gassosa
Causata dall’aspirazione d’aria accidentale soprattutto per la CV della succlavia o giugulare.
Clinica:
• dispnea acuta
• rumore a ruota di mulino3 all’auscultazione
• nelle forme gravi si ha pure insufficienza cardiorespiratoria
• cianosi
• collasso cardiovascolare
• convulsioni fino al coma.
Nelle forme lievi si ha malessere leggero, dispnea lieve, piccola ipotensione, quadro clinico di un
TIA il tutto recede spontaneamente dopo qualche minuto o mezzora.
Manovre da effettuare:
• scintigrafia polmonare
3 Bianco
•
•
•
•
posizionare il paziente in Trendelenburg spinto per bloccare la bolla nell’apice del
ventricolo dx
aspirare l’aria mediante il catetere stesso (spostandolo temporaneamente in avanti)
somministrazione generosa di O2
ossigenoterapia iperbarica
Tromboflebite profonda su catetere
Inizialmente la sintomatologia è aspecifica con dolenzia all’arto da cui il vaso origina e febbricola
poi se la trombosi è totale si presenta il gonfiore al medesimo arto, febbre forte, dolore (un segno
specifico e precoce è la palpazione di un cordone doloroso a monte del catetere che indica la
presenza di una trombosi parziale). Bisogna effettuare subito un doppler dei vasi interessati e
un’angiografia che permette una precisa valutazione del danno e indica l’eventuale terapia
fibrinolitica. Ovviamente si deve rimuovere il CVC, somministrare anticoagulanti (iniziare con dosi
generose di eparina continuare con dicumarolici per diverse settimane).
Infezioni locoregionali e sistemiche
I meccanismi d’infezione sono: via periluminare (zona a minore resistenza soggetta a
colonizzazione cutanea; via endoluminare; crescita microbica sull’estremità vascolare del CVC (in
tal caso la provenienza dei batteri è un’altra); somministrazione di soluzioni di perfusione altamente
contaminate (condizione rarissima ma esistente).
Esistono delle varianti del classico catetere venoso centrale:
•
•
PICC (Peripherally Inserted Central Catheters)
Port-a-cath
PICC (peripherally inserted central catheter)
Catetere venoso centrale inserito perifericamente all’altezza del braccio (v.basilica) con l’aiuto di
ecoguida.
Venoso Centrale → il tubicino arriva in una vena centrale del torace: la Vena Cava Superiore.
Accesso periferico → per raggiungere la Vena Cava Superiore viene introdotto il catetere partendo
dalla vena del braccio.
È un sistema venoso a lungo termine, può cioè rimanere in sede fino ad un massimo di 6 mesi.
I vantaggi del PICC
• è un accesso venoso, in una vena di grosso calibro, che permette la somministrazione di
farmaci che se iniettati perifericamente potrebbero causare danni tessutali alla vena stessa;
• richiede una minima “manutenzione”;
• riduce il rischio di trombosi venosa centrale;
• consente libertà di movimento.
Controindicazioni:
• Nota o sospetta batteriemia o setticemia;
• Pregressa radioterapia sul sito di inserimento previsto;
• Pregressi episodi di trombosi venosa o interventi di chirurgia vascolare nel sito di
posizionamento previsto;
• Fattori locali in grado di prevenire l’adeguata stabilizzazione del dispositivo (eritemi, edemi,
eczemi…)
Complicanze
• attorcigliamento del tratto esterno del catetere (KinKing);
• piccola emorragia locale;
• infezioni;
• tromboflebite meccanica
• ostruzione del lume interno;
• traumi accidentali (es. strappi);
• errato fissaggio o posizionamento della medicazione del presidio.
Posizionamento
Il posizionamento avviene al letto del paziente, non serve il digiuno. È una procedura sterile che
viene eseguita nella sua stanza. Il catetere viene inserito nel terzo medio del braccio, sopra il
gomito, per garantire la massima mobilità. Esternamente sarà visibile il catetere con la medicazione
trasparente. Quando non viene utilizzato il PICC sarà coperto da una medicazione.
Utilizzo
L’accesso al catetere avviene tramite la connessione di siringhe, raccordi, deflussori e deve essere
fatta con il sistema Luer-lock connettendo a quest’ultima siringhe e/o raccordi in caso di prelievi,
deflussori in caso di infusioni farmacologiche.
Medicazione
La medicazione può, dopo addestramento, essere sostituita dal parente o da personale sanitario a
domicilio. La medicazione del PICC, salvo rimozione accidentale della stessa, deve essere sostituita
ogni 7 giorni.
Manutenzione → lavaggio del catetere
IL PICC deve essere lavato internamente:
•
•
•
al termine di ogni infusione (in caso di infusioni non continue);
al termine dei prelievi ematici;
una volta alla settimana in caso di utilizzo discontinuo.
Nei casi indicati occorre lavare il PICC con 20 ml di soluzione fisiologica. Nel lavaggio non è
necessario utilizzare soluzione eparinata.
PORT-A-CATH
I port sono dei sistemi definiti “Totalmente Impiantabili” poiché vengono inseriti completamente
in una tasca sottocutanea.
Sono costituiti da due componenti: un Catetere Venoso Centrale ed un piccolo dispositivo con
membrana di silicone.
Per comprenderne il funzionamento lo si potrebbe paragonare ad un “portaspilli”.
Con questo sistema, utilizzando aghi adeguati, si può accedere attraverso la cute al catetere senza
maneggiarlo, come invece accade per i cateteri Venosi Centrali (CVC), e, di conseguenza, viene a
diminuire il rischio di infezione.
Tecnicamente il port ha una forma circolare o ovale, con all’interno una camera chiusa in alto da un
tappo di silicone, circondata da un rivestimento di materiale biocompatibile (plastica, titanio),
aperta lateralmente nel punto dove il sistema si collega al catetere.
A seconda della finalità e della sede d’impianto:
•
Port-a-cath venoso: a livello toracico, anteriormente al piano costale (II spazio
•
•
•
•
•
intercostale);
PAS-port: braccio o avambraccio;
Port-a-cath arterioso;
Sistema Infusaid: in fossa iliaca, per l’infusione di chemioterapici distrettuali a livello
epatico o iliaco;
Port per terapia spinale: parete anteriore dell’addome, per terapie antidolorifiche.
Port-a-cath peritoneale: per le terapie endoperitoneali.
INDICAZIONI ALL'IMPIANTO
I port sono utilizzati in pazienti che hanno particolari esigenze di terapie a medio e lungo termine.
Vengono impiegati nel caso di:
• fragilità vasale o vene periferiche di difficile accesso;
• cicli di chemioterapia, per prevenire o superare i frequenti episodi di flebite e tromboflebite
legati ai farmaci;
• alimentazione artificiale, totale o parziale, effettuata con sacche parenterali, per evitare
l’immobilità del paziente e soprattutto le complicanze trombotiche.
TECNICA D'IMPIANTO
Il Port va impiantato in sala operatoria da un chirurgo esperto onde ridurre al minimo le possibili
complicanze specifiche.
In anestesia locale si incannula una vena di grosso calibro a livello toracico o al collo. Si preferisce
utilizzare la vena succlavia sotto clavicolare. La metodica utilizzata è quella di Seldinger.
Per inserire il port sotto la pelle, si confeziona una piccola “tasca” nella quale viene alloggiato il
dispositivo, una volta collegato al catetere. Il port viene suturato alla fascia del muscolo pettorale;
quindi si richiude il sottocute e la cute.
Se si incannula una vena distante dal posizionamento del port (es: la giugulare), il catetere deve
essere “tunnellizzato”, ovvero lo si deve fare passare sotto la pelle, creando un vero e proprio tunnel
sottocutaneo.
Ad intervento ultimato e dopo la rimozione dei punti, sul torace residuerà solo una piccola cicatrice.
Il PAS-port viene impiantato con tecnica simile a quella per il port-a-cath, con la sola differenza che
la vena viene identificata ed incannulata al braccio ed il port viene allocato in una tasca sottocutanea
nella parte interna del braccio.
RIMOZIONE DEL PORT: CAUSE
Il port può rimanere in sede anche per anni e non dare problemi se gestito in maniera corretta,
l’indicazione alla sua rimozione scaturisce dal suo mancato utilizzo o in caso di complicanze
specifiche quali infezione o ostruzione del sistema.
Le possibili complicanze vanno suddivise:
•
•
quelle legate all’incannulamento di una vena centrale (quindi comuni sia all’impianto di un
port-a-cath che al posizionamento di un CVC esterno);
quelle che dipendono dal confezionamento della tasca sottocutanea per allocare il port.
Le evenienze più temibili sono l’ostruzione e l’infezione del catetere o della tasca.
Ostruzione: si manifesta con la difficile infusione del farmaco o della NPT. Buona regola è lavare
il port ogniqualvolta lo si utilizza, a fine terapia e/o al momento della sostituzione della sacca per
nutrizione (con soluzione fisiologica) ed evitare, a meno che non sia il medico a richiederlo
esplicitamente, di effettuare prelievi attraverso il sistema. Se si osserva qualche ostacolo al deflusso
si deve prima eseguire una radiografia del torace per escludere complicanze legate al
posizionamento del catetere e quindi, se tutto rientra nella norma, si deve cercare di liberare il
catetere con infusione a pressione moderata di soluzione fisiologica, eventualmente eparinata.
Infezione: i segni clinici sono la febbre alta, con brivido scuotente che sale al momento
dell’infusione: va trattata con terapia antibiotica ed antifungina massiva, eventualmente in ricovero
ospedaliero. Anche la tasca o il tunnel attraverso cui passa il catetere si possono infettare: la pelle al
di sopra del serbatoio diventerà rossa, calda e dolente ed eventualmente, può comparire anche
materiale purulento.
Se non si riesce a risolvere il problema, bisogna espiantare il port ed attendere almeno una
settimana prima di reimpiantarlo all’altro emitorace.
Prevenire le complicanze infettive è relativamente semplice
Bisogna sempre sterilizzare accuratamente la cute prima di inserire l’ago come anche al momento
della sua rimozione; non si deve lasciare l’ago in sede per più di 5 giorni in caso di semplice terapia
infusiva e non più di 3 in caso di nutrizione parenterale (si è visto che quest’ultima predispone
maggiormente alle infezioni). In quest’ultimo caso, inoltre, si devono sostituire tutti i kit da
infusione ogni volta che si sostituisce la sacca.
Quando il port non viene utilizzato, è buona regola lavarlo almeno una volta al mese, infondendo
come minimo 50 cc di fisiologica.
Francesco Di Girolamo
TRAPIANTI DI ORGANO: PRINCIPI GENERALI
Si definisce trapianto la procedura di prelievo di cellule, tessuti od organi da un individuo e di
impianto in un individuo (ricevente) solitamente diverso dal donatore. Scopo di tale attività è quello
di rimpiazzare una funzione del ricevente ormai persa.
Classificazione
Secondo le caratteristiche donatore-ricevente si possono distinguere le seguenti modalità di
trapianto:
• trapianto autologo (autotrapianto): cellule, tessuti od organi prelevati da un individuo
vengono trapiantati a lui stesso (per es. trapianto di cute per riparare estese perdite di
sostanza);
•
trapianto singenico (isotrapianto): si realizza tra due individui geneticamente identici;
•
trapianto allogenico (allotrapianto): si realizza tra due individui geneticamente diversi ma
appartenenti alla stessa specie;
•
trapianto xenogenico (xenotrapianto): si realizza tra individui appartenenti a due specie
diverse.
In base al sito di impianto i trapianti vengono distinti in:
• trapianto ortotopico: l´organo viene a essere posizionato nella sua normale sede anatomica
(per es. il fegato), previa eliminazione dell´organo malato;
•
trapianto eterotopico: l´organo viene posizionato in una sede diversa (per es. il rene che
viene posizionato in fossa iliaca anastomizzando i vasi renali con i vasi iliaci).
Immunobiologia del trapianto
Rigetto
È la conseguenza della normale attività di difesa operata dal sistema immunitario dell´individuo nei
confronti della penetrazione di agenti estranei alla sua costituzione e potenzialmente ostili. Esistono
sostanzialmente due linee di difesa: l´immunità umorale e l´immunità cellulare. La prima è mediata
da anticorpi prodotti dai linfociti B, la seconda è operata dai linfociti T.
Un trapianto tra due individui appartenenti alla stessa specie ma geneticamente diversi
(allotrapianto) viene rigettato dall´ospite in 7-10 giorni (rigetto primario). Un secondo trapianto tra
i due stessi individui viene rigettato entro 2-3 giorni (rigetto secondario), dimostrando la presenza
di memoria immunologica, una delle caratteristiche fondamentali dell´immunità acquisita.
La rapidità di inizio, il meccanismo immunologico coinvolto e, soprattutto, le caratteristiche del
quadro anatomo-patologico sono i criteri utilizzati per classificare la reazione di rigetto in iperacuta,
acuta e cronica.
Rigetto iperacuto
Avviene entro pochi minuti dalla rivascolarizzazione dell´organo trapiantato. Consiste nella rapida
occlusione trombotica del sistema vascolare dell´organo trapiantato. Da un punto di vista
fisiopatologico, il rigetto iperacuto è prodotto da anticorpi preformati che si legano all´endotelio
vascolare dell´organo trapiantato attivando il sistema del complemento. I componenti attivati del
complemento e il danno endoteliale innescano il sistema della coagulazione con conseguente
trombosi, ischemia e necrosi dell´organo trapiantato. Gli anticorpi preformati o naturali sono
probabilmente una risposta ad antigeni polisaccaridici espressi dai batteri che colonizzano l'apparato
digerente.
Gli anticorpi naturali sono generalmente rivolti contro gli antigeni di gruppo sanguigno AB0 o del
sistema maggiore di istocompatibilità MHC.
Il problema del rigetto iperacuto dovuto ad anticorpi anti AB0 è stato risolto selezionando il
ricevente compatibile con il donatore per il sistema AB0.
Gli anticorpi contro le molecole MHC possono comparire in seguito a trasfusioni di sangue, ripetute
gravidanze o precedenti trapianti. L´esecuzione di un test in grado di rilevare la presenza nel siero
del ricevente di anticorpi capaci di lisare i linfociti del donatore (cross-match) permette di evitare il
rischio del rigetto iperacuto.
Il rigetto iperacuto è il meccanismo specifico di distruzione di uno xenotrapianto e rappresenta a
tutt'oggi l´ostacolo principale all´impiego nell´uomo di organi provenienti da animali.
Rigetto acuto
In base al quadro anatomo-patologico distinguiamo: il rigetto acuto vascolare e il rigetto acuto
cellulare.
•
Rigetto acuto vascolare. È caratterizzato da necrosi fibrinoide di arterie e arteriole.
Questa forma di rigetto è mediata da anticorpi IgG rivolti contro gli alloantigeni delle
cellule endoteliali.
•
Rigetto acuto cellulare. È caratterizzato dalla presenza di un importante infiltrato cellulare
linfocitario e macrofagico che interessa il parenchima dell´organo trapiantato e da necrosi
parenchimale.
Diverse evidenze sperimentali indicano come effettore della lisi delle cellule allogeniche, la
sottopopolazione dei linfociti T citotossici (CTL), caratterizzati dall´espressione della proteina di
membrana CD8. L´attivazione dei linfociti citotossici avviene a opera di un´altra sottopopolazione
di linfociti T, detti helper, che si caratterizzano per l´espressione di CD4.
I CD4 del ricevente sono allertati da particolari cellule contenute nell´organo trapiantato
denominate APC (Antigen Presenting Cells), che migrano nelle sedi della risposta immunitaria del
ricevente dopo la rivascolarizzazione dell´organo. Le comunicazioni tra le cellule coinvolte nella
risposta immunitaria avvengono grazie alla produzione di citochine (soprattutto IL-2 e IL-4).
La distruzione della cellula bersaglio a opera del linfocita citotossico avviene attraverso due vie: la
liberazione di granuli contenenti "perforina" e l´attivazione di enzimi capaci di degradare il DNA
nucleare della cellula bersaglio.
Le citochine prodotte dai linfociti T CD4+ e CD8+ modificano le caratteristiche di superficie delle
cellule endoteliali rendendole in grado di reclutare monociti dal torrente circolatorio, che vengono
così indirizzati verso il sito di esposizione dell´antigene allogenico.
Il monocita, in presenza di citochine (soprattutto IFN-), si trasforma in macrofago attivato che
elimina l´antigene (reazione dell´ipersensibilità ritardata).
Rigetto cronico
Può essere successivo a un episodio di rigetto acuto, ma può anche insorgere senza essere preceduto
da un evidente episodio acuto. È caratterizzato dalla progressiva fibrosi dell´organo che perde la
propria normale architettura. Può essere il risultato dei fenomeni di riparazione successivi alla
necrosi cellulare provocata dal rigetto acuto.
La fibrosi potrebbe essere la conseguenza di un´attivazione di macrofagi, che libererebbero fattori
di crescita per le cellule mesenchimali, o la risposta all´ischemia cronica provocata dall´alterazione
del distretto circolatorio dell´organo trapiantato. È molto comune il reperto di occlusione vascolare
dovuta alla proliferazione delle cellule muscolari della tonaca intima (arteriosclerosi accelerata).
Malattia da reazione del trapianto verso l´ospite
È una forma particolare di rigetto in cui cellule immunocompetenti (linfociti T) del donatore,
contenute nell´organo trapiantato, aggrediscono i tessuti del ricevente. Si tratta di una
caratteristica complicanza del trapianto di midollo, ma può presentarsi anche dopo il trapianto di
altri organi, specie se il ricevente è stato sottoposto a pesante immunosoppressione.
Valutazione preoperatoria della compatibilità
Il grado di risposta immunitaria del ricevente svolge un ruolo fondamentale per la riuscita di un
trapianto. Ai fini di diminuire il rischio e l´intensità del rigetto è fondamentale ottenere il migliore
abbinamento possibile donatore-ricevente.
Le indagini pretrapianto sono volte a ottimizzare i seguenti parametri:
• compatibilità del gruppo sanguigno AB0 che permette di evitare il rischio del rigetto
iperacuto legato alla presenza di anticorpi naturali preformati IgM;
•
assenza di anticorpi preformati diretti verso le cellule del donatore (cross-match);
•
compatibilità HLA. Più elevato è il numero di alleli HLA-A e B (almeno 4 antigeni in
comune) condivisi tra donatore e ricevente, maggiore è la sopravvivenza del trapianto.
Prevenzione e terapia del rigetto
A causa dell´elevato polimorfismo degli alleli del sistema MHC, le combinazioni possibili degli
antigeni HLA sono praticamente infinite e, quindi, la probabilità di trovare, al di fuori della cerchia
costituita dai fratelli, due individui identici per il sistema MHC è praticamente inesistente.
La possibilità di ottenere la sopravvivenza di un allotrapianto è legata quindi alla capacità di
prevenire o far regredire la naturale reazione del sistema immunitario alla penetrazione di antigeni
riconosciuti come estranei.
Esistono diverse strategie di trattamento del ricevente che rendono possibile contrastare la reazione
di rigetto.
Le due più importanti sono:
• l´immunosoppressione;
•
l´immunomanipolazione.
Immunosoppressione
Rappresenta la procedura più comunemente usata di trattamento del paziente trapiantato. Lo scopo
principale è quello di prevenire lo sviluppo del rigetto. Il rischio di rigetto acuto è particolarmente
elevato nelle prime settimane dopo il trapianto e tende ad attenuarsi con il tempo. Nel lungo periodo
si può manifestare una forma più insidiosa, e non ancora completamente compresa nei meccanismi
fisiopatologici, di rigetto definito cronico che distrugge progressivamente l´organo trapiantato. La
reazione di rigetto è contrastata dalla somministrazione di farmaci che intervengono in differenti
fasi della risposta immunitaria. Si preferisce la somministrazione contemporanea di più farmaci allo
scopo di inibire efficacemente il sistema immunitario con i minori effetti collaterali possibili. Non
esistono schemi fissi di terapia e ogni centro trapianti si regola secondo la propria esperienza.
Esistono comunque principi di carattere generale.
Innanzitutto i protocolli di immunosoppressione prevedono di articolare la terapia in due fasi.
La prima, detta di "induzione", viene effettuata nelle prime due settimane e prevede la
somministrazione di alte dosi di steroidi, ciclosporina o FK506 (tacrolimus) e azatioprina.
La seconda fase, detta di "mantenimento", ha l´obiettivo di evitare l´insorgenza di episodi acuti di
rigetto. Anche per questa seconda fase esistono consuetudini tipiche di ogni centro, ma si possono
individuare alcune linee guida. Il cardine farmacologico della terapia immunosoppressiva è
rappresentato dall´utilizzo della ciclosporina o, alternativamente, dell´FK506 in associazione a
basse dosi di steroidi e azatioprina. Tuttavia esiste attualmente un´evoluzione nel trattamento
immunosoppressivo che prevede l´uso per brevi periodi di tempo di cortisone e la sostituzione
dell'azatioprina con il micofenolato.
L´eventuale episodio di rigetto richiede l´instaurarsi di una terapia antirigetto che si basa
soprattutto sull´utilizzo in prima battuta di alte dosi di metilprednisolone somministrato per via
endovenosa.
L´inefficacia di questo provvedimento terapeutico rende necessario il ricorso ai sieri policlonali o
monoclonali (OKT3) diretti contro i linfociti.
Effetti collaterali dell´immunosoppressione
La prevalenza di neoplasie in pazienti sottoposti a trapianto di rene è compresa tra il 5 e il 16%,
rappresentando un valore significativamente maggiore di quello trovato nella popolazione non
trapiantata di pari età. Il 60% dei tumori è costituito da neoplasie della cute, della labbra, del collo
dell´utero e, soprattutto, linfomi.
Circa l´80% dei pazienti sviluppa almeno un episodio infettivo dopo il trapianto. Il 40% delle cause
di morte dopo il trapianto è dovuto a complicanze infettive. Agenti eziologici sono batteri nel 55%
dei casi, virali nel 33% (herpes virus, citomegalovirus, herpes simplex virus, Epstein-Barr virus,
varicella-zoster) e fungini nel 15% (Candida albicans, Aspergillus fumigatus, Pneumocystis
carinii). Le sedi più soggette a infezione sono le vie urinarie, la ferita chirurgica, l'addome e i
cateteri intravenosi.
Immunomanipolazione
Dal punto di vista sperimentale è stato ormai dimostrato che il trapianto simultaneo di midollo
osseo e di cellule, tessuti od organi provenienti dallo stesso donatore è in grado di indurre tolleranza
al trapianto.
Questo settore della ricerca trapiantologica ha preso avvio dopo la documentazione dell´esistenza di
un passaggio di cellule APC dall´organo trapiantato al ricevente. Il fenomeno è direttamente
proporzionale alle dimensioni dell´organo o alla quantità di midollo osseo trapiantato. Le APC sono
in grado di crescere di numero nel ricevente fino a creare una popolazione linfocitaria mista
donatore-ricevente (chimerismo) innescando una serie di fenomeni responsabili dell´accettazione
permanente dell´organo senza la necessità di nessuna terapia immunosoppressiva.
DONATORI
• Larga parte da cadaveri;
• Donatore vivente (rene, fegato)
Per quanto riguarda i donatori cadaveri deve essere presente morte cerebrale accertata da un
collegio medico composto da un medico legale, da un anestesista-rianimatore, da un
neurofisiopatologo oppure un neurologo esperto in EEG. Quando si presenta un paziente in stato di
incoscienza causato da una presunta morte cerebrale, si deve avvisare la direzione sanitaria che
provvederà a nominare il collegio medico. La morte viene dichiarata in caso di arresto cardiaco con
ECG piatto per almeno 20 minuti oppure se durante il periodo di osservazione (variabile da un
minimo di 6 ore ad un massimo di 24 ore a seconda delle caratteristiche del paziente) si verifichino
contemporaneamente queste 3 condizioni:
• stato di incoscienza;
•
•
assenza dei riflessi del tronco cerebrale e del respiro spontaneo;
silenzio elettrico cerebrale.
A queste 3 condizioni va aggiunto l'assenza di flusso cerebrale in alcuni sottogruppi di pazienti:
• bambini d'età < 1 anno;
• paziente sotto l'effetto di depressori del SNC;
• ipotermia;
• alterazioni endocrino-metaboliche.
Viene dichiarata la morte cerebrale se le 3 (o 4) condizioni si verificano ad inizio, metà e fine del
periodo di osservazione.
VALUTAZIONE CLINICA DEL DONATORE
• Possibilmente < 60 anni;
• No precedenti neoplasie (eccetto alcune del SNC);
• No infezioni batteriche, virali o micotiche;
• No Ab anti-HIV;
• No diabete mellito, ipertensione arteriosa, vasculopatie;
• No ischemia prolungata.
PRELIEVO MULTIORGANO DAL CADAVERE
• Incisione giugulare-pubica con sternotomia;
• Isolamento dei principali vasi venosi ed arteriosi degli organi che devono essere prelevati;
• Aorta e cava chiuse distalmente ai vasi renali;
• Introduzione di un catetere nell'aorta per la conservazione degli organi;
• Infusione nelle coronarie di una soluzione cardioplegica a 4°C che ne determina l'arresto;
• Perfusione degli organi addominali con soluzione fredda;
• Con l'arresto dell'attività cardiaca, inizia il periodo di “ischemia fredda”;
• L'ischemia fredda termina alla rivascolarizzazione dell'organo dopo il reimpianto;
• L'assenza di ossigeno determina l'arresto dei processi metabolici cellulari compresa la
pompa sodio-potassio → edema cellulare.
• Il cuore dev'essere trapiantato entro 4 ore dall'espinato;
• Il rene può essere trapiantato con successo anche dopo 24 ore.
TRAPIANTO DI FEGATO
PRINCIPALI INDICAZIONI
• Insufficienza epatica acuta (virale, tossica…)
• Cirrosi epatica (virale, alcolica, autoimmune)
• Malattie colestatiche croniche (cirrosi biliare, colangite sclerosante)
• Epatocarcinoma (in assenza di invasione vascolare o malattia extra-epatica)
• Malattie metaboliche (Deficit di α-1-antitripsina, Malattia di Wilson, fibrosi cistica, S. di
Crigler-Najar).
CONTROINDICAZIONI ASSOLUTE
• Età > 65 anni
• Tossicodipendenza
• Infezioni in atto
• Alcolismo in atto
• Patologie psichiatriche gravi
• Neoplasie extra-epatiche.
CONTROINDICAZIONI RELATIVE
• Età > 60 anni
• Trombosi parziale o totale della vena porta
• Pregressi interventi vascolari o del distretto epatobiliare di ostacolo alla tecnica di trapianto
• HBV-DNA+
• HIV +
• Patologie extra-epatiche (insufficienza cardiaca, respiratoria, renale)
PROTOCOLLO DIAGNOSTICO PER IL TRAPIANTO DI FEGATO
• TC spirale con mdc ev e per os con fase arteriosa, venosa e calcolo del volume epatico
• Ecocolor Doppler addome e vasi epatici
• Ecocardiogramma
• EGDS e colonscopia
• HCV-Ab e se positivo HCV-RNA
• HBsAg e se positivo HBeAg, HBV-DNA, HDV-Ab
• Sierologia per CMV, EBV, HIV
• Test allergici cutanei
• Valutazione psichiatrica
• alfa-fetoproteina, CEA
• Ab anti-nucleo, anti-ribosomi, anti-mitocondri, anti-muscolo liscio, anti-tireoglobulina
• Scintigrafia ossea
I pazienti per essere iscritti alla lista dei trapianti devono avere un punteggio Child-Pugh > 7.
I criteri UNOS stabiliscono la priorità nell’assegnazione di un fegato.
Classe 1
• Insufficienza epatica fulminante
• Insufficienza epatica dopo trapianto di fegato – primary non function
• Trombosi arteria epatica
• Riceventi pediatrici (<18 a) con aspettativa di vita <7 gg
Classe 2A
Pazienti con cirrosi, punteggio Child ≥ 10, con emorragia intrattabile delle varici o encefalopatia
allo stadio III o sindrome epato-renale o ascite intrattabile.
Classe 2B
Pazienti con cirrosi, punteggio di Child ≥10 o pazienti con cirrosi, punteggio di Child ≥ 7 ed
emorragia recidivante delle varici o encefalopatia recidivante o sindrome epato-renale o peritonite
batterica spontanea
Classe 3: pazienti con cirrosi che necessitano di ricovero ospedaliero, Child ≥ 7
Ai criteri UNOS sono stati associati i criteri di MELD (Model for End Stage Liver Disease)
Valuta, in maniera più oggettiva, la sopravvivenza di pazienti con cirrosi ed insufficienza epatica
terminale. Si basa su:
• determinazione bilirubinemia
• INR
• creatinina
PER IL TRAPIANTO EPATICO
• Necessaria tipizzazione ABO
• Non indispensabile quella HLA
• Peso del donatore non deve superare del 10-20% quello del ricevente
VIE DI ACCESSO
•
•
Bisottocostale
Sottocostale destro prolungato verticalmente, sulla linea mediana, fino al processo xifoideo.
Epatectomia del fegato nativo → Impianto del fegato del donatore
Tempo 1: epatectomia
• Sezione dei legamenti del fegato
• Isolamento e clampaggio delle strutture vascolari epatiche e della via biliare
ESISTONO 2 TECNICHE PER IL TRAPIANTO
• Tecnica convenzionale
• Tecnica piggy-back
Epatectomia con tecnica convenzionale
• Clampaggio sopra- e sotto- epatico della V. cava
• Posizionamento di un by-pass veno-veno tra V. femorale sin, V. porta e V. ascella sin in
modo da decomprimere il sistema venoso splancnico e favorire il ritorno venoso dagli arti
inferiori
• Anastomosi T-T a livello della V cava sopra- e sottoepatica
• Anastomosi T-T della V porta
• Anastomosi T-T dell’A. Epatica
• Anastomosi biliare coledoco-coledocica su tubo di Kehr
• Se c’è discrepanza di calibro tra coledoco del donatore e del ricevente si può confezionare
una anastomosi bilio-digestiva.
Epatectomia con tecnica piggy-back
La tecnica convenzionale, largamente adottata da tutti i centri trapianti del mondo, presenta alcune
problematiche operatorie: uso del bypass veno-venoso, riduzione del flusso ematico renale,
instabilità emodinamica dovuta al clampaggio totale della vena cava, sanguinamento dal retro
peritoneo. Per ovviare a queste problematiche, maggiormente dovute al clampaggio totale della
vena cava, all’uso della circolazione extra corporea ed al sanguinamento peritoneale, è stata
applicata una nuova tecnica di trapianto definita“ piggy-back technique ”. Tale tecnica prevede
durante l’epatectomia la preservazione della vena cava nativa retro epatica, questo permette di
mantenere il ritorno venoso al cuore, di prevenire le alterazioni emodinamiche e di non utilizzare il
bypass veno-venoso. Tuttavia la Piggyback technique trova il suo tallone di Achille nella ostruzione
dell’efflusso sanguigno a livello della anastomosi venosa cavale-epatica. Per minimizzare il
problema dell’ostruzione dell’ efflusso ematico a livello dell’anastomosi cavale questa deve essere
confezionata su un’ostio il più ampio possibile, costruito mettendo insieme le tre vene
sovraepatiche. Questa tecnica appare ora la più fisiologica per minimizzare il problema
dell’ostruzione all’efflusso venoso e delle complicanze associate ad esso (ascite).
Monitoraggio post-trapianto
• Nei primi giorni: monitoraggio dei parametri vitali in terapia intensiva
• Terapia immunosoppressiva
•
•
•
•
•
•
Evitare complicanze settiche
Monitorare la funzionalità epatica
Indispensabile dosaggio ematico giornaliero della ciclosporina
Ecodoppler giornaliera dei vasi epatici nella prima settimana
Colangiografia trans-Kehr
Rimozione Kehr a 6 mesi dal trapianto dopo controllo radiologico
Complicanze post-trapianto epatico
Precoci
• Rigetto iperacuto o acuto
• Primary non-function
• Complicanze vascolari (trombosi dell'arteria epatica, vena porta, vena cava)
• Stenosi o deiscenza dell’anastomosi biliare
• Infezioni
Tardive
• Rigetto cronico
• Ripresa della malattia di base
• Infezioni
• Tumori post-trapianto
• Osteoporosi
• Nefropatia cronica da trapianto
Francesco Di Girolamo
TRAPIANTO DI RENE
Il trapianto renale è la migliore terapia (sostitutiva) per il paziente uremico. Il rene da trapiantare
può essere prelevato da un donatore vivente o cadavere.
DONATORE VIVENTE – criteri di selezione:
• consanguineità → in genere da genitori o fratelli;
• compatibilità ABO e HLA → per ridurre il rischio di rigetto immunologico;
• elevata motivazione → la donazione deve essere sempre spontanea;
• eccellenti condizioni cliniche;
• funzione renale normale.
Rischio di mortalità del donatore 0,1%
TIPIZZAZIONE DEL GRUPPO SANGUIGNO AB0
Viene sempre eseguita perché nessun trapianto può sopravvivere se esiste incompatibilità AB0 tra
donatore e ricevente.
TIPIZZAZIONE HLA
Tra donatore e ricevente è indispensabile l'identità o parziale identità. Tra genitore e figlio esiste
sempre una semi-identità con compatibilità del 50%. Tra due fratelli c'è una probabilità del 25% di
compatibilità completa, ma anche un 25% di incompatibilità incompleta.
HLA sono antigeni che inducono il rigetto e si dividono in 2 classi:
• HLA di classe I → sono espressi da tutte le cellule nucleate;
• HLA di classe II → sono espressi solo dalle APC e sono necessarie per la presentazione
dell'antigene ai linfociti CD4+ T helper.
La compatibilità degli antigeni HLA viene verificata con test sierologici oppure con PCR.
RICEVENTE
La selezione del ricevente deve avvenire sulla base delle seguenti caratteristiche:
• compatibilità immunologica col donatore;
• età (oggi il trapianto si può conseguire anche dopo i 65 anni);
• condizioni cliniche;
• malattia di base;
• fattori psicologici.
Ogni ricevente può ricevere il trapianto di un solo rene.
Patologie che rappresentano controindicazioni all'intervento chirurgico e/o alla successiva
terapia immunosoppressiva:
• ulcera peptica;
• malattie epatiche;
• malattie psichiatriche;
• tubercolosi in fase attiva;
• infezioni croniche.
Patologie che richiedono un trattamento chirurgico preliminare:
• grave reflusso vescico – ureterale;
• reni policistici di grandi dimensioni;
• patologie urologiche (ipertrofia prostatica);
• colelitiasi con colecistiti ricorrenti;
• diverticolosi del colon con diverticoliti ricorrenti.
PRELIEVO DEI RENI DAL DONATORE
Il prelievo dei reni è più semplice dal donatore vivente per due motivi:
• migliori condizioni del donatore vivente;
• disponibilità di esami strumentali (TAC – RMN – ANGIOGRAFIA) eseguiti in precedenza
che permettono al chirurgo di conoscere bene le condizioni anatomiche del paziente e il tipo
di vascolarizzazione del rene da prelevare.
Il prelievo del rene da donatore cadavere, è associato a quello di altri organi (per legge si vieta solo
il prelievo a scopo di trapianto di cervello e gonadi). Il rene viene prelevato per ultimo, per cui
l'ischemia renale dura più a lungo. Prima del prelievo, tutti gli organi devono essere lavati, cioè
liberati del sangue contenuto nei vasi mediante perfusione con soluzione salina contenente sostanze
protettive per le cellule.
Gli organi prelevati vengono spediti a centri di trapianto e conservati in contenitori contenenti
ghiaccio. E' anche possibile utilizzare una macchina che perfonde continuamente i reni con
soluzioni saline fredde.
I reni in ghiaccio si conservano fino a 24-36 ore.
ISCHEMIA CALDA – ISCHEMIA FREDDA.
Nel periodo di tempo compreso tra l'interruzione della circolazione del donatore e la ripresa della
circolazione nel ricevente, il rene deve affrontare due tipi di ischemia.
Un'ischemia calda, che comprende la somma dei tempi intercorsi:
• tra l'interruzione della circolazione renale nel donatore + il completamento delle procedure
di perfusione renale e raffreddamento del rene dopo il prelievo;
• e tra la rimozione del rene dal ghiaccio e il completamento dell'anastomosi vascolare
durante il trapianto, con cui riprende la perfusione ematica e l'ossigenazione del rene.
Un'ischemia fredda, che comprende il periodo di conservazione a freddo dopo il prelievo.
L'ischemia calda non deve superare i 40 minuti. L'ischemia fredda può essere protratta fino a max
24-36 ore. Onde evitare la comparsa di gravi alterazioni ischemiche che possono compromettere in
via transitoria o definitiva la ripresa della funzione renale.
INTERVENTO CHIRURGICO DI TRAPIANTO RENALE
Il rene da trapiantare viene sistemato in una delle due fosse iliache (trapianto eterotopico), a lato
della vescica, in sede extraperitoneale:
• perché l'uretere del donatore che viene trapiantato insieme al rene è corto;
• inoltre la protezione del rene trapiantato è fornita dalle ossa del bacino e la sua sede
superficiale ne permette la palpazione;
Per agevolare l'esecuzione dell'anastomosi arteriose e venose il rene sinistro viene trapiantato in
fossa iliaca destra e il rene destro in fossa iliaca sinistra. Dopo le anastomosi vascolari si effettua la
uretero-cistoneostomia, cioè l'anastomosi tra uretere del rene trapiantato e vescica del ricevente.
Si effettua un'incisione cutanea a livello sovra-inguinale (l'accesso xifopubico viene riservato ai casi
in cui si deve effettuare anche la nefrectomia nel ricevente). La vena renale viene anastomizzata
terminolateralmente alla vena iliaca esterna. L'anastomosi dell'arteria renale è di solito
termino-laterale con l'arteria iliaca interna; se questo vaso è compromesso viene utilizzata
l'arteria iliaca esterna. La via urinaria viene ricostruita mediante una ureterocistoneostomia con
tecnica antireflusso. Se l'uretere è molto breve si potrà effettuare una uretero-ureterostomia o una
pieloureterostomia.
J-stent: è un catetere a J posizionato tra uretere e vescica che serve per mantenere pervia la nuova
via urologica. Viene rimosso dopo alcuni giorni nel corso di cistoscopia.
COMPLICANZE
Chirurgiche
• Infezioni nella sede di intervento.
• Emorragie post – operatorie: ridurre il dosaggio di eparina;
Rottura del rene trapiantato, può aversi in caso:
• trauma;
• ischemia diffusa per trombosi arteriosa o venosa;
• rigetto iperacuto o acuto;
• terapia chirurgica: espianto.
Vascolari
• trombosi dell'arteria o della vena renale;
• stenosi dell'arteria renale:
• da angolazione o torsione;
• da errori tecnici nell'anastomosi;
•
da placche ateromasiche nell'arteria del ricevente o del
donatore;
Urologiche
• Leakage (stravaso di urine) dalla vescica o dall'uretere causato perlopiù da una fistola in
uretere distale provocata da necrosi ureterale conseguente ad una ridotta irrorazione;
• Ostruzione ureterale: è frequente nei primi giorni, è rilevabile ecograficamente come una
dilatazione a monte dell'ostruzione.
Infettive
Fattori predisponenti:
• immunodepressione terapeutica;
• insufficienza renale (uremia);
• diabete mellito;
• età avanzata;
• prolungato stazionamento di cateteri vascolari e urinari;
• stravasi urinari da lesioni renali o ureterali o vescicali.
Agenti etiologici
• nei primi due mesi prevalgono le infezioni batteriche della ferita chirurgica, delle vie
urinarie, polmoniti, sepsi;
• tra il secondo e il sesto mese prevalgono le infezioni virali (herpes virus, virus dell'epatite,
citomegalovirus) e le infezioni opportunistiche (pneumocisti carinii, listeria m., aspergilus e
altri funghi, TBC);
Gastrointestinali ed epatiche
• Emorragie gastrointestinali, sono potenzialmente letali:
• predisposizione a gastrite e ad ulcere:
• ipersecrezione acida da stress;
• ipercalcemia da iperparatiroidismo secondario;
• terapia corticosteroidea;
Neoplastiche
• Nei trapiantati l'incidenza di neoplasie aumenta.
• Neoplasie più frequenti:
• tumori cutanei:
• linfomi, soprattutto NH;
• sarcoma di Kaposi.
•
Fattori predisponenti:
• depressione del sistema immunitario;
• aumento della suscettibilità ad infezioni sostenute da oncovirus;
• oncogenicità di alcuni farmaci immunosoppressori (azotioprina soprattutto
causa alterazioni cromosomiche).
Ossee
Necrosi asettica della testa del femore: è causata dall'utilizzo cronico di corticosteroidi ad alte dosi.
Recidive della malattia renale primitiva
RIGETTO
Esistono differenti tipo di rigetto in base al tempo di insorgenza e ai meccanismi coinvolti e alle
caratteristiche anatomo-patologiche.
RIGETTO IPERACUTO
Il rene trapiantato diventa prima teso e rosa, per l'iperemia e poi diventa molle. La diuresi se
presente si arresta. La terapia immunosoppressiva è inefficace. È necessario ricorrere
immediatamente all'espianto chirurgico per evitare complicanze emorragiche da rottura del rene.
Per limitare il rischio di rigetto iperacuto è necessario prima del trapianto eseguire prove di
compatibilità:
• compatibilità AB0;
• cross – match : è una prova di compatibilità diretta degli antigeni HLA;
Il rischio di rigetto iperacuto è minimo se la compatibilità AB0 è completa e il cross-match è
negativo.
RIGETTO ACUTO
Si verifica tra 1 – 5 settimane dopo il trapianto. E' mediata da meccanismi immunitari di tipo
cellulare.
Clinicamente il rigetto acuto si manifesta con IRA non oligurica, asintomatica. Talora si manifesta
con oliguria.
Diagnosi: Ecocolordoppler e biopsia renale.
E necessario fare diagnosi differenziale con altre cause di IRA nel trapiantato:
•
NTA: nel 50% dei reni trapiantati non si ha ripresa immediata della funzione renale perché
si ha NTA, causata dall'ischemia conseguente al prelievo; in caso di NTA bisogna aspettare
fino a 3-4 settimane perché si abbia la restitutio ad integrum dell'epitelio tubulare e riprenda
la funzione renale;
•
nefrotossicità da ciclosporina
diagnosi differenziale difficile, perché non sempre i livelli del farmaco sono elevati e non
esiste un quadro clinico caratteristico.
RIGETTO CRONICO
E' una disfunzione cronica d'organo. E' caratterizzato da una compromissione della funzione del
rene trapiantato con lenta progressione verso l'IRC.
I meccanismi patogenetici coinvolti sono:
• immunologici: cioè una risposta immunitaria simile a quella coinvolta nel rigetto acuto, ma
più lenta e attenuata;
• non immunologici: nefrotossicità di alcuni farmaci anti-rigetto utilizzati.
Alterazioni istologiche:
• fibrosi interstiziale iniziale;
• ispessimento della parete dei vasi: causato da un processo di aterosclerosi accelerata.
Terapia:
• misure dietetiche e farmacologiche della IRC, fino a quando si rende necessaria la terapia
dialitica cronica;
• se è sospettata la nefrotossicità da ciclosporina, si tenta lo switch cioè la sostituzione con
altri farmaci immunosoppressori come la rapamicina.
Giovanni De Carlo