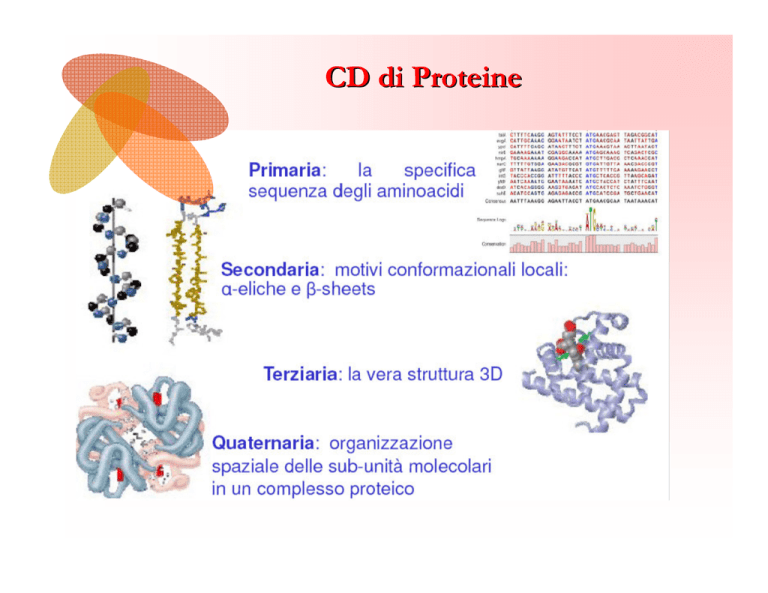
CD di Proteine
CD di Proteine
La struttura secondaria di una proteina può
esere determinata mediante spettroscopia
CD nella regione dell’UV-lontano
(190-250 nm).
L’attività ottica di una
proteina è principalmente
dovuta alla sua struttura
macromolecolare.
Spettro CD della poli-lisina
CD di Proteine
Lo spettro CD di una proteina nel lontano UV
può essere sensibile a certi aspetti della
struttura terziaria
A queste lunghezze d’onda i cromofori sono gli amino acidi aromatici e i legami
disolfuro.
I segnali CD nel lontano UV sono circa nulli, se una proteina conserva la
sua struttura secondaria ma non mantiene una struttura terziaria ben definita. Se
invece compaiono dei segnali in questa regione spettrale vi è chiara indicazione
che la proteina possiede una struttura tridimensionale definita.
Lo spettro CD nel lontano UV è anche sensibile a piccole modificazioni
della struttura terziaria dovute ed interazioni proteina-proteina.
Emoglobina
L’emoglobina è una proteina globulare
presente nei globuli rossi ed ha la funzione di
trasportare l’ossigeno nel sangue.
L’emoglobina è una proteina tetramerica
costituita da quattro catene polipetidiche
(subunità).
Nella molecola di emoglobina ciascuna
subunità lega un gruppo eme, di conseguenza
l’emoglobina può legare quattro molecole di
ossigeno.
Il gruppo eme dell’emoglobina è uguale a
quello presente nella mioglobina.
Eme: gr. cromoforo
Gruppo Eme
Gruppo Eme
Gruppo Eme
Gruppo Eme
Perché
Perché????
Emoglobina
Gli orbitali esterni conivolti nei legami dei metalli di
transizione sono quelli d
Nel compesso ottaedrico del Fe (II) nella emoglobina
i 5 orbitali d si scompongono in due set:
•2 obitali dx2-y2 and dz2 puntano lungo gli assi verso i
leganti
•gli altri 3 3 dxy, dxz, dxz puntano tra gli assi x,y,z e
non sono influenzati dalla repulsione con i leganti
Emoglobina
Differenza di energia
che corrisponde ad un
assorbimento di luce
Emoglobina
Deossiemoglobina
(alto spin)
spin)
Ossiemoglobina
(basso spin)
spin)
Emoglobina
Deossiemoglobina
(alto spin)
spin)
Ossiemoglobina
(basso spin)
spin)
CD di Proteine:
Studio della denaturazione
Le proteine possono essere denaturate in vari modi:
1.variando la temperatura,
2.variando il pH fino a condizioni estreme,
3.utilizzando denaturanti chimici.
Gli organismi termofili sono caratterizzati da una temperatura di crescita
ottimale compresa tra 50 e 80°C
Per gli organismi ipertermofili tale temperatura è compresa tra 80 e 120°C.
L’identificazione dei principi di adattamento delle proteine alle alte
temperature è indispensabile per chiarire il meccanismo del folding e le
funzione--struttura.
relazioni funzione
CD di Proteine:
Studio della denaturazione
Lo spettro della proteina nativa a 20°C
mostra una banda negativa con un minimo
profondo tra i 210 e 220 nm e un’intensa
banda positiva tra i 190 e i 195 nm. Queste
caratteristiche sono tipiche di proteine
contenenti molti elementi di struttura
secondaria quali α-eliche e foglietti β.
Lo spettro CD dell’enzima a 108°C mostra
un minimo meno profondo tra i 210 e220 nm,
tuttavia, la struttura della proteina è ancora
parzialmente conservata. Questo mostra che
la SsoPox è una proteina estremamente
resisitente alla tempratura,
tempratura, come è lecito
aspettarsi
essendo
una
proteina
proveniente da un batterio ipertermofilo.
ipertermofilo.
Quadruple eliche di DNA
Nelle regioni terminali dei cromosomi, dette regioni telomeriche, il
DNA diventa da doppio, singolo filamento. Questa regione è ricca di
Guanine e priva di geni (cioè non codifica amminoacidi per le proteine )
ed ha la capacità di ripiegarsi su se stessa formando un’insieme di
interessantissime strutture a quadrupla elica.
Quadruple eliche di DNA
Durante la fase della divisione cellulare, nel corso della quale i cromosomi
vengono duplicati, il telomero subisce un accorciamento. Ma tale accorciamento viene
integrato e protetto, nelle sue porzioni consumate, dall’enzima telomerasi .
Questo enzima è attivo solo nelle cellule germinali e quindi durante lo sviluppo
embrionale, garantendo così la completezza dei telomeri alla nascita. Nel corso della
vita però la telomerasi tende a scomparire determinando un progressivo
accorciamento del DNA telomerico. Quindi la regressione telomerica viene a
coincidere con l’invecchiamento cellulare.
Quadruple eliche di DNA
Purtroppo nelle cellule tumorali la telomerasi torna ad essere attiva e ciò comporta l’integrità
dei telomeri e quindi la replicazione senza limiti di queste tipi di cellule che
diventano, per tale motivo, immortali .
La natura però ha trovato una soluzione per opporsi alla scomoda attività della
telomerasi nelle cellule tumorali: ha arricchito il DNA telomerico di guanine.
Questo a sua volta potrà formare una struttura a quadrupla elica che rende
difficile la fase di riconoscimento del DNA telomerico all’enzima telomerasi.
Quadruple eliche di DNA
La quadrupla elica è costituita da una serie di unità fondamentali, le G-tetradi, che
consistono in un arrangiamento planare di quattro guanine, associate a formare un
ciclo grazie allo scambio di legami a idrogeno (legami Hoogsteen), nello specifico
ogni guanina riceve e dona due legami ad idrogeno.
Una quadrupla elica presenta una cavità al suo interno in cui si affacciano gli atomi
di ossigeno del gruppo carbonilico delle guanine, ciò crea un sito di legame specifico
per gli ioni metallici, la cui presenza stabilizza fortemente la struttura. In particolare
la molecola si stabilizza con ioni metallici come il potassio, il sodio o lo stronzio.
Quadruple eliche di DNA
14
12
CD ( 263 nm )
10
8
6
4
2
0
-2
10
20
30
40
50
60
70
80
90
100
temp. (°C)
Dallo studio termodinamico della denaturazione termica di una
quadrupla elica di DNA è possibile determinare le seguenti grandezze
termodinamiche:
•Tm
•∆H°;
•∆S°;
•∆G298K
Riassumendo
Da un’analisi CD possiamo ottenere informazioni sulla struttura tridimensionale di
macromolecole otticamente attive come DNA e proteine.
Per farlo si utilizza lo spettropolarimetro, uno strumento in grado di misurare l'ellitticità
generata da un campione al variare della lunghezza d'onda del raggio incidente (siamo nel
campo degli UV), ottenendo così lo spettro di quel campione.
Ogni struttura secondaria delle proteine ha un suo spettro caratteristico dovuto alla
disposizione spaziale dei legami peptidici. Confrontando questi spettri con quello di una
proteina qualsiasi è possibile ricavare il tipo di strutture secondarie di quella proteina e in che
misura sono presenti.
Con la spettroscopia di dicroismo circolare non possiamo sapere quali sono, ad esempio, gli
aminoacidi coinvolti in tali strutture (per queste informazioni bisogna ricorrere alla più
complessa spettroscopia NMR (o EPR) e alla cristallografia con i raggi X) però permette in
modo rapido di ottenere informazioni come la stabilità della struttura di una proteina al
variare della temperatura o dell'intorno chimico in cui si trova.










