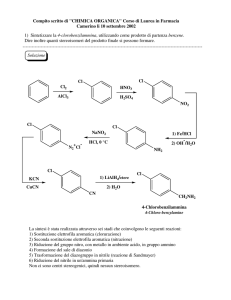
Complementi di Chimica Organica
Composti Aromatici: Benzene
C6H6
(1825)
(1865)
Friedrich August Kekulé
Complementi di Chimica Organica
Composti Aromatici: Benzene, energia di coniugazione
∆H = -119.5 KJ/mol
(-119.2 x 3 = -357.6)
∆H = -208.2 KJ/mol
-357.6 KJ/mol – (-208.2 KJ/mol) = -149.4 KJ/mol
ENERGIA DI
CONIUGAZIONE
Complementi di Chimica Organica
Composti Aromatici: Benzene
Distanza di legame C-C: 1.40 A
(C-C: 1.48 A, C=C: 1.32 A)
La reattività del benzene è differente dalla
reattività tipica delle olefine, anche se coniugate
Complementi di Chimica Organica
Composti Aromatici: Benzene, orbitali molecolari
6 orbitali atomici p
Orbitale π a più
bassa energia
Complementi di Chimica Organica
Composti Aromatici: formule di risonanza
(Kekulè)
...
...
...
(Dewar)
La struttura di una molecola che contiene legami delocalizzati può essere espressa come
l’ibrido delle diverse forme canoniche che possono essere scritte. Nessuna di queste forme
esiste realmente, la vera struttura di queste molecole è sempre la stessa ed è la media delle
forme canoniche pesate secondo la loro stabilità relativa.
Complementi di Chimica Organica
Composti Aromatici: formule di risonanza
Come individuarle:
● Le formule di risonanza devono rispettare le regole delle strutture di Lewis
● La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
disponendo gli elettroni di valenza in modi diversi)
● Tutte le formule canoniche devono avere lo stesso numero di elettroni spaiati
Come valutarne l’importanza:
● Le strutture con un numero maggiore di legami covalenti sono più stabili
● La stabilità è diminuita dall’aumento della separazione di carica (se vi sono più di due
cariche la struttura è molto poco stabile, peggio ancora se vi sono due cariche uguali
adiacenti)
● Strutture con cariche negative su atomi più elettronegativi sono più stabili di quelle con
cariche negative su atomi meno elettronegativi.
● Strutture con angoli o lunghezze di legame distorte sono meno stabili.
Complementi di Chimica Organica
Composti Aromatici: 6 elettroni
Anelli a 6 atomi:
N
benzene
antracene
piridina
Anelli a 5 atomi:
N
N
H
S
O
N
H
pirrolo
tiofene
furano
imidazolo
pKa (cp) ~ 16
ciclopentadiene
Ciclopentadienil
carbanione
Complementi di Chimica Organica
Composti Aromatici: 4n+2 elettroni
Anelli a 7 atomi:
cicloeptatriene
Ione tropilio
Anione
cicloeptatrienilico
Altri anelli:
NH
Catione
ciclopropenilico
Ciclobutadiene
(4e, antiaromatico)
N
N
HN
Porfina (18e)
Azulene
(µ = 0.8 D)
Complementi di Chimica Organica
Composti Aromatici: 4n+2 elettroni
E
Ione tropilio
Anione
cicloeptatrienilico
Complementi di Chimica Organica
Reattività del benzene
δH
H
H
H
H
H
δ+
Complementi di Chimica Organica
Reattività del benzene
a) Addizione:
A
A B
B
Perde l’energia di
coniugazione
b) β eliminazione:
A
-A B
B
Orbitale π instabile
(poca sovrapposizione)
Complementi di Chimica Organica
Reattività del benzene
c) Sostituzione:
X
Y
Nessuna alterazione del
sistema aromatico!
Complementi di Chimica Organica
Reattività del benzene
a1) Sostituzione nucleofila (SN2):
Il gruppo uscente porta
via un doppietto elettronico da un atomo di C sp2
Y
X
Y
Il nucleofilo attacca un centro
ricco di elettroni
a2) Sostituzione nucleofila (SN1):
X
Carbocatione molto instabile
Y
Complementi di Chimica Organica
Reattività del benzene
a3) Sostituzione radicalica
H
X
Y
X Y
Radicale instabile
a4) Sostituzione elettrofila:
Y
X
Un elettrofilo attacca un centro
ricco di elettroni
Y
Complementi di Chimica Organica
Sostituzione elettrofila aromatica
W
Y
X
Perdita dell’energia di
coniugazione
W
Y
X
Y
X
Y
Il gruppo uscente lascia gli
elettroni del legame
Y
Carbocatione stabilizzato
per risonanza
Y
X
X
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: attivazione e
disattivazione
A
B
Y
X
A
B
A
Y
X
B
Y
X
Normalmente le reazioni di sostituzione elettrofila aromatica sono sotto controllo
cinetico: si ottiene il prodotto che si forma più velocemente, non il più stabile.
Sostituenti che stabilizzano la carica positiva stabilizzano l’intermedio (ione arenio)
e quindi lo stato di transizione: aumenta la velocità della reazione
Sostituenti che destabilizzano la carica positiva destabilizzano l’intermedio (ione
arenio) e quindi lo stato di transizione: diminuisce la velocità della reazione
L’effetto è maggiore nelle posizioni 2,4 (orto e para). I gruppi attivanti (che
stabilizzano la carica positiva) sono orto-para orientanti, i gruppi disattivanti (che
destabilizzano la carica positiva) sono meta orientanti.
Complementi di Chimica Organica
Sostituzione elettrofila aromatica
‡
‡
‡
H
H
G°
A
H
B A
H
B
A
AB
HB
Coordinata di reazione
Complementi di Chimica Organica
Naftalene: orientazione
‡
‡
‡
G°
‡
Coordinata di reazione
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: attivazione e
disattivazione
HNO3
NO2
Krel = 1
HNO3
NO2
a) Effetto induttivo (elettronegatività): I
NR3
-I
Krel = 23
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: attivazione e
disattivazione
b) Effetto di risonanza : R
NR2
NR2
+R
HO
O
C
HO
O
C
HO
O
C
-R
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: orientazione
A
A
A
Y
X
Y
X
A
Y
X
X
A
Y
X
Y
X
X
A
Y
X
Y
Y
X
A
A
Y
X
Y
X
A
A
Y
A
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: attivazione e
orientazione
Orto-para orientanti
Meta orientanti
Attivanti
Disattivanti
Potenti
-NR2 (+R), -OH (-I, +R), -O- (+I, +R)
-CF3, -NR3+ (-I)
Intermedi
-OR, -NHCOR (-I, +R)
-CN, -SO3H, -NO2 (-R,-I)
Deboli
-R (+I, +R), -Ph (+R)
-CHO, -COR, -COOR (-R,-I)
Disattivanti
-F, -Cl, -Br, -I (-I, +R)
Cl
Cl
Y
Alogeni (-I, +R):
X
Y
X
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: orientazione
NO2
CH3
CH3
CH3
NO2
Il gruppo attivante prevale sul disattivante.
L’attivante forte prevale sull’attivante debole.
Bisogna tener conto degli effetti sterici.
OCH3
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: reazioni
1) Nitrazione
2 HNO3
NO2+
H2O
NO3
O N O
NO2
H
H
NO2
B
1) HNO3
2) HNO3/H2SO4
3) HNO3 fumante / H2SO4
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: reazioni
2) Solfonazione
SO3
2 H2SO4
H3 O +
HSO4
O
O S
O
H
SO3
H
SO3
B
Reazione reversibile!
1) H2SO4
2) H2SO4 fumante
SO3H
HB
B
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: reazioni
3) Alogenazione
Br2
FeBr3
Br
FeBr4
Br
H
Br
H
Br
B
1) NBS
2) X2
3) X2 / FeX3, AlX3
X = Cl, Br, I
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: reazioni
3) Alchilazione/Acilazione di Friedl-Craft
RCl, RCOCl
AlCl3
R , RCO
FeBr4
R
H
R
R
H
B
1) RCl, MXn
2) ROH, H2SO4
3) R-CH=CH2, H2SO4
● La reazione non va in sistemi
aromatici disattivati
● Nel caso delle acilazioni bisogna
usare più di un equivalente di AlCl3
Complementi di Chimica Organica
Sostituzione elettrofila aromatica: reazioni
3) Alchilazione/Acilazione di Friedl-Craft
CH3CH2CH2CH2Cl
H3C
CH3CH2CHCl
CH3
CH3
CH3
CH3
CH3CCl
CH3
O
CH3CH2CH2CCl
Trasposizione carbocationi alchilici!
AlCl3
O
C
CH2CH2CH3 Zn/HCl
CH2CH2CH2CH3