Scuola di
Scienze della Salute Umana
Corso di Laurea in Infermieristica
Distress Thermometer:
analisi dei fattori di rischio e
protezione nei pazienti
sottoposti a trapianto di
cellule staminali
emopoietiche.
Relatore
Laura Rasero
Correlatore
Luigi Rinaldi
Candidato
Rossella Borrelli
Anno Accademico 2013/2014
Oh! Signore, fa di me un istrumento della tua pace:
Dove è odio, fa ch'io porti l'Amore,
Dove è offesa, ch'io porti il Perdono,
Dove è discordia, ch'io porti l'Unione,
Dove è dubbio, ch'io porti la Fede,
Dove è errore, ch'io porti la Verità,
Dove è disperazione, ch'io porti la Speranza.
Dove è tristezza, ch'io porti la Gioia,
Dove sono le tenebre, ch'io porti la Luce.
Oh! Maestro, fa ch’io non cerchi tanto:
Ad esser consolato, quanto a consolare.
Ad essere compreso, quanto a comprendere.
Ad essere amato, quanto ad amare.
Poiché:
Si è: Dando, che si riceve;
Perdonando, che si è perdonati;
Morendo, che si risuscita a Vita Eterna.
S. Francesco
RINGRAZIAMENTI
Il prendersi cura è un atto creativo, è un gesto che modifica l’esistente generando
bellezza. Sono questi gli aspetti intrinseci della professione infermieristica che ho
potuto cogliere e che ho cercato di apprendere al meglio in questo mio percorso di
formazione universitaria. Pur essendo solo l’inizio di un lungo percorso, trovo
doveroso porgere i miei più sentiti ringraziamenti a tutti coloro che mi hanno
permesso di conoscere al meglio il vero significato della nostra professione.
Sono molte le persone cui sono grata ed esprimo riconoscenza.
Ringrazio in particolare chi ha collaborato e mi ha aiutato nella stesura di questo
mio elaborato finale, tra cui: la Prof.ssa Laura Rasero per la fiducia accordatami
accettando il ruolo di Relatrice per questo lavoro di tesi, il Dott. Luigi Rinaldi
infermiere presso il centro Trapianto di Midollo Osseo di Careggi, per avermi
trasmesso la sua esperienza e l’amore per la professione infermieristica, così come
ringrazio il Dott. Mauro Marsullo coordinatore dello stesso centro, per la sua
disponibilità e il Prof. Andrea Guazzini per la sua infinita pazienza.
Un doveroso ringraziamento è rivolto alla mia famiglia, senza la quale non avrei
mai neppur cominciato questa soddisfacente carriera: a lei consegno questa mia
ultima fatica lavorativa e il mio diploma di laurea, in segno di riconoscimento per gli
sforzi sostenuti, non solo finanziari e per aver sempre creduto in me.
Il ringraziamento più caloroso è per il mio fidanzato Luca, che con amore,
pazienza e fiducia mi ha sostenuto per tutti questi anni, condividendo con me
momenti di gioia e restando sempre al mio fianco nei momenti di difficoltà. È a lui, il
mio futuro, che dedico questo successo.
Un grazie speciale a tutte le amiche ed a tutti gli amici con cui ho vissuto
l’università, come esperienza unica ed indimenticabile che mi ha permesso di
crescere e diventare una persona migliore e che porterò sempre nel cuore.
Grazie di vero cuore.
Rossella Borrelli
INDICE
Introduzione................................................................................................................ 1
Prima parte ................................................................................................................. 3
1. Capitolo: Trapianto di cellule staminali ematopoietiche pluripotenti ........... 3
1.1
Introduzione ................................................................................................... 3
1.2
Sorgenti di cellule staminali emopoietiche .................................................... 5
1.3
Condizionamento e regimi preparativi .......................................................... 8
1.4
Tipologie di trapianto .................................................................................... 9
1.5
Decorso e complicanze del trapianto ........................................................... 16
1.6
Risultati del trapianto di cellule staminali emopoietiche ............................. 23
2. Capitolo: Gestione infermieristica nel trapianto di CSE .............................. 24
2.1
Processo di assistenza infermieristica .......................................................... 25
3. Capitolo: Degenza a bassa carica microbica, tra Distress e Coping............. 35
3.1
Premessa ...................................................................................................... 35
3.2
L’adattamento alla malattia ......................................................................... 36
3.3
Risposta agli stressor ................................................................................... 37
4. Capitolo: Distress, sesto parametro vitale in oncologia ................................. 42
4.1
Test di screening per il Distress ................................................................... 43
4.2
Distress Thermometer.................................................................................. 44
Seconda parte ........................................................................................................... 51
5. Progetto di ricerca ............................................................................................. 51
5.1
Introduzione e background scientifico......................................................... 51
5.2
Obiettivi dello studio ................................................................................... 52
5.3
Procedure e metodo ..................................................................................... 52
5.4
Analisi dei dati ............................................................................................. 55
6. Risultati .............................................................................................................. 56
6.1
Analisi statistica descrittiva epidemiologica................................................ 56
6.2
Analisi statistiche inferenziali ..................................................................... 72
7. Discussioni e conclusioni ................................................................................ 106
Allegati .................................................................................................................... 112
Bibliografia e Sitografia ........................................................................................ 113
Introduzione
Nel corso degli anni l’approccio terapeutico con trapianto di cellule staminali
emopoietiche ha preso sempre maggior piede, rendendo la procedura più sicura e
garantendo sempre maggiori successi, rendendo così indispensabile il porre maggiore
attenzione agli aspetti psicosociali della malattia e del trattamento. La valutazione
della qualità dell’assistenza è tradizionalmente effettuata mediante indici immediati,
quali mortalità e sopravvivenza, trascurando la valutazione di diversi e importanti
fattori che riguardano la salute dell’individuo come le risposte agli stressor. Dalla
ricerca sullo stress è emersa una nuova visione del funzionamento dell’organismo
umano fondata sulle interrelazioni tra i grandi sistemi biologici dell’organismo e la
psiche. Lo stress è oggi considerato un’importante modulatore del sistema
immunitario, in quanto è stato dimostrato come alcuni parametri immunitari siano
influenzati da stressor sia fisici che psicologici. Alcune teorie suggeriscono infatti,
come eventi stressanti siano in grado di innescare risposte cognitive ed affettive in
grado di indurre cambiamenti nel sistema nervoso centrale e sul sistema
endocrinologico, causando in ultimo, modulazioni verso il basso del sistema
immunitario. La letteratura esistente sui sopravvissuti ad un trapianto allogenico di
cellule staminali evidenzia una buona qualità di vita dopo il trapianto ma evidenzia
altresì la presenza di distress emozionale e psicologico in una buona proporzione di
questi pazienti. Il distress può essere considerato nel range delle paure,
preoccupazioni e tristezze o problemi disabilitanti come depressione clinica, ansietà
generalizzata, panico, isolamento o crisi spirituali o esistenziali. Secondo le
statistiche riportate dal gruppo NCCN circa il 40% dei pazienti con nuova diagnosi di
cancro mostrano un livello significativo di distress. Per questi motivi il Distress è
stato riconosciuto come il sesto parametro vitale in oncologia e come per gli altri
parametri vitali, sono stati adottati degli strumenti che permettono il monitoraggio
dei livelli di distress. Nella fattispecie la linea-guida NCCN fornisce un algoritmo per
identificare rapidamente i pazienti con distress significativo, mediante l’utilizzo del
test di screening Distress Thermometer, scala analogico-visiva, composta da un
primo livello di indagine che indaga il grado di Distress riportato su un termometro
numerato da 0-10, ed accompagnato da un secondo livello d’indagine:
1
una Problem List in cui si chiederà ai pazienti di a n notare l ’o ri gi n e d e l
di s t r es s ( pr obl em i fisici, sociali, psicologici, o spirituali). Il monitoraggio del
distress svolge un ruolo di fondamentale importanza nei pazienti sottoposti a
trapianto di CSE, essendo una procedura complessa che richiede interventi
psico-oncologici in una varietà di fasi, a partire dall’inizio del ricovero, al
trapianto stesso, alle crisi dovute alla GvHD, ma anche e soprattutto dopo la
dimissione dalla struttura ospedaliera, si registrano infatti durante tutto l’iter
terapeutico sintomi somatici, problemi fisici, di ruolo e sessuali. Esistono evidenze
in merito al fatto che le questioni psicosociali sono associate ad una diminuzione
della compliance del paziente ed un aumento della morbilità nel periodo posttrapianto, ad esempio la depressione può diminuire la motivazione e l’adesione con
il piano terapeutico. Al contrario un approccio centrato sul paziente è associato ad
aumento
della
compliance,
maggiore
soddisfazione
e
risoluzione
delle
preoccupazioni interne. Il trapianto di CSE costituisce inoltre un lungo e doloroso
periodo della vita, che crea notevoli esigenze e problemi nei pazienti stessi e nelle
famiglie, richiedendo cure complicate e competenti non solo in ambito tecnico.
Diviene quindi indispensabile adottare una visione d’insieme del paziente,
considerando esigenze e preoccupazioni e garantendo una tempestiva ed efficace
assistenza sanitaria, in quanto un intervento che non aiuta emotivamente non è in
grado di fornire un beneficio fisico. Su questo sfondo, scopo dello studio è la
determinazione delle risposte individuali agli stressor nei diversi momenti del
periodo di ricovero, nei pazienti sottoposti a trapianto autologo e allogenico di CSE.
Nella fattispecie sono stati correlati i fattori sociodemografici di ciascuno dei 285
pazienti esaminati, con il grado di distress e i 36 items che compongono la
problem list del Distress Thermometer, per ciascuna rilevazione (al momento del
colloquio, e a + 1,+8,+15,+22,+29,+36 giorni dal trapianto). Ciò ha permesso di
individuare i fattori di rischio e protezione che influenzano il grado di distress e
studiare i cambiamenti psicopatologici occorsi in relazione ai cambiamenti
situazionali ed ambientali che il paziente affronta nel lungo periodo di ricovero. Lo
studio dei fattori di rischio e protezione consente quindi, il miglioramento
dell’assistenza erogata al paziente, attraverso la personalizzazione dei piani di
assistenza, che può quindi avvenire sulla base di dati ottenuti con l’ausilio di
strumenti adeguati.
2
Prima parte
1.
Capitolo: Trapianto di cellule staminali
ematopoietiche pluripotenti.
1.1
Introduzione
Sebbene la chirurgia, la radioterapia e la chemioterapia abbiano migliorato i tassi di
sopravvivenza degli assistiti oncologici, molte patologie oncologiche che
inizialmente rispondono alla terapia poi si ripresentano. Questo si verifica
particolarmente nelle neoplasie ematologiche che riguardano il midollo osseo. Il
trapianto di cellule staminali ematopoietiche pluripotenti (HSCT), precedentemente
definito trapianto di midollo osseo (TMO) consiste nel prelievo di cellule progenitrici
del sistema emopoietico e nella loro successiva infusione endovenosa in un paziente
sottoposto a radio- e/o chemioterapia. Consente di ristabilire la funzionalità
ematopoietica nei pazienti con sistema ematopoietico compromesso o deficitario,
offrendo la possibilità di somministrare dosi molto elevate di chemio-radioterapia,
ricostituendo la riserva di cellule staminali distrutte dalle terapie. Le cellule sane
trapiantate infatti, permettono al midollo osseo di ritornare a produrre tutte le cellule
ematiche necessarie al paziente. Il processo attraverso cui si ottengono le cellule
donate si è evoluto negli anni. Queste ultime infatti, possono essere ottenute da
tradizionale raccolta di grandi quantità di midollo osseo ottenuto in sala operatoria, in
anestesia generale, tuttavia il trapianto di cellule staminali ematiche periferiche
(PBSCT) che usa l’aferesi del donatore per raccogliere cellule staminali da
reinfondere è la metodica più utilizzata. È considerato sicuro e con un migliore
rapporto costo-efficacia rispetto alla tradizionale raccolta di midollo. Per quanto
concerne il tipo di trapianto (allogenico, autologo, aploidentico), la scelta dipende
dall’indicazione al trapianto stesso, dalla sua urgenza e dall’età del paziente.
3
La procedura di trapianto consiste in alcuni passaggi fondamentali, costituiti dalla
scelta della tipologia di trapianto da effettuare (da midollo, sangue periferico,
cordone
ombelicale),
dall’uso
di
regimi
preparativi
(condizionamento),
dall’esecuzione del tipo di trapianto e dei problemi connessi, quali la tipizzazione
HLA per la scelta del donatore nel caso del trapianto allogenico, eventuale
decontaminazione (purging) cellulare nel caso di trapianto autologo. L’attecchimento
e l’autoperpetuazione delle cellule emopoietiche del donatore sono definiti
chimerismo, piattaforma sulla quale si basa l’effetto terapeutico del trapianto. Il
periodo successivo all’infusione delle cellule staminali è caratterizzato dal
trattamento con farmaci ad azione immunosoppressiva, i quali, se favoriscono
l’attecchimento delle cellule del donatore e prevengono il conflitto immunologico fra
donatore e ricevente, espongono tuttavia il paziente a un notevole rischio infettivo,
solo parzialmente mitigato dall’isolamento in stanze a bassa carica microbica. La
finestra terapeutica del trapianto è limitata dalla notevole tossicità della procedura.
Vi possono essere danni d’organo legati al regime di condizionamento, infezioni
opportunistiche, mucositi, seconde neoplasie e reazioni tossiche immunologiche tra
ospite e ricevente (GvHD/rigetto). 1 Altro grosso limite è rappresentato dalla ricaduta
della malattia di base. Quindi, la guarigione del paziente si ottiene solo per quei
soggetti che mantengano la bilancia del trapianto in perfetto equilibrio, evitando sia
la tossicità del trapianto sia la recidiva della malattia di base del paziente (Fig. 1.1). 2
Guarigione
Figura 1.1 - La bilancia del trapianto evidenzia
come la guarigione sia possibile solo in
perfetto equilibrio fra tossicità e rischio di
recidiva. Le diverse tipologie di trapianto
possono costare i piatti della bilancia più verso
la recidiva o verso la Tossicità
Tipo Donatore: Incompatibile, Unità
Cordonale, volontario, fratello,
tossicità
1
recidiva
Gianluigi Castoldi, Malattie del sangue e degli organi ematopoietici, 6 ed., Milano, McGraw-Hill,
2013
2
Alberto Bosi, Manuale di malattie del sangue, Milano, Elsevier, 2012
4
La possibilità di utilizzare diverse sorgenti di cellule staminali estende l’intervento a
quasi tutti i pazienti che ne necessitano. Pertanto nel corso degli ultimi quattro
decenni, dall’inizio della sua attuazione nel 1973, il numero totale di procedure di
trapianto ha visto un notevole incremento, passando da 109 nel primo decennio
(1973-1982) a 939 negli ultimi dieci anni (2003-12).3 Tutto ciò è stato reso possibile
dalla riduzione della mortalità trapiantologica, dovuta all’acquisizione di esperienze
cliniche sempre più consolidate, all’adozione di regimi di condizionamento ridotti
che tengano conto anche delle comorbidità del paziente, alla maggior efficacia della
terapia di supporto e a una migliore prevenzione delle complicanze infettive.
1.2
Sorgenti di cellule staminali emopoietiche
Sono rappresentate dal midollo osseo, dal sangue periferico e dal cordone
ombelicale. Fino ai primi anni Novanta, l’unica sorgente di cellule staminali era
rappresentata dal midollo osseo (BM); successivamente, il sangue periferico (PBSC)
e poi anche il sangue placentare (CB) hanno dimostrato di essere valide fonti
alternative di progenitori emopoietici capaci di ricostituire l’ambiente midollare dopo
trattamento chemio- radioterapico ad alte dosi.
1.2.1 Midollo osseo
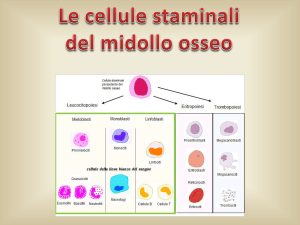
Il midollo osseo è la sede dell’ematopoiesi, o formazione delle cellule del sangue. In
un bambino, tutte le ossa dello scheletro sono coinvolte in questo processo che
diminuisce via via che il bambino cresce. Nell’età adulta, di solito l’attività del
midollo è limitata alla pelvi, alle coste, alle vertebre e allo sterno. Il midollo
rappresenta il 4-5% del peso corporeo, quindi è uno dei maggiori organi. Esso è
costituito da gruppi isolati di cellule (midollo rosso) separate da grasso (midollo
giallo). Con l’avanzare dell’età, la proporzione di midollo rosso, attivo, diminuisce a
favore di quella del midollo giallo; in un individuo sano, tuttavia, quest’ultimo può
essere nuovamente sostituito da midollo rosso in caso di necessità. Il midollo osseo è
un organo molto vascolarizzato, contenente cellule non differenziate, dette cellule
staminali.
3
O'Meara A, Holbro A, Meyer S, Martinez M, Medinger M, Buser A, Halter J, Heim D, Gerull S, Bucher
C, et al., Forty years of haematopoietic stem cell transplantation: a review of the Basel experience;
Swiss Medical Weekly, 2014; 144:w13928
5
Le cellule staminali possono autoreplicarsi, assicurando un apporto continuo di
cellule progenitrici durante tutta la vita dell’individuo. In presenza di opportuni
stimoli le cellule staminali danno inizio a un processo di differenziazione che
produce cellule staminali mieloidi o linfoidi: da queste avranno origine gli specifici
tipi di cellule del sangue. Nella fattispecie dalle cellule staminali linfoidi derivano
linfociti T o B. Le cellule staminali mieloidi si differenziano in tre grandi tipi di
cellule: eritrociti, leucociti e piastrine. Pertanto, ad eccezione dei linfociti, tutte le
cellule del sangue derivano da cellule staminali mieloidi. Un difetto nelle cellule
staminali mieloidi può causare problemi per la produzione di leucociti, di eritrociti e
di piastrine.4 Il midollo osseo rappresenta la fonte classica di cellule staminali
utilizzabili ai fini trapiantologici. Secondo la metodica classica, durante una anestesia
generale o spinale, si prelevano, dalle cavità osteomidollari delle creste iliache, circa
15-20 ml di sangue midollare per chilogrammo (Kg) di peso del ricevente. Il prelievo
viene eseguito con aghi da aspirato midollare e siringhe, con tecnica molto simile a
quella impiegata per l’aspirato midollare a scopo diagnostico. Il midollo prelevato
viene fatto passare attraverso dei filtri per eliminare il grasso, le spicole ossee e per
disperdere gli aggregati di cellule midollari; quindi viene reinfuso in 5-8 ore per via
endovenosa come una normale trasfusione di sangue. La quantità ottimale di cellule
in grado di garantire l’attecchimento, espressa come cellule mononucleate/kg di peso
corporeo del ricevente, è pari a circa 2-4 × 108. 5 Durante la procedura di donazione
vengono reinfuse al donatore una o due unità di sangue autologo predepositato, onde
minimizzare i rischi trasfusionali.
1.2.2 Sangue periferico
Negli anni recenti, è andato diffondendosi l’impiego di cellule staminali da sangue
periferico, come fonte alternativa di cellule emopoietiche. La dimostrazione che
cellule emopoietiche staminali sono presenti nel sangue periferico è venuta
dall’osservazione che dopo trattamento con fattori di crescita o dopo chemioterapia
vi è un progressivo incremento di questi elementi in circolo, un processo definito
come mobilizzazione.
4
S. C. Smeltzer, B. Bare, J. Hinkle, K. Cheever, Brunner Suddarth- Infermieristica medico-chirurgica.
Vol 1, 4ed., Casa editrice Ambrosiana, Milano, 2010.
5
P. Corradini, R. Foà, M. Boccadoro, et al. Manuale di ematologia, 2. ed., Torino, Minerva medica,
2015.
6
Le caratteristiche biologiche delle cellule staminali emopoietiche (CSE) sono state
oggetto di numerosi studi, resi talora difficoltosi per l’esiguità del loro numero in
periferia. Le concentrazioni di CSE nel midollo osseo infatti, sono 10-100 volte
superiori a quelle presenti nella circolazione periferica. Le procedure per aumentare
le concentrazioni di CSE in circolo sono pertanto necessarie al fine di assicurare
l’adeguatezza e il successo delle raccolte. 6 Il donatore viene trattato per 4-7 giorni
con un fattore di crescita granulocitario (G-CSF, granulocyte colonystimulating
growth factor) sottocute, e sottoposto a leucaferesi per uno o più giorni consecutivi.
Le cellule staminali vengono quantificate mediante citofluorimetria che valuta
l’antigene CD34 presente sulla superficie delle cellule stesse. Relativamente al
donatore il trattamento è nella maggior parte dei casi ben tollerato, esente da rischi e
presenta il vantaggio di non richiedere anestesia generale. Quanto al ricevente,
l’impiego di progenitori da sangue periferico si associa a una più rapida risalita posttrapianto dei globuli bianchi e delle piastrine, con conseguente riduzione
dell’ospedalizzazione e delle complicanze legate al rischio infettivo. Alcuni problemi
particolari connessi con l’uso di cellule CD34+ periferiche riguardano la mancata
mobilizzazione in alcuni soggetti, la contemporanea mobilizzazione di cellule
patologiche, la contaminazione con un grande numero di linfociti.
1.2.3 Cordone ombelicale
Il sangue contenuto nel cordone ombelicale e nella placenta al momento della nascita
rappresenta una sorgente particolarmente ricca di cellule staminali emopoietiche. La
relativa immaturità di queste cellule consente di superare più facilmente la barriera
immunologica nelle fasi di attecchimento rispetto alle cellule derivanti da altre
sorgenti. Le tecniche di prelievo attualmente a disposizione hanno permesso di
raggiungere un volume di sangue di circa 80-160 ml, contenenti fino a 2 ×106/cellule
CD34+, tuttavia è da considerarsi insufficiente per effettuare trapianti nell’adulto.
Per tale motivo sono allo studio procedure intese a ottenere un’espansione in vitro di
cellule staminali derivate dal cordone ombelicale, ad esempio incubandole con fattori
di crescita, citochine stimolatorie, cellule mesenchimali e componenti del
complemento.
6
EBMT, Formazione infermieristica EBMT: Mobilizzazione e aferesi di cellule staminali emopoietiche,
7
Più ampiamente utilizzati sono, nella pratica clinica, i trapianti che utilizzano due
unità
cordonali
parzialmente
compatibili
(Double
umbilical
cord
blood
transplantation) o una metodica alternativa, chiamata intra-BM injection (IBMI),
nella quale il graft viene iniettato direttamente a livello del bacino. I vantaggi del
trapianto da cordone sono: la rapida disponibilità dell’unità compatibile, già tipizzata
e criopreservata; la maggiore tolleranza al mismatch HLA e quindi la possibilità di
reperire un donatore per la gran parte dei pazienti; il minore rischio di GVHD, di
trasmissione di infezioni e l’assoluta sicurezza per il donatore. Le cellule staminali
del cordone ombelicale inoltre possono essere più facilmente trasdotte da vettori
retrovirali rispetto alle cellule staminali midollari, offrendo in questo modo nuove
possibilità per una terapia genica in vari disordini. Lo svantaggio è rappresentato
fondamentalmente dallo scarso numero di cellule mononucleate del cordone, che
determina un attecchimento più ritardato e un maggiore rischio di graft failure. Sono
oggi a disposizione registri (Eurocord Transplant Project) che forniscono linee guida
per la raccolta, la criopreservazione, la tipizzazione e il controllo di qualità del
prodotto finale, in modo tale da creare banche-dati utili all’impiego.7
1.3
Condizionamento e regimi preparativi
Il regime di condizionamento consiste nella somministrazione di chemio/radioterapia
ad alte dosi, con una duplice funzione: distruggere le cellule tumorali residue e
indurre un’immunodepressione nel ricevente, consentendo quindi l’attecchimento del
sistema emopoietico al donatore. I regimi di condizionamento definiti mieloablativi o
convenzionali contengono chemioterapia ad alte dosi in grado di provocare una
pancitopenia irreversibile, se non sono seguiti dal trapianto di cellule emopoietiche. I
più comunemente utilizzati comprendono la ciclofosfamide e l’irradiazione corporea
totale (TBI), oppure l’associazione del busulfano con la ciclofosfamide.
Tali regimi di condizionamento comportano una mortalità trapiantologica pari al 2040% e non sono pertanto applicabili a pazienti di età superiore ai 55 anni o affetti da
patologie concomitanti che coinvolgono organi importanti come cuore, rene, fegato o
polmoni.
7
G. Castoldi, Malattie del sangue e degli organi ematopoietici, 6. ed., Milano, McGraw-Hill, 2013
8
Partendo dal presupposto, in parte documentato, che l’attività antitumorale del
trapianto allogenico sia dovuta anche all’effetto immunomediato dai linfociti del
donatore (graft versus leukemia), dal 1997 sono stati introdotti i regimi di
condizionamento detti a ridotta intensità o non mieloablativi.
Tali
regimi
di
condizionamento
presentano
un’attività
prevalentemente
immunosoppressiva in grado di garantire un attecchimento stabile del midollo
mediante una immunoablazione del sistema emopoietico del ricevente. Possedendo
una media o moderata attività citotossica, i regimi di condizionamento a intensità
ridotta inducono danni mucosi e d’organo molto limitati, riducendo la mortalità
trapiantologica e rendendo quindi eleggibili al trattamento anche pazienti anziani
(solitamente sino ai 65-70 anni) o pesantemente pretrattati. 8
Figura 1.3.1 Schema di condizionamento generico
chemio chemio chemio TBI
TBI
TBI
Riposo
riposo
TMO
-8
-4
-3
-2
-1
0
1.4
-7
-6
-5
Tipologie di trapianto
Il trapianto di cellule staminali emopoietiche è classificato in base all'identità del
donatore in:
-
Autologo. Le cellule del donatore utilizzate per la procedura appartengono al
paziente stesso;
-
Allogenico. Da una persona diversa, consanguinea o meno, selezionata in
quanto HLA-compatibile;
-
8
Singenico. Quando il donatore e il paziente sono due gemelli identici.
Shi M et al. Blood Lymphatic Cancer , 2013;3:1–9
9
Figura 1.4.1 Differenze fra l'HSCT autologo e allogenico
Trapianto Autologo
Definizione Cellule staminali ottenute dal
9
Trapianto Allogenico
Cellule staminali fornite da un
sangue o dal midollo osseo del
donatore HLA-identico,
paziente stesso
consanguineo oppure estraneo
Indicazioni Leucemie, linfomi, mieloma
multiplo
Alcuni tipi di leucemie,
linfomi e altri disturbi del
midollo osseo
Vantaggi
Nessun rischio di rigetto
Le cellule del donatore
possono attaccare le cellule
cancerose residue (effetto del
trapianto contro il cancro graft-versus-cancer)
Svantaggi
- Cellule cancerose possono
venire raccolte
- Rischio di rigetto
- Le cellule del donatore
contemporaneamente alle
possono attaccare
cellule staminali
l'organismo del paziente
- Le cellule cancerose possono
aggirare le difese immunitarie
(malattia del trapianto contro
l'ospite - graft-versus-host)
- Aumento del rischio di
infezione
Usi
Compensare il fallimento
Sostituire il sistema
ematopoietico durante i cicli
ematopoietico dei pazienti con
chemioterapici ad alte dosi, per il
insufficienza acquisita o
trattamento dei tumori del sistema congenita e, più di frequente,
ematopoietico
sfruttare l'effetto del trapianto
contro il tumore, o graft-vstumour
9
EBMT Nurses Group International Study Day HCST patients: where are we going? Actual practice
and new challenges, Florence, 2014
10
1.4.1 Trapianto Autologo
La ricostituzione delle cellule emopoietiche dopo la terapia mieloablativa può essere
ottenuta reinfondendo cellule staminali emopoietiche del sangue periferico o del
midollo osseo del paziente stesso, prelevate nelle settimane prima del regime di
condizionamento e criopreservate. Questa procedura verso la fine degli anni ’80 è
radicalmente cambiata grazie all’osservazione che i fattori di crescita emopoietici
impiegati per accelerare la ripresa emopoietica dopo la chemioterapia avevano la
capacità di espandere e indurre il rilascio nel sangue periferico di elevate quantità di
cellule staminali. Nella pratica quotidiana a livello mondiale il 90% degli
autotrapianti è effettuato con cellule mobilizzate da sangue periferico e non più con
midollo osseo, in questo modo la ripresa emopoietica post-trapianto avviene nel giro
di una decina di giorni sia per i neutrofili, che per le piastrine, con una conseguente
riduzione del periodo di pancitopenia grave, ovvero la riduzione del numero di tutte
le cellule presenti nel sangue (meno di 500 neutrofili µl/ e 20.000 piastrine/ µl). In
questo modo l’autotrapianto, è divenuto una procedura molto comune, con una bassa
mortalità, in genere dell’1-2%.
1.4.1.1 Risultati clinici e indicazioni all’uso del trapianto autologo:
Malattie onco-ematologiche
Nonostante il problema della possibile reinfusione di cellule neoplastiche presenti nel
midollo osseo, anche quando il prelievo viene eseguito in remissione completa,
l’autotrapianto è stato largamente impiegato come terapia post-remissione nella
leucemia mieloblastica acuta nei pazienti fino a 60 anni di età. Gli studi clinici
dimostrano che circa il 45-50% dei pazienti così trattati possono guarire. Esistono
dati anche a supporto del trapianto autologo per le sindromi mielodisplastiche
(anemia refrattaria con eccesso di blasti) nei pazienti di età inferiore ai 60 anni che
abbiano fatto ricorso a una chemioterapia di induzione e che siano in remissione
completa.
11
Il trattamento di doppio autotrapianto preceduto dalle alte dosi di melphalan10 (200
mg/mq) nel regime di condizionamento è considerato oggi il trattamento più efficace
per i pazienti con mieloma multiplo alla diagnosi fino a 60-65 anni di età. I linfomi
non Hodgkin e il linfoma di Hodgkin fino a 60-65 anni vengono frequentemente
sottoposti a trapianto autologo come terapia di salvataggio delle malattia
chemiosensibile in prima ricaduta. Sono meno chiare nella letteratura internazionale
le indicazioni al trapianto autologo per i linfomi follicolari in ricaduta o per i linfomi
a grandi cellule B a cattiva prognosi alla diagnosi o per i linfomi a cellule T. I
linfomi follicolari sono generalmente sottoposti ad autotrapianto in prima ricaduta,
ma essendo la localizzazione midollare di malattia molto comune, è importante
ottenere delle cellule staminali prive di cellule tumorali residue per migliorare
significativamente la sopravvivenza di questi pazienti dopo autotrapianto. Essenziale
per il successo della procedura è che la malattia neoplastica sia in risposta completa o
almeno parziale. La tossicità della procedura come nel trapianto allogenico dipende
in modo importante dalle comorbidità che può avere il paziente oltre alla malattia
neoplastica (e.g. infezioni pregresse, cardiopatie, diabete etc.).
Malattie autoimmuni
Studi pilota hanno fornito dei risultati interessanti nel lupus sistemico, nella
sclerodermia, nell’artrite reumatoide e nella sclerosi multipla. Sono dati che derivano
dalle casistiche limitate di pazienti con malattie molto avanzate, in queste situazioni
cliniche
l’autotrapianto
immunosoppressivo
per
è
stato
utilizzato
distruggere
i
come
cloni
trattamento
linfocitari
altamente
responsabili
dell’autoimmunità.
10
Il Melphalan è un agente chemioterapico appartenente alla classe dei farmaci cosiddetti alchilanti,
sostanze che esercitano un’azione tossica a livello cellulare (per questo sono definite citotossiche),
provocando in tal modo la morte delle cellule neoplastiche. Trova indicazione nel trattamento di
diverse neoplasie, in particolare per il mieloma multiplo, il carcinoma dell’ovaio e della mammella,
ma trova indicazione anche in alcuni regimi di condizionamento prima del trapianto di midollo osseo.
http://chemocare.com/chemotherapy/drug-info/Melphalan.aspx#.VQLEcY6G8vk
12
1.4.2 Trapianto allogenico
Il trapianto allogenico di CSE consiste nella reinfusione di cellule staminali
ematopoietiche (CSE) di un donatore sano, in un ricevente (il soggetto malato) dopo
che il ricevente è stato sottoposto a regimi di condizionamento, cioè preparato con la
somministrazione di chemioterapia e/o radioterapia ad alta intensità. Individuare un
donatore di CSE idoneo per poter procedere al trapianto significa tipizzare sia
donatore che ricevente, ovvero verificare, con tecniche di biologia molecolare in alta
risoluzione, che le cellule dell’uno e dell’altro siano HLA compatibili, ovvero
presentino gli stessi antigeni di istocompatibilità. Di conseguenza, è un pre-requisito
di fondamentale importanza per il successo del trapianto allogenico che sia il
ricevente che il donatore abbiano un sistema HLA il più possibile simile, in modo da
limitare il rischio della condizione nota come Graft Versus Host Disease (GVHD,
Malattia del Trapianto contro l’Ospite), cioè quella condizione in cui linfociti del
donatore colpiscono i tessuti del ricevente, non riconoscendoli come self. I geni del
sistema HLA hanno la caratteristica di essere estremamente variabili da individuo ad
individuo; per tale motivo, la variabilità genetica è molto elevata al di fuori
dell’ambito familiare mentre nell’ambito familiare è più ristretta ed ogni fratello ha
una probabilità del 25% di essere HLA compatibile col paziente. Tuttavia, per dare la
possibilità di trovare un donatore compatibile anche a quei pazienti che non
dispongono di un donatore HLA-compatibile all’interno del nucleo familiare, sono
stati creati i Registri Internazionali di Donatori Volontari di CSE o i Network di
Banche di Sangue di Cordone Ombelicale.
1.4.2.1 Tipologia di trapianto allogenico
Parliamo di:
-
Trapianto singenico quando il donatore è rappresentato da un gemello
identico omozigote.
-
Trapianto allogenico di CSE da donatore familiare compatibile quando il
donatore HLA-compatibile viene trovato all’interno del nucleo familiare del paziente
(probabilità di circa il 25-30%).
-
Trapianto allogenico di CSE da donatore volontario quando il donatore è un
volontario iscritto nei Registri Internazionali di Donatori di CSE.
13
Il tempo mediano per l’identificazione di un donatore volontario HLA compatibile
può variare da 1 a 16 mesi.
-
Trapianto allogenico di CSE da sangue di cordone ombelicale (SCO) quando
la fonte di CSE è costituita dal SCO prelevato al momento del parto da donatrici sane
e accuratamente selezionate e conservato in Banche di SCO. Il tempo mediano per
l’identificazione è di sole 3 settimane.
-
Trapianto allogenico di CSE da familiare non compatibile (aploidentico)
quando il donatore condivide con il paziente almeno un aplotipo del sistema HLA,
condizione che è naturalmente riscontrabile nei genitori e figli del paziente. Il tempo
mediano per la sua identificazione corrisponde ai tempi dello studio dell’HLA, cui
seguono circa 10-15 giorni per la preparazione alla donazione. La scelta di questo
tipo di trapianto è spesso dettata dall’urgenza clinica dello stesso.
1.4.2.2 Risultati clinici e indicazioni all’uso del trapianto allogenico
Il trapianto allogenico rappresenta ancora oggi l’unica opzione terapeutica con
prospettiva di guarigione in molte malattie ematologiche. I dati del registro
internazionale international bone marrow transplant registry, indicano che negli
ultimi 5 cinque anni circa il 60% dei trapianti sono stati eseguiti per leucemie acute o
croniche, il 20% circa è stato eseguito per linfomi, o mieloma multiplo, e il restante
20% per malattie non neoplastiche.
Leucemia mieloblastica acuta e mielodisplasia. La chemioterapia convenzionale e
il trapianto autologo possono guarire circa il 40-50 % delle leucemie mieloidi non
promielocitiche. La presenza di alterazioni cariotipiche o alterazioni di FLT3 sono
da considerarsi un fattore prognostico sfavorevole e quindi costituiscono
un’indicazione al trapianto allogenico anche in prima remissione per i pazienti di età
inferiore ai 55-60 anni. Il trapianto allogenico è inoltre indicato in tutti i pazienti in
seconda o successiva remissione, sebbene la mortalità trapiantologica, così come la
percentuale di recidive in questi casi aumentino. Infatti, la probabilità di
sopravvivenza libera da leucemie a 5 anni è circa del 60-65%, quando il trapianto
viene eseguito in prima remissione e del 25-35% quando viene fatto in seconda o
successiva remissione. Per le mielodisplasie, i migliori risultati in termini di
sopravvivenza sono stati dimostrati trapiantando pazienti giovani, in stadio iniziale.
14
-
In generale, si può dire che il trapianto è indicato alla diagnosi di pazienti ad
alto rischio secondo lo score prognostico internazionale, mentre per i rimanenti è
consigliato lo stretto monitoraggio della malattia in modo tale da procedere
eventualmente al trapianto ai primi segni di aumento della quota blastica.
-
Leucemia linfoblastica acuta. La chemioterapia tradizionale non è in grado di
curare la maggior parte dei pazienti affetti da leucemia linfoblastica, pertanto per i
pazienti con un donatore familiare HLA-identico vi è l’indicazione a effettuare il
trapianto anche in prima remissione, specialmente se permane la presenza di malattia
molecolare nonostante la remissione clinica.
Con il trapianto allogenico effettuato in prima remissione, la sopravvivenza libera da
leucemia a cinque anni è del 40-50% circa, mentre scende al 20-40% quando il
trapianto viene eseguito in remissioni successive alla prima. La presenza del
cromosoma Filadelfia t(9;22), costituisce un’indicazione anche per la ricerca di un
donatore non familiare, in quanto la prognosi è infausta.
-
Leucemia mieloide cronica e mielofibrosi. 11
11
P. Corradini, R. Foà, M. Boccadoro, et al. Manuale di ematologia, 2. ed., Torino, Minerva medica,
2015.
15
1.5
Decorso e complicanze del trapianto
Figura 1.5.1 Cronologia delle complicanze del trapianto di cellule staminali ematopoietiche
12
1.5.1 Principali problematiche cliniche dopo il trapianto allogenico
Complicanze che avvengono nei primi 100 giorni
Esse sono principalmente legate alla tossicità d’organo della chemio-radioterapia del
regime di condizionamento, alle infezioni durante la pancitopenia e alla insorgenza
della GVHD acuta.
-
Rigetto: è una complicanza rara specie con l’utilizzo delle cellule staminali
periferiche che contengono un grande quantitativo di progenitori emopoietici e
linfociti T. è causato dal sistema immunitario residuo del ricevente, che reagisce
contro le cellule del donatore. Il rigetto può manifestarsi nei primi 30 giorni come
mancato attecchimento, ossia il paziente rimane pancitopenico dopo trapianto
(primary graft failure) o può avvenire in un secondo momento come perdita
dell’attecchimento, ossia si ha un recupero dei leucociti neutrofili e delle piastrine
seguito da un successivo calo dei valori (secondary graft failure).
12
EBMT Nurses Group International Study Day HCST patients: where are we going? Actual practice
and new challenges, Florence, 2014
16
La terapia di questa complicanza consiste in un trattamento immunosoppressivo
seguito dalla reinfusione di altre cellule emopoietiche del donatore.
-
Infezioni. Sono una delle principali cause di decesso per questi pazienti.
Nelle prime 2-3 settimane post-trapianto, durante la fase di pancitopenia grave, sono
comuni le infezioni batteriche, fungine e da virus erpetici. Fino al sesto mese, prima
cioè della completa normalizzazione delle funzioni immunitarie, i pazienti restano a
rischio di infezioni micotiche, virali, parassitarie e da batteri capsulati.
L’immunodeficienza è da attribuirsi al regime di condizionamento, in quanto
danneggia la normale ematopoiesi dei neutrofili, dei monociti, dei macrofagi e delle
cellule germinative delle mucose, causando una temporanea perdita dell’integrità
della barriera delle mucose. Il tratto gastroenterico, che normalmente contiene un
grande numero di batteri ed un numero minore di funghi commensali ed altri batteri
saprofiti, diventa terreno per potenziali germi patogeni. In teoria tutti i pazienti
trapiantati perdono rapidamente tutti i linfociti T e B dopo il condizionamento,
perdendo così la memoria immunitaria accumulata nel tempo con l’esposizione agli
agenti infettanti, antigeni ambientali e vaccini. Durante il primo mese dopo il TMO,
il maggior deficit di difesa dell’ospite include l’indebolimento della fagocitosi e i
danni alle barriere mucocutanee. Inoltre, frequentemente, i pazienti posizionano
cateteri venosi centrali (CVC) fissi per settimane o mesi, per poter gestire le terapie
endovenose, le trasfusioni e le nutrizioni parenterali totali. Questi dispositivi,
purtroppo, rappresentano anche una via d’accesso per i germi patogeni opportunisti,
in particolare quelli che colonizzano la pelle, es. Stafilococchi coagulasi-negativi,
Stafilococco aureo, Candida, Enterococchi.
L’attecchimento è definito come il momento in cui il paziente riesce a mantenere una
conta assoluta di neutrofili maggiore a 500 mm3 ed un numero assoluto di piastrine
tra le 20000-50000 mm3 per almeno tre giorni consecutivi senza trasfusioni. Se non
vengono utilizzati corticosteroidi, l’attecchimento è associato alla ripresa della
funzione fagocitaria che riduce il rischio di infezioni batteriche e fungine. In ogni
caso, tutti i pazienti trapiantati, e in modo particolare gli allogenici, hanno
disfunzioni immunitarie per mesi dopo l’attecchimento. I pazienti sottoposti a HSCT
sviluppano varie infezioni in tempi diversi dopo il trapianto e il recupero del sistema
immunitario nei trapiantati avviene in tre fasi cominciando dal giorno 0 del trapianto:
17
La prima fase, chiamata pre-attecchimento, si instaura nei primi 30 giorni dopo il
trapianto. In questa fase il paziente presenta due grandi fattori di rischio: la
prolungata neutropenia e la rottura della barriera mucocutanea dovuta alla fase di
condizionamento e al frequente accesso alla via venosa per la somministrazione delle
terapie. Durante la fase di pre-attecchimento i rischi di infezione sono gli stessi sia
per i trapianti autologhi che per gli allogenici, e le infezioni opportunistiche possono
presentarsi sotto forma di neutropenia febbrile. La maggiore fonte di infezione
proviene dalla flora batterica orale, gastrointestinale e della pelle.
La seconda fase, detta di post-attecchimento, si instaura dopo 30-100 giorni dal
trapianto. In questa fase domina l’indebolimento dell’immunità cellulo-mediata sia
per i trapianti autologhi che allogenici. Per questi ultimi la dimensione e l’impatto di
questo deficit sono determinate dall’importanza della GVHD (Graft Versus Host
Disease).
Durante l’attecchimento i virus erpetici e il CMV sono i maggiori patogeni: il CMV
può causare polmoniti, epatiti, coliti e superinfezioni. Particolarmente temibili e
dominanti in questa fase lo Pneumocisti Carinii e l’Aspergillo.
La terza fase si verifica dopo 100 giorni dal trapianto. Durante questa fase, di solito, i
pazienti che hanno subito trapianto autologo hanno un recupero più rapido della
funzione immunitaria, con conseguente minor rischio di sviluppare infezioni
opportunistiche rispetto agli allogenici, che invece, soprattutto se sono riceventi da
un donatore non consanguineo, MUD o da cordone ombelicale, sono particolarmente
a rischio di infezioni da CMV, Varicella Zoster virus, Epstein-Barr virus, virus
respiratori
acquisiti
in
comunità,
Haemophilus
Influenzae,
streptococcus
pneumoniae.
Il rischio di acquisire queste infezioni è approssimativamente proporzionale alla
gravità della GVHD.13
-
Complicanze polmonari.
-
Microangiopatia trombotica
13
Raccomandazioni del CDC di Atlanta per la prevenzione delle infezioni opportuniste nei pazienti
sottoposti a trapianto di cellule staminali emopoietiche, U. O. Ematologia e centro trapianto midollo
osseo, Piacenza
18
-
Malattia veno-occlusiva del fegato. La malattia veno-occlusiva (veno-
occlusive disease, VOD) è una temibile complicazione del trapianto allogenico e del
trapianto autologo. È la conseguenza di un danno epatico dovuto al regime di
condizionamento che può portare a morte in oltre l’80% dei pazienti.
Clinicamente si manifesta con un incremento di peso non giustificato, ittero, dolenzia
in corrispondenza della zona ipocondriaca destra con epatomegalia, ascite e
ritenzione idrica. Non vi sono attualmente test diagnostici definitivi e la diagnosi è
fondamentalmente clinica: si ritiene che valori serici elevati dell’inibitore-1
dell’attivatore del plasminogeno possano essere associati a pazienti con VOD.
L’esecuzione di una biopsia epatica può essere necessaria per convalidare la
diagnosi. Dal punto di vista istopatologico il tessuto epatico mostra la deposizione di
fibrinogeno e fattore VIII a livello delle vene centrolobulari con danno delle cellule
endoteliali sinusoidali (SEC), formazione di gap tre le cellule stesse con imbibimento
ematico dello spazio del Disse, dissezione delle SEC e loro embolizzazione a valle.
Tale fenomeno comporta l’ostruzione dei sinusoidi, riducendo l’efflusso venoso
epatico e comportando una ipertensione portale post-sinusoidale. La terapia, basata
sull’uso di attivatore del plasminogeno di tipo tissutale ed eparina, è in grado di
ottenere risposte in circa il 30-40% dei pazienti, peraltro in associazione a rischi
emorragici. 14
-
Graft-versus-host-disease
Il sistema immunitario è una precisa macchina per la difesa dell'organismo da agenti
patogeni. In particolare è composto da tre tipi cellulari derivanti tutti dalla linea
mieloide delle cellule sanguigne. In particolar modo il sistema di regolazione del
sistema immunitario permette il riconoscimento di organismi estranei al corpo
stesso. Nel caso di un trapianto, può verificarsi il fenomeno inverso, ossia l'organo
trapiantato, che in questo caso è estraneo al corpo del ricevente, produce dei segnali
che attivano le cellule immunitarie in esso contenute contro l'ospite. La malattia del
trapianto contro l'ospite (lingua inglese Graft versus Host Disease da cui
l'acronimo GVHD) è una comune forma di complicanza medica, una sindrome che si
ottiene quando durante un trapianto di tessuto od organo, le cellule immunologiche
forniscono una risposta esagerata aggredendo il sistema immunitario della
persona, riconoscendolo come corpo estraneo.
14
(Castoldi, 2013)
19
Tale fenomeno si verifica più sovente in pazienti immunosoppressi, cioè i riceventi
di trapianto che sono sottoposti ad un trattamento con farmaci in grado di
diminuire la risposta immunitaria al fine di ottenere un migliore attecchimento
dell'organo trapiantato.
Nel caso specifico i farmaci immunosoppressori sono indirizzati a bloccare la
reazione specifica contro l'organo trapiantato, evitando quindi la morte dello stesso,
fenomeno che viene chiamato rigetto. Casi specifici riguardano il trapianto delle
cellule staminali periferiche allogeniche e il trapianto di midollo osseo.15
Complicanze tardive
Le complicanze che avvengono dopo i primi 100 giorni dal trapianto sono
principalmente legate a problemi di ricostituzione immunologica ( infezioni virali e
fungine) o a fenomeni di aggressione immunitaria cronica (GVHD cronica) da parte
del sistema immune del donatore verso i tessuti del ricevente.
-
GVHD cronic. Sebbene la GVHD cronica possa manifestarsi in assenza di
GVHD acuta, generalmente la sua insorgenza è molto frequente a seguito delle forme
acute severe e i segni clinici ricordano quelli di comune riscontro nelle patologie
autoimmunitarie. Nell’80% dei casi si ha coinvolgimento cutaneo con eritema o
lesione cutanee a impronta sclerodermica (depigmentazione, papule lichenoidi,
fibrosi del derma e del sottocute, alopecia). La xeroftalmia e la xerostomia associata
a lichen planus, ulcere e atrofia della mucosa orale si riscontrano nel 50-70% dei
casi. Altre manifestazioni cliniche meno frequenti comprendono epatopatia cronica
con aumento della bilirubina e degli enzimi epatici, trombocitopenia, bronchiolite
obliterante, disturbi della motilità intestinale, pleuriti e pericarditi, artralgie sino
all’anchilosi e atrofia muscolare. Il sistema immunitario di questi pazienti è
profondamente compromesso, di conseguenza sono frequenti le infezioni. Il
trattamento prevede l’utilizzo di ciclosporina e prednisolone; la terapia di seconda
linea consiste nella somministrazione di farmaci immunosoppressori in associazione
alla ciclosporina quali il micofenolato, la rapamicina, l’azatioprina e la pentostatina.
Con l’avvento dei regimi di condizionamento a ridotta intensità e l’utilizzo di
infusione di linfociti del donatore per il trattamento della recidiva post-trapianto si è
parzialmente abbandonata la definizione di GVHD acuta e cronica basata sul tempo
15
http://www.staminafoundation.org/section/gvhd-staminali-adulte
20
di insorgenza (prima e dopo 100 giorni dal trapianto), per definire la diagnosi di
sindrome acuta o cronica più sui segni e sintomi. Pertanto, è stata identificata la
GVHD acuta tardiva che insorge dopo 100 giorni in assenza di segni di GVHD
cronica e la sindrome overlap che non ha limiti di tempo e presenta caratteristiche sia
della GVHD acuta che cronica.
-
Disordini linfoproliferativi post trapianto. Derivano dalla linea linfocitaria B
e sono associate a disfunzione dei linfociti T e a infezione da Epstein Barr Virus.
L’incidenza cumulativa è pari a circa l’1% a 10 anni con un picco di incidenza a 1-5
mesi dal trapianto. Il quadro clinico comprende febbre con interessamento
linfonodale o degli organi non ematopoietici; a livello istologico l’aspetto è quello
del linfoma diffuso a grandi cellule B. Con l’introduzione della PCR (polymerase
chain reaction) quantitativa per la determinazione dei genomi di EBV, la diagnosi
può esser fatta su sangue periferico in uno stadio precoce, quando la febbre
costituisce l’unico sintomo della malattia.
Il rischio di PTLD è particolarmente elevato nei pazienti sottoposti a trapianto da
donatore non consanguineo, e nei casi di trapianto con deplezione dei linfociti T. Il
trattamento si basa principalmente sulla somministrazione di anticorpo anti-CD 20
(Rituximab).
-
I secondi tumori. Il rischio di mielodisplasie o leucemie secondarie è molto
basso dopo trapianto allogenico, è sicuramente superiore dopo il trapianto autologo.
Il periodo medio di insorgenza di tumori solidi post-trapianto è di circa 5-6 anni. È
stata riportata un’incidenza cumulativa pari all’8% a 20 anni e il rischio sembra
aumentare con il tempo senza evidenza di un plateau. Sono stati osservati tumori
della cavità orale, melanomi, tumori epatici, del sistema nervoso centrale, della
tiroide, dell’osso e del tessuto connettivo. La somministrazione di TBI ad alte dosi
aumenta in generale l’incidenza dei tumori secondari. Nei fumatori l’incidenza dei
tumori secondari è maggiore.
21
1.5.2 Principali problemi clinici dopo il trapianto autologo
Il trapianto autologo è una procedura più semplice rispetto all’allotrapianto e risolve
il problema di dover trovare un donatore HLA compatibile in quanto il paziente
stesso funge da donatore con le proprie cellule staminali. Inoltre l’autotrapianto è
gravato da minori complicanze infettive poiché non causa una prolungata immunocompromissione, tuttavia permangono ancora alcuni potenziali rischi per il paziente:
-
Le
infezioni
della
fase
pancitopenia
conseguente
al
regime
di
condizionamento, in cui si attende l’attecchimento delle cellule staminali trapiantate;
-
La possibile contaminazione delle cellule staminali con cellule tumorali
residue, in particolare nelle leucemie e nei linfomi follicolari e mantellari;
-
La ricaduta della malattia neoplastica;
-
La cardiotossicità da chemio-radioterapia.
La profilassi anti-infettiva ha ridotto il rischio di infezioni gravi batteriche o
micotiche. L’utilizzo di anticorpi monoclonali umanizzati rivolti contro gli antigeni
di superficie di alcune cellule tumorali durante le terapie pre-trapianto e anche dopo
l’autotrapianto hanno di molto ridotto il problema della contaminazione neoplastica
delle cellule staminali e hanno anche ridotto il numero delle ricadute di malattia.
Purtroppo tali anticorpi non sono ancora disponibili per tutto lo spettro di malattie
neoplastiche che vengono curate con l’autotrapianto, anche perché in molte neoplasie
ematologiche non sono stati identificati degli antigeni specifici per la sola cellula
tumorale.
22
1.6
Risultati
del
trapianto
di
cellule
staminali
emopoietiche
Il trapianto di CSE si è dimostrato un potente mezzo per sconfiggere malattie
altrimenti ineradicabili. Come ampiamente descritto in precedenza, le cause di
fallimento del trapianto di CSE sono rappresentate dalla mortalità legata alla
procedura e dalla ricaduta della malattia di base.
I risultati sono influenzati da numerose variabili, tra cui alcune legate alla patologia
di base (diagnosi, fase di malattia, fattori prognostici), altre legate al donatore
(familiare o no, completamente o parzialmente compatibile).
I risultati variano poi in funzione della tecnica di trapianto utilizzata, del tipo di
regime di condizionamento, del tipo di sorgente di cellule staminali e del tipo di
profilassi della GvHD. I donatori familiari istocompatibili espongono a un minor
rischio trapiantologico, ma a un maggiore rischio di recidiva rispetto ai non
consanguinei, aspetti che sono ancor più evidenti nei pochi casi di trapianto da
fratello gemello monocoriale.
Tuttavia, il parametro che condiziona più di ogni altro il risultato del trapianto è la
fase di malattia, che, se molto avanzata, comporta una più elevata incidenza sia di
ricaduta della malattia sia di tossicità trapiantologica, e i risultati sono spesso
deludenti. Diversamente, il trapianto effettuato in una fase più precoce della malattia
consente di avere più del 50% di pazienti lungosopravviventi, spesso con ottima
qualità di vita.16
16
(Bosi, 2012)
23
2.
Capitolo: Gestione infermieristica nel
trapianto di CSE
Data la complessità di cura di cui necessitano i pazienti sottoposti a trapianto di
cellule staminali ematopoietiche, la figura dell’infermiere risulta essenziale, poiché
in grado di erogare assistenza specifica e riconoscere le complicanze inerenti la
terapia trapiantologica17. L’infermiere inoltre è un esperto nella valutazione olistica
del paziente e presenta una spiccata capacità di influenzare i sintomi nel paziente
oncologico.18 L’assistenza infermieristica delle persone sottoposte a TMO è
complessa e richiede un alto livello di abilità, in quanto il successo del trapianto è
influenzato in modo consistente dall’assistenza infermieristica. L’infermiere
nell’unità di TMO può essere estremamente soddisfatto ma anche molto stressato.
Alcuni studi dimostrano infatti, come vi sia una correlazione tra il distress vissuto dai
pazienti, nel periodo di degenza e il disagio espresso dagli infermieri a seguito
dell’incremento dei bisogni assistenziali ed emotivi dei pazienti stessi. Dunque
mediante l’attuazione di interventi volti a ridurre il distress nel personale
infermieristico o nel paziente avremo miglioramenti del grado di distress in entrambi
i protagonisti e da parte del paziente un miglioramento della qualità di vita e maggior
soddisfazione verso il trattamento. 19
17
Emilia Campos de Carvalho ,Infusion of Hematopoietic Stem Cells: Types, Characteristics, Adverse
and Transfusion Reactions and the Implications for Nursing, Rev. Latino-Am. Enfermagem
,Brasil,2010, 18(4):716-24
18
L. Boonstra, K. Harden, S. Jarvis, et al., Sleep disturbance in hospitalized recipients of stem cell
transplantation, Clinical journal of oncology nursing,15:3(271-276), 2011
19
Norbert Grulke, Wolfgang Larbig, Horst Ka¨chele, Distress in patients undergoing allogeneic
haematopoietic stem cell transplantation is correlated with distress in nurses, European Journal of
Oncology Nursing, 13:( 361–367), 2009
24
2.1
Processo di assistenza infermieristica
Tutte le persone assistite devono essere sottoposte ad approfondita valutazione pretrapianto per accertare lo stato della malattia. Devono essere eseguiti un
accertamento nutrizionale, una visita medica completa e degli esami relativi alla
funzione degli organi, oltre a una valutazione psicologica. Gli esami del sangue
comprendono l’accertamento di precedenti esposizioni ad antigeni (per esempio,
virus dell’epatite, citomegalovirus, virus dell’herpes simplex,). Devono essere
valutati anche il sistema di sostegno della persona e le risorse economiche e
assicurative. Risulta inoltre fondamentale l’educazione dell’assistito riguardo l’iter
diagnostico-terapeutico pre e post- trapianto e il consenso informato. Durante la fase
di trattamento del TMO, quando si somministra chemioterapia ad alte dosi (regime di
condizionamento) e un’irradiazione di tutto il corpo, è richiesta un’assistenza
infermieristica specialistica. La tossicità acuta della nausea, della diarrea, della
mucosite e della cistite emorragica, richiede uno stretto monitoraggio e una costante
attenzione da parte dell’infermiere. La gestione infermieristica nell’infusione di
midollo osseo o di cellule staminali consiste nel monitoraggio dei parametri vitali e
della saturazione, dell’ossigeno, nell’accertamento degli effetti collaterali, come
febbre, brividi, dispnea, dolore toracico, reazioni cutanee, nausea, vomito,
ipo/ipertensione, tachicardia, ansia e cambiamenti del gusto, ma la persona può
andare incontro anche a complicanze maggiori quali l’insufficienza renale acuta,
l’arresto cardio circolatorio, l’embolia polmonare ecc. nonché nell’offrire sostegno
continuo ed educazione all’assistito.
Durante la fase di aplasia midollare, fino a che si verifica l’attecchimento, i malati
sono ad alto rischio di morte da sepsi e sanguinamento. Gli assistiti richiedono
sostegno con emoderivati e fattori di crescita emopoietica. Le infezioni potenziali
possono essere batteriche virali, fungine e di origine protozoaria. Le complicanze
renali derivano da tossicità da chemioterapia usata nei regimi di condizionamento o
per trattare infezioni. La sindrome da lisi del tumore e la necrosi tubulare acuta sono
un altro rischio dopo HSCT. La GVHD richiede valide capacità di accertamento
infermieristico per scoprire precoci effetti sulla cute, sul fegato e sul tratto
gastrointestinale.
La
malattia
veno-occlusiva
del
fegato
da
regime
dì
condizionamento usato nel BMT può determinare ritenzione di liquidi, ittero, dolore
addominale, asciti, epatomegalia ed encefalopatia.
25
Le complicanze polmonari, come edema polmonare, polmonite interstiziale e altre
polmoniti, spesso complicano la guarigione dopo trapianto. L’accertamento continuo
nelle visite di follow-up per le persone sottoposte a trapianto di cellule staminali
emopoietiche è essenziale per scoprire gli effetti tardivi della terapia, che si
verificano 100 giorni dopo, o oltre, la procedura. Gli effetti tardivi includono
infezioni (per esempio, infezione da varicella zoster), anomalie polmonari restrittive
e polmoniti ricorrenti. In seguito a TMO può svilupparsi anche cataratta e spesso per
gli effetti collaterali delle terapie si verifica sterilità.
2.2.1 Il processo di assistenza
infermieristica
nel malato
oncologico
Le prospettive per gli assistiti oncologici sono molto migliorate grazie ai progressi
scientifici e tecnologici. Tuttavia, a causa della malattia stessa o di varie modalità di
trattamento, la persona può trovarsi ad affrontare molti problemi secondari, come
infezioni, leucopenia, sanguinamenti, problemi cutanei, problemi nutrizionali, dolore
fatigue e stress psicosociale.
Accertamento
Indipendentemente dal tipo di trattamento e dalla prognosi di cancro, molti assistiti
oncologici sono suscettibili a questi problemi e complicanze. All’interno dell’equipe
sanitaria oncologica, l’infermiere riveste un ruolo importante nel valutare questi
problemi e complicanze:
- INFEZIONI. Le infezioni sono la causa principale di mortalità tra gli assistiti
oncologici. I fattori predisponesti le infezioni sono riassunti nella Tabella 2.2.1.
L’infermiere ispeziona siti comuni di infezione, quali, faringe, cute, zona perianale,
apparato urinario e respiratorio, devono essere controllati con frequenza, così come i
segni tipici di infezione come febbre, gonfiore, arrossamento, drenaggio e dolore, che
tuttavia possono essere assenti nel soggetto immunosoppresso a causa della ridotta
risposta infiammatoria locale, in cui la febbre può essere il solo segno evidente di
infezione. Sia la conta totale dei globuli bianchi, sia la concentrazione dei neutrofili
sono importanti per determinare la capacità dell’organismo di combattere l’infezione.
26
Tabella 2.2.1 FATTORI PREDISPONENTI IL MALATO ONCOLOGICO
ALLE INFEZIONI
FATTORI
MECCANISMI SOTTOSTANTI
Molti agenti causano mielosoppressione, provocando una
Chemioterapia/
riduzione della produzione e della funzionalità dei globuli
Radioterapia
bianchi. Gli agenti chemioterapici che causano mucositi
danneggiano l’integrità della cute e della membrana mucosa.
Danni organici, quali fibrosi polmonare o cardiomiopatia,
associati a taluni agenti, possono predisporre la persona a
infezioni. Le radiazioni coinvolgenti siti di produzione del
midollo osseo possono avere, come conseguenza,
mielosoppressione e danni tissutali.
Neoplasia maligna Le cellule tumorali possono infiltrare il midollo e interferire con
la produzione di globuli bianchi e linfociti. Neoplasie maligne
ematologiche (leucemie e linfomi) sono legate ad alterazioni
della funzionalità e della produzione di cellule ematiche
Riporta come conseguenza, alterazioni della funzionalità e della
Malnutrizione
produzione di cellule della risposta immunitaria. Può
contribuire alla compromissione dell'integrità cutanea.
Gli antibiotici alterano l'equilibrio della flora batterica,
diventando patogeni.
Creano meccanismi d’ingresso per organismi patogeni.
Farmaci
Cateterizzazione
urinaria
e
endovenosa
Altre
procedure Provoca danni cutanei e può introdurre organismi esogeni nel
sistema
invasive
L’invecchiamento è legato a indebolimento delle funzioni
Età
organiche e alla diminuzione della produzione e del
funzionamento delle cellule del sistema immunitario
Patologia cronica Associate a compromissione della funzionalità organica e ad
alterazioni della risposta immunitaria
Espone a infezioni ospedaliere e alla colonizzazione di nuovi
Degenza
organismi
prolungata
27
- SANGUINAMENTI. L’infermiere accerta l’assistito oncologico per fattori che
possono contribuire a emorragie. Questi includono la mielosoppressione come
conseguenza della chemioterapia, radioterapia o somministrazione di altri farmaci
che interferiscono con la coagulazione e la funzione piastrinica. Siti associati spesso
a emorragie sono la cute e le membrane mucose, il cervello e gli apparati intestinale,
urinario e respiratorio. Devono essere controllati e riferiti eventuali abbondanti
sanguinamenti in feci, urine, escreato o vomito (melena, ematuria, emottisi,
ematemesi), nonché nei siti di iniezione, contusioni (ecchimosi), petecchie e
alterazioni dello stato mentale.
- PROBLEMI CUTANEI. Il mantenimento dell’integrità cutanea e tissutale è un
problema a causa degli effetti della chemioterapia, radioterapia e chirurgia e di
procedure invasive a scopo diagnostico e terapeutico. Come parte dell’accertamento,
l’infermiere identifica l’eventuale presenza di questi fattori predisponenti e di altri
possibili fattori di rischio, quali deficit nutrizionali, incontinenza fecale e urinaria,
immobilità, immunosoppressione, piaghe cutanee multiple e modifiche legate all’età.
Risulta dunque fondamentale rilevare la presenza di lesioni o ulcerazioni cutanee
causate dal tumore, la presenza di qualsiasi lesione delle membrane della mucosa
orale e i loro effetti sullo stato nutrizionale dell’assistito e sul suo livello di benessere
e alterazioni nell’integrità tissutale dell’apparato gastrointestinale, in quanto risultano
particolarmente fastidiose per gli assistiti.
- PERDITA DEI CAPELLI. L’infermiere annota la presenza di alopecia (caduta di
capelli), un’altra forma di danno tissutale di frequente riscontro in soggetti sottoposti
a radioterapia o chemioterapia. Inoltre, l’infermiere deve anche valutare l’impatto
psicologico di questo effetto collaterale sull’assisto e sui suoi familiari. Nel caso del
trapianto ai pazienti è richiesto il taglio dei capelli all’entrata in TMO. A seguito poi
della ricrescita durante la degenza gli verranno ritagliati di nuovo al momento della
caduta che di solito avviene poco dopo l’attecchimento.
- PROBLEMI
NUTRIZIONALI.
Un
importante
ruolo
infermieristico
è
l’accertamento dello stato nutrizionale dell’assistito. Un’alterazione dello stato
nutrizionale può contribuire alla progressione della malattia, alla diminuzione della
sopravvivenza, all’immunocompetenza, all’aumentata incidenza di infezioni, al
ritardo della guarigione tissutale, alla diminuita abilità funzionale, alla capacità di
continuare la terapia con antineoplastici, all’aumentata degenza ospedaliera, e
28
all’alterata funzione psicosociale. Un alterato stato nutrizionale, un calo ponderale e
la cachessia (perdita muscolare, soggetto emanciato) possono verificarsi a causa di
una riduzione dell’apporto calorico e proteico, degli effetti di un tumore locale, di
una patologia sistemica, gli effetti collaterali legati alla terapia, dello stato emotivo
della persona. Il peso dell’assistito e il suo apporto calorico devono essere rilevati
quotidianamente. Altre informazioni ottenibili con l’accertamento includono la storia
alimentare, la frequenza e durata degli episodi di anoressia, le alterazioni
nell’appetito, le situazioni e i cibi che aggravano o alleviano l’anoressia, la storia
farmacologica. Si verifica che l’assistito presenta difficoltà nella masticazione o
deglutizione se si sono verificati episodi di nausea, vomito o diarrea. I dati clinici e di
laboratorio sono utili per l’accertamento dello stato nutrizionale; fra essi vi sono le
rilevazioni antropometriche (piega cutanea del tricipite e circonferenza del tratto
medio superiore del braccio), i livelli di proteinemia (albumina e transferrina), gli
elettroliti sierici, la conta dei linfociti, i valori dell’emoglobina, l’ematocrito, i livelli
di creatinina urinaria e i livelli di ferro sierico.
- DOLORE. Nel cancro, dolore e malessere possono essere legati alla malattia
sottostante, alla pressione che il tumore esercita, a procedure diagnostiche o alle
terapie utilizzate. Come in ogni altra situazione che comporti la presenza di dolore,
anche nel caso di cancro la sofferenza è condizionata da fattori fisici e psicosociali.
L’infermiere accerta anche i fattori che possono aumentare la percezione di dolore
dalla persona, come paura e apprensione, senso di spossatezza, rabbia e isolamento
sociale. Le scale di valutazione del dolore sono utili sia per identificare il livello di
sofferenza della persona prima di intraprendere terapie antalgiche, sia per valutare la
loro efficacia.
- FATIGUE. Per effettuare un accertamento accurato, l’infermiere deve distinguere
tra fatigue acuta, che si verifica dopo un’esperienza che richiede energia, e fatigue
cronica, che è spesso caratterizzata dal senso di essere sopraffatti, è eccessiva e non
risponde al riposo. La fatigue acuta ha una funzione protettiva a differenza di quella
cronica, che influisce gravemente sulla qualità della vita. La fatigue è il più comune
effetto collaterale riferito dai soggetti sottoposti a chemioterapia e radioterapia.
L’accertamento si basa sull’individuazione della presenza di stanchezza, debolezza,
mancanza di energia, incapacità di assolvere alle necessità quotidiane, diminuzione
di interesse, di motivazione e di capacità di concentrazione. La persona può diventare
29
meno reattiva alla conversazione o apparire pallida con un rilassamento della
muscolatura facciale. L’infermiere esamina gli agenti di stress fisiolologici e
psicologici che contribuiscono alla fatigue, che può essere preceduta, accompagnata
o seguita da dolore, nausea, dispnea, stipsi, paura e ansia.
- STATO PSICOSOCIALE L’accertamento dell’assistito oncologico si concentra
anche sullo stato mentale psicologico del soggetto e dei suoi familiari nell’affrontare
questa esperienza cosi minacciosa per la vita, sui test diagnostici, sulle modalità di
trattamento spiacevoli e sulla progressione della malattia. L’infermiere accerta
l’umore e le reazioni emotive della persona ai risultati dei test diagnostici e alla
prognosi, nonché il suo passaggio attraverso i vari stadi del lutto e il rapporto con i
familiari nel comunicare loro la diagnosi e la prognosi.
- IMMAGINE
CORPOREA.
L’infermiere
identifica
potenziali
minacce
all’immagine corporea della persona e accerta l’abilità della persona di affrontare le
molte alterazioni della propria immagine corporea che sperimenta nel corso della
malattia e del trattamento. L’ingresso nel sistema sanitario è spesso accompagnato da
depersonalizzazione. Vi sono enormi minacce all’autostima allorché la persona
prende coscienza della malattia, di possibili infermità e della morte. Molti assistiti
oncologici sono costretti a modificare il loro stile di vita per adattarsi alle terapie o
come diretta conseguenza della malattia. Le priorità e i valori cambiano quando
l’immagine corporea è minacciata. Chirurgia sfigurante, perdita dei
capelli,
cachessia, alterazioni cutanee, alterazioni dei modelli di comunicazione e disfunzioni
sessuali sono alcuni dei devastanti effetti del cancro e del suo trattamento che
possono minacciare l’autostima della persona e la sua immagine corporea. Il compito
dell’infermiere è quello di raccogliere le difficoltà del paziente e attraverso la
relazione e la compliance che si è creata, interagire con la persona in modo di
attenuare la sofferenza e spostare l’attenzione su obiettivi più importanti, alla sua
accettazione.
30
Diagnosi Infermieristiche in TMO
Rischio elevato di gestione inefficace del regime terapeutico;
Rischio di ansia e paura;
Rischio di coping inefficace;
Rischio di deficit cura di sé;
Rischio elevato di infezione;
Rischio di compromissione della mucosa;
Dolore acuto;
Rischio di alterazione ritmo sonno;
Rischio di tensione nel ruolo del caregiver;
Rischio di sofferenza spirituale
Pianificazione e obiettivi
Gli obiettivi principali per l’assistito possono includere il mantenimento dell’integrità
tissutale, il mantenimento dello stato nutrizionale, il sollievo dal dolore e dalla
fatigue, il miglioramento dell’immagine corporea, l’effettiva progressione attraverso
il processo di lutto e l’assenza di complicanze.
Interventi infermieristici di psico-oncologia
L’intervento psicologico si propone di aiutare il paziente e i suoi familiari nella
gestione dello stress che necessariamente è associato ai vari momenti dell’iter
terapeutico, di mantenere e ristabilire la qualità di vita antecedente la diagnosi, di
attenuare l’ansia e la depressione, di aiutare il paziente a trovare un senso a ciò che
sta vivendo e soprattutto di aiutarlo ad attivare tutte le risorse psichiche per far fronte
alla malattia e ai trattamenti, di aiutare la famiglia ad integrare la malattia nella
propria organizzazione quotidiana, di sviluppare modalità più funzionali e positive
per affrontare la malattia. In alcuni casi l’approccio psicologico può richiedere un
intervento integrato con l’ausilio della psico-farmacologia. Nella reazione alla
malattia oncologica va sottolineato come elemento chiave la valutazione cognitiva
che il paziente dà all’evento stesso, caratterizzandone l’attribuzione di significato. I
processi di valutazione cognitiva sono influenzati da vari fattori tra cui la struttura di
personalità del malato, l’insieme di convinzioni su di sé e sulla propria situazione, le
aspettative e i progetti personali, il senso di identità e di controllo degli eventi, le
esperienze precedenti e il livello di supporto sociale ricevuto.
31
I fattori che possono influire negativamente nel processo di adattamento alla malattia
possono consistere in un elevato valore simbolico soggettivo attribuito all’evento,
nella ridotta capacità di gestione delle situazioni stressanti, nello scarso senso di
controllo della situazione e nella percezione di minaccia e di perdita. L’intervento
psicologico può esser effettuato in sessioni individuali e/o di gruppo, inteso o come
un gruppo di pazienti, ma anche tutto il nucleo familiare. L’avvento di una malattia
complessa come il cancro, con tutte le implicazioni relative ed affettive, rompe
l’equilibrio emozionale che la famiglia si è data e richiede uno sforzo di
riadattamento. La tabella 2.2.2 riassume i principali interventi psicologici e
psicoterapeutici utilizzati in oncologia, le metodologie di intervento e gli obiettivi
che si propone. La terapia comportamentale e cognitiva è centrata sulla crisi
scatenata dalla malattia oncologica e sul controllo del sintomo.
Gli incontri sono a cadenza settimanale e si protraggono per alcuni mesi. Si
configura perlopiù come una psicoterapia breve e lo scopo è quello di analizzare e
modificare schemi di risposte non adattive e patologiche. È il caso di pazienti con
disturbi del sonno, nausea e vomito anticipatorio, fobie legate alla malattia, dolore
psicogeno, anoressia. La terapia cognitiva mette in rilievo come aspettative, pensieri,
credenze, convinzioni siano spesso decisive nel determinare o influenzare le modalità
di reazione sia da un punto di vista psicologico sia somatico. La psicoterapia ad
orientamento analitico applicata in ambito oncologico non è, come per le precedenti
impostazioni psicoterapeutiche, così sistematica e ricca di documentazione
bibliografica, di solito sono terapie più lunghe nel tempo in quanto prevedono un
lavoro psicodinamico profondo. A differenza delle precedenti l’obiettivo è la
ristrutturazione della personalità. Anche le terapie di gruppo si fanno sostanzialmente
agli stessi paradigmi teorici di quelli utilizzati negli incontri individuali, tuttavia
lavorare in gruppo è per certi versi molto differente, infatti il gruppo stesso ha in sé
un potenziale terapeutico molto forte. È possibile individuare fattori terapeutici
generali che si riscontrano in tutti i gruppi a prescindere dal tipo di conduzione e di
riferimento teorico:
- I partecipanti possono essere modello l’uno per l’altro
- Possono aiutarsi reciprocamente nella comprensione delle dinamiche psicologiche
reattive alla malattia
32
- Condividono le esperienze, imparano ad ascoltarsi e anche a realizzare il proprio
vissuto
- Si possono sentire inclusi ed accettati in un gruppo e questo può contrastare il
senso di solitudine vissuto in famiglia e/o nei rapporti sociali
- Possono parlare liberamente dei propri vissuti e sentirsi compresi
- Il gruppo può essere un forte contenitore delle ansie reciproche
Gruppi di malati oncologici sono solitamente costituiti da 8/10 pazienti, gli incontri
si svolgono a cadenza settimanale della durata di 90 min circa a seduta. La
composizione può essere eterogenea oppure omogenea per patologia e/o trattamento.
L’obiettivo può esser la riduzione del sintomo (es. nausea e vomito anticipatorio,
insonnia, etc. ) oppure il confronto verbale su temi comuni a tutti i malati come la
paura della malattia, mutilazioni chirurgiche e le loro implicazioni psico-sociali,
ripercussioni sulla famiglia, paura della cronicizzazione. In questi ultimi anni sono
stati pubblicati numerosi studi sull’efficacia dei trattamenti psicologici e
psicoterapeutici nei malati di tumore.
In particolare si è osservato: riduzione dei sintomi( tensione, rabbia, insonnia, ansia,
depressione), migliore capacità di adattamento, migliore comunicazione con i
familiari e lo staff medico, aumento dell’autostima e dell’immagine corporea,
migliore gestione dello stress e della relazione con il partener. Una recente revisione
sugli effetti degli interventi psicologici sottolinea come questi possano avere
importanti implicazioni anche da un punto di vista economico, andando a ridurre il
costo complessivo dell’intervento medico. Esistono altri interventi a valenza
psicologica anche se non strettamente psicoterapeutici, sono rappresentati
sostanzialmente dai programmi informativi sulla malattia e sui trattamenti e dai
gruppi di mutuo aiuto. I programmi informativi si propongono di promuovere nei
pazienti una più chiara comprensione della loro situazione aumentando la
conoscenza sulla malattia e sui trattamenti. 20
20
Gianni Bonadonna, Medicina oncologica, VIII ed., Milano, Elsevier Masson, 2007
33
Tab. 2.2.2 Terapie psicologiche nei malati oncologici
TIPO
DI METODI
E OBIETTIVI
INTERVENTO
STRATEGIE
ADOTTATE
Informazioni
sulla Aumentare la conoscenza
Tecniche
psicoeducazionali malattia, sui trattamenti, riguardo la malattia e sui
sugli studi clinici, sulla trattamenti; favorire il senso di
gestione
degli
effetti controllo sull’esperienza della
collaterali e sugli aspetti malattia; aumentare i livelli di
emozionali.
compliance; aiutare a risolvere
i problemi pratici; favorire la
comunicazione con l’equipe
terapeutica.
Rilassamento
(training Ridurre lo stress psicologico
Tecniche
rilassamento Sviluppare
modalità
più
comportamentali autogeno,
muscolare progressivo); funzionali e positive per
desensibilizzazione
affrontare le cure e la gestione
sistemica; Biofeedback
della malattia
Visualizzazioni
di Modificare i processi mentali e
comportamenti
immagini mentali; Ipnosi; conseguenti
disadattivi
Distrazione
e
programmazione
di
attività
Analisi delle convinzioni Verbalizzare i pensieri e
sulla malattia e sui sentimenti relativi alla malattia
Tecniche
trattamenti
Aiutare ad affrontare le
cognitive
Ristrutturazioni mentali tematiche
esistenziali
sulla malattia e sui sollecitate dalla malattia
trattamenti
Modificare i processi mentali e
conseguenti
comportamenti
disadattivi
Esplorazione dei conflitti Chiarire
l’influenza
di
Tecniche
emozionali antecedenti la eventuali
esperienze
psicodinamiche
malattia
precedenti alla diagnosi
Analisi della malattia alla Aiutare ad integrare la malattia
luce delle dinamiche nella propria esperienza di vita
psichiche inconsce
34
3
Capitolo: Degenza a bassa carica
microbica, tra Distress e Coping
3.1
Premessa
Il tempo della malattia è spesso accompagnato da stress molto intenso. Tutto ciò è
particolarmente vero quando parliamo di una malattia complessa come il cancro. La
diagnosi oncologica e le terapie spesso lunghe e debilitanti possono provocare nei
malati un vissuto di ansia, disagio e disorientamento psicologico che può interessare
anche tutto il contesto familiare. Fare i conti con una malattia oncologica è per la
stragrande maggioranza delle persone uno shock emotivo intenso e sollecita tutti gli
aspetti della vita. La condizione di malattia non è solo una questione meramente
fisica, essere malati significa vivere una difficoltà che abbraccia ogni aspetto della
vita: fisico, mentale e spirituale. Non rientrano nell’osservazione clinica i corpi
complessi; che pensano, che si emozionano, che soffrono, che gioiscono. Il corpo di
cui stiamo parlando non è il corpo senz’anima dei tavoli anatomici, quello che
Michel Foucault ha descritto essere alla base della clinica medica21. Il corpo di cui
stiamo parlando è quello che ciascuno di noi sperimenta direttamente nel mondo e
nelle relazioni. È quello carico di senso e che rende unica e irripetibile la vita. Tutto
ciò significa consentire alla persona malata di cancro la possibilità di esprimere i suoi
vissuti personali, di elaborarli nella narrazione, di confrontarsi, di costruire un senso
comune all’evento. Quello che genericamente possiamo chiamare sofferenza
psicologica riassume un insieme di sintomi che sono diversi in relazione allo stadio
della malattia, ma anche ai trattamenti. Da alcune ricerche effettuate sia negli Stati
Uniti sia in Europa emerge che i disturbi psicologici osservati più frequentemente
durante tutto l’iter terapeutico sono: ansia, depressione, nausea e vomito
anticipatorio, anoressia, disfunzioni sessuali, disturbi del sonno, dolore psicogeno e
disturbi cognitivi. In molti casi questi sintomi soddisfano per intensità e frequenza i
criteri diagnostici del Diagnostic and Statistical Manual of Mental Disorder (DSMIV).22
21
22
Michel Foucault, Nascita della clinica-Una archeologia dello sguardo medico, Torino, Einaudi,1969
G. Bonadonna, Medicina oncologica, 8 ed., Milano, Elsevier Masson, 2007
35
3.2 L’adattamento alla malattia
Le specifiche modalità di risposta alla malattia, ovvero la caratterizzazione del
processo di adattamento, vengono racchiuse all’interno del concetto di coping. Esso
può essere definito come lo sforzo cognitivo e comportamentale di gestire lo stress
psicologico, quando questo supera un certo livello di guardia. La reazione alla
malattia, legata agli stressor e alle caratteristiche personali, consente di affrontare la
crisi come un momento di transizione verso successive condizioni di adattamento
oppure di disadattamento. In uno studio condotto su 31 pazienti, a distanza di 1-2
anni dal TMO, si evince che la possibilità di guarigione e la positività del decorso
della malattia sono proporzionali al coinvolgimento attivo del paziente, protagonista
della terapia e dell’evoluzione dei sintomi, nei cambiamenti del corpo e nei vissuti
soggettivi. In particolare uno stile di coping efficace e una personalità attiva, gioiosa
e ottimista, pur presentando i normali e comprensibili livelli di ansia e depressione,
sono associati ad un incremento della sopravvivenza post-trapianto. Contrariamente è
stato osservato che gli esiti peggiori e un calo della sopravvivenza si hanno in quei
pazienti che presentano uno stile di coping inefficace e la propensione verso
l’accettazione della malattia, intesa come un’attitudine ad arrendersi e mostrarsi
passivi nei confronti di essa, perché non riescono neppure ad elaborare la depressione
e a trasformarla in voglia di lottare efficacemente contro il male.
23
Un numero
estremamente elevato di studi ha rilevato che il 60-70% dei pazienti con cancro
presenta una normale risposta di adattamento alla malattia, mentre il 30-40% non
riesce ad adattarsi e manifesta disturbi della sfera affettiva; principalmente
depressione, ansia e disturbi dell’adattamento, in accordo con i sistemi nosografici
ICD-1024 e DSM-IV25, in risposta al cancro e ai trattamenti oncologici. Una
percentuale di pazienti che si aggira intorno al 15-25% manifesta inoltre altre
condizioni significative di sofferenza psicologica e sociale (ad esempio ansia
correlata allo stato di salute, umore irritabile, demoralizzazione, o distress
23
A. Molassiotis et al., sympton distress, coping style and biological variables as predictors of survival
after bone marrow transplantation, Journal of psychosomatic research, vol. 42,3: (275-285), 1997
24
La classificazione ICD (International Classification of Diseases) è la classificazione internazionale
delle malattie e dei problemi correlati, stilata dall'Organizzazione mondiale della sanità (OMS).
25
Il Manuale diagnostico e statistico dei disturbi mentali, noto anche con la sigla DSM (Diagnostic
and Statistical Manual of Mental Disorders), è uno dei sistemi nosografici per i disturbi mentali o
psicopatologici più utilizzati da medici, psichiatri e psicologi di tutto il mondo, sia nella pratica clinica
che nell'ambito della ricerca.
36
emozionale) che non sono identificabili attraverso i sistemi diagnostici come il DSMIV e l’ICD-10, mentre possono essere colti con altri sistemi, quali i Diagnostic
Criteria for Psychosomatic Research (DCPR). Ciò assume particolare rilievo poiché
tali quadri appaiono caratterizzati da un’importante disfunzionalità ed ostacolano il
normale processo di adattamento. Numerosi studi hanno messo in luce
un’associazione esistente tra distress clinicamente significativo e modalità di coping
disfunzionale, riduzione della qualità della vita e delle relazioni sociali, rischio di
suicidio, riabilitazione più lunga, scarsa aderenza ai trattamenti, reazione abnorme
nei confronti della malattia, disturbi del funzionamento familiare, nonché possibile
riduzione della sopravvivenza del paziente.
26
Con l’intento di aumentare la
probabilità con cui i pazienti oncologici con sintomi di disagio psicosociale vengono
identificati ed aiutati, sono stati elaborati e proposti strumenti di screening e
diagnostici e implementate le linee-guida. Dal momento che il disagio psicologico
può svilupparsi durante tutte le diverse fasi della malattia, le pratiche di screening
sono state raccomandate come parte integrante della comune pratica clinica
nell’ambito dell’oncologia e delle cure palliative.
3.3 Risposta agli stressor
Le caratteristiche peculiari con cui la malattia colpisce la persona (fisicamente e
psicologicamente) vengono riunite sotto il concetto di distress. Dalla ricerca sullo
stress è emersa una nuova visione del funzionamento dell’organismo umano fondata
sulle interrelazioni tra i grandi sistemi biologici dell’organismo e la psiche. Lo stress
è oggi considerato un importante modulatore del sistema immunitario, in quanto è
stato dimostrato come alcuni parametri immunitari siano influenzati da stressor sia
fisici che psicologici. Eventi stressanti infatti, sono in grado di innescare risposte
cognitive ed affettive in grado di indurre cambiamenti nel sistema nervoso centrale e
sul sistema endocrinologico, causando in ultimo, modulazioni verso il basso del
sistema immunitario, con conseguenze quali l’aumento del tasso di infezione e
aumento della progressione e dell’incidenza del cancro27.
26
M.G. Nanni, R. Carruso, L. Grassi, Implicazioni cliniche e criticità nella valutazione del distress
emozionale in oncologia come sesto parametro vitale, Giornale Italiano di Psico-Oncologia. Vol. 13 N. 1/2011
27
A. Molassiotis et al., sympton distress, coping style and biological variables as predictors of survival
after bone marrow transplantation, Journal of psychosomatic research, vol. 42,3: (275-285), 1997
37
Per questi motivi, il contenimento dei livelli di stress è da ricercarsi prevalentemente
nei pazienti affetti da patologie onco-ematologiche e candidati al trapianto di cellule
staminali
emopoietiche,
poiché
fortemente
debilitati
sia
fisicamente
che
psicologicamente. Tra i fattori di rischio per il distress possiamo identificare:
-
Peggiore funzionamento fisico, dovuto ai trattamenti mielosoppressivi indotti
da chemio/radioterapia ed eventuali effetti collaterali (Infezioni, nausea, vomito,
anemia, sanguinamenti);
-
Dolore e Fatigue;
-
Precedenti disturbi psichiatrici;
-
Cattiva comunicazione con l’equipe curante;
-
Assenza di sostegno sociale;
-
Storia personale e familiare di cancro.
Il disagio psicologico se non adeguatamente riconosciuto e trattato può favorire
l’insorgenza di complicanze come una riduzione dell’adesione alle cure, aumento
della permanenza del ricovero, ritiro dalla vita sociale e compromissione delle
relazioni, peggioramento della qualità di vita, aumento della morbilità. 28
Inoltre i pazienti possono manifestare specifiche complicanze psicologiche a seconda
della fase del percorso assistenziale in cui si trovano. Vengono identificati lungo il
percorso assistenziale tre stadi di particolare importanza: la prima fase relativa
all’ingresso del paziente in reparto vengono rilevati stati di ansia esistenziale e di
depressione legato all’insieme di dubbi e incertezze che il paziente porta con sé e alla
paura di morire. In questo contesto può rivelarsi fondamentale l’intervento del
professionista infermiere, che attraverso un approccio relazionale corretto ed un
intervento educativo mirato può contribuire a ridurre significativamente l’ansia del
paziente. La mancanza di informazioni infatti può sviluppare incertezza, ansia e
depressione nell’assistito. Nel giorno del trapianto di cellule staminali invece si
assiste ad una notevole diminuzione dei livelli di ansia, tuttavia ad un incremento dei
disturbi somatoformi. Inoltre durante il ricovero il paziente può andare incontro ad
un esperienza di stress da isolamento, correlato da un lato alla carenza di supporto
sociale che si ha durante il periodo di isolamento protettivo, durante il quale le
relazioni interpersonali con familiari e amici sono ridotte al minimo, e dall’altro agli
28
M.A.Annunziata, La valutazione del distress: sesto parametro vitale in oncologia, III° Conferenza
Regionale HPH del Friuli Venezia Giulia.
38
alti livelli di ansia registrati inizialmente che possono in un secondo momento essere
espressi attraverso sintomi fisici, spie di un disagio profondo. Infine, nella fase postTMO, i disturbi somatoformi rappresentano il problema principale accusato dai
pazienti, possono presentarsi sia un vissuto di paura relativo alla perdita del supporto
dei sanitari, sia una crisi della compliance nella relazione con il personale sanitario,
sia, infine, un profondo distress associato a un vissuto di perdita permanente (ad es.
infertilità). Il supporto della famiglia e delle persone più care al paziente è di
fondamentale importanza nell’esperienza di una persona con cancro, riconosciuti
come parte integrante del progetto di cura. Il semplice abbraccio di una persona cara
arreca nel paziente un aumento dei livelli di autostima, memoria, benessere, e una
diminuzione dei livelli di stress, ansia e depressione. Tuttavia gli abbracci terapeutici
e la vicinanza fisica dei propri cari è limitata nei pazienti degenti in un unità di
trapianto
di
midollo
osseo,
i
quali
sperimentano
lunghi
periodi
di
immunodepressione determinati dai regimi di condizionamento radio/chemioterapici. A causa dell’estrema esposizione a rischi di tipo infettivo è necessario allora
proteggere il più possibile questi malati in ambienti isolati, dove l’aria viene immessa
a pressione positiva dopo esser stata filtrata attivamente per una massima
decontaminazione. La camera sterile è un ambiente di degenza singolo, all’interno
del quale la persona trascorre un periodo di tempo variabile dai 20 giorni, fino anche,
nei casi limite, a 6-9 mesi, in attesa dell’attecchimento del nuovo midollo osseo,
della fine del periodo di aplasia e della normalizzazione dei parametri clinici. I
pazienti sottoposti a trapianto di midollo osseo e degenti all’interno di una camera
sterile sperimentano una condizione simile a quella vissuta in una terapia intensiva.
Pazienti ricoverati in tale ambito o in ambienti particolarmente stressanti sono esposti
a sviluppare dei cambiamenti di carattere percettivo-sensoriale noti come sindrome
ICU (Intensive Care Unit), nel cui sviluppo incidono fattori quali la malattia
organica, la personalità del paziente, l’età e la situazione emotiva, ma sono altrettanto
decisivi fattori ambientali come l’isolamento, l’ambiente impersonale, il sovraccarico
sensoriale e la deprivazione del sonno. Secondo uno studio, per i pazienti i principali
fattori di stress ambientali presenti in una camera sterile, riguardano: 29
29
G.Caocci, G. La Nasa, A. Orabo, Humanizing medical structures: the issue of a low-bacterial
environment in the bone marrow transplant unit, Journal of Medicine & The Person, vol 2, n.3, 2004
39
-
Riduzione/impossibilità al movimento a causa degli esigui spazi ambientali o
delle condizioni psicofisiche del soggetto.
-
Alterazione del ritmo sonno veglia, dovuto alle frequenti interruzioni del
riposo, indotte da stressori acustici e luminosi presenti nella camera.
-
Presenza di numerose pompe di infusione collegate a cateteri venosi centrali
ed elettrodi per la monitorizzazione dei parametri vitali su monitor di rilevazione dati
-
Scarsa possibilità di vista sull’ambiente esterno
-
Scarsa privacy
Inoltre è stato mostrato come la degenza presso un unità sterile possa alterare la
percezione del mondo esterno, del tempo, del corpo, di sé e dell’ambiente in pazienti
sottoposti a TMO. Rendersi conto anticipatamente riguardo particolari esigenze o
alterazioni presenti nell’esperienza del paziente può risultare decisivo per spostare
l’attenzione del team di cura su tali richieste, favorendole o modificandole il più
possibile, nell’obiettivo di garantire alla persona il massimo benessere psicofisico
possibile. Nonostante significativi progressi, il trapianto di cellule staminali rimane
una procedura estremamente stressante, sia dal punto di vista fisico che emotivo. In
questo contesto può instaurarsi la depressione, una delle condizioni psichiatriche più
comuni nei pazienti sottoposti a trattamento oncologico e un sintomo significativo e
potenzialmente limitante che si manifesta nel corso del trattamento per trapianto di
cellule staminali emopoietiche. Studi indicano infatti che la depressione è prevalente
nei pazienti sottoposti a HSCT , e che un quarto/un terzo di essi sperimenta la
depressione durante la degenza in isolamento o nei primi 100 giorni dal trapianto. La
depressione è associata a molte conseguenze fisiche e psicosociali potenzialmente
negative e interferisce significativamente con la qualità della vita e in generale con la
salute, inoltre può essere coesistente con altri importanti problemi, come il disturbo
da stress post-traumatico30 e l’ideazione suicidaria nei sopravvissuti dopo trapianto.
Un’indagine esplorativa condotta su un totale di 228 pazienti, evidenzia come il
sintomo della depressione varia in base alle fasi del trattamento, in particolare
vengono individuati due momenti; un primo tempo è rappresentato dalla prima visita,
prima dell’inizio del trapianto; un secondo momento invece dalla prima visita
ambulatoriale, dopo 6-7 settimane dal trapianto di HSCT.
30
http://www.apc.it/disturbi-psicologici/disturbo-da-stress-post-traumatico
40
Una prevalenza dei sintomi depressivi (31%) si sono registrati nel secondo momento,
dopo il trapianto; rispetto al 6% di pazienti che manifestano depressione prima del
trapianto. Per cui molti dei partecipanti che raggiungevano elevati punteggi di
depressione post-trapianto, non risultavano depressi prima del trapianto, ciò sta ad
indicare che un paziente apparentemente stabile emotivamente, prima del trapianto
può comunque presentare un rischio significativo per la depressione nel post-HCT.
Dunque non è consigliato attendere i sintomi depressivi, ma piuttosto un attento
riconoscimento, da parte del team curante, degli indicatori di distress, come l’ansia,
tensione e irritabilità, presenti nei pazienti già nelle fasi di pre-trapianto. La presenza
di distress prima del trapianto è infatti indicato come il più valido fattore predittivo
per ansia e depressione post-HSCT. 31
31
S.B Artherholt, F.Hong, D.L. Berry, J.R.Fann, Risk factors for depression in patients undergoing
hematopoietic cell transplantation, Biol Blood Marrow Transplant, 2014, 20: (946-950)
41
4
Capitolo: Distress, sesto parametro vitale in
oncologia
Secondo le ultime stime dell’OMS (organizzazione mondiale della sanità), i tumori
figurano tra le principali cause di morbilità e mortalità in tutto il mondo, con circa 14
milioni di nuovi casi e 8,2 milioni di decessi correlati cancro nel 2012.32 La diagnosi
di cancro e il trattamento sono spesso associati ad elevati livelli di distress
psicosociale, tuttavia molti malati di cancro che necessitano di un aiuto psicosociale,
non ricevono l’adeguato supporto a causa delle difficoltà nel riconoscimento dei
bisogni psicologici dei pazienti. Per tale motivo il National Comprehensive Cancer
Network ( NCCN) ha elaborato delle linee guida per il riconoscimento, la valutazione
e il trattamento del disagio psicosociale, detto anche Distress, per evitare termini
stigmatizzanti quali psichiatrico o psicosociale.
Il Distress è definito come una multifattoriale spiacevole esperienza di natura
psicologica (cognitiva, comportamentale, affettiva), sociale, e/o spirituale che può
interferire con la capacità di efficace adattamento al cancro, ai suoi sintomi fisici e
ai suoi trattamenti. È possibile descrivere il distress come un continuum, che va da
un comune normale sentimento di vulnerabilità, tristezza e paura da un lato, a
problemi che possono divenire invalidanti, come la depressione, l’ansia, il panico,
l’isolamento sociale e le situazioni di crisi spirituale ed esistenziale dall’altro. 33
Secondo Il NCCN tutti i pazienti devono esser sottoposti a screening per il Distress
ad inizio visita, ad intervalli appropriati e quando clinicamente indicato,
specialmente in caso di cambiamenti in status di malattia, come una remissione o
anche in caso di progressione della patologia. Il Distress deve essere identificato,
valutato, in relazione al grado ( lieve, moderato, grave) e alla causa del disagio, per
poter al meglio effettuare un piano assistenziale adeguato, indirizzando la persona al
servizio più idoneo e offrendo l'opportunità, agli operatori sanitari, di comprendere
meglio le preoccupazioni e le problematiche dei loro pazienti, instaurando un
rapporto di empatia e di reciproca fiducia con la persona assistita.
32
33
http://www.epicentro.iss.it/temi/tumori/aggiornamenti.asp
NCCN clinical practice guidelines in oncology, Distress Management, 2014
42
4.1 Test di screening per il Distress
L’Identificazione dei bisogni psicologici del paziente è fondamentale per sviluppare
un piano di cura e gestire i bisogni del paziente. Lo strumento di screening ideale per
il monitoraggio del distress nei pazienti con cancro dovrebbe essere semplice ed
efficace, e dovrebbe integrare la valutazione delle preoccupazioni psicologiche e
sociali, così come la valutazione fisica. Inoltre lo screening dovrebbe non solo
quantificare il livello di stress, come ad esempio con il termometro del distress (scala
0-10), ma anche la natura del disagio, quindi il termometro del distress dovrebbe
esser correlato con una lista che ne permetta l’identificazione del problema
correlato.34 Tra gli strumenti più comunemente utilizzati per la misurazione del
Distress emozionale troviamo: L’Hospital Anxiety and Depression Scale (HADS), il
sistema Edmontom Symptom Assesment System (ESAS), Canadian Problem Check
List e Psychological Screen for Cancer (PSSCAN) e il Distress Thermometer (DT).35
Edmonton Symptom Assessment System (ESAS)
L' ESAS è lo strumento di screening più utilizzato in Canada, fa riferimento
all'individuazione di 9 dei comuni sintomi presenti nel paziente oncologico. La
gravità di ogni sintomo viene valutata su una scala numerica da 0 a 10 ( 0 equivale ad
assenza di sintomo, 10 corrisponde alla massima gravità del sintomo). I sintomi
esaminati includono lo screening per il dolore, stanchezza, nausea, depressione,
ansia, sonnolenza, appetito, benessere, e mancanza di respiro. L'ESAS presenta
comunque delle limitazioni, in quanto analizza problematiche fisiche e psicosociali
ma trascura quelle pratiche.
Canadian Problem Check List rappresenta uno strumento di screening in
riferimento a problematiche psicosociali, pratiche e fisiche, adottato in associazione
con la somministrazione dell' ESAS.
34
L. Vitek, M.Q. Rosenzweig, S. Stollings Distress in Patients With Cancer:Definition, Assessment, and
Suggested Interventions, Clinical journal of oncology nursing, 2007, Vol.11, 3: (413-418)
35
Cancer Journay Action Group “ Guide to Implementing Screening for Distress, the 6th Vital Sign
Moving Towards Person-Centered Care, Canadian Partnership against cancer, 2009
43
Hospital Anxiety and depression Scale (HADS) è una scala molto semplice,
composta da 14 item che esplorano tanto l’ansia generalizzata che la depressione,
mantenendo divisi i due punteggi. La caratteristica principale della scala è che
esclude dalla valutazione la sintomatologia somatica, la quale potrebbe esser confusa
con i sintomi della malattia o con gli effetti collaterali del trattamento (e.g. calo
ponderale, fatigue); concentrando invece l’attenzione, per la depressione, sulla
riduzione delle capacità edoniche, considerate gli indicatori più sensibili di questo
disturbo.36-37
4.2 Distress Thermometer
Uno strumento specifico, il termometro del distress (DT Distress Thermometer), è
stato elaborato dal gruppo del NCCN che lo ha posto come test di screening breve
che può essere utilizzato nella comune pratica clinica e con rapidità per valutare il
distress in ambito oncologico. Il DT è uno strumento a carattere di analogo visivo
(come la scala Visual Analogue Scale per il dolore), composito di due parti: una
prima parte chiede al soggetto di indicare il suo livello di distress sperimentato
nell’ultima settimana, compreso il giorno stesso della rilevazione, ponendo un
cerchio attorno al numero corrispondente al termometro su una scala che va da 0 a 10
(da 0= Assenza di Distress, a 10= Distress Estremo) e una seconda parte che indaga
possibili problematiche in differenti campi, incluso quello fisico, emotivo, spirituale,
familiare e pratico; quest’ultima parte è di fondamentale importanza per indagare
anche l’origine del disagio e pone le condizioni per l’attuazione di interventi
specifici. 38
36
http://www.psychiatryonline.it/node/3520
P.C. Trask, A.Paterson, M.Riba, et al., Psycosocial consideration Assessment of psychological
distress in prospective bone marrow transplant patients, Boon Marrow Trasplantation, 2002, 29:
(917-925)
38
S.S. Tavernier , Translating research on the distress thermometer into practice, Clinical journal of
oncology nursing, 2014, Vol. 18, 26-30
37
44
Figura 4.2 Distress Thermometer secondo le linee guida Del NCCN
La diffusione di questo modello ha contribuito alla formulazione del concetto di
distress emozionale come sesto parametro vitale, con la stessa rilevanza di pressione
sanguigna, temperatura, frequenza cardiaca, respirazione e dolore e alla proposta di
integrazione della metodologia di screening in oncologia all’interno del sistema di
assistenza sanitaria dei diversi paesi. Seguendo gli obiettivi degli standard proposti
dal NCCN, viene raccomandato l’uso ordinario del DT in ambito oncologico come
mezzo di identificazione rapida dei pazienti che presentano livelli di distress
indicativi di morbidità psicosociale, al fine di facilitare il loro invio adeguato per
interventi di tipo psicosociale. Il DT trova la sua applicazione in diversi contesti
oncologici quali i servizi oncologici ambulatoriali, i reparti ospedalieri, le unità di
cure palliative, e nelle diverse fasi del percorso della malattia.
45
Sono stati redatti moltissimi studi per stabilire l’affidabilità e la validità del Distress
Thermometer come strumento di screening per il distress, in particolare secondo uno
studio condotto da Jacobs et al., il DT è anche uno strumento utile per lo screening
del disagio nei pazienti sottoposti a trapianto di midollo osseo, poiché presenta una
maggiore sensibilità e specificità rispetto al Center for Epidemiological StudiesDepression Scale (CES-D).
39
Inoltre lo stesso autore, in un diverso studio hanno
riscontrato che un punteggio cut-off al DT di 4 è necessario per ottimizzarne la
sensibilità e la specificità nell’individuazione dei casi, rispetto a
strumenti
psicologici considerati gold standard per la misurazione della morbilità psicologica
in oncologia, quali l’Hospital Anxiety and Depression Scale (HADS) e il Brief
Symptom Inventory-18 (BSI-18).
40
Una meta-analisi di studi con più di 14.000
soggetti con cancro hanno confermato la validità di un punteggio corrispondente a 4
al DT come cut-off per l’identificazione del distress (sensibilità 81%, specificità
72%) e la necessità di invio e di intervento per disagio a livello psicologico e sociale
(NCCN, 2014).
39
P.B Jacobsen, S.Ransom,M. Booth-Jones, Validation of the Distress Thermometer with bone
marrow transplant patients, Psycho-Oncology, 15: 604-612,2006
40
Jacobsen PB, Donovan KA, Trask PC, Fleishman SB, Zabora J, Baker F, Holland JC. Screening for
psychologic distress in ambulatory cancer patients. Cancer 2005; 103:1494-1502.
46
Algoritmo per la gestione del Distress
TEST di
SREENING:
Distress
Thermometer
VALUTAZIONE
A chi? – Tutti i malati di cancro
Quando?- pratica routinaria atta a misurare e
controllare le emozioni
Come?- il team di cura consegna e spiega gli
strumenti di rilevazione e preannuncia che i valori
ottenuti saranno discussi all’interno di un colloquio
DT < 4 (Disagio lieve/controllato), I sintomi del
disagio sono attesi (paura, preoccupazione e incertezza
del futuro, poco sonno, scarso appetito, riduzione della
concentrazione) e gestiti sistematicamente dal team
oncologico primario.
DT ≥ 4 (Disagio moderato/grave), il team oncologico
deve approfondire il motivo del disagio (eccessive
preoccupazioni e paure, tristezza eccessiva,
disperazione , problemi familiari gravi, problemi
spirituali o religiosi) e richiedere l’intervento di uno
psicologo, assistente sociale, o di consigliere spirituale,
a seconda dei problemi individuati nella lista dei
INTERVENTI
-Colloquio: Ha lo scopo di restituire al paziente (in
termini non quantitativi) lo stato della propria salute
emozionale.
Si conclude solitamente con la riduzione dell’intensità
emotiva, espressa dal paziente sul piano sia non verbale
sia verbale. In caso di mancata riduzione dei segnali di
distress, l’obiettivo diventa la motivazione del paziente a
intraprendere un percorso psicologico più strutturato.
-Gestione dei problemi: Pratici/sociali-emotivi-spiritualifisici
-Riduzione del livello di ansia
47
Il valore numerico attribuito dal paziente sulla scala analogica del termometro del
distress (da 0 a 10 ), esprime il livello di disagio, di ansia e preoccupazione del
paziente. Secondo le linee guida si possono individuare tre zone all’interno delle
quali è possibile identificare il range del distress del paziente:
1.
41
0-3: Il suo punteggio indica i livelli di difficoltà sono ben controllati al
momento. Il personale comunque sarà sempre a disposizione per ogni ulteriore fonte
di aiuto.
2.
4-6 : Il punteggio indica che vi sono delle difficoltà/ preoccupazioni
significativi. In tal caso è opportuno accertarsi delle cause del distress, relative alla
seconda parte dello screening e favorire il colloquio tra team curante e paziente.
3.
7-10: Il punteggio indica un alto livello di difficoltà, in questo caso è bene
parlarne e confrontarsi assolutamente con l'equipe sanitaria.
41
Hillingdon Oncology & Palliative Care Team, Coping with Stress: The Distress Thermometer, West
London Cancer Network
48
Divisione in zone a seconda del grado di distress:
Zona verde
Score fra 03
Questa zona rappresenta un
lieve disagio ed è di norma
gestito dal team e sono
"attesi" sintomi di disagio:
paura, preoccupazione e
incertezza del futuro,
preoccupazioni per la
malattia, la tristezza per la
perdita di buona salute, la
rabbia e la sensazione che la
vita è fuori controllo, poco
sonno, scarso appetito.
Zona gialla
Score fra 46
Questa zona è un
segnale d'allarme che
indica che le cose stanno
andando fuori controllo
per questo paziente. C'è
bisogno di un intervento
chiaro per ottenere che
questo paziente torni
nella zona verde.
Zona rossa
Score fra 7-10
Questa zona richiede una
risposta urgente da parte
del team clinico. Questi
pazienti
hanno
dei
problemi più gravi per
cui l’analisi deve essere
più
approfondita
e
immediata deve essere la
valutazione. A seconda
dei problemi individuati
nella lista dei problemi
dovremmo rivolgersi a
uno specialista di salute
mentale, l’ assistente
sociale,
o
ad
un
consigliere spirituale.
Per tutti i gruppi dovrebbe avvenire:
1) I punteggi siano riconosciuti da
tutto il team;
2) Il colloquio col paziente va
rivalutato;
3) Seguire con il piano di azione
stabilito in base alla zona dove ci
troviamo.
49
Tabella interventi relativi a livelli di ansia42
42
M.C. Townsend, Diagnosi infermieristiche in psichiatria, Edizioni Internazionali, Roma.2002
50
Seconda parte
5
Progetto di ricerca
5.1 Introduzione e background scientifico
Le patologie oncoematologiche nel loro complesso rappresentano circa il 10% di
tutti i tumori, facendo registrare, nel nostro Paese, 40.000 nuove diagnosi ogni
anno.43 Il trapianto di cellule staminali autologo o allogenico rappresentano valide
opzioni di trattamento, in grado di migliorare significativamente la sopravvivenza in
questo gruppo di pazienti. Allo stesso tempo i pazienti sottoposti a trapianto di
cellule staminali emopoietiche (CSE) ricevono alte dosi di chemio-radioterapia,
esponendoli a sostanziali effetti collaterali durante tutto il periodo di degenza
ospedaliera nelle camere di isolamento, influenzando negativamente la salute
connessa alla qualità di vita del paziente. Il trapianto di CSE è una procedura
complessa che richiede interventi psico-oncologici in una varietà di fasi, a partire
dall’inizio del ricovero, al trapianto stesso, alle crisi dovute alla GvHD, ma anche e
soprattutto dopo la dimissione dalla struttura ospedaliera. Diversi studi hanno
esaminato
la
prevalenza
dei
sintomi
dopo
HSCT;
vengono
segnalati
prevalentemente: infezioni, stanchezza, GvHD, ansia, depressione, fatigue e paura di
recidiva.44-45 Altri studi dimostrano inoltre la presenza di distress emotivo prima di
esser sottoposti a trapianto di CSE, in particolare durante il consenso informato,
considerato come un momento di forte disagio in cui il paziente è chiamato a
fronteggiare le terapie e a prendere decisioni importanti sulla propria salute.46
43
http://www.tumoridelsangue.it/epidemiologia/
AMJ Braamse, B van Meijel et al., Distress, problems and supportive care needs of patients treated
with auto-or allo-sct, Bone Marrow Trasplantation,2014,49: (292-298)
45
Areej R. El-jawahri et al., Quality of life and mood of patients and family caregivers during
hospitalization for hematopoietic stem cell transplantation, Cancer,2014
46
PC Trask, A Paterson, M. Riba, Psycosocial consideration Assessment of psychological distress in
prospective bone marrow transplant patients, Bone Marrow Transplantation, 2002, 29 : (917-925)
44
51
Il Distress è definito come una multifattoriale spiacevole esperienza di natura
psicologica (cognitiva, comportamentale, affettiva), sociale, e/o spirituale che può
interferire con la capacità di efficace adattamento al cancro, ai suoi sintomi fisici e
ai suoi trattamenti. È possibile descrivere il distress come un continuum, che va da
un comune normale sentimento di vulnerabilità, tristezza e paura da un lato, a
problemi che possono divenire invalidanti, come la depressione, l’ansia, il panico,
l’isolamento sociale e le situazioni di crisi spirituale ed esistenziale dall’altro
(NCCN, 2014).
Esso ha un effetto negativo sia sulla qualità della vita, ma determina anche una minor
aderenza alle cure e una diminuzione in termini di sopravvivenza. Il tempo della
malattia è spesso accompagnato da stress molto intenso, obiettivo del team di cura è
il contenimento dei livelli di distress, per incrementare l’aderenza terapeutica e la
risposta alle terapie. Ciò può esser attuato mediante l’utilizzo di test di screening,
come il Distress Thermometer, strumento a carattere di analogo visivo varato dal
gruppo NCCN per valutare il distress e le relative cause nella comune pratica clinica,
in ambito oncologico. Il distress dunque deve esser mantenuto entro un range di
valori, riconosciuto come disagio controllato (DT=0-3) e individuato già nelle fasi
prima del trapianto in quanto predittivo di ansia e depressione nel post-trapianto.
5.2 Obiettivi dello studio
Obiettivo del presente studio è valutare il Distress nei pazienti sottoposti a differenti
tipi di trapianto di cellule staminali ematopoietiche. In particolare analizzare la
relazione tra i fattori sociodemografici e clinici caratterizzanti il paziente ed il suo
grado di Distress (fattori di rischio e protezione), ed il costrutto sotto indagine (i.e.,
distress); in uno studio osservazionale.
5.3 Procedure e metodo
5.3.1 Procedure di campionamento/selezione del campione
Al fine di individuare i pazienti eleggibili per lo studio, la selezione del campione ha
previsto la preliminare stesura di un protocollo contenente sia i criteri di
inclusione/esclusione, che la metodologia adottata per il reclutamento.
52
Campionamento:
Il campione di riferimento è stato reclutato attraverso un censimento completo non
probabilistico relativo alla struttura ospedaliera Centro Trapianti di Midollo Osseo
(TMO) dell' Azienda Ospedaliera Universitaria Careggi di Firenze.
I pazienti risultati eleggibili per lo studio sono 285 pazienti sottoposti a trapianto di
cellule staminali emopoietiche.
Criteri di inclusione:
A) Essere stati sottoposti a trapianto di CSE secondo una delle modalità prese in
considerazione,
B) Essere ricoverati nella struttura di riferimento all'interno del periodo:
Novembre 2011- Settembre 2014.
Criteri di esclusione: minori, barriere linguistiche, problemi cognitivi.
5.3.2 Protocollo clinico di rilevazione misure, e metodi associate
Il protocollo di screening per la gestione del disagio emozionale, presso il Centro
TMO San Luca vecchio di Careggi, prevede la somministrazione del Distress
Thermometer, validato in italiano, a tutti i pazienti candidati a trapianto di CSE
(ALLEGATO A).
Lo strumento viene somministrato al paziente primariamente dal coordinatore al
momento del colloquio prima dell’ingresso nell’unità di degenza. Successivamente il
Distress Thermometer viene consegnato al paziente dagli infermieri del reparto a
partire dal giorno successivo al trapianto e poi viene somministrato con cadenza
settimanale. Quindi a seconda del tipo di trapianto effettuato (autologo/allogenico), si
può riassumere così la cadenza delle rilevazioni:
- Dal giorno 0 del trapianto Autologo : ogni 7 giorni a +1, +8, +15, +22, +29
- Dal giorno 0 del trapianto Allogenico: ogni 7 giorni a +1, +8, +15, +22, +29, +36
Il Distress Thermometer dopo la compilazione viene esaminato e allegato in cartella
infermieristica.
Per la stesura del database di ricerca è risultata fondamentale la revisione della
cartelle cliniche e infermieristiche, in formato cartaceo, dei pazienti presenti
nell’unità di degenza dal Novembre 2011 a Settembre 2014.
53
I parametri di interesse estratti dalle cartelle, sono i seguenti:
1.
Tipologia di trapianto: Autologo / Allogenico
2.
Tipo di donatore nel trapianto allogenico: MUD, da cordone, da familiare.
3.
numero di trapianti ricevuti
4.
Età Paziente
5.
Genere: maschio-femmina
6.
Patologie candidate al trapianto Allogenico: leucemia mieloide cronica/acuta,
linfomi, sindrome mielodisplastica, leucemia linfoblastica acuta, LLC, Mieloma
multiplo, linfoma non Hodgkin, linfoma Hodgkin.
Patologie candidate al trapianto Autologo: Mielomi, linfomi, sclerosi, LMA,ST,
HDG, LNH.
7.
Scolarità: elementare, media inferiore, diploma, laurea.
8.
Stato civile: sposato/a, celibe/nubile, Divorziato/a, separato/a, vedovo/a,
convivente.
9.
Presenza figli
10.
Numero Figli
11.
Figli a carico
12.
Professione:
disoccupato,
studente,
L.
dipendente,
L.
autonomo,
Professionista, casalinga, pensionato.
13.
Presenza familiare portatore di disabilità
14.
Categoria di rischio comorbidità per TMO Allogenico
15.
Nazionalità
16.
Sonno disturbato
17.
Presenza patologie di interesse psichiatrico
18.
Dolore
19.
DT al colloquio
20.
giorno del TMO
Inoltre ad ogni giornata (+1, +8,+15,+22..) sono stati riportati il valore del
termometro a DT, e la presenza/assenza dei problemi evidenziati dal paziente come
fonte di disagio (riferibili alla seconda parte del DT):
-Problemi pratici : Cura dei figli, Alloggio, Economici, Scolatici/lavorativi,
Trasporti, Partner, Figli , Altri.
54
-Problemi emozionali/ spirituali: Depressione, Paure, Nervosismo, Tristezza,
Preoccupazione, Perdita di interessi, Spirituali.
-Problemi fisici: Aspetto, Dolore, Lavarsi/vestirsi, Nausea, Fatica/stanchezza,
Muoversi, Respirazione, Mucosite, Mangiare, Digerire, Stipsi, Disturbi, Minzione,
Febbre, Secchezza cute, Naso chiuso, Formicolio, Sonno, Sfera Sessuale, Diarrea,
Memoria, Come si vede.
5.4 Analisi dei dati
Al fine di analizzare i dati raccolti dal presente studio per rispondere alle ipotesi di
ricerca iniziali, si sono suddivise le procedure dedicate in tre sottofasi principali.
Nella prima fase si è proceduto al preprocessing dei dati, attraverso il quale si sono
valutate sia le caratteristiche metriche delle dimensioni prese in considerazione (i.e.,
media, mediana, deviazione standard, etc), sia le precondizioni necessarie alla
somministrazione
delle tecniche
statistiche
inferenziali
di
interesse (e.g.,
equinumerosità campionaria, normalità della distribuzione di frequenza dei caratteri
continui e numerosità di cella minima per il test non parametrico del 2). Al fine di
verificare le ipotesi sostantive è stato necessario discretizzare alcune variabili per
poter utilizzare tutti i dati raccolti tramite confronti basati su test 2.
Nella seconda fase si sono calcolate le statistiche descrittive ed epidemiologiche,
fornendo così dati aggregati opportuni alla terza fase.
Nella terza fase si sono adottate le statistiche inferenziali necessarie per l’indagine
proposta dalle ipotesi del presente lavoro. In particolare i fattori sociodemografici di
interesse, e le condizioni cliniche, rappresentate in termini di fattori discreti (e.g.,
sesso, tipo trapianto, etc), sono state confrontate ed analizzate ricorrendo al test del
2. Infine i fattori emersi come significativamente relati alle dimensioni criterio del
presente studio, sono stati trattati in maniera congiunta attraverso un modello di
regressione logistica multipla, raffinando così il miglior modello (i.e., il modello di
rischio caratterizzato dalla maggior varianza spiegata) associabile ai dati. In
particolare abbiamo prodotto modelli differenti per i differenti momenti in cui è stato
rilevato il termometro del Distress, ottenendo così indicazioni circa le variabili di
interesse significativamente associate all’evoluzione del trattamento.
55
6
Risultati
Per la valutazione della significatività statistica dei risultati, sono state utilizzate
procedure e metodiche quali le statistiche descrittive epidemiologiche e le statistiche
inferenziali mono/multivariate. Le statistiche descrittive hanno permesso di fornire
una sintesi semplice del campione e delle misure raccolte necessarie per un’analisi
quantitativa dei dati, la statistica inferenziale, invece ha permesso di raggiungere
conclusioni che si estendono oltre i dati raccolti nel loro immediato, permettendo
dunque di valutare in che modo i dati raccolti influenzano il grado di Distress.
6.1 Analisi statistica descrittiva epidemiologica
Nell’analisi delle descrittive epidemiologiche sono stati adottati gli strumenti classi
messi a disposizione dalla statistica descrittiva, come gli indici di sintesi, che in
unico valore esprimono una specifica caratteristica della distribuzione dei dati:
-
Indici di posizione o tendenza centrale ( media, mediana,
moda)
-
Indici di variabilità o dispersione (varianza, deviazione standard, range, range
interquartile)
-
Indice di asimmetria (skewness)
Avvalendosi dei suddetti indici, sono stati analizzati i seguenti dati: Genere, età,
scolarità, presenza figli- N° figli- Figli a carico, patologia, stato civile, professione,
presenza familiare portatore di disabilità, sonno disturbato, presenza patologie di
interesse psichiatrico, nazionalità, dolore e i livelli di distress nelle varie rilevazioni.
56
Genere:
I risultati mostrano che su un totale di 285 pazienti, il genere prevalente risulta quello
maschile, nel numero di 160 e 125
Figura 1 –descrittiva epidemiologica-genere
femmine.
GENERE
Tabella 1 -Genere
Frequenza Percentuale
Maschi
160
56,1%
Femmine 125
43,9%
Totale
100%
285
43,90
%
Maschi
56,10
%
Femmine
Età paziente:
Dai risultati si evince che l’età del campione di 285 pazienti è compresa nel range tra
i 16 e i 69anni, con una media pari a 48,8 anni; mediana=51anni e moda pari a 59
anni.
Tabella 2. Età paziente
Media
48.80
Mediana
51
Moda
59
Dev.standard
12,611
Varianza
159,046
Skewness
-0,491
Kurtosis
-0,606
Età minima
16
Età massima
69
Figura 2. Descrittiva epidemiologica- età paziente
57
Tasso di scolarità:
A fronte di tale paramento l’indice del grado di istruzione è stato registrato indicando
il valore numerico di seguito:
1 = diploma di scuola elementare
2 = diploma di scuola media inferiore
3= diploma di scuola media superiore
4= Laurea universitaria
I risultati mostrano che il tasso di scolarità è prevalentemente concentrato tra 2 e 3,
rispettivamente diploma scuola media inferiore e superiore, mostrando comunque la
presenza di un certo numero di pazienti con diploma di scuola elementare o laurea.
La mediana indica tuttavia una prevalenza di pazienti con diploma di maturità.
Figura 3 Descrittiva epidemiologica- tasso di scolarità
Tabella 3. Tasso di scolarità
Media
2,65
Mediana
3
Moda
3
Dev.standard
0,828
Varianza
0,686
Skewness
-0,076
Kurtosis
-0,556
Minimo
1
Massimo
4
58
Patologia:
Dall’analisi dei dati si evince che la patologia prevalente nei pazienti sottoposti a
trapianto di cellule staminali emopoietiche è il mieloma multiplo con il 33%, seguito
da Linfoma Hodgkin 11,2%, Linfoma non Hodgkin 10,5%, leucemia mieloide acuta
8,9%.
Figura 4 Descrittiva epidemiologica- patologia
PATOLOGIA
Leucemia mieloide cronica
Linfoma
Leucemia linfobastica acuta
Linfoma non hodgkin
Leucemia linfoblastica cronica
Leucemia Mieloide acuta
Sindrome mielodisplastica
Mieloma multiplo
Linfoma hodgkin
Sclerosi
0
0,40%
6% 8,90%
11,20%
7,70%
3,50%
10,50%
0
33%
Tabella 4. Patologia
Mieloma multiplo
Frequenza Percentuale
94
33%
Leucemia mieloide acuta
54
8,9%
Linfoma Hodgkin
Linfoma non Hodgkin
Linfoma
Sclerosi
Sindrome mielodisplastica
Leucemia mieloide cronica
32
30
22
17
10
9
11,2%
10,5%
7,7%
6%
3,5%
3.2%
Leucemia linfoblastica acuta
9
3.2%
Leucemia linfoblastica cronica 1
0,4%
59
Presenza figli:
Figura 5 descrittiva epidemiologicapazienti con figli
Tabella5. Presenza figli
Frequenza
Assenza
65
Presenza
170
Tot. pazienti 235
esaminati
Missing data
50
Percentuale
22,8%
59,6%
82,5%
Pazienti con figli
Assenza
65
Presenza
17,5%
Numero figli:
170
Figura 5.1 descrittiva epidemiologica-numero figli
Tabella5.1 Numero figli
Tot. Pazienti con figli 170
Media
1,84
Mediana
2
Moda
2
Dev.standard
0,756
Varianza
0,572
Skewness
0,854
Kurtosis
1,317
N° Minimo
1
N° Massimo
5
Figli a carico:
Figura 5.2- descrittiva epidemiologica-pazienti con figli a carico
Pazienti con figli
a carico
112
122
60
Assenza
Tabella 5.2 Figli a carico
Frequenza Percentuale
Assenza
112
39,3%
Presenza
122
42,8%
Tot. pazienti
esaminati
Missing data
234
82%
51
17,9%
Presenza
Escludendo i missing data (50/285 pazienti), possiamo evincere che su un totale di
235 pazienti, una prevalenza di 170 pazienti è genitore di un range che va da 1 a 5
figli. Nella fattispecie, secondo la mediana i pazienti risultano genitori di 2 figli e
prevalentemente questi ultimi vivono ancora con i genitori (conf. Figli a carico in
122 pazienti).
Stato civile:
I risultati evidenziano una prevalenza di pazienti sposati ( 149 Pz.), seguiti da 48
pazienti celibe/nubile.
Tabella 6. Stato civile
Frequenza
Sposato/a
149
Celibe/Nubile
48
Convivente
14
Divorziato/a
9
Separato/a
8
Vedovo/a
5
Tot. Pazienti esaminati 233
Missing data
52
Percentuale
52,3%
16,8%
4,9%
3,2%
2,8%
1,8%
81,8%
18,2%
Figura 6 Descrittiva epidemiologica- stato civile
STATO CIVILE
Sposato/a
5
14
Celibe/Nubile
8
9
Divorziato/a
Separato/a
48
149
Vedovo/a
Convivente
61
Professione:
I risultati d’interesse mostrano una prevalenza di lavoratori dipendenti pari a 98
pazienti, seguiti da 36 pazienti con un’attività propria, 34 pazienti in pensione, 25
pazienti liberi professionisti, 17 pazienti disoccupati al pari con le casalinghe e 7
studenti.
Tabella. 7 Professione
Frequenza
Lavoratore dipendente 98
Lavoratore autonomo
36
Pensionato
34
Professionista
25
Disoccupato
17
Casalinga
17
Studente
7
Tot. Pazienti esaminati 234
Missing data
51
Percentuale
34,4%
12,6%
11,9%
8,8%
6,0%
6,0%
2,5%
82,1%
17,9%
Figura 7 Descrittiva epidemiologica-stato civile
PROFESSIONE
Disoccupato
34
17
Studente
7
Lavoratore
dipendente
Lavoratore
autonomo
Professionista
17
25
98
36
62
Casalinga
Paziente con familiare portatore di disabilità:
I dati analizzati mostrano che una significativa percentuale di pazienti non presenta
in famiglia persone con handicap, in particolare 218 su 230 pazienti. Tuttavia è
presente un gruppo di 12 pazienti che si fa carico di familiari con disabilità di natura
fisica (9 pazienti); di natura psichica (2 pazienti) o familiari non autosufficienti (1
paziente).
Tabella 8. Familiare con disabilità
Frequenza
Nessuna disabilità
218
Disabilità fisiche
9
Disabilità psichiatriche 2
Non autosufficiente
1
Tot. Pazienti esaminati 230
Missing data
55
Percentuale
76,5%
3,2%
0,7%
0,4%
80,7%
19,3%
Figura 8. Paziente con familiare
portatore di disabilità
Familiare con
disabilità
Familiare con
disabilità
Nessuna
disabilità
Disabilità
fisiche
Disabilità
psichiatrich
e
Presenza
disabilità
Non
autosufficien
te
63
Paziente con presenza di sonno disturbato:
I risultati evidenziano che su 191 pazienti esaminati 104 non mostrano disturbi del
sonno, a differenza dei restanti 87 pazienti. Di quest’ultimi 52 pazienti assumono
farmaci per riposare meglio, mentre 37 pazienti pur avendo problemi nel dormire non
assume alcun tipo di farmaci.
Tabella 9. Paziente con sonno disturbato
Frequenza
Assenza
104
Presenza (assume farmaci)
52
Presenza (non assume farmaci) 35
Tot. Pazienti esaminati
191
Missing data
94
Percentuale
36,5%
18,2%
12,3%
67,0%
33,0%
Figura 9.Disturbo del sonno
Sonno disturbato
Paziente con sonno
disturbato
Assenza
87
Presenza
104
64
35
52
assume
farmaci
non assume
farmaci
Pazienti con problemi a carattere psichico:
Dall’analisi dei dati risulta che su 226 pazienti analizzati, 206 pazienti non
presentano all’ingresso problemi psicologici, mentre 20 pazienti dichiarano di
soffrirne.
Tabella 10. Paziente con problemi di natura psichica
Frequenza
Percentuale
Assenza
206
72,3%
Presenza
20
7,0%
Tot. pazienti esaminati
226
79,3%
Missing data
59
20,7%
Figura 10 paziente con problemi di natura
psichica
Paziente con problemi
psichici
20
assenza
presenza
206
65
Nazionalità
I risultati mostrano campione a nazionalità molto eterogenea, tuttavia i pazienti
risultano prevalentemente italiani.
Tabella 11. Nazionalità pazienti
Frequenza Percentuale
albanese
3
1,1%
cilena
1
0,4%
cingalese
2
0,7%
egiziana
1
0,4%
italiana
210
73,7%
moldava
1
0,4%
peruviana
1
0,4%
polacca
1
0,4%
portoghese 1
0,4%
rumena
7
2,5%
statunitense 2
0,7%
svedese
1
0,4%
svizzera
1
0,4%
tedesca
2
0,7%
ucraina
1
0,4%
Figura 10 Nazionalità paziente
NAZIONALITA'
albanese
cilena
cingalese
egiziana
italiana
moldava
peruviana
polacca
portoghese
rumena
statunitense
svedese
svizzera
tedesca
ucraina
66
Pazienti con dolore all’ingresso
Dall’analisi dei dati si evince che all’anamnesi i pazienti riferiscono prevalentemente
assenza di dolore (142 pazienti su 196); 39 pazienti presentano dolore e altri 15
pazienti dichiarano dolore acuto.
Tabella 12 Pazienti con dolore all’ingresso
Frequenza Percentuale
Assenza di dolore
142
49,8%
Dolore presente all'ingresso 39
13,7%
Presenza di dolore cronico 15
5,3%
Tot. pazienti esaminati
196
68,8%
Missing data
89
31,2%
Figura 2 Pazienti con dolore all’ingresso
Dolore
15
39
Assenza
Dolore all'ingresso
Dolore cronico
142
Rilevazioni del Distress Thermometer:
1.
Al colloquio:
I risultati mostrano che al momento del colloquio con il coordinatore del reparto
centro trapianti midollo osseo (TMO), i pazienti riferiscono un grado di distress che
va da 0 a 7. Nella fattispecie la moda mostra un maggior numero di pazienti con
valore 4 al termometro del Distress.
67
Tabella 13
DT al colloquio
Media
Mediana
Moda
Dev. Standard
Varianza
Skewness
Kurtosis
Minimo
Massimo
Tot. Pazienti esaminati
Missing data
2.
Figura 13 Distress Thermometer al colloquio
3,86
4,00
4
2,104
4,429
-0,504
-0,266
0
7
21
264
+1 giorno dal trapianto
Dai risultati possiamo evincere che il Distress rilevato il giorno dopo il trapianto
mediante screening con DT, si una mediana di 3 e i pazienti mostrano un grado di
distress che varia da 0 a 9.
Tabella 14
DT +1 giorno dal TMO
Media
2,67
Mediana
3,00
Moda
4
Dev. Standard
2,038
Varianza
4,155
Skewness
0,364
Kurtosis
-0,227
Minimo
0
Massimo
9
Tot. Pazienti esaminati 208
Missing data
77
68
Figura 14 Distress Thermometer a +1
giorno dal TMO
3.
+8 dal trapianto
Figura 15 Distress Thermometer a +8 giorni
dal TMO
Tabella 15
DT a +8 giorni dal TMO
Media
3,14
Mediana
4,00
Moda
4
Dev. Standard
2,131
Varianza
4,541
Skewness
0,362
Kurtosis
-0,128
Minimo
0
Massimo
10
Tot. Pazienti esaminati 197
Missing data
88
I valori rilevati al Distress Thermometer dopo 8 giorni dal trapianto risultano
compresi in un range tra 0 e 10. Nella fattispecie la moda rilevata è pari a 4.
4.
+15 dal trapianto
I dati in questione mostrano che dopo 15 giorni dal trapianto il valore più espresso al
DT è 4. E il range di valori è compreso tra 0 e 10.
Figura 16 Distress Thermometer a +15 giorni dal TMO
Tabella 16
DT a +15 giorni dal TMO
Media
Mediana
Moda
Dev. Standard
2,87
3,00
4
2,046
Varianza
Skewness
Kurtosis
Minimo
Massimo
Tot. Pazienti esaminati
4,187
0,778
1,614
0
10
109
Missing data
176
69
5.
+22 dal trapianto
Dal grafico si evince dopo 22 giorni dal trapianto valori di distress compresi tra 0 e 8
e una media di 3.
Figura 17 Distress Thermometer a +15 giorni dal TMO
Tabella17
DT a +22 giorni dal TMO
Media
3,02
Mediana
3,00
Moda
4
Dev. Standard
2,354
Varianza
Skewness
Kurtosis
Minimo
Massimo
Tot. Pazienti esaminati
5,543
0,328
-0,924
0
8
47
Missing data
238
6.
+29 dal trapianto
Dal grafico si evince come il campione tende ulteriormente a ridursi, e ciò è dovuto
alla riduzione dell’ospedalizzazione. Il valore del DT più ripetuto è 1 in un range che
va da 0 a 8, con una media di 3,22.
Figura 18- Distress Thermometer a +29 giorni dal TMO
Tabella 18
DT a +29 giorni dal TMO
Media
3,22
Mediana
3,00
Moda
1
Dev. Standard
2,532
Varianza
6,410
Skewness
0,467
Kurtosis
-0,856
Minimo
0
Massimo
8
Tot. Pazienti esaminati 27
Missing data
258
70
7.
+36 dal trapianto
Dalla tabella si può evincere che il range di valori al DT indicato dai pazienti varia
da tra 0 e 7.
Figura 19- Distress Thermometer a +36 giorni
dal TMO
Tabella 19
DT a +36 giorni dal TMO
Media
2,06
Mediana
2,00
Moda
0
Dev. Standard
2,106
Varianza
4,434
Skewness
0,823
Kurtosis
0,105
Minimo
0
Massimo
7
Tot. Pazienti esaminati 17
Missing data
268
Andamento del Distress
4,5
4
3,86
3,5
3,22
3,14
2,87
3
3,02
2,67
2,5
2,06
2
1,5
1
0,5
0
Andamento Distress Thermometer
DT Colloquio
DT+1
DT +8
DT +15
DT +22
DT +29
DT +36
71
6.2 Analisi statistiche inferenziali
Mentre la statistica descrittiva si occupa di rappresentare l’informazione contenuta in
un dato insieme o campione di dati, la statistica inferenziale utilizza tale
informazione per fare delle affermazioni più generali riguardanti i parametri della
popolazione, da cui il campione è stato estratto. Le affermazioni della statistica
inferenziale sono di due tipi:
1.
STIMA: si vuole indicare un valore plausibile per il parametro della
popolazione, sotto una delle 2 forme:
-
un valore ben definito (STIMA PUNTUALE)
-
un intervallo in cui molto verosimilmente il parametro sia incluso (STIMA
INTERVALLARE)
2.
VERIFICA DI IPOTESI: indicare quale tra due specifiche ipotesi sul
parametro (nulla o alternativa) sia da accettare.
Tra le inferenziali sono state considerate esclusivamente i parametri significativi,
ovvero con p value ≤ 0,05 e 0,01.
6.2.1 Inferenziali univariate
Nelle inferenziali univariate si sono verificati solo gli effetti diretti, e non mediati, tra
i singoli fattori di interesse e le variabili criterio dello studio (i.e., il termometro del
distress).
6.2.1.1 Effetto dell’età
Mediante la seguente analisi si vuole analizzare come l’età del paziente influenza le
dimensioni di seguito riportate (solo le significative), nei vari momenti di
rilevazione del Distress tramite Distress Thermometer, al fine di verificare eventuali
comorbidità o effetti non dovuti alla condizione clinica.
72
Effetto dell’età nella Prima rilevazione del Distress Thermometer:
+1 giorno dal trapianto.
Presenza figli
120
100
80
60
40
20
0
≤ 51
> 51
54
11
65
105
No
SI
Cura dei figli
120
100
80
60
40
20
0
≤ 51
> 51
NO
93
103
SI
17
8
Effetto dell’età su presenza figli: Vi è la presenza di più genitori tra i pazienti con un
età superiore a 51, rispetto ai pazienti con età inferiore o uguale a 51(età media).
Effetto dell’età su cura dei figli: Pazienti con un età inferiore ai 51 avvertono come
più problematica la cura dei figli.
Tristezza
Paure
100
80
60
40
20
0
≤ 51
>51
NO
73
89
SI
37
22
100
80
60
40
20
0
≤ 51
>51
NO
78
94
SI
32
17
Effetto dell’età su la Paura: Paziento con un età inferiore ai 51 anni riferiscono di
esser maggiormente impauriti.
Effetto dell’età su Tristezza: Avvertita maggiormente dai pazienti con età inferiore
ai 51 anni.
73
Preoccupazione
80
70
60
50
40
30
20
10
0
NO
≤51
52
>51
69
SI
58
42
Fatica
80
70
60
50
40
30
20
10
0
NO
≤51
49
>51
70
SI
61
41
Effetto dell’età su preoccupazione:
Avvertita maggiormente dai pazienti con un età inferiore ai 51 anni.
Effetto dell’età sulla Fatica: Avvertita maggiormente come stressante nei pazienti
con età inferiore ai 51 anni.
Formicolio
120
100
80
60
40
20
0
Diarrea
120
100
80
60
40
20
0
≤51
≤51
>51
>5
1
NO
100
81
NO
92
103
SI
10
30
SI
18
8
Effetto dell’età su formicolio: Si presenta maggiormente nei pazienti con età
superiore ai 51 anni.
Effetto dell’età su diarrea: Si presenta maggiormente nei pazienti con età inferiore
ai 51 anni.
74
Effetto dell’età sulla memoria: Pazienti con
Titolo asse
Memoria
120
100
80
60
40
20
0
età inferiore ai 51 anni avvertono come
fattore di stress la perdita della memoria.
≤51
>51
NO
84
97
SI
26
14
Effetto dell’età nella seconda rilevazione del Distress Thermometer:
+8 giorni dal trapianto.
Cura dei figli
120
100
80
60
40
20
0
Economici
≤ 51
>51
NO
95
103
SI
13
2
120
100
80
60
40
20
0
≤51
>51
NO
96
102
SI
12
3
Effetto dell’età sulla cura dei figli: Avvertita come fattore di stress nei pazienti con
età inferiore ai 51 anni.
Effetto dell’età sui problemi economici: Avvertiti come fonte di maggior disagio nei
pazienti con età inferiore ai 51 anni.
75
Nervosismo
Paure
100
Titolo asse
80
60
40
20
0
≤51
>51
120
100
80
60
40
20
0
NO
79
91
NO
SI
29
14
SI
≤51
>51
84
96
24
9
Effetto dell’età su Paure: Si presenta maggiormente nei pazienti con età inferiore ai
51 anni.
Effetto dell’età sul Nervosismo: Esso è espresso maggiormente nei pazienti con età
inferiore ai 51 anni.
Titolo asse
Prepccupazione
80
70
60
50
40
30
20
10
0
Disturbi minzionali
120
100
80
60
40
20
0
NO
≤51
60
>51
76
NO
SI
48
29
SI
≤51
103
>51
92
5
13
Effetto dell’età sulle Preoccupazioni: Riferite maggiormente nei pazienti con età
inferiore ai 51 anni.
Effetto dell’età sui disturbi della minzione: Sono maggiormente espressi nei
pazienti con età superiore ai 51 anni.
76
Formicolio
120
100
80
60
40
20
0
Memoria
100
80
60
40
20
≤51
>51
0
NO
96
79
SI
12
26
≤51
>51
NO
81
90
SI
27
15
Effetto dell’età sul formicolio:
Avvertito maggiormente nei pazienti con età superiore ai 51 anni.
Effetto dell’età sulla memoria: Pazienti con età inferiore ai 51 anni risentono
maggiormente della riduzione della memoria.
Distress Thermometer
+1
80
70
60
50
40
30
20
10
0
Effetto dell’età sul valore numerico
espresso al Distress Thermometer
rilevato il giorno successivo al
trapianto: Pazienti con età inferiore
ai 51 anni presentano un livello di
Distress superiore a 3 al Distress
Thermometer a +1.
DT ≤ 3
≤51
50
>51
70
DT >3
51
37
77
Chi-Square Tests
Al fine di dimostrare il valore predittivo e la significatività dei risultati sopradescritti,
riferibili all’età del paziente, si riporta di seguito per ogni fattore del Distress
Thermometer, il valore del 2 (Pearson Chi-Square) e la relativa significatività
(p<0,01/ p<0,05), sia per il Distress Thermometer esaminato a +1 giorno dal
trapianto, sia quello rilevato a + 8 giorni. Dai grafici si evince che alla rilevazione
del distress a 8 giorni dal trapianto, compaiono nuovi fattori predittivi, quali il
nervosismo, problemi economici e disturbi della minzione, mentre non sono più
rilevanti fattori come fatica, tristezza e diarrea. Inoltre si può notare un incremento
del valore del 2 per items quali cura dei figli (da 3,746 a 8,349) ; preoccupazione (
da 4,944 a 6,530); paure ( da 5,389 a 6,039), ed una diminuzione del 2 per:
formicolio (da 11,990 a 6,768) ; memoria (da 4,529 a 3,861.
Distress Thermometer +1. Età paziente discretizzata: ≤51 / > 51 anni
Pearson Chi-Square
Asymp. Sig. (2-sided
Presenza figli
37,826
P <0,01
Formicolio
11,990
P <0,01
Fatica
7,623
P < 0,05
Tristezza
6,076
P < 0,01
Paure
5,389
P <0,05
Preoccupazione
4,944
P < 0,05
Memoria
4,529
P < 0,05
Diarrea
4,462
P < 0,05
Cura dei figli
3,746
P <0,05
Distress Thermometer +8. Età paziente discretizzata: ≤51 / > 51 anni .
Pearson Chi-Square
Asymp. Sig. (2-sided
Cura dei figli
8,349
P< 0,05
Nervosismo
7,577
P<0,01
Formicolio
6,768
P<0,01
Preoccupazione
6,530
P<0,01
Paure
6,039
P<0,01
Problemi economici
5,541
P< 0,01
Disturbi minzione
4,135
P<0,05
Memoria
3,861
P<0,05
78
Distress Thermometer +1
0
5
10
15
20
25
30
memoria
diarrea
fatica
preoccupazione tristezza
paure
cura dei figli
35
40
formicolio
presenza figli
Distress Thermometer +8
0
2
4
memoria
6
8
10
formicolio
disturbi della minzione preoccupazione
nervosismo
paure
problemi economici
cura dei figli
79
6.2.1.2
Effetto del sesso
Effetto del sesso nella prima rilevazione del Distress Thermometer:
+1 giorni dal trapianto.
Patologie
psichiatriche
Paure
120
100
140
120
100
80
60
40
20
0
80
60
40
20
Maschio
a
0
Femmin
Maschio
Fmmina
Assenza
128
78
NO
104
58
Presenza
5
15
SI
19
40
Effetto del genere sulle patologie psichiatriche: Il grafico mostra una prevalenza di
patologie psichiatriche nel genere femminile.
Effetto del genere sulle paure: Il grafico mostra una maggior espressione delle
paure nel sesso femminile.
Nervosismo
120
100
80
60
40
20
0
Preoccupazione
80
60
40
20
0
Maschio
Femmina
NO
106
73
NO
SI
17
25
SI
Maschio
75
Femmina
46
48
52
Effetto del genere su nervosismo:
Il nervosismo è meno rappresentativo nel genere maschile.
Effetto del genere sulle preoccupazioni: Le preoccupazioni sono maggiormente
rappresentate nelle donne.
80
Formicolio
100
80
60
40
20
0
Maschio
Femmina
NO
93
88
SI
30
10
Effetto del genere sul formicolio:
Come si evince dal grafico il formicolio è maggiormente espresso nel genere
maschile.
Effetto del genere sulla memoria:
Maggior rappresentativo nel sesso femminile.
Effetto del sesso nella prima rilevazione del Distress Thermometer:
+8 giorni dal trapianto.
Trasporti
140
120
100
80
60
40
20
0
NO
SI
Paure
120
100
80
60
40
20
0
Maschio
Femmina
Maschio
Femmina
119
88
NO
106
64
1
5
SI
14
29
Effetto del sesso sui trasporti:
Il problema dei trasporti è poco rappresentativo per entrambi i sessi, ma prevalente
nel genere femminile.
Effetto del sesso sulle paure:
Il sesso femminile avverte maggiori paure rispetto al genere maschile.
81
Preoccupazione
Perdita d'interessi
100
80
60
40
20
0
Maschio
Femmina
NO
88
48
SI
32
45
120
100
80
60
40
20
0
Maschio
Femmina
NO
110
77
SI
10
16
Effetto del genere sulle preoccupazioni:
Nella seconda rilevazione del Distress, vediamo che le preoccupazioni tra genere
femminile e maschile quasi si equivalgono, tuttavia vi è una prevalenza femminile.
Effetto del genere sulla perdita d’interessi: Maggiore nel genere femminile.
Aspetto
120
100
80
60
40
20
0
NO
SI
Dolore
100
80
60
40
20
0
Maschio
Femmina
Maschio
Femmina
111
73
NO
95
53
9
20
SI
25
40
Effetto del genere sull’aspetto:
Le donne avvertono come fattore di Distress il cambiamento dell’aspetto
maggiormente rispetto al sesso maschile.
Effetto del genere sul dolore:
Il sesso femminile percepisce il dolore come fonte di distress, maggiormente rispetto
al genere maschile.
82
Lavarsi/vestirsi
120
100
80
60
40
20
0
Maschio
Femmina
NO
110
76
SI
10
17
Muoversi
120
100
80
60
40
20
0
Maschio
Femmina
NO
103
69
SI
17
24
Effetto del genere sul lavarsi/vestirsi:
Prevalente nel genere femminile
Effetto del genere sul muoversi: prevalente nel genere femminile
Respirazione
140
120
100
80
60
40
20
0
NO
SI
Mucosite
100
80
60
40
20
0
Maschio
Femmina
Maschio
Femmina
116
80
NO
81
35
4
13
SI
39
58
Effetto del genere sulla respirazione: Avvertita maggiormente stressante nel genere
femminile.
Effetto del genere sulla mucosite: La mucosite è un fattore di distress molto
rappresentativo in entrambi i sessi, tuttavia presenta un alta incidenza nel genere
femminile, mostrandosi nella maggior parte delle donne sottoposte a trapianto di
CSE.
83
Mangiare
70
60
50
40
30
20
10
0
NO
SI
Febbre
Maschio
65
Femmina
28
55
65
120
100
80
60
40
20
0
Maschio
Femmina
NO
102
65
SI
18
28
Effetto del genere sul mangiare:
Il mangiare è avvertito come un’importante fattore di disagio in entrambi i sessi. Il
genere maschile il numero di chi soffre nel magiare quasi equivale il numero degli
uomini che non mostrano questo problema. Nel sesso femminile invece le donne che
riferiscono difficoltà nel mangiare sono più del doppio delle donne che non
riferiscono questa difficoltà.
Effetto del genere sulla febbre: Prevalente nel genere femminile
Formicolio
Sonno
100
80
60
40
20
0
100
80
60
40
20
Maschio
Femmina
NO
94
59
SI
26
34
0
Maschio
Femmina
NO
92
83
SI
28
10
Effetto del genere sul formicolio:
Il genere maschile dichiara il formicolio come fattore di distress, maggiormente
rispetto al genere femminile.
Effetto del genere sul sonno: La difficoltà nel dormire è percepita come fattore di
distress prevalentemente nel genere femminile.
84
Effetto
Memoria
120
100
80
60
40
20
0
del
genere
sulla
memoria:
Disturbi della memoria sono
percepiti
maggiormente
stressanti nel genere femminile.
Maschi
Femmine
NO
107
64
SI
13
29
Effetto del sesso nella prima rilevazione del Distress Thermometer:
+15 giorni dal trapianto.
70
60
50
40
30
20
10
0
NO
SI
Tristezza
70
60
50
40
30
20
10
0
Titolo asse
Titolo asse
Paure
Maschi
64
Femmine
42
6
17
NO
SI
Maschio
62
Femmina
42
8
17
Effetto del genere sulle paure:
Maggiormente rappresentative nel sesso femminile.
Effetto del genere sulla tristezza: maggiormente rappresentative nel sesso
femminile.
85
Digerire
70
60
50
40
30
20
10
0
NO
SI
Memoria
Maschio
61
Femmina
38
9
21
70
60
50
40
30
20
10
0
NO
Maschio
64
Femmina
45
6
14
SI
Effetto del genere nel digerire:
Si rileva un maggior grado di distress nel sesso femminile per quanto concerne la
dispepsia.
Effetto dell’età sulla memoria:
Il disagio è prevalente nel sesso femminile.
Effetto del sesso nella prima rilevazione del Distress Thermometer:
+22 giorni dal trapianto.
Preoccupazione
30
preoccupazione:
Inoltre notiamo che le donne che
10
riferiscono
5
86
sulla
espressa nel genere femminile.
15
SI
genere
preoccupazione è maggiormente
20
NO
del
Dal grafico si evince che la
25
0
Effetto
uno
preoccupazione
Maschio
26
Categoria 2
17
4
15
stato
quasi
di
equivale
numericamente alle donne
non esprimono questo disagio.
che
Muoversi
35
30
25
20
15
10
5
0
NO
SI
Memoria
Maschio
30
Femmina
28
0
4
35
30
25
20
15
10
5
0
NO
SI
Maschio
30
Femmina
28
0
4
Effetto del genere sul movimento: Il grafico mostra che non è avvertito come fonte
di disagio il non potersi muovere.
Effetto del genere sulla memoria: poco rappresentativo, ma prevalente nel genere
femminile.
Effetto del sesso nella prima rilevazione del Distress Thermometer:
+29 giorni dal trapianto.
Effetto
Respirazione
18
16
14
12
10
8
6
4
2
0
NO
SI
del
genere
sulla
respirazione:
Prevalente nel genere maschile.
Maschio
13
Femmina
17
4
0
87
Chi-Square Tests
Al fine di dimostrare il valore predittivo e la significatività dei risultati sopradescritti,
riferibili all’età del paziente, si riporta di seguito per ogni fattore del Distress
Thermometer, il valore del 2 (Pearson Chi-Square) e la relativa significatività
(p<0,01/ p<0,05), nelle rilevazioni del Distress Thermometer a + 1, + 8,+15,+22,+29
giorni dal trapianto.
Effetto del sesso. Distress Thermometer +1
Pearson Chi-Square
Paure
17,938
Presenza patologie psichiatriche 10,381
Formicolio
7,405
Memoria
4,851
Nervosismo
4,842
Preoccupazione
4,338
Asymp. Sig. (2-sided)
P<0,01
P< 0,01
P < 0,01
P < 0,05
P < 0,05
P < 0,05
Distress Thermometer +1
0
88
5
10
15
memoria
formicolio
preoccupazione
nervosismo
paure
patologie psichiatriche
20
Effetto del sesso. Distress Thermometer +8
Pearson Chi-Square Asymp. Sig. (2-sided)
Mucosite
18,843
P < 0,01
Memoria
13,706
P < 0,01
Paure
12,386
P <0,01
Mangiare
12,329
P < 0,01
Dolore
12,153
P < 0,01
Preoccupazione
10,709
P < 0,01
Aspetto
8,738
P < 0,01
Respirazione
8,084
P < 0,01
Febbre
7,062
P < 0,01
Sonno
5,743
P < 0,01
Formicolio
5,658
P < 0,01
Lavarsi /vestirsi
4,683
P<0,05
Muoversi
4,567
P < 0,05
Trasporti
3,950
P < 0,05
Perdita d’interessi 3,847
P < 0,05
Distress Thermometer +8
0
2
4
6
8
10
12
14
16
18
memoria
sonno
formicolio
febbre
mangiare
mucosite
respirazione
muoversi
lavarsi/vestirsi
dolore
aspetto
perdita d'interessi
preoccupazioni
paure
trasporti
20
89
Effetto del sesso. Distress Thermometer +15
Pearson Chi-Square Asymp. Sig. (2-sided)
Digerire 9,273
P < 0,01
Paure
8,954
P < 0,01
Tristezza 6,193
P< 0,01
Memoria 5,615
P < 0,01
Distress Thermometer +15
0
2
4
memoria
6
digerire
8
tristezza
10
paure
Effetto del sesso. Distress Thermometer +22
Pearson Chi-Square Asymp. Sig. (2-sided)
Preoccupazione 8,196
P <0, 01
Muoversi
4,009
P < 0,05
Memoria
4,009
P < 0,05
Distress Thermometer +22
0
2
memoria
90
4
muoversi
6
8
preoccupazione
10
Effetto del sesso. Distress Thermometer +29
Pearson Chi-Square Asymp. Sig. (2-sided)
Respirazione 4,533
P < 0,05
Dai grafici sopradescritti si evince quali fattori influenzano prevalentemente il
distress in entrambi i sessi alle rilevazioni del Distress Thermometer da + 1 a +29
giorni dal trapianto. Nella fattispecie vediamo che alla rilevazione del DT a +1 il
fattore predominante è la paura (2 = 17,938), che tuttavia va progressivamente
diminuendo nelle rilevazioni a + 8 e +15. Alle paure seguono il formicolio, la
memoria, il nervosismo e la preoccupazione. Nella rilevazione del Distress a +8
giorni dal trapianto, come dimostra il grafico notiamo una predominanza della
mucosite (2=18,843) avvertita particolarmente stressante da entrambi i sessi. Nella
seconda rilevazione inoltre si nota un aumento del numero dei fattori stressanti
segnalati al termometro del distress, infatti la mucosite è seguita dal disagio legato
alla perdita della memoria, dalle paure, difficoltà nel mangiare, dolore,
preoccupazione, disagio legato al cambiamento dell’aspetto, compaiono problemi
della respirazione, febbre, formicolio, difficoltà nel lavarsi/vestirsi, muoversi e poi in
misura minore anche disagio legato ai trasporti e viene riferita anche una perdita
d’interessi. Nella rilevazione del DT a + 15 invece compare il disagio legato alla
dispepsia (2=9,273), seguito da paure, tristezza e memoria. Alla rilevazione del DT
a +22 sono rilevanti le preoccupazioni, (2 = 8,196) seguite da difficoltà nel
muoversi, e memoria. Nell’ultima rilevazione a + 29 si evidenzia la respirazione
come disagio.
91
6.2.1.3
Effetto del tipo di trapianto
Di seguito si vuole analizzare come il tipo di trapianto ( Trapianto di cellule
staminali Autologo / Allogenico) influenza il distress nelle diverse rilevazioni e i
parametri ad esso correlati, segnati nella seconda parte del questionario del Distress
Thermometer.
Effetto del Tipo di trapianto nella prima rilevazione del Distress
Thermometer: +1 giorni dal trapianto
Genere
120
100
80
60
40
20
0
Alloggio
200
150
100
50
Autotrapi
anto
Allotrapia
nto
0
Maschio
108
52
NO
Femmina
79
46
SI
Auotrapianto
Allotrapianto
143
67
4
7
Effetto del trapianto sul genere:
Dal grafico si evince una predominanza di trapianti autologhi in entrambi i sessi,
tuttavia vi è un minor divario tra donne sottoposte a trapianto autologo e allogenico,
rispetto ai maschi in cui il divario è maggiore.
Effetto del tipo di trapianto sull’alloggio:
Il problema dell’alloggio è poco rappresentativo in entrambi i tipi di pazienti, tuttavia
è prevalente nei pazienti sottoposti a trapianto autologo.
92
Dolore
160
140
120
100
80
60
40
20
0
NO
SI
Fatica
100
80
60
40
20
Autotrapianto
134
Allotrapianto
59
13
15
0
NO
Autotrapianto
86
Allotrapianto
33
61
41
SI
Effetto del trapianto sul dolore: Dal grafico si evince una predominanza nel
trapianto allogenico.
Effetto del trapianto sulla fatica: Dal grafico si evince che nel trapianto allogenico
i pazienti che risentono della fatica superano i pazienti che non avvertono questa
difficoltà. Anche nel trapianto autologo la fatica è molto rappresentativa.
Mangiare
140
120
100
80
60
40
20
0
Febbre
160
140
120
100
80
60
40
20
0
Autotrapianto
Allotrapianto
NO
117
45
NO
SI
30
29
SI
Autotrapiant
o
Allotrapianto
139
63
8
11
Effetto del tipo di trapianto sul mangiare:
Dal grafico si evince che in proporzione il numero di pazienti che hanno subito un
trapianto allogenico risentono maggiormente della difficoltà nel mangiare, rispetto ai
pazienti sottoposti a trapianto autologo.
Effetto del trapianto sulla febbre:
Dal grafico si evince una prevalenza nel trapianto Allogenico
93
Diarrea
Formicolio
120
100
80
60
40
20
0
150
100
50
0
Autotrapiant
Autotrapianto
Allotrapianto
NO
113
68
NO
o
135
SI
34
6
SI
12
Allotrapianto
60
14
Effetto del trapianto sul formicolio: Maggiormente rappresentativo nel trapianto
autologo.
Effetto del trapianto sulla diarrea: Maggiormente rappresentativo nel trapianto
allogenico.
Effetto del trapianto sulla nausea:
Nausea
140
120
100
80
60
40
20
0
Colpisce
in
egual misura,
proporzionalmente
ma
maggiore
è
nel
trapianto allogenico.
Autotrapianto
Allotrapianto
NO
115
42
SI
31
32
Effetto del Tipo di trapianto nella prima rilevazione del Distress
Thermometer: +8 giorni dal trapianto
Cura dei figli
Effetto del trapianto sulla cura dei
150
figli: Non è molto rappresentativo, ma
100
prevalente nel trapianto allogenico.
50
0
NO
SI
94
Autotrapianto
135
Allotrapianto
63
6
9
Formicolio
120
100
80
60
40
20
0
Dolore
120
100
80
60
40
20
Autotrapiant
o
Allotrapiant
o
NO
108
67
NO
SI
33
5
SI
0
Autotrapianto
105
Allotrapianto
43
36
29
Effetto del trapianto sul dolore: Prevalente nel trapianto Autologo.
Effetto del trapianto sul formicolio: Prevalente nel trapianto autologo.
Effetto del Tipo di trapianto nella prima rilevazione del Distress
Thermometer: +15 giorni dal trapianto
Mucosite
NO
Titolo asse
50
40
30
20
10
0
Febbre
Autotrapianto
47
SI
12
Allotrapianto
43
27
70
60
50
40
30
20
10
0
Autotrapia
nto
Allotrapia
nto
NO
46
64
SI
13
6
Effetto del tipo di trapianto sulla mucosite: Maggiormente rappresentativo
nell’allotrapianto.
Effetto del trapianto sulla mucosite: Maggiormente espresso nel trapianto
autologo.
95
Formicolio
80
70
60
50
40
30
20
10
0
NO
SI
Effetto del trapianto sul formicolio:
Maggiormente presente nel trapianto
autologo.
Autotrapianto
47
Allotrapianto
67
12
3
Distress
Thermometer +1
100
80
60
40
20
0
96
Effetto del trapianto sul valore del
Distress Thermometer: Dal grafico si
evince che nell’allotrapianto il numero
dei pazienti con un distress > 3 a 1
giorno da trapianto supera in numero
dei pazienti con un DT< 3. Anche nel
Autotrapianto
Allotrapianto
≤3
88
32
>3
52
36
trapianto
autologo
un
abbastanza significativo.
DT >3
è
Chi-Square Tests
Al fine di dimostrare il valore predittivo e la significatività dei risultati sopradescritti,
riferibili al tipo di trapianto, si riporta di seguito per ogni fattore del Distress
Thermometer, il valore del 2 (Pearson Chi-Square) e la relativa significatività
(p<0,01/ p<0,05), nelle rilevazioni del Distress Thermometer a + 1, + 8,+15 giorni
dal trapianto.
Distress thermometer +1
Pearson Chi-Square Asymp. Sig. (2-sided)
Nausea
11,642
p. < 0,01
Mangiare
8,872
p. < 0,01
Formicolio 7,492
p.< 0,01
Dolore
5,809
p.< 0,01
Febbre
5,561
p.< 0,05
Diarrea
5,485
p.< 0,05
Alloggio
4,725
p.< 0,05
Fatica
3,832
p.< 0,05
Distress Thermometer +8
Pearson Chi-Square Asymp. Sig. (2-sided)
Formicolio
8,810
p.< 0,01
Cura dei figli 4,949
p. < 0,05
Dolore
p. <0,05
4,888
Distress Thermometer +15
Pearson Chi-Square Asymp. Sig. (2-sided)
Formicolio 8,029
p. < 0,01
Mucosite
5,046
p. < 0,05
Febbre
4,620
p. < 0,05
97
Distress Thermometer +8
0
2
4
formicolio
6
dolore
8
10
cura dei figli
Distress Thermometer +15
0
2
4
formicolio
98
6
febbre
8
mucosite
10
Dai grafici sopradescritti si evince che il problema maggiormente predittivo di
Distress in entrambi i trapianti è la nausea, di conseguenza anche il mangiare al DT
+1 è molto predittivo. Il mangiare è seguito dal formicolio, rappresentativo in tutte e
tre le rilevazioni. A questo segue il Dolore, la Febbre, Diarrea, Alloggio, Fatica.
Nella rilevazione del DT a +8 compare anche la mucosite, presente anche al DT +15
oltre che alla febbre.
6.2.1.4 Presenza figli
Dal grafico si evince che pazienti
Rischio comorbidità
per trapianto
allogenico
18
16
14
12
10
8
6
4
2
0
Rischio basso
Rischio
intermedio
Rischio alto
sottoposti a trapianto allogenico che
hanno figli presentano un rischio di
comorbidità superiore ai pazienti
che non hanno figli. Ed è vero
anche il contrario, ovvero pazienti
senza figli presentano un basso
rischio di comorbidità per trapianto
assenza figli
6
Presenza figli
3
2
9
3
16
figli.
Sonno Disturbato
80
70
60
50
40
30
20
10
0
NO
Si, assume
farmaci
Si, non assume
farmaci
allogenico, rispetto ai pazienti con
Dal grafico si evince che tra i
pazienti con figli quelli che
presentano sonno disturbato
superano
quelli
che
non
soffrono disturbi del sonno.
Assenza figli
36
Presenza figli
68
Mentre i pazienti senza figli
12
40
disturbato superano quelli con
3
32
che non soffrono di sonno
sonno disturbato.
99
6.2.1.5
Sonno disturbato
Dal grafico si evince che tra i
Presenza di patologie
psichiatriche
pazienti che presentano patologie
psichiatriche
120
la
maggioranza
soffre di disturbi del sonno e per
100
questo assume farmaci.
80
60
40
20
0
NO
SI, ma
assume
farmaci
Si, ma non
assume
farmaci
Assenza
97
40
32
Presenza
6
11
3
Dolore
90
80
70
60
50
40
30
20
10
0
100
Dal grafico si evince che la
maggior parte dei pazienti
che non presenta dolore non
ha sonno disturbato, mentre
la i pazienti con dolore
presentano
No
Si, ma
assume
farmaci
Si, ma non
assume
farmaci
NO
Dolore
all'ingresso
82
31
12
15
10
7
Dolore cronico
5
4
5
disturbato.
anche
sonno
Dal grafico si evince che la
Distress Thermometer
+15
totalità dei pazienti con dolore
cronico presenta un DT>3 alla
rilevazione del Distress a 15
35
30
25
20
15
10
5
0
giorni dal trapianto.
No
Dolore
All'ingresso
Dolore cronico
≤3
31
9
0
>3
19
4
4
6.2.2 Analisi statistica inferenziale multivariata, la regressione
logistica
L’analisi di regressione logistica è una metodologia impiegata per prevedere il valore
di una variabile dipendente dicotomica sulla base di un insieme di variabili
esplicative, sia di tipo qualitativo che quantitativo. Gli obiettivi possono essere
molteplici, fra cui individuare tra le variabili indipendenti quelle a maggiore potere
esplicativo, che vanno quindi interpretate come determinanti del possesso o meno
dell’attributo: a seconda che siano correlate positivamente o negativamente con il
fenomeno studiato possono essere considerate rispettivamente come fattori di rischio
o come fattori di protezione. Per cui sono stati analizzati gli effetti congiunti nelle
variabili componenti lo spettro rilevato dal termometro (variabile indipendente), sul
valore complessivo della qualità della vita e quindi del grado di Distress (variabile
dipendente). A questo scopo sono stati adottati i valori della statistica multivariata
come il wald e la significatività che dimostrano quanto il modello è predittivo e la
sua validità; l’Exp (B), espressione dell’odds ratio, indice utilizzato per definire il
rapporto di causa-effetto tra due fattori, per esempio tra un fattore di rischio e una
malattia, per cui per valori <1 siamo difronte ad un fattore di protezione, mentre per
valori >1 sono espressione del fattore di rischio. Mentre il valore di Nagelkerke ci
dice quanta varianza spiega il modello.
101
6.2.2.1 Distress Thermometer – Prima rilevazione
Di seguito sono stati confrontati gli items corrispondenti alla seconda parte del
questionario del Distress Thermometer con il relativo grado di distress. Nella
fattispecie si è voluto analizzare come gli items influenzano il grado di distress e
quali sono i fattori di rischio e protezione. Nella prima rilevazione a 1 giorno dal
trapianto sono risultati significativi i seguenti fattori: Aspetto, Economici, Memoria,
Secchezza cute, Preoccupazione, Tristezza, Nervosismo, Nausea. Dalle tabelle si
evince che L’aspetto, in questa prima rilevazione presenta il fattore di rischio più alto
legato al Distress, in quanto Exp (B) > 1. Mentre presenta il Wald più alto la
preoccupazione, cioè significa che la variabile indipendente preoccupazione ha un
rapporto statisticamente significativo con la variabile dipendente Distress,
significativo dunque di un rapporto causa effetto.
Riepilogo elaborazione casi
Riepilogo dei casi per cui abbiamo un valore non nullo del termometro:
Casi non pesati
Casi selezionati
N
Percentuale
Incluso nell'analisi
205 71,9
Casi mancanti
80
Totale
285 100,0
28,1
285 100,0
Totale
Variabili nell’equazione
B
Wald Sign.
Exp(B)
Model -0,285 4,075 p. <0.05 0,752
Valore della statistica multivariata (Wald) di 4,075 e significativa (p. < 0.05),
dimostra la validità del modello.
R-quadrato di Nagelkerke
0,461
Il valore di Nagelkerke ci dice quanta varianza spiega il modello. In questo caso
abbiamo un modello che spiega il 46,1% della varianza.
102
Variabile dipendente:
Valore del Distress Thermometer
DT ≤3
DT >3
Variabili nell'equazione
B
Wald Sign.
Exp(B)
Aspetto
1,464 4,375 p. < 0.05 4,324
Economici
1,269 3,972 p. < 0.05 3,556
Memoria
1,149 4,642 p. < 0.05 3,154
Secchezza cute
1,114 4,278 p. < 0.05 3,048
Preoccupazione 1,098 8,018 p. < 0.01 2,997
Tristezza
1,078 5,156 p. < 0.05 2,940
Nervosismo
0,982 4,121 p. < 0.05 2,670
Nausea
0,847 4,554 p. < 0.05 2,333
6.2.2.2 Distress Thermometer – Seconda rilevazione
In questa seconda rilevazione si può evincere dalle tabelle che il disagio
particolarmente espresso dai pazienti al momento del questionario con DT a + 8
giorni dal trapianto è l’Alloggio, esso presenta un Exp (B) di 58,696, espressione così
di un alto fattore di rischio per il distress. Mentre presenta il wald più alto la
depressione con 10,063, espressione di causa effetto. Risultano comunque
significativi e legati al fattore di rischio tutti i seguenti fattori: Alloggio, trasporti,
depressione, respirazione, economici, nervosismo.
Riepilogo elaborazione casi
Casi non pesati
N
Casi selezionatiIncluso nell'analisi 196
Casi mancanti
89
Totale
285
Casi non selezionati
0
Totale
285
Percentuale
68,8
31,2
100,0
,0
100,0
103
Variabili nell'equazione
B
Wald Sign. Exp(B)
Model 1,597 70,014 <0.01 0,202
R-quadrato di Nagelkerke
0,415
Variabili nell'equazione
B
Wald
4,072 5,044
Alloggio
3,099 6,226
Trasporti
Depressione 2,505 10,063
Respirazione 2,069 7,907
1,883 5,938
Economici
Nervosismo 1,183 3,637
Sign.
<0,05
<0,05
<0,01
<0,01
<0,05
<0,05
Exp(B)
58,696
22,182
12,244
7,918
6,573
3,265
6.2.2.3 Distress Thermometer – Terza rilevazione
Dalla tabella si evince che la respirazione presenta un altissimo fattore di rischio
correlato al distress ( Exp (B) 88,962). Seguito da Lavarsi/vestirsi, Disturbi
Minzione, Aspetto, Come si vede, Paure. Invece il formicolio presentando un valore
di Exp (B)< 1, è espressione di un fattore protettivo nei confronti del distress.
Riepilogo elaborazione casi
Casi non pesati
N Percentuale
Casi selezionatiIncluso nell'analisi 106 37,2
Casi mancanti
179 62,8
Totale
285 100,0
Casi non selezionati
0 ,0
Totale
285 100,0
Variabili nell'equazione
B
Wald Sign.
Exp(B)
Model -0,461 5,339 <0,05 0,631
R-quadrato di Nagelkerke
0,516
104
Variabili nell'equazione
B
Wald Sign.
Exp(B)
Respirazione
4,488
5,029 p.<0,05
88,962
Lavarsi/vestirsi
4,105
4,491 p.<0,05
60,661
Disturbi Minzione 3,069
4,009 p.<0,05
21,529
Aspetto
3,049
3,540 p. <0,05
21,094
Come si vede
2,697
3,539 p.<0,05
14,828
Paure
2,001
7,346 p. < 0,01 7,393
Formicolio
-4,558 4,753 p.<0,05
0,010
6.2.2.4 Distress Thermometer – Quarta, quinta e sesta rilevazione
La tabella mostra che dalla IV- V-VI rilevazione non è possibile evincere risultati
significativi, in quanto vi è la presenza di pochi casi residui e non rappresentativi.
Ciò è dovuto alla diminuzione del numero di pazienti nell’unità di degenza correlato
alla dimissione del paziente stesso, per cui si ha una diminuzione del numero di
rilevazioni del DT a + 22, +29,+36 giorni dal trapianto.
Statistiche
Termometro D IV Termometro D V Termometro D VI
NValido
47
Mancante 238
27
17
258
268
105
7
Discussioni e conclusioni
Dall’analisi dei risultati sopra illustrati, emerge un campione di nazionalità a
prevalenza italiana (73.7%) composto prevalentemente dal sesso maschile, che
presenta un’età media di 48,8 anni, prevalentemente affetto da mieloma multiplo,
con un tasso di scolarità medio corrispondente al diploma di scuola media superiore.
La prevalenza del campione è costituita da pazienti sposati e genitori in media di due
figli a carico, e lavoratori dipendenti. Quasi la totalità del campione non presenta
parenti con disabilità di natura fisica o psichica di cui si devono prendere cura. Il
45,5% dei pazienti al momento del colloquio riferisce di soffrire di disturbi del
sonno, di cui il 18.3% di questi non assume farmaci per poter riposare meglio. Inoltre
il 27,5% dei pazienti riferisce la presenza di dolore all’ingresso e l’8,8% dei pazienti
soffre di disturbi psichici. I pazienti candidati a trapianto di cellule staminali
emopoietiche, poiché ad alto rischio di disagio e stress possono sviluppare modelli di
coping inefficace, causa di una minor risposta e aderenza terapeutica e sviluppo di
ansia e depressione post-trapianto. Per questi motivi ogni paziente candidato al
trapianto viene monitorizzato tramite Distress Thermometer, al momento del
colloquio e dal giorno dopo il trapianto ogni settimana, per valutare il grado di
distress e le relative cause espresse dal paziente stesso. Dai risultati sull’andamento
del distress, valutato statisticamente dopo aver riportato il valore del DT di ciascun
paziente, si evince che i livelli più alti di distress si rilevano al momento del
colloquio, ma anche a 29 e 8 giorni dal trapianto. Mentre i livelli più bassi di distress
si rilevano a + 36 e +1 giorni dal trapianto. Tali risultati sono in linea con i dati di
letteratura, un livello più alto di distress al momento del colloquio è legato infatti ad
uno stato di ansia e depressione, manifestazione dell’insieme di dubbi e incertezze
che il paziente porta con sé e alla paura di morire. In questo contesto può rivelarsi
fondamentale l’intervento infermieristico, che attraverso un approccio relazionale
corretto
ed
un
intervento
educativo
mirato
può
contribuire
a
ridurre
significativamente l’ansia del paziente. La mancanza d’informazioni infatti può
contribuire allo sviluppo di incertezza, ansia e depressione nell’assistito. Nel giorno
del trapianto di cellule staminali si assiste invece ad una notevole diminuzione dei
livelli di ansia.
106
Questo è dovuto al fatto che i pazienti affetti da patologie oncoematologiche, a
differenza dei malati di tumore solido, vivono la malattia come sistemica che
colpisce interamente il proprio essere e dalla quale risulta difficile scindersi. Il
trapianto di cellule staminali rappresenta per questi pazienti una speranza di
guarigione, ciò spiega livelli inferiori di distress alla rilevazione del Distress
Thermometer il giorno successivo al trapianto. Tuttavia un aumento dei livelli di
distress dopo il trapianto in particolare a +8 è legato ad un incremento dei disturbi
somatoformi, e all’esperienza di stress da isolamento, correlato da un lato alla
carenza di supporto sociale che si ha durante il periodo di isolamento protettivo,
durante il quale le relazioni interpersonali con familiari e amici sono ridotte al
minimo, e dall’altro agli alti livelli di ansia registrati inizialmente che possono in un
secondo momento essere espressi attraverso sintomi fisici, spie di un disagio
profondo. Valori più alti del DT si riscontrano anche a + 29 giorni dal trapianto, ciò è
legato ai disturbi somatoformi, ma può anche esser correlato ad una serie di fattori tra
i quali i disturbi propri causati dalla procedura terapeutica in sé per sé. Alcuni
sintomi di malattia psicosomatica infatti possono essere confusi, in questa fase, con
quelli propri che il trapianto di cellule staminali emopoietiche può causare, come mal
di testa, problemi gastrointestinali, ecc. Inoltre un livello più alto di distress verso la
fine della degenza, quindi in prossimità della dimissione può esser dovuto
all’aumento dei livelli di ansia scaturita dal dover abbandonare l’unità di isolamento,
entro la quale in un certo senso il paziente si sente protetto, ed affrontare le
problematiche che possono instaurarsi nel ritorno alla normalità. Per questi motivi,
l’aumento dei livelli di distress, inoltre può esser associato sia ad un vissuto di paura
relativo alla perdita del supporto dei sanitari, sia una crisi della compliance nella
relazione con il personale sanitario, infine, un profondo stato di distress può esser
associato ad un vissuto di perdita permanente (ad es. infertilità).
Mediante l’analisi statistica multivariata delle regressioni logistiche è stato possibile
dimostrare quali sono i fattori di rischio e protezione per lo sviluppo del distress,
espressi dal paziente mediante lo screening del Distress Thermometer nelle sue varie
rilevazioni. In particolare vediamo che nella rilevazione del DT a 1 giorno dal
trapianto il fattore di rischio maggiormente rappresentativo di distress riguarda
l’aspetto del paziente, ovvero come questi si vede.
107
Ciò può esser legato alle modificazioni dell’aspetto che la persona assume, in quanto
sottoposta a regime di condizionamento radio/chemioterapico, necessario per il
verificarsi dell’aplasia midollare che permetterà il successivo attecchimento delle
cellule staminali emopoietiche infuse con il trapianto. Nella rilevazione del distress a
+1 si può notare infatti la presenza di fattori di rischio quali l’aspetto, secchezza cute
e nausea, legati agli effetti tossici della radio e chemioterapia. Infatti per ridurre il
disagio legato alla vista della perdita di capelli, questi ultimi vengono rasati prima
dell’inizio delle cure. Inoltre compaiono come fattori di rischio anche una
diminuzione delle capacità mnemoniche, problemi economici, tristezza e
nervosismo. Mentre il fattore di rischio rilevato che presenta anche il più alto valore
di wald riguarda la preoccupazione, espressione di una maggior causa effetto per la
comparsa del disagio. I fattori che possono indurre uno stato di preoccupazione nel
paziente, possono esser riconducibili alla paura che il trapianto non abbia effetto,
oppure alla lontananza dal contesto familiare e il non poter provvedere alla propria
famiglia.
Nella rilevazione a +8 giorni dal trapianto il fattore che presenta un’Odds Ratio
maggiore è il parametro alloggio, ciò può esser dovuto alla condizione di isolamento.
La stanza di degenza pur essendo dotata di connessioni internet, televisori, webcam
etc. con i quali il paziente può restare in comunicazione con i propri cari, tuttavia non
si può sostituire alla vicinanza e all’affetto dimostrato attraverso profondi abbracci.
Il valore che mostra un wald più alto è la depressione, espressione che la sua
presenza determina un aumento dei livelli di distress.
Nella rilevazione del DT a +15 giorni dal trapianto invece si nota a differenza delle
precedenti rilevazioni, disturbi fisici, talvolta di origine somatoforme, in particolare
si registra come fattore di rischio più alto associato al distress, che presenta anche il
valore più alto di wald, la respirazione. Ad essa segue il lavarsi/ vestirsi, disturbi
minzione, aspetto, come la persona si vede e paure, rappresentano tutti fattori di
rischio per lo sviluppo del distress. Mentre si riscontra che il formicolio è associato
ad un fattore protettivo. Ciò può esser spiegato, in quanto dai risultati si evince che il
sesso femminile e un età <51 anni sono dei fattori di rischio per il distress, allora
possiamo affermare anche il contrario, ovvero il sesso maschile e un età >51 anni
costituiscono dei fattori protettivi per il distress, e poiché questi gruppi di pazienti
108
manifestano disagio prevalentemente per quanto riguarda i fattori fisici, tra cui il
formicolio, possiamo dire che il formicolio è un fattore protettivo.
Tra i fattori sociodemografici che influenzano il grado di distress vi è l’età anagrafica
del paziente. È stato riscontrato infatti che i pazienti con età media inferiore ai 51
anni manifestano più paura, tristezza, fatica, problemi economici e nella cura dei
figli, maggiori preoccupazioni e nervosismo e la percezione di una perdita delle
capacità mnemoniche. Mentre soggetti con età superiore ai 51 anni manifestano
prevalentemente sintomi fisici, legati al formicolio e disturbi della minzione. Per cui
nei soggetti più giovani i problemi sono principalmente di natura psicologica, quindi
meno oggettivabili rispetto ai problemi di natura fisica dei soggetti meno giovani.
Per quanto riguarda il genere, dall’analisi dei risultati si evince che il distress nel
sesso
femminile
è
correlato
alla
manifestazione
di
paure,
nervosismo,
preoccupazione, modifiche dell’aspetto, dolore, lavarsi e vestirsi, mucosite, disturbi
del sonno, dispepsia. Mentre il sesso maschile sperimenta maggiormente problemi
legati al formicolio e alla respirazione. Questa diversità nell’espressione dei problemi
percepiti come fonte di disagio è intrinseca nella diversità tra i due generi; le donne
infatti sono più ansiose degli uomini e ciò è correlato ad uno squilibrio degli ioni
calcio e magnesio. La principale differenza tra uomo e donna sta nel fatto che il
funzionamento delle ghiandole della riproduzione nell'uomo è continuo mentre nella
donna è ciclico. La donna è caratterizzata dalla continua fluttuazione dei tassi di
estrogeno e dall'aggiunta intermittente di progesterone, ormoni che esercitano
entrambi potenti effetti sull'umore e su tutte le funzioni neurotrasmettitrici. Inoltre le
donne sono più abituate ad esternare e ad esprimere meglio le proprie emozioni
rispetto all’uomo
47
, da ciò ne deriva una diversa espressione dello stato doloroso
associato alla malattia.
Per quanto riguarda gli effetti del distress correlati al diverso tipo di trapianto, sia
esso autologo o allogenico, si riscontrano maggiori problematiche nei pazienti
sottoposti a trapianto di cellule staminali allogenico, legate principalmente
all’alloggio, dolore, febbre, diarrea, nausea, cura dei figli e mucosite. Mentre pazienti
sottoposti a trapianto di CSE autologo, manifestano prevalentemente disagio legato
alla fatica, mangiare, formicolio e febbre.
47
http://www.francescagalvani.org/articoli/95-differenze-tra-maschi-e-femmine-di-fronte-al-dolorecronico.html
109
La differenza tra le diverse manifestazioni è collegata alle diverse complicanze che si
verificano in entrambi i tipi di trapianto, il trapianto allogenico infatti è correlato ad
un maggior numero di effetti tossici legato alla terapia.
Altri fattori di rischio che sono stati individuati dal presente studio, in grado di
influenzare il distress, riguardano la presenza di figli e il sonno disturbato. È stato
riscontrato infatti che pazienti con figli presentano un maggior rischio di comorbidità
per trapianto allogenico. Inoltre la presenza di figli è in grado di influenzare
negativamente il sonno, ciò può esser dovuto all’aumento delle preoccupazioni nei
confronti dei figli e alla loro cura. Inoltre il sonno disturbato si riscontra nella totalità
dei pazienti con dolore cronico e nei pazienti con dolore all’ingresso, oltre che nei
soggetti con disturbi psichici. Si può dunque dedurre quanto sia fondamentale un
attento controllo delle cause che possono incidere sul disturbo del sonno, che può
contribuire ad una varietà di disfunzioni psicologiche e fisiche, come l’insonnia,
dolore cronico, distress respiratorio, obesità, ansia e stress.48
La ricerca condotta per l’elaborazione dello studio ha messo in evidenza la presenza
di fattori che sono in grado di incidere sullo sviluppo del distress che se non
adeguatamente individuato e monitorizzato mediante Distress Thermometer,
contribuisce allo sviluppo di problemi quali l’ansia, disturbi somatoformi o
depressione, problemi comuni nei pazienti che affrontano un trapianto di cellule
staminali emopoietiche. Importante dunque il mantenimento di valori del Distress
<4, cutoff che esprime un disagio controllato, come è stato rilevato nella media dei
soggetti analizzati nel presente studio. Tuttavia la presenza anche moderata di tali
problemi richiede la presa di coscienza da parte del personale dei fattori di rischio e
protezione che influenzano il distress e lo sviluppo di un’assistenza centrata sugli
effettivi bisogni del paziente che, come si è visto, possono variare notevolmente nel
corso del ricovero, che può presentare anche una durata molto lunga. L’infermiere
gioca in questo contesto un ruolo centrale essendo si il fautore dell’assistenza
giornaliera, ma potendo rappresentare anche un confidente, un amico, un alleato. Il
paziente che affronta un trapianto di cellule staminali emopoietiche affronta non solo
una procedura terapeutica complessa, ma va incontro ad una serie di restrizioni che
limitano significativamente la sua sfera di vita, a partire dall’alimentazione, al regime
48
L. Boonstra, K. Harden , S. Jarvis , Sleep disturbance in hospitalized recipients of stem cell
transplantation, Clinical journal of oncology nursing, 2011,vol15,3:271-276
110
di isolamento protettivo, che rappresenta forse l’elemento più significativo per gli
stessi. In questo contesto l’infermiere rappresenta dunque non solo il professionista
che si prende cura, ma viene identificato anche come colui che conosce in modo
approfondito il paziente, che si preoccupa non solo della salute fisica, ma anche dei
suoi bisogni psicoemozionali. L’Infermiere è una figura chiave dell’ equipe curante
in quanto ha modo di passare molto tempo con il malato, momenti in cui può
dialogare con lui e può ascoltarlo in maniera attiva; in queste occasioni può capire
come si sente il paziente, se è in difficoltà e quindi cercare di ripercorrere con lui i
vissuti, può riscontrare nel paziente tante paure per il futuro e per quando sarà
dimesso e quindi cercare di fornirgli informazioni corrette.
Dal colloquio con il paziente dunque si possono cogliere campanelli d’allarme,
progettare e pianificare l’assistenza sulla base dei bisogni riscontrati. L’integrazione
tra i diversi professionisti riveste un ruolo fondamentale nella cura e nel prendersi
cura dei pazienti oncoematologici, che necessitano di interventi tecnici specifici, ma
anche educativo-relazionali durante tutto il percorso di cura, e il professionista
infermiere può e deve fungere da punto di comunicazione tra le diverse figure
coinvolte, rappresentando comunque il professionista maggiormente coinvolto
nell’assistenza diretta al malato.
111
Allegati
Allegato A: Distress Thermometer adottato dal centro TMO- Careggi
112
Bibliografia e sitografia
-
A. Molassiotis et al., sympton distress, coping style and biological variables as
predictors of survival after bone marrow transplantation, Journal of psychosomatic
research, vol. 42,3: (275-285), 1997
-
AMJ Braamse, B van Meijel et al., Distress, problems and supportive care needs of
patients treated with auto-or allo-sct, Bone Marrow Trasplantation,2014,49: (292-298)
-
Areej R. El-jawahri et al., Quality of life and mood of patients and family caregivers
during hospitalization for hematopoietic stem cell transplantation, Cancer,2014
-
Bosi, Manuale di malattie del sangue, Milano, Elsevier, 2012
-
E. Menoni, A. Ridolfi, Psicologia clinica e percorsi assistenziali. Distress, coping e
qualità di vita nei pazienti con trapianto di midollo osseo, Rivista di Psicologia Clinica n.2,
2008
-
E. Saita, Psico-oncologia: una prospettiva relazionale, Milano, UNICOPLI, 2009.
-
EBMT Nurses Group International Study Day HCST patients: where are we going?
Actual practice and new challenges, Florence, 2014
-
EBMT, Formazione infermieristica EBMT: Mobilizzazione e aferesi di cellule
staminali emopoietiche,
-
Emilia Campos de Carvalho, Infusion of Hematopoietic Stem Cells: Types,
Characteristics, Adverse and Transfusion Reactions and the Implications for Nursing, Rev.
Latino-Am. Enfermagem ,Brasil,2010, 18(4):716-24
-
European group for Blood and Marrow Transplantation, Blood and marrow
transplantation, European School of Hematology, Paris, 2000 revised ed.
-
G. Bonadonna, Medicina oncologica, 8 ed., Milano, Elsevier Masson, 2007
-
G. Castoldi, Malattie del sangue e degli organi ematopoietici, 6. ed., Milano,
McGraw-Hill, 2013
-
G.Caocci, G. La Nasa, A. Orabo, Humanizing medical structures: the issue of a low-
bacterial environment in the bone marrow transplant unit, Journal of Medicine & The
Person, vol 2, n.3, 2004
-
Hillingdon Oncology & Palliative Care Team, Coping with Stress: The Distress
Thermometer, West London Cancer Network
113
-
Jacobsen PB, Donovan KA, Trask PC, Fleishman SB, Zabora J, Baker F, Holland
JC. Screening for psychologic distress in ambulatory cancer patients. Cancer 2005;
103:1494-1502.
-
L. Boonstra, K. Harden , S. Jarvis , Sleep disturbance in hospitalized recipients of
stem cell transplantation, Clinical journal of oncology nursing, 2011,vol15,3:271-276
-
L. Vitek, M.Q. Rosenzweig, S. Stollings, Distress in Patients With Cancer:
Definition, Assessment, and Suggested Interventions, Clinical journal of oncology nursing,
2007, Vol.11, 3: (413-418)
-
M.A.Annunziata, La valutazione del distress: sesto parametro vitale in oncologia,
III° Conferenza Regionale HPH del Friuli Venezia Giulia.
-
M.C. Townsend, Diagnosi infermieristiche in psichiatria, Edizioni Internazionali,
Roma.2002
-
M.G. Nanni, R. Carruso, L. Grassi, Implicazioni cliniche e criticità nella valutazione
del distress emozionale in oncologia come sesto parametro vitale, Giornale Italiano di
Psico-Oncologia. Vol. 13 - N. 1/2011
-
NCCN clinical practice guidelines in oncology, Distress Management, 2014
-
Norbert Grulke, Wolfgang Larbig, Horst Ka¨chele, Distress in patients undergoing
allogeneic haematopoietic stem cell transplantation is correlated with distress in nurses,
European Journal of Oncology Nursing, 13:( 361– 367), 2009
-
O'Meara A, Holbro A, Meyer S, Martinez M, Medinger M, Buser A, Halter J, Heim
D, Gerull S, Bucher C, et al., Forty years of haematopoietic stem cell transplantation: a
review of the Basel experience. Swiss Med Wkly, 2014;144:w13928
-
P. Corradini, R. Foà, M. Boccadoro, et al. Manuale di ematologia, 2. ed., Torino,
Minerva medica, 2015.
-
P.B Jacobsen, S.Ransom,M. Booth-Jones, Validation of the Distress Thermometer
with bone marrow transplant patients, Psycho-Oncology, 15: 604-612,2006
-
P.C. Trask, A.Paterson, M.Riba, et al., Psycosocial consideration Assessment of
psychological distress in prospective bone marrow transplant patients, Boon Marrow
Trasplantation, 2002, 29: (917-925)
-
Passweg JR et al. Swiss medical weekly, 2012;142:w13696; American Cancer
Society - Stem Cell Transplants
114
-
Raccomandazioni del CDC di Atlanta per la prevenzione delle infezioni opportuniste
nei pazienti sottoposti a trapianto di cellule staminali emopoietiche, U. O. Ematologia e
centro trapianto midollo osseo, Piacenza
-
S. C. Smeltzer, B. Bare, J. Hinkle, K. Cheever, Brunner Suddarth- Infermieristica
medico-chirurgica. Vol 1, 4ed., Casa editrice Ambrosiana, Milano, 2010.
-
S.B Artherholt, F.Hong, D.L. Berry, J.R.Fann, Risk factors for depression in patients
undergoing hematopoietic cell transplantation, Biol Blood Marrow Transplant, 2014, 20:
(946-950)
-
S.Caponetti, S.Marcelli, MR. La Rocca et al., Il percorso di risposta agli stressor del
paziente con sindrome mieloproliferativa o linfoproliferativa sottoposto a trapianto di
cellule staminali emopoietiche, Confronto professionale, IPASVI, Ancona, 2012,1:9-13.
-
S.S. Tavernier , Translating research on the distress thermometer into practice,
Clinical journal of oncology nursing, 2014, Vol. 18, 26-30
-
Saria MG et al. Clinical journal of oncology nursing, 2007;11:53–63;
-
Shi M et al. Blood Lymphatic Cancer , 2013; 3:1–9
-
http://ibmdr.galliera.it/info/informazioni-per-i-donatori/la-donazione-di-cellule-
staminali-emopoietiche.
-
http://vecchiosito.istitutotumori.mi.it/istituto/cittadino/MielomaMultiplo_glos
sario.asp?voce=leucaferesi
-
http://chemocare.com/chemotherapy/drug- info/Melphalan.aspx#.VQLEcY6G8vk
-
http://www.farmacoecura.it/tumore/trapianto-di-midollo-e-staminali-rischi-e-
procedura/
-
http://www.epicentro.iss.it/temi/tumori/aggiornamenti.asp
-
http://www.psychiatryonline.it/node/3520
-
http://www.staminafoundation.org/section/gvhd-staminali-adulte
-
http://www.tumoridelsangue.it/epidemiologia/
-
http://www.francescagalvani.org/articoli/95-differenze-tra-maschi-e-femmine-di-
fronte-al-dolore-cronico.htm
115
116
117