SINTESI PROTEICA (nozioni generali)
La sintesi di una proteina a partire dal DNA richiede due passaggi fondamentali: la trascrizione e la
traduzione.
Durante la trascrizione le informazioni contenute in un gene sono trasferite dal DNA a una
molecola di RNA chiamata mRNA (RNA messaggero).
La traduzione è la fase dove vengono sintetizzate le proteine secondo la sequenza di nucleotidi del
mRNA.
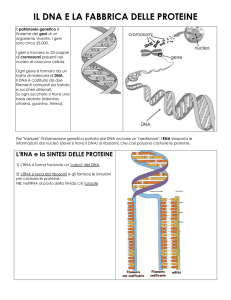
Trascrizione
All’interno del nucleo della cellula il DNA contenente il gene che codifica per una proteina fa da
stampo per la formazione di un filamento complementare di mRNA.
Questo mRNA esce dal nucleo e nel citoplasma, si unisce ad un ribosoma, dove avverrà la
traduzione, cioè la lettura dell’informazione ricevuta dal DNA..
Traduzione
I ribosomi sono organuli cellulari formati da due sub-unità di dimensioni differenti e costituiti da
rRNA (RNA ribosomiale) legato ad alcune proteine ( i ribosomi si formano nel nucleo).
Le proteine vengono sintetizzate nei ribosomi presenti sul RER o liberi nel citoplasma a partire
dalla “lettura” delle informazioni genetiche presenti nel mRNA.
Le informazioni contenute nel mRNA sono organizzate in triplette, chiamate anche codoni, formate
da gruppi di tre nucleotidi che, nel “linguaggio” utilizzato durante la trascrizione, corrispondono a
degli specifici aminoacidi.
CODONE
Le triplette sono più numerose degli aminoacidi, come possiamo vedere facendo un semplice
calcolo.
Le triplette sono formate da tre nucleotidi, ed i nucleotidi sono quattro, quindi abbiamo 4*4*4
possibili combinazioni, che corrispondono a 64 triplette differenti.
Mentre gli aminoacidi sono solo 20.
Questo significa che parecchie triplette corrisponderanno allo stesso aminoacido, inoltre esistono
delle triplette chiamate non senso.
Le triplette non senso svolgono una funzione simile alla punteggiatura, indicando l’inizio o la fine
di un gene.
Tornando ai ribosomi, il meccanismo per la sintesi proteica richiede l’intervento di un altro RNA, il
tRNA (RNA di trasporto).
Il tRNA trasporta all’interno del ribosoma l’aminoacido che corrisponde alle triplette di nucleotidi
del mRNA.
Questi aminoacidi vengono uniti tra loro secondo l’ordine del mRNA, fino a creare una proteina
completa. Ricordiamo che una proteina è formata da una catena di amminoacidi uniti da un legame
chiamato peptidico.
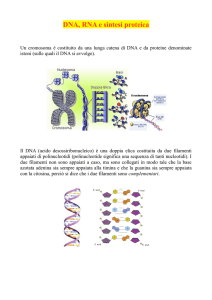
DNA
Il DNA (acido desossiribonucleico) contiene le informazioni necessarie per il funzionamento
dell'organismo e per la trasmissione dei caratteri alle generazioni successive.
Il DNA è formato da lunghe catene di nucleotidi, ognuno dei quali è composto da una base azotata,
da uno zucchero, chiamato desossiribosio, e da un gruppo fosfato.
Struttura del DNA
Le basi azotate del DNA sono quattro: adenina (A), timina (T), citosina (C) e guanina (G).
Adenina e Guanina sono chiamate basi puriniche perché derivano dalla purina. Mentre la Timina e
la Citosina derivano dalla pirimidina e sono chiamate basi pirimidiniche.
Ricapitolando, ogni nucleotide è formato da una molecola di desossiribosio legata a una di queste
quattro basi e ad gruppo fosfato.
Inoltre, il gruppo fosfato dei singoli nucleotidi può legarsi allo zucchero di un altro nucleotide,
formato così una catena di nucleotidi unita da una scheletro, dove si alternano uno zucchero ed un
fosfato.
Questa è la struttura di base di un singolo filamento. La molecola del DNA è formata da due
filamenti complementari, uniti in modo da formare una struttura nota come doppia elica.
La struttura a doppia elica del DNA è stata scoperta nel 1953 grazie al lavoro di Francis Crick e
James Watson.
La doppia elica è formata da due catene di nucleotidi unite dai legami idrogeno che si creano tra le
rispettive basi azotate.
Questi legami si formano solo tra una purina e una pirimidina, perciò gli appaiamenti sono possibili
solo tra adenina e timina, e tra citosina e guanina.
Replicazione del DNA
La replicazione del DNA è una fase importante per la corretta trasmissione delle informazioni
genetiche da una generazione alla successiva.
Le cellule sono in grado di replicarsi dividendosi in due cellule figlie che, grazie alla replicazione
del DNA, avranno entrambe lo stesso identico patrimonio genetico. Sempre che non si verifichino
delle mutazioni casuali, ma si tratta di un eventualità molto rara.
Una molecola di DNA è composta da una doppia elica formata da due filamenti complementari.
Questi due filamenti sono uniti dai legami idrogeno che si creano tra le rispettive basi azotate.
Durante la replicazione degli eucarioti, i due filamenti di DNA vengono separati da un enzima
chiamato DNA-elicasi. Questo enzima spezza i legami idrogeno che tengono uniti i due filamenti,
che si separano.
Entrambi i filamenti di DNA fanno da stampo per la formazione di un nuovo filamento
complementare. Creando così due copie identiche dello stesso cromosoma.
La sintesi del filamento complementare avviene ad opera dell'enzima DNA-polimerasi.
Questo tipo di replicazione è chiamata semiconservativa perché entrambe le due nuove molecole di
DNA contengono un filamento originale e uno appena "stampato".
RNA
L'RNA, o acido ribonucleico, è una molecola che svolge un ruolo molto importante nella sintesi
proteica.
La struttura del RNA è simile a quella del DNA, infatti entrambe le molecole sono formate da
catene di nucleotidi, anche se sono presenti alcune differenze fondamentali.
Ossidrile (OH)
I nucleotidi che costituiscono l'RNA sono formati da uno zucchero a cinque atomi di carbonio
chiamato ribosio, mentre nel DNA lo zucchero è il desossiribosio (privo di un gruppo -OH).
Le basi azotate presenti nell'RNA sono quattro: adenina (A), guanina (G), citosina (C), e uracile
(U). L'uracile non è presente nel DNA, dove invece troviamo la timina (T).
Inoltre, il DNA forma una struttura a doppia elica composta da due filamenti complementari,
mentre l'RNA è costituito da un singolo filamento.
Esistono tre tipi principali di RNA: l'RNA messaggero (mRNA), l'RNA di trasporto (tRNA) e
l'RNA ribosomiale (rRNA).
RNA messaggero (mRNA)
Sull'RNA messaggero (mRNA) vengono trascritte le informazioni presenti sui geni che si trovano
nel DNA all'interno del nucleo.
L'mRNA permette di trasportare le informazioni contenute nei geni, fuori dal nucleo, nel
citoplasma, dove avviene la sintesi proteica.
RNA ribosomiale (rRNA)
L'RNA ribosomiale (rRNA) si lega ad alcune proteine per formare i ribosomi, delle strutture
formate da due sub-unità dove avviene la sintesi proteica.
RNA di trasporto (tRNA)
Le molecole di RNA di trasporto (tRNA) sono ripiegate su se stesse in modo da formare una
particolare struttura a forma di trifoglio.
Queste molecole sono dotate di tre nucleotidi, chiamati anticodoni, che formano una sequenza
complementare ai codoni del mRNA.
Inoltre, le molecole di tRNA sono legate all'amminoacido che corrisponde al loro anticodone.
Modificazioni post-traduzionali delle proteine
La maturazione delle proteine non termina con la traduzione, ma si spinge, attraverso passaggi
successivi, fino alla definizione delle forme (conformazioni) che permettono ai polipeptidi di
svolgere funzioni sempre più complesse e specifiche.
La cellula è infatti in grado di legare covalentemente altre molecolore alle proteine, in particolare
alle catene laterali di alcuni amminoacidi, o di spezzare legami già esistenti.
Questi meccanismi prendono il nome di modificazioni post-traduzionali, in quanto successive alla
traduzione. Nel caso in cui siano contemporanee ad essa, si parla di modificazioni co-traduzionali.
In una proteina che presenta solo amminoacidi, gli unici legami covalenti che si possono trovare,
oltre ovviamente ai legami peptidici, sono i ponti disolfuro. Essi si formano per ossidazione delle
catene laterali di due cisteine, mediante la fusione dei gruppi sulfidrici (-SH).
I ponti disolfuro sono molto importanti per definire la struttura proteica in quanto permettono di
avvicinare stabilmente porzioni di una proteina anche molto distanti fra loro. Nel caso dell’insulina,
per esempio, tre ponti di solfuro sono in grado di tenere legate e ripiegate le due catene
polipeptidiche costituenti di questo ormone. In altri casi di strutture proteiche come il collagene e la
cheratina, i ponti di solfuro garantiscono grande elasticità e resistenza alle macrostrutture che vanno
a costituire, come il tessuto connettivo, capelli, zoccoli e unghie.
La glicosilazione è una modificazione che consiste nell’aggiunta di una o più unità di zucchero, a
opera di un enzima chiamato glicosiltranferasi. A seconda della catena amminoacidica sulla quale
gli zuccheri vengono legati distinguiamo la N-glicosilazione (coinvolge la catena laterale di
un’asparagina) e la O-glicosilazione (su un residuo di serina o treonina). La presenza dello
zucchero è spesso importante per aiutare la proteina a raggiungere la conformazione corretta, in
modo da permetterle di continuare la sua maturazione e proteggendola da attacchi eventuali di altri
enzimi (proteasi). La N-glicosilazione è in realtà una modificazione co-traduzionale poichè le
glicosiltransferasi presenti nel reticolo endoplasmatico sono in grado di modificare covalentemente
la proteina man mano che trovano il corretto sito di glicosilazione. La O-glicosilazione avviene
invece in alcune cisterne dell’apparato di Golgi. Le proteine dotate di zuccheri prendono il nome di
glicoproteine, le quali sono importanti per le cellule per esempio per motivi di difesa o
segnalazione.
La fosforilazione consiste invece nell’aggiunta di un gruppo fosfato (PO43-) ai gruppi idrossilici (OH) di residui di serina, treonina o tirosina. Gli enzimi deputati a queste reazioni vengono
chiamate chinasi, le quali sono specifiche per il substrato da fosforilare. Il donatore del gruppo
fosfato è primariamente l’ATP, che subisce l’idrolisi di uno dei suoi fosfati.
La reazione inversa viene chiamata defosforilazione, catalizzata dall’enzima fosfatasi.
La fosforilazione introduce una grande modificazione a livello della proteina poichè causa
l’inserimento di un gruppo "ingombrante" per dimensioni (il fosfato) e carico negativamente. In
particolare quest’ultima caratteristica può introdurre nuove interazioni elettrostatiche (es. ponti
salini) con gruppi carichi positivamente, come le catene laterali di arginina, istidina e lisina
(amminoacidi con comportamento basico). Ciò può causare un nuovo ripiegamento della proteina,
con un conseguente cambio di conformazione che può portare la proteina a legarsi (o anche a
staccarsi) da una certa molecola, modificandone per esempio il posizionamento all’interno della
cellula.
Nel caso degli enzimi, la fosforilazione può anche modificare loro attività sia in “positivo” sia in
“negativo”: a seguito di fosforilazione l’enzima infatti può risultare attivato o disattivato e la
defosforilazione ovviamente causa l’effetto contrario. Questa fenomeno è molto importante per il
controllo dell’attività enzimatica da parte delle cellule, che utilizzano la fosforilazione come un
interruttore molecolare al fine di “spegnere” o “accendere” gli enzimi al momento opportuno.
Un altro metodo con il quale le cellule regolano l’attività enzimatica è il “taglio” di alcune porzioni
delle proteine, al fine per esempio di liberarne i siti attivati, altrimenti ostruiti. Questa
modificazione post-traduzionale prende il nome di processamento (o taglio) proteolitico e viene
portata a termine da enzimi chiamati proteasi. Le proteasi hanno in generale il compito di scindere
legami peptidici e la loro attività viene spesso controllata con un processamento proteolitico ad
opera di altre proteasi: una proteasi idrolizzando ne attiva un’altra, la quale ne idrolizza e taglia
un’altra e così via.
Altre modificazioni comuni nelle cellule sonol’acetilazione, ovvero l’aggiunta di un gruppo acetile
(-COCH3)la metilazione, aggiunta di un metile (-CH3) l’acilazione, cioè l’aggiunta di lunghe
catene di atomi di carbonio.
Apparato del Golgi
La maturazione delle proteine. provenienti dal RER o dal citoplasma avviene nel Golgi, dove le
proteine vengono modificate prima di essere trasferite alla loro destinazione finale.
Le modifiche apportate sono essenzialmente di 4 tipi:
1. glicosilazione (aggiunta di zuccheri) o deglicosilazione (rimozione di zuccheri);
2. solfatazione (aggiunta di gruppi solfato … cioè contenenti atomi di zolfo);
3. fosforilazione (aggiunta di gruppi fosfato … cioè contenenti atomi di fosforo).
L'apparato di Golgi ha quindi una funzione molto importante, non solo quella di rielaborare
(modificare e maturare le proteine), ma anche di selezionare ed esportare i prodotti cellulari. Questo
organulo può interagire con altri, come il reticolo endoplasmatico rugoso, per indirizzare ed
etichettare certe vescicole contenenti prodotti cellulari verso la loro destinazione, che può essere
quello di confluire in altri organi o inserirsi nella membrana plasmatica e farne uscire il contenuto.
Possiamo fare un esempio con una proteina che deve raggiungere un lisosoma. Inizialmente questa
proteina viene fornita di una specifica sequenza segnale che la indirizza nel reticolo endoplasmatico
rugoso. Qui, le viene rimossa la sequenza segnale, sostituita con un oligosaccaride (cioè l'indirizzo
in etichetta), e la proteina ora si chiama glicoproteina . Gli enzimi del Golgi modificano
l'oligosaccaride aggiungendogli un gruppo fosfato non per normale fosforilazione ma con
N.acetilglucosammina fosfotransferasi che decide su quale substrato attaccare il gruppo fosfato. Il
riconoscimento avviene grazie ad una sequenza segnale nella proteina che viene riconosciuta
dall'enzima transferasi. La proteina fosforilata si lega ad un recettore specifico; dopo viene
racchiusa all'interno di una vescicola mediante l'estroflessione della membrana cellulare. In questo
modo la proteina resta divisa dal citoplasma quindi può raggiungere il lisosoma.
Meccanismi simili regolano ed indirizzano proteine diverse verso altri componenti cellulari.
L'apparato del Golgi è responsabile dell'esportazione di queste proteine, ed è anche coinvolto
nell'immagazzinamento di altre, fino a che queste non devono essere utilizzate o espulse dalla
cellula.
I prodotti di questo apparato vengono secreti come piccole vescicole che migrano verso la
membarana plasmatica con quest'ultima si fondono per rinnovarne i componenti.