Corso di Complementi di
Chimica e Biochimica
L’elettrochimica e i metodi
elettrochimici di analisi
Prof. M. Pasquali
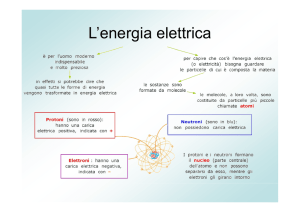
L’elettrochimica è quella branca della chimica che studia il
passaggio di elettroni da una specie chimica ad un’altra.
Lo spostamento delle cariche elettriche avviene fondamentalmente in
due modi:
1)
Movimento di elettroni (o di buche positive). Questi materiali sono
detti conduttori di I° specie o semi conduttori. In questo caso il
movimento delle cariche elettriche non provoca spostamenti di
materia e quindi di masse.
2) Movimento di ioni in un fluido. In questo caso il passaggio della
corrente elettrica è dovuto al movimento di particelle più o meno
pesanti che detengono una particolare carica elettrica, che sono
appunto gli ioni. Esistono ioni positivi detti CATIONI e ioni negativi
detti ANIONI. In questo caso si parla di conduttori di II° specie, in
quanto ad un trasferimento di carica corrisponde un movimento di
massa.
Prof. M. Pasquali
Conduttori di I° specie
La grandezza che li contraddistingue è la resistenza specifica o resistività.
V = R!I
Dalla legge di Ohm si ha:
I è la quantità di corrente (misurata in Ampere) che attraversa il conduttore metallico quando
ai suoi estremi si applica una differenza di potenziale V .
R è la resistenza del conduttore, costante a temperatura costante che si misura in Ohm
(Ω).
L
R="!
S
ρ è la resistenza specifica o resistività del mezzo, L è la lunghezza del conduttore ed S è la
sua sezione.
Quindi ρ è la resistenza offerta al passaggio di corrente da un conduttore che ha lunghezza
di 1 cm e superficie 1cm2. ρ si misura in Ω cm.
Spesso si fa uso del concetto di conducibilità del conduttore e non di resistenza; la
conducibilità è l’inverso della resistenza:
1 1 S
"= = !
R # L
si misura in Siemens (S) o Ω-1
"=#!
S
L
In cui χ è la conducibilità specifica o conduttanza del mezzo, è l’inverso della resistenza
specifica e si misura in S cm-1 oppure in Ω-1 cm-1.
Prof. M. Pasquali
Conduttori di II° specie
Per i conduttori di seconda specie
valgono i concetti di resistenza R e di
conducibilità X, anche se i fattori che
l’influenzano sono molteplici, proprio in
virtù della loro natura
(Temperatura, concentrazione della
soluzione elettrolitica, tipo di solvente)
Prof. M. Pasquali
Dati che caratterizzano i vari tipi di conduttori
Tipo conduttore Portatori di
carica mobile
Concentrazione di
portatori (n° cm-3)
Mobilità (cm2 s-1 V-1)
Energia di attivazione
(kcal mol-1)
Elettroni
≈ 1022
104
non attivato
Semiconduttore
(Ge)
Elettroni
Buche
1012 ÷ 1018
1012 ÷ 1018
3.8·103
1.8·103
0.2
0.2
Vacanze
(NaCl)
5·105 (a 25°C)
8·1014 (a 400°C)
4·1017 (a 800°C)
10-3 (a 727 °C)
20
Solido ionico
Ioni
1023
10-4÷10-3
4
Ioni
1016÷1023
10-3
2.5
Metallo
Sale fuso
(nitrati alcalini)
Soluzione
elettrolitica
Prof. M. Pasquali
Sistemi elettrochimici
I sistemi elettrochimici sono caratterizzati dalla
disposizione in serie di conduttori di I° specie e di II° specie.
Una cella elettrochimica è costituita da due conduttori di I° specie immersi nel
conduttore di II° specie. In tale configurazione i due conduttori di prima specie a
contatto con il conduttore di seconda specie si dicono elettrodi;
il conduttore di seconda specie interposto tra gli elettrodi si chiama elettrolita.
Prof. M. Pasquali
Il passaggio di corrente in un sistema elettrochimico comporta delle
trasformazioni chimiche agli elettrodi dovute al fatto che in
corrispondenza della superficie di separazione tra il conduttore di I°
specie (elettrodo) e il conduttore di II° specie (elettrolita) avviene
un cambio di portatori di elettricità corrispondente ad una cessione
o ad una addizione di elettroni.
Reazioni di Riduzione
elettroni come reattivi
Reazioni di Ossidazione
elettroni come prodotti
Prof. M. Pasquali
Reazione di scarica di ioni: ioni come reattivi
Ni2+ + 2e- → Ni
Reazione di ionizzazione: ioni come prodotti
O2 + 2H2O + 4e- → 4 OHReazione di scarica di ioni: ioni come reattivi
2Cl- → Cl2 + 2eReazione di ionizzazione: ioni come prodotti
Na → Na+ + e-
Connessi con i processi di scambio elettronico che avviene agli elettrodi, vi sono
una serie di altri processi che avvengono alcuni sugli elettrodi altri nella soluzione
in prossimità dell’elettrodo e altri ancora nel corpo della soluzione stessa che
accompagnano il processo elettrochimico vero e proprio.
Per una generica reazione redox:
Ox + ne- ↔ Rid
H3O+sup+ sol ← H3O+ (sol) sup
H+sup+ H2O ← H3O+sup
Hads ← H+ads+ e-
H+ads ← H+sup
2 H3O+ + 2e- ↔ H2(gas) + 2 H2O
2Hads → H2ads
Prof. M. Pasquali
H3O+(sol) sup ← H3O+ (sol) Bulk
(2Hads → H2sup)
H2sup → H2(g)↑
Prof. M. Pasquali
Come primo argomento si affronterà
lo studio delle soluzioni elettrolitiche
poi gli aspetti legati ai processi elettrodici
e per ultimo le modalità di controllo dei processi.
Prof. M. Pasquali