Fisiologia, lezione del 13 ottobre 2005
SISTEMA CARDIOVASCOLARE
Il sistema cardiovascolare si è evoluto negli animali più differenziati per garantire l’apporto di
sostanze nutritive e di ossigeno questo perché ossigeno e sostanze nutritive provengono
dall’ambiente esterno, l’organismo unicellulare può recuperare queste sostanze direttamente in
quanto la distanza che le sostanze devono percorrere per arrivare all’interno dell’organismo è breve.
Cioè l’ossigeno o la sostanza nutritiva passa per diffusione semplice e quindi si distribuisce alla
cellula. Questo sistema ovviamente non è applicabile a organismi pluricellulari perché il processo di
diffusione avviene rapidamente per differenza di concentrazione, ma copre delle distanze molto
piccole. Quindi le sole cellule del nostro organismo che sono esposte all’ambiente esterno e
potrebbero ricavare ossigeno e sostanze nutritive dall’ambiente esterno stesso sono le cellule più
superficiali della cute; difficilmente le cellule più interne riescono a procurarsi queste sostanze con
questo sistema. Quindi si è evoluto un sistema che potesse trasportare le sostanze nutritive e
l’ossigeno all’interno del nostro organismo e contemporaneamente allontanare le sostanze di scarto
prodotte dai tessuti durante l’attività metabolica.
Nel 1600 Harvey ha descritto l’organizzazione dell’apparato cardiovascolare.
L’apparato cardiovascolare è costituito da 2 componenti fondamentali: una componente,
rappresentata dal cuore, che è una pompa; e un’altra componente, che è il sistema vasale, costituita
da un insieme di tubi che sono naturalmente connessi al cuore e attraverso i quali scorre il sangue
attraverso i vari tessuti. In particolare nei mammiferi il cuore è diviso in due pompe distinte: noi
abbiamo un cuore destro e un cuore sinistro che sono ben separati da un setto per cui non c’è mai
comunicazione tra queste due pompe. Queste due pompe funzionano dal punto di vista meccanico
in serie, funzionano contemporaneamente ma mettono capo a due sistemi vascolari differenti e
distinti. Funzionano contemporaneamente per evitare che ci sia un accumulo di sangue da un
compartimento all’altro del cuore. Cuore destro e cuore sinistro sono connessi ai due circoli: uno è
il circolo cosiddetto polmonare che è alimentato dal cuore di destra; e l’altro è il circolo sistemico
alimentato dal cuore di sinistra. Il cuore di destra pompa il sangue in un unico distretto che è il
circolo polmonare, questo passaggio attraverso il polmone ho lo scopo di arricchire il sangue di
ossigeno, quindi sangue povero di ossigeno che è tornato all’atrio di destra tramite le vene passa nel
ventricolo di destra e quando questo si contrae viene spinto all’interno della arteria polmonare. Il
cuore di sinistra invece ha il compito di spingere il sangue in tutti gli altri tessuti del nostro
organismo e per fare questo il circolo sistemico comprende vari circoli distrettuali che sono
posizionati un parallelo tra di loro, quindi la quantità di sangue che viene espulsa dal ventricolo
sinistro e che passa all’interno dell’aorta poi si distribuisce, tramite le ramificazioni dell’aorta, nei
vari circoli distrettuali che sono, partendo dall’alto: cerebrale, degli arti superiori, splancnico,
renale, coronario (responsabile della irrorazione del cuore stesso). La disposizione di questi circoli
in parallelo è dal punto di vista funzionale importante perché con questo tipo di disposizione
possiamo modificare la distribuzione del sangue all’interno dei vari distretti, possiamo deviare una
certa quantità di sangue da un distretto che momentaneamente ne ha relativamente poco bisogno
verso un distretto che in quel momento richiede una maggiore quantità di ossigeno. Ci sono due
distretti che in generale non subiscono mai una riduzione di flusso e sono il cerebrale e il
coronarico. Altri distretti possono subire una variazione di flusso in relazione alle necessità
metaboliche del momento. Per quanto riguarda i circoli distrettuali possiamo dire che il circolo
renale e il circolo splancnico sono due circoli che ricevono una quantità di sangue molto elevata se
viene paragonata al loro effettivo consumo di ossigeno; questa discrepanza è legata al fatto che il
circolo renale ha il significato di portare sangue al rene che provvede a estrarre le scorie
metaboliche che poi vengono eliminate con la formazione delle urine, quindi è importante che
attraverso il rene nell’unità di tempo passi un grosso volume di sangue tant’è vero che attraverso i
reni passa il 22% della quantità di sangue che viene espulsa in un minuto dal cuore, è molto
1
confrontato soprattutto alle dimensioni dell’organo. Stesso discorso per l’intestino che nel momento
in cui avviene il processo digestivo richiede un grosso afflusso di sangue per garantire la massima
efficienza del processo di assorbimento: le sostanze nutritive passano attraverso l’epitelio intestinale
e devono entrare nel torrente circolatorio per arrivare al fegato.
I distretti circolatori sono organizzati in vasi disposti in serie tra di loro che hanno funzioni diverse:
-arterie (vasi di distribuzione)
-capillari (vasi di scambio)
-vene (vasi di raccolta)
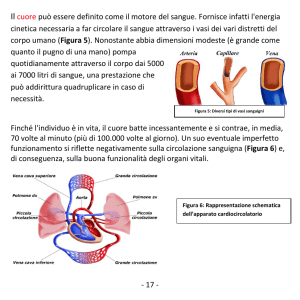
Il cuore è un organo impari, il suo peso è di 300g nell’uomo, 220-230g nella donna, è posto nel
mediastino dietro lo sterno, tra i due polmoni in posizione mediana ma non simmetrica: 1/3 del
cuore si trova nella parte destra della gabbia toracica e la parte prevalente del cuore si trova nella
porzione sinistra della gabbia toracica. Ha una forma conica con base superiore da cui entrano e
partono i vasi. La base si trova in corrispondenza del 2° spazio intercostale, l’apice arriva al 5°
spazio intercostale di sinistra. La forma e la posizione del cuore cambiano da soggetto a soggetto. Il
cuore è posto tra lo sterno e la colonna vertebrale, due strutture rigide. Questo fatto fa si che si
possa ricorrere ad un massaggio manuale del cuore per spingere il sangue all’interno dei vasi.
Il cuore è avvolto all’interno della gabbia toracica dal sacco pericardio costituito da un sacco
fibroso esternamente che avvolge tutto il cuore e si inserisce grosso modo alla radice dei vasi. Il
pericardio si dispone con un foglietto parietale verso i polmoni e uno viscerale che si dispone sulla
superficie esterna del cuore. Tra il foglietto parietale e il foglietto viscerale c’è uno spazio virtuale
che è lo spazio pericardico che contiene un piccolo volume di liquido pericardico utile per
agevolare i movimenti del cuore e rendere l’interazione tra polmoni e il cuore indolore.
La posizione del cuore è importante dal punto di vista semeiotico perché dobbiamo conoscere i
punti in cui insorgono rumori indicativi sull’attività cardiaca. I rumori che noi sentiamo derivano
dai movimenti di apertura e di chiusura delle valvole cardiache.
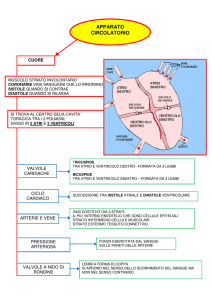
Ogni metà del cuore è divisa in due cavità: una cavità superiore rappresentata dall’atrio e una
inferiore che è il ventricolo. La comunicazione tra atrio e ventricolo avviene solamente in
corrispondenza degli orifizi atrioventricolari che sono chiusi da valvole. Il cuore presenta una
struttura scheletrica, il cosiddetto anello fibroso disposto intorno a queste zone di comunicazione sia
tra gli atri e i ventricoli (orifizio atrioventricolare di dx e di sn)sia tra i ventricoli e l’arteria che da
essi parte (orifizio aortico e orifizio polmonare): Questo anello fibroso fa si che non ci sia nessun
tipo di comunicazione di tipo elettrico tra l’atrio e il ventricolo, la muscolatura dell’atrio è distinta
dalla muscolatura del ventricolo, l’anello fibroso rende queste camere separate dal punto di vista
funzionale. Questo anello fibroso è il punto di inserzione di due diversi tipi di strutture: da una parte
la muscolatura ventricolare che si inserisce sul lembo esterno dell’anello fibroso – la muscolatura
ventricolare origina dall’anello fibroso, presenta un andamento longitudinale verso il basso e
arrivata a livello dell’apice si ribalta e assume una direzione di tipo perpendicolare verso l’interno e
dà origine ai muscoli papillari. Internamente all’anello fibroso invece si inseriscono i lembi
valvolari delle valvole atrioventricolari (due a sinistra-bicuspide o mitrale e tre a destra-tricuspide),
questi lembi si aprono o si chiudono a seconda della pressione esistente nelle due camere del cuore.
Le corde tendinee inserite sui lembi delle valvole da una parte e sui muscoli papillari dall’altra
durante la contrazione del ventricolo impediscono che ci sia una retroapertura della valvola
all’interno dell’atrio perché tirano verso il basso il lembo valvolare.(52min-controllo)
Gli osti arteriosi dei ventricoli sono provvisti ciascuno di tre valvole a nido di rondine che si
inseriscono alla radice del vaso all’interno dell’anello fibroso e non necessitano di corde tendinee,
perché la loro forma a coppa fa si che nel momento in cui il sangue al termine della sistole tornando
indietro riempie queste coppe facendole addossare l’una all’altra impedendo un rigurgito di sangue
all’interno del ventricolo stesso. Queste valvole sono responsabili dell’unidirezionalità del flusso. A
livello delle vene quindi dei vasi che tornano al cuore non ci sono valvole ma c’è comunicazione
libera tra vene ed atri , il sangue non refluisce perché la pressione a livello degli atri è sempre molto
2
bassa, l’atrio ha una scarsa attività di pompa e quindi al massimo si arresta momentaneamente
durante la contrazione atriale il flusso del sangue che ritorna al cuore.
Sia i vasi in ingresso (le vene) che i vasi in uscita (le arterie) sono posizionati dalla stessa parte del
cuore, questa organizzazione conferisce l’unidirezionalità del flusso stesso, in più i muscoli papillari
che sporgono all’interno della parete del cuore quando si contraggono creano una sorta di imbuto
che dirige il sangue verso la valvola semilunare e quindi verso l’arteria mentre occlude in un certo
senso la valvola atrioventricolare. Per quanto riguarda l’irrorazione del cuore, il cuore è irrorato da
due vasi che son le cosiddette arterie coronarie, destra e sinistra. Le arterie coronarie sono i primi
vasi che partono dall’aorta subito aldilà dei lembi valvolari. I grossi vasi del cuore hanno poche
anastomosi, quelli più piccoli formano una fitta rete ricca di anastomosi. Il cuore è il tessuto in cui
c’è il maggior numero di capillari rispetto al numero di cellule (circa un capillare per fibra
muscolare). Il cuore è una bestia da soma: comincia a battere nel feto nel grembo materno e
prosegue ininterrottamente, regolarmente e in maniera efficiente per tutta la vita. Il cuore si contrae
in maniera ritmica, ad ogni sistole segue una diastole, in questa fase di rilassamento muscolare il
cuore si riposa. Per quanto riguarda il circolo venoso, le vene del cuore hanno un andamento
analogo a quello delle arterie e si riverso a livello del seno coronario presso l’atrio destro, esistono
comunque alcune vene (vene minime) che portano il sangue direttamente all’interno del cuore. Il
cuore si contrae anche se isolato e posto in una soluzione fisiologica a concentrazione opportuna di
elettroliti, in particolare sodio, potassio e calcio. Ciò significa che il cuore funziona
indipendentemente da altri fattori esterni che possono influenzarne l’attività. Tuttavia è importante
il controllo del cuore che è doppio, sia di tipo nervoso che di tipo ormonale. L’innervazione del
cuore è a carico del sistema nervoso autonomo, sia ortosimpatico (azione stimolante) che
parasimpatico (azione inibente). L’azione di pompa del cuore non dipende dall’innervazione, si
pensi a questo proposito ai nervi dei trapiantati, questi sono cuori denervati.
Il cuore è costituito per circa il 75% da cellule muscolari dette miociti o, più specificatamente,
cardiomiociti le quali hanno alcune caratteristiche che le avvicinano alle fibre muscolari
scheletriche e altre caratteristiche che le avvicinano al muscolo liscio. I cardiomiociti sono più
piccoli rispetto alle fibre del muscolo striato scheletrico e c’è differenza di dimensioni tra le cellule
muscolari dell’atrio e quelle del ventricolo: in quest’ultimo risultano essere più lunghe e di diametro
maggiore. Questa differenza microscopica tra le cellule ricalca una differenza di tipo funzionale; in
quanto la contrazione dell’atrio è una contrazione di scarso significato. Inoltre c’è da puntualizzare
che il cuore destro ha una parete più sottile perché deve sviluppare una forza minore, rispetto a
quello di sinistra, per pompare il sangue nel circolo polmonare dimensionalmente più piccolo di
quello sistemico e con una pressione del sangue minore rispetto a quella del sangue nel circolo
sistemico perché nel circolo polmonare mancano le arteriose che sono i caratteristici vasi di
resistenza che con la loro muscolatura liscia offrono maggiore resistenza al sangue.
Il muscolo cardiaco presenta la caratteristica striatura del muscolo scheletrico dovuta alla presenza
di quelle caratteristiche unità contrattili fondamentali rappresentate dal sarcomero. Nel muscolo
liscio la striatura non c’è perché queste strutture sono poco organizzate.
3
Fisiologa, lezione del 14 ottobre 2005
MIOCARDIO
Il miocardio è costituito da cellule muscolari che vengono dette miociti o cardiomiociti. I
cardiomiociti dell’atrio hanno una forma tendenzialmente ellittica mentre quelli del ventricolo
hanno una forma prevalentemente cilindrica e queste cellule del ventricolo hanno dimensioni
nettamente più grosse rispetto a quelle dell’atrio: possono arrivare a lunghezze anche di 50-100μ
confrontate a lunghezze di al massimo 20μ a livello dell’atrio. Ribadiamo che le cellule muscolari
del cuore sono molto minori rispetto alle fibrocellule della muscolatura scheletrica, pur presentando
un aspetto in parte simile. Le cellule del ventricolo di forma cilindrica hanno la caratteristica di
biforcarsi nella zona terminale prendendo contatto con altre cellule. Il contatto tra una cellula e
l’altra avviene in corrispondenza di strutture ben definite che sono i cosiddetti dischi intercalari;
questi dischi intercalari sono importanti in quanto da un punto di vista funzionale fanno in modo
che ci sia una comunicazione quindi la forza meccanica che si sviluppa in una cellula si aggiunge
alla forza meccanica della cellula attigua, quindi tutte le cellule che costituiscono il miocardio alla
fine lavorano tutte insieme, infatti, pur essendo le cellule separate l’una dall’altra, dal punto di vista
funzionale si comportano come se fossero un sincizio cioè un unico tessuto muscolare che funziona
insieme. Questo è importante perché per agire da pompa efficace la muscolatura che si trova intorno
alla cavità contenente sangue deve essere ristretta contemporaneamente. Le cellule miocardiche
possiedono un singolo nucleo (mentre quelle scheletriche sono polinucleate).
La striatura è legata alla presenza, su queste cellule, di unità contrattili semplici rappresentate dai
sarcomeri. Il sarcomero è delimitato da due linee Z e la striatura è dovuta al fatto che in questa unità
contrattile sono presenti i miofilamenti contrattili che sono l’actina e la miosina che si
sovrappongono solamente in parte. A livello delle linee Z si attaccano i miofilamenti di astina, nella
parte centrale del sarcomero si trovano i filamenti spessi di miosina che sono in parte sovrapposti ai
filamenti di astina. La banda scura A (anisotropa) corrisponde alla zona in cui i due filamenti sono
sovrapposti, nella zona centrale c’è una banda chiara H dove sono presenti solamente i filamenti di
miosina, poi la linea scura M che è la zona centrale. La lateralmente abbiamo poi la banda I
(isotropa) chiara è caratterizzata dalla sola presenza di filamenti di astina. Questa disposizione così
precisa dei miofilamenti è responsabile dell’aspetto striato della cellula.
Le varie cellule sono connesse l’une alle altre in corrispondenza di quelle strutture che prendono il
nome di dischi intercalari, la superficie del disco è occupata in parte dalla zona di attacco dei
filamenti di astina alla fascia aderente della giunzione tra una cellula e l’altra e in parte da altre
piccole zone di adesione che sono i cosiddetti desmosomi. Una parte del disco intercalare è formata
da strutture che prendono il nome di gap junction che sono delle zone in cui è possibile una
comunicazione diretta tra il citoplasma di due cellule attigue, queste gap junction prendono il nome
di connessoni e sono come due canali costituiti da proteine transmembrana che prendono il nome di
connessine e sono presenti in numero di 6 a costituire il connessone. La caratteristica di questi
connessoni è che non sono sempre aperti, ma sono sensibili alla variazioni della concentrazione del
calcio, in particolare quando la concentrazione del calcio citoplasmatica aumenta il connessone si
chiude.
Oltre ai miofilamenti di actina e miosina i miociti contengono altri tipi di filamenti: filamenti
intermedi che costituiscono una sorta di citoscheletro che è importante per garantire una
connessione tra le cellule, tra i miofilamenti del sistema contrattile e la membrana cellulare. La
banda I nella quale non è presente miosina è caratterizzata dal fatto di possedere una certa elasticità,
quindi può essere distesa e questo può accadere ad esempio se ci sia un aumento di sangue nel cuore
per cui le pareti vengono distese e le bande Z di tutti i sarcomeri verranno allontanate tra di loro.
Nel momento in cui cessa la causa di questa distensione la situazione torna come in partenza.
Durante la contrazione non c’è accorciamento dei miofilamenti ma c’è scorrimento degli stessi.
All’esterno dei miociti c’è della matrice extracellulare di tessuto connettivo costituita da diverse
4
proteine con funzione di tipo meccanico (fornisce un sostegno alla contrazione), ma sembra che
abbia anche delle funzioni di tipo metabolico. All’interno di questa matrice sono presenti diverse
proteine tra cui per esempio il collagene che è prodotto dai fibroblasti ed è responsabile della
rigidità del tessuto miocardico; un eccesso di fibre collagene porterebbe una eccessiva rigidità delle
pareti cardiache e comprometterebbe la funzionalità del cuore stesso.
Il sarcolemma (membrana cellulare) dei miociti è caratterizzato dal fatto che presenta delle
invaginazioni che sono i cosiddetti sistemi T presenti in corrispondenza della linea Z dei sarcomeri.
Queste invaginazioni aumentano del 30% la superficie della membrana cellulare e avvicinano il
compartimento extracellulare alla cellula, quindi facilitano gli scambi e l’apporto di ossigeno e di
sostanze nutritive alla cellula miocardica, inoltre a livello di queste invaginazioni sono presenti dei
canali particolari che sono i cosiddetti canali L del calcio. Nel miocita poi c’è un’altra struttura
estremamente importante rappresentata dal reticolo sarcoplasmatico nel quale distinguiamo due
strutture leggermente differenti: una struttura a forma grosso modo di cisterna posizionata in
prossimità dei tubuli T deputata alla funzione di rilascio di calcio quando la cellula viene eccitata; in
prossimità delle cisterne c’è un sistema di tubuli sottili che possiedono una sorta di pompa che capta
il calcio dal compartimento citoplasmatico per immagazzinarlo all’interno del reticolo
sarcoplasmatico. I tubuli T uniti alle cisterne del reticolo sarcoplasmatico prendono il nome di diadi,
a differenza di quelle che ci sono nel muscolo scheletrico che sono triadi.
All’interno del tessuto miocardico ci sono altre cellule muscolari che sono differenziate e
costituiscono sia il tessuto nodale che il tessuto di conduzione. Si tratta sempre di miociti che però
presentano in maniera meno evidente i miofilamenti contrattili ed hanno altre strutture più
sviluppate proprio per esplicare la funzione caratteristica: il tessuto nodale quella di dare origine
all’eccitamento spontaneo, il tessuto di conduzione quella di propagare rapidamente l’evento
elettrico lungo tutto il tessuto cardiaco. Nei miociti è presente un numero elevatissimo di
mitocondri in relazione all’elevato consumo di ossigeno e all’elevato fabbisogno energetico di
queste cellule. Internamente le cavità cardiache sono rivestite da uno strato di endotelio tessuto che
costituisce anche la parete interna dei vasi, è simile a un epitelio pavimentoso semplice ma deriva
da un foglietto embrionale differente. L’endotelio non è solamente una struttura di rivestimento,
negli ultimi anni si è scoperto che ha funzione secernente.
Proprietà del miocardio: 1) eccitabile; 1a) refrattarietà 2) conducibilità; 3) ritmicità; 4) contrazione.
1) Eccitabilità: un tessuto si dice eccitabile quando è in grado di rispondere ad uno stimolo adeguato
in durata ed intensità con un cambiamento di stato. Tutte le cellule in generale ma in particolare
quelle eccitabili presentano un potenziale di membrana detto anche potenziale di riposo (che ha un
valore negativo, nel miocardio è intorno ai -90mV). Da che cosa dipende il potenziale di
membrana? Dalla differente concentrazione di ioni sui due lati della membrana che presenta una
diversa permeabilità per quegli ioni. Gli ioni che possono determinare questo potenziale sono il
potassio, presente in una concentrazione maggiore all’interno della cellula e minore all’esterno, il
sodio, molto più concentrato all’esterno e poco all’interno della cellula. Tuttavia mentre lo ione
potassio riesce a passare attraverso la membrana cellulare il sodio fa molta fatica, la membrana è
poco permeabile al sodio. Anche il calcio è molto più concentrato all’esterno che all’interno, ma la
membrana è poco permeabile al calcio. Di fatto noi abbiamo la fuoriuscita di calcio non seguita da
un passaggio in senso opposto di altre cariche positive. In realtà non ci sono molte più cariche
negative nella cellula perché è sempre rispettata l’elettroneutralità tra i compartimenti
dell’organismo (equilibrio di Gibbs-Donnan). Però le cariche positive di potassio che fuoriescono
vengono in un certo senso ostacolate dalle cariche negative delle proteine intracellulari le quali a
causa delle loro dimensioni non riescono a fuoriuscire; neppure il cloro intracellulare esce
accompagnando il potassio. Il potassio che fuoriesce attira contro la membrana le cariche negative
delle proteine le quali d’altra parte trattengono aldilà della membrana le cariche positive del
potassio. Non bisogna dimenticare che esiste anche la pompa sodio-potassio che fisiologicamente
porta fuori dalla cellula il sodio e dentro la cellula il potassio, quindi è una pompa per definizione
5
elettrogenica perché sposta 3 ioni Na+ contro 2 ioni K+ partecipando in minor parte all’accumulo di
cariche negative all’interno della membrana cellulare.
Il potenziale non ha lo stesso valore in tutte le cellule del tessuto miocardico: le cellule del
miocardio di lavoro hanno un potenziale di riposo di -90mV, le cellule del tessuto nodale hanno un
potenziale di riposo meno negativo (circa -60mV). Applicando uno stimolo alle cellule del tessuto
miocardico si osserva una variazione del potenziale di azione;questa variazione è la risposta della
cellula eccitabile allo stimolo, e prende il nome di potenziale di azione. In seguito ad uno stimolo il
potenziale si sposta rapidamente dal valore di -80mV verso valori di potenziali meno negativi,
raggiunge lo 0, lo supera e arriva addirittura ad un valore positivo: la cellula si depolarizza, perde la
propria polarità. Nel potenziale di azione del tessuto miocardiche si hanno caratteristicamente 4
fasi, la sua durata è di 250-300ms. Risposta rapida caratteristica di cellule del miocardio di lavoro e
delle cellule del Purkinje.
Esiste un altro tipo di risposta detta lenta che si verifica in cellule con un potenziale di membrana
meno negativo di -90mV, la fase di depolarizzazione (fase 0) è più lenta, difficilmente questa
risposta lenta supera il valore 0, è più lenta anche la fase di ripolarizzazione.
1a)La refrattarietà è la caratteristica per cui la cellula non risponde allo stimolo, pur adeguato,
quindi non è più eccitabile. La refrattarietà viene distinta in due tipi: refrattarietà assoluta, quindi
non c’è nessuna possibilità di rispondere allo stimolo, refrattarietà relativa,cioè modificando il tipo
di stimolo, cambiando l’ampiezza, la durata dell’applicazione dello stimolo possiamo indurre una
risposta nella nostra cellula.
Nella risposta rapida il periodo di refrattarietà relativo termina con l’inizio della fase 4, cioè con il
ritorno del potenziale di riposo al valore di partenza; nel caso della risposta lenta invece questo
periodo di refrattarietà relativo persiste anche nella fase 4, per un certo tempo,cioè anche se il
potenziale di riposo è ritornato al valore di partenza la cellula risulta comunque in eccitabile o
parzialmente in eccitabile, ha un’eccitabilità ridotta. Questo tipo di risposta lenta noi lo possiamo
osservare sia in cellule specializzate del cuore (cellule del nodo seno-atriale, del nodo atrioventricolare, del fascio di His) sia nel miocardio comune modificando alcuni parametri caratteristici
come ad esempio la concentrazione extracellulare del potassio: se la concentrazione extracellulare
di potassio aumenta, meno potassio tenderà ad uscire della cellula ed il potenziale di riposo
assumerà valori meno negativi. Il concetto di potenziale d’azione è sempre legato ad u valore di
soglia che è diverso a seconda che la risposta sia rapida o lenta.
Cosa causa questo evento elettrico così particolare? Il potenziale d’azione si manifesta nel momento
in cui cambia la permeabilità ad alcuni ioni. Nella risposta rapida la fase 0 è legata a un repentino
aumento della permeabilità agli ioni sodio che passa tramite canali voltaggio-dipendenti e si aprono
quando si raggiunge un determinato valore di potenziale. Nella risposta rapida il potenziale di soglia
è di circa -60mV. Il rapido afflusso di ioni sodio e quindi di cariche positive nella cellula porta il
potenziale a valori ancora meno negativi, addirittura positivi. I canali del sodio, voltaggio
dipendenti, sono analoghi ai canali del sodio della fibra nervosa: sono canali a cinetica rapidissima
che presentano un duplice cancello, uno di attivazione e un cancello di inattivazione. Sostanze come
la lidocaina hanno la caratteristica di poter mantenere in uno stato inattivo il canale per un tempo
più lungo, pur ritornando il potenziale al valore di partenza (farmaci anti-aritmici), in questo modo
si può ridurre l’eccitabilità del miocardio. Fase 1, non ugualmente ampia in tutte le cellule del
miocardio, è particolarmente evidente a livello delle cellule atriali, a livello delle cellule del
Purkinje, a livello delle cellule ventricolari epicardiche, è legata al fatto che c’è una attivazione di
una corrente di uscita del potassio (transient outward), corrente che ha come effetto quello di
rapidamente riportare il valore del potenziale da un valore positivo (+20-+30mV) a un valore meno
positivo, verso lo zero. Alla fase 1 segue la fase 2 legata al fatto che c’è una attivazione di alcuni
canali del calcio voltaggio dipendenti che hanno una cinetica di attivazione più lenta rispetto a
quelli del sodio, sono canali che vengono attivati dal voltaggio ma hanno una soglia più alta nel
senso che si attivano a valori di potenziale intorno a -50,-40mV. Quindi si attivano durante la fase 0
del potenziale d’azione, ma avendo una cinetica più lenta rispetto ai canali del sodio, naturalmente
6
determineranno una corrente di calcio ritardata responsabile della fase di plateau del potenziale
d’azione. In questa fase 2 oltre alla corrente in ingresso di calcio carico positivamente, c’è una
corrente di potassio in uscita detta corrente rettificante ritardata, in cui il potassio si sposta verso
l’esterno della cellula. In questa fase 2 di plateau c’è un equilibrio tra le cariche positive di calcio
che entrano e quelle positive di potassio che escono. Anche i canali del calcio sono canali dotati di
due cancelli, di apertura e di inattivazione, ciò significa che successivamente all’apertura c’è anche
l’inattivazione del canale del calcio. Nel momento di chiusura del canale del calcio prevarrà la
corrente di uscita del potassio responsabile della ripolarizzazione della cellula. Oltre alla corrente di
potassio rettificante ritardata subentra successivamente una ulteriore corrente di potassio detta
rettificante in ingresso. Il concetto di rettificazione è legato alla voltaggio-dipendenza di un canale,il
fatto che sia in ingresso o in uscita non dipende dal senso con cui si sposta lo ione, ma dal voltaggio
che apre il canale. Si parla di rettificazione in uscita quando ciò che scatena l’apertura del canale è
una depolarizzazione, cioè un interno meno negativo.
7
Fisiologia, lezione del 20 ottobre 2005
AUTOMATICITA’
I canali del potassio abbiamo detto sono i canali responsabili della ripolarizzazione della cellula
miocardica e a seconda della entità della corrente di potassio varia la velocità con cui avviene la
ripolarizzazione; in particolare abbiamo detto che ci sono delle cellula come quelle del Purkinje che
hanno la fase 1 di rapida ripolarizzazione iniziale dovuta alla corrente transiente in uscita del
potassio. La fase 2 è legata alla corrente di calcio in ingresso attivata ad un valore soglia intorno ai
-50mV che ha una velocità di attivazione relativamente lenta soprattutto se confrontata alla velocità
di attivazione della corrente di sodio. Nella fase 2 quindi c’è una corrente di calcio, cioè di cariche
positive che entrano e sono grosso modo bilanciate dalle cariche positive del potassio che escono, la
fase di plateau dipende dall’equilibrio tra queste due correnti positive in senso opposto. La fine
della fase 2 e il passaggio alla fase 3 è determinato dal fatto che progressivamente la corrente di
calcio si inattiva e quindi progressivamente l’ingresso di calcio si riduce per cui viene a prevalere
comunque la corrente di potassio rettificante ritardata la quale si attiva per valori di potenziale
positivi (intorno allo 0). Quando si passa alla fase 3 e quindi la cellula si sta ripolarizzando e man
mano acquista negatività allora si attiva l’ultima corrente di potassio che è la corrente rettificante in
ingresso che è la responsabile del completamento della ripolarizzazione, questa corrente rettificante
in ingresso è attivata da valori che sono positivi. Quindi la ripolarizzazione della fase 3 è legata a tre
correnti di potassio: la transiente in uscita, la rettificante ritardata e la rettificante in ingresso.
Abbiamo un’ultima corrente che invece si attiva per valori di potenziale negativi ed è quella
responsabile del completamento della ripolarizzazione e del mantenimento del potenziale di riposo
della cellula miocardica, è responsabile quindi della fase 4. Questa corrente di potassio
progressivamente si va riducendo, non perché si inattivano i canali che risultano aperti quando la
cellula è polarizzata, ma perché il potassio entrando e riportando il valore del potenziale di
membrana al valore di riposo si avvicina al suo potenziale di equilibrio, quindi la corrente di
potassio si va esaurendo perché viene a mancare la forza che sposta il potassio.
Le cellule ventricolari del miocardio comune, cioè il miocardio di lavoro, presentano una fase 1
poco pronunciata mentre hanno una fase 2 di plateau molto marcata, il che corrisponde ad una
corrente di calcio in ingresso molto intensa, questo funzionalmente è importante, perché è l’ingresso
di calcio che determina l’inizio del meccanismo della contrazione,cioè è responsabile
dell’accoppiamento eccitazione-contrazione. Nelle cellule del sistema di conduzione l’ingresso di
calcio è inferiore. Al diminuire della corrente di calcio diminuisce la forza di contrazione sviluppata
dalla cellula. I canali del calcio non sono solo voltaggio-dipendenti, ma hanno la possibilità di
essere modulati da vari fattori e questo li differenzia per quanto riguarda il loro comportamento dai
canali del sodio che sono voltaggio-dipendenti ma non sono modulabili quindi potranno essere
chiusi per la somministrazione di sostanze come la tetrodotossina che chiude i canali del sodio e
quindi impedisce la corrente di sodio,ma in condizioni fisiologiche non c’è un qualche meccanismo
che possa modificare la permeabilità di questi canali al sodio. Viceversa per quanto riguarda i canali
del calcio che presentano come i canali del sodio un doppio cancello, uno di apertura e uno di
inattivazione, essi possono essere modulati e sono modulati caratteristicamente per esempio dal
sistema nervoso autonomo ovvero dal mediatore chimico del sistema nervoso autonomo
ortosimpatico: la noradrenalina legandosi ad effettori β-adrenergici attiva l’adenilato ciclasi nelle
cellule determinando l’aumento della concentrazione dell’AMPciclico (cAMP) il cui aumento di
concentrazione fa si che aumenti il numero di canali aperti e la probabilità che questi canali risultino
aperti, quindi in ultima analisi la liberazione di noradrenalina potrà determinare un maggior flusso
di ioni calcio verso l’interno. La modulazione avviene anche grazie a un sito di fosforilazione per
cui nel momento in cui avviene la fosforilazione del canale questo risulta aperto per un tempo più
lungo, ci sarà un numero maggiore di canali aperti e quindi come conseguenza una corrente in
ingresso di calcio maggiore a cui seguirà nella cellula una forza di concentrazione maggiore. Il
8
sistema nervoso parasimpatico agisce in senso opposto riducendo la corrente in ingresso del calcio.
L’altro canale che è responsabile della ripolarizzazione, il canale del potassio anch’esso può essere
modulato. In particolare ci sono dei canali del potassio che non sono voltaggio-dipendenti, quindi
attivati dalla variazione del potenziale, ma sono canali del potassio ligando-dipendenti e quindi che
operano in risposta all’interazione tra un mediatore chimico e il recettore specifico in particolare per
esempio l’ACh (acetilcolina), mediatore chimico del sistema nervoso parasimpatico, si lega ai
recettori muscarinici determinando l’apertura dei canali tramite una G-proteina di tipo inibitorio,
apertura del canale e come risultato iperpolarizzazione della cellula, quindi l’apertura del canale
corrisponde a un aumento della corrente in uscita del potassio e il raggiungimento di un potenziale
di membrana più negativo. Nella fase 4 del potenziale di azione abbiamo il cosiddetto periodo di
recupero della cellula, ritorno alla attività e ritorno alla situazione di partenza, in particolare, nello
stesso modo in cui succede nella fibra nervosa, in questo periodo c’è il ripristino delle
concentrazioni di sodio e di potassio a cavallo della membrana tramite l’attività della pompa
sodio-potassio ATPasi, per cui la pompa in questa fase di riposo della cellula pompa verso l’esterno
gli ioni sodio e verso l’interno gli ioni potassio in modo che si ritorni alle concentrazioni ioniche di
partenza. Sempre nella fase 4 avviene anche un altro scambio e il ripristino della concentrazione di
un altro ione che è lo ione cacio; lo ione calcio, che è entrato durante la fase di plateau deve essere
portato nuovamente fuori per abbassarne la concentrazione citosolica e questo può avvenire sia
tramite uno scambio, a livello della membrana luminale, sodio-calcio per cui il sodio entra e il
calcio poi esce, sia attraverso una pompa ATPasi calcio-attivata, presente sia a livello del reticolo
sarcoplasmatico sia a livello della membrana luminale quindi il calcio che si è liberato nel
citoplasma in parte viene reimmagazzinato nel reticolo sarcoplasmatico e in minor misura viene
pompato fuori dalla cellula. In alcune cellule e in condizioni particolari è stata descritta anche una
corrente di cloro in ingresso che sembra possa contribuire alla fase 1 del potenziale d’azione, quindi
l’attivazione di questa corrente al cloro potrebbe essere in parte responsabile di una fase 1
particolarmente pronunciata in alcune cellule, sembra che venga anche attivata dal cAMP.
Questo avviene nella risposta rapida. Ci sono cellule del miocardio che presentano una risposta con
caratteristiche differenti, di tipo lento. Le risposte di tipo lento si possono avere sperimentalmente
bloccando con la tetrodotossina i canali del sodio, annullando la corrente in ingresso di sodio,
quindi la risposta lenta non implica movimento di ioni sodio. La risposta lenta ha una fase 0 lenta
rispetto alla fase 0 della risposta rapida e presenta anche una soglia che è più alta, la soglia di questa
risposta lenta è ad un valore potenziale che si aggira intorno ai -50mV, soglia dei canali del calcio, a
-50mV il canale del sodio è già inattivo. Nella risposta lenta non c’è la fase 1 di ripolarizzazione
rapida, si passa direttamente ala fase 2 di plateau che risulta poco marcato. La fase 2 è legata al fatto
che la corrente di calcio si sta progressivamente esaurendo e si attivano i canali del potassio,
conseguentemente inizia la ripolarizzazione, in questa fase 2 il potenziale di membrana tende
abbastanza rapidamente al valore di riposo. Il potenziale di riposo di una cellula a risposta lenta ha
un valore meno negativo del potenziale di riposo di una cellula a risposta rapida: rimane a un valore
intorno a -60mV. Questo è dovuto al fatto che la corrente in uscita del potassio è meno evidente e
l’uscita del potassio non riesce a riportare la cellula al valore del potenziale delle altre cellule,
quindi si arresta prima la corrente depolarizzante in uscita del potassio, in questo tipo di cellula il
potassio rimane ben distante dal suo valore di potenziale di riposo che è sempre intorno a -90mV.
Questo tipo di risposta lenta è presente in particolare nelle cellule che costituiscono il tessuto di
avviamento del cuore ovvero le cellule del nodo seno-atriale, le cellule del nodo atrio-ventricolare e
le cellule del fascio di His. Le cellule del tessuto di avviamento hanno la caratteristica di poter
andare incontro in maniera spontanea alla depolarizzazione, questo è legato al fatto che queste
cellule non mantengono il potenziale di riposo a un valore costante, ma in queste cellule si osserva
un progressivo decadimento della corrente in uscita del potassio che è responsabile della fase 4 del
potenziale di azione. La corrente in uscita del potassio, responsabile della ripolarizzazione della
membrana, quindi della fase 4 del potenziale di azione, decade progressivamente (corrente di fondo
del potassio). Come risultato si ha che il potenziale di questa cellula tende lentamente a spostarsi
9
verso il valore soglia a livello del quale si aprono i canali del calcio con insorgenza del potenziale di
azione che avrà le caratteristiche specifiche di una risposta di tipo lento. In realtà la automaticità di
questi gruppi cellulari è legata non solamente al decadimento di questa corrente, ma è legata anche
al fatto che ci sono altre due correnti. Le correnti che sono responsabili della insorgenza spontanea
del ritmo quindi del potenziale di azione a livello del cuore sono tre. Abbiamo due correnti in
entrata, If che è una corrente di sodio (‘f’ sta per funny, è una corrente definita bizzarra), ICa++, e una
corrente in uscita, Ik+. Il fatto che venga raggiunto il potenziale soglia dipende dall’equilibrio tra le
correnti in ingresso di sodio e calcio e la corrente in uscita dello ione potassio. La corrente in uscita
dello ione potassio spontaneamente tende a diminuire e questo farà avvicinare il potenziale della
cellula ad un valore meno negativo, inoltre la corrente di sodio (funny) viene attivata da valori di
potenziale negativi e è tanto più intensa quanto più negativo è il potenziale della membrana, inoltre
questa corrente del sodio, al contrario delle altre correnti del sodio che determinano la fase 0, può
essere modulata da mediatori chimici. Oltre a questa corrente del sodio in ingresso abbiamo la
corrente in ingresso del calcio attivata a valori di potenziale intorno a -50mV; in realtà in queste
cellule ci son due canali del calcio: i canali cosiddetti transient che si aprono per potenziali più
negativi (-55mV) e hanno un tempo di aprtura breve e poi i canali di tipo L (long lasting) che negli
altri tipi di cellule sono responsabili del plateau e si aprono a -50mV. Quindi queste tre correnti
sono i responsabili del raggiungimento del valore soglia e quindi dell’insorgenza del potenziale di
azione. Nelle cellule nodali il potenziale di azione non presenta una fase 4 ma c’è un progressivo
decadimento della polarità della membrana, naturalmente in base alla pendenza di questa fase si
avrà una maggiore o minore probabilità di raggiungere il valore soglia e quindi l’insorgenza del
potenziale di azione. La fase in cui il potenziale di azione tende a decrescere lentamente viene detta
fase di pre-potenziale ed è la fase caratteristica di queste cellule del tessuto di avviamento. Nel
tessuto di avviamento ci sono vari gruppi di cellule (nodo seno-atriale, nodo atrio-ventricolare,
fascio di His) e quello con ritmo più frequente è responsabile della attivazione del cuore, quindi è
responsabile della frequenza con cui il cuore si eccita e successivamente si contrae. Questo gruppo
di cellule è fisiologicamente rappresentato dalle cellule del nodo seno-atriale indicato come
pace-maker del cuore. La frequenza con cui avviene questo eccitamento può modificare. Le cellule
del nodo seno-atriale isolate scaricano con una frequenza intrinseca di 100 battiti/rimuto. Per
modificare la frequenza in teoria si può modificare la pendenza della fase di prepotenziale, si può
spostare verso valori meno negativi il potenziale soglia, infine può avvenire che il potenziale di
partenza della cellula sia più negativo. Le modificazioni viste hanno come risultato quello di
diminuire la frequenza; modificazioni in senso opposto determineranno un aumento della frequenza
di scarica. Se stimoliamo il sistema nervoso parasimpatico e quindi determiniamo una liberazione di
acetilcolina, l’acetilcolina va a legarsi a recettori muscarinici e in particolare si lega a canali del
potassio determinandone l’apertura, questi sono canali diversi da quelli che determinano un
progressivo decadimento della corrente e la loro apertura determina una maggiore uscita del
potassio quindi un rallentamento della fase di prepotenziale e una riduzione della frequenza di
scarica. Contemporaneamente però il parasimpatico riduce anche le due correnti in ingresso quindi
depolarizzanti di sodio (If) e di calcio perché, come abbiamo detto, la corrente del sodio è attivata
da potenziali più negativi. Viceversa se stimoliamo l’ortosimpatico determinando il rilascio di
noradrenalina che si lega a recettori β-adrenergici si viene ad aumentare la corrente in ingresso dello
ione calcio oltre a stimolare la corrente funny del sodio. La noradrenalina ha un effetto cronotropo
positivo perché aumenta il numero di batti al minuto. Essendo la frequenza spontanea del tessuto
nodale di 100b/min., normalmente il cuore è soggetto all’azione del parasimpatico infatti la
frequenza normale risulta in feriore a 100b/min. (in genere è di 70-80b/min.).
L’eccitabilità delle cellule miocardiche modifica durante il potenziale d’azione, in particolare
l’eccitabilità è pari a 0, quindi la cellula è completamente ineccitabile quando il potenziale della
cellula si trova nelle fasi 0, 1, 2, e parte della 3, cioè durante la fase di depolarizzazione che durante
gran parte della fase di ripolarizzazione, finché il potenziale di membrana è tornato a valori negativi
intorno a -50mV. In questo caso noi parliamo di un periodo di refrattarietà assoluta, cioè la cellula è
10
assolutamente ineccitabile perché i cancelli di inattivazione del sodio sono chiusi e si riapriranno
quando il potenziale di membrana sarà tornato a valori negativi (intorno a -50mV). Quando si
raggiunge il potenziale di membrana di -50mV l’eccitabilità non ritorna completamente ma aumenta
progressivamente nella cellula man mano che il potenziale di membrana assume valori più negativi.
In questa fase compresa tra il potenziale di -50mV e quello di -80mV siamo nel periodo di
refrattarietà relativa, il che significa che uno stimolo più intenso può determinare una risposta della
cellula, risposta che però ha caratteristiche diverse rispetto alla risposta della cellula normalmente
eccitabile, perché sono pochi i canali del sodio che sono attivi e quindi che si possono aprire e
determinare un flusso in ingresso di ioni sodio. Le risposte modificano man mano che si ha un
potenziale di membrana progressivamente più negativo. La prima risposta all’inizio di refrattarietà
relativa ha le caratteristiche di una risposta di tipo lento, la fase 0 di depolarizzazione procede
lentamente, non si raggiunge neanche il valore di potenziale 0, quindi è una risposta di entità ridotta
che presumibilmente non riesce neppure a spostarsi lungo la fibra miocardica. Man mano che si
riacquista la polarità della cellula le risposte diventano progressivamente più simili alla risposta
normale. E’ possibile che occasionalmente ci siano degli eccitamenti prematuri nel cuore, le
conseguenze per il soggetto variano a seconda del periodo di refrattarietà in cui questo eccitamento
prematuro insorge; le conseguenze saranno tanto meno gravi quanto più tardiva è l’insorgenza di
questa attivazione precoce. Nel caso di cellule che presentino una risposta lenta, anche qui modifica
la eccitabilità e, la modificazione dell’eccitabilità ha caratteristiche diverse rispetto alle
modificazioni dell’eccitabilità delle cellule a risposta rapida, perché in questo tipo di cellule
addirittura c’è un periodo di refrattarietà che comprende una fase della ripolarizzazione, quindi c’è
quella fase di refrattarietà post-ripolarizzazione. Anche qui le differenze cambiano a seconda della
fase in cui insorge questo eccitamento precoce.
Il fatto che ci sia questo periodo di refrattarietà assoluto in cui la cellula è assolutamente ineccitabile
è estremamente importante dal punto di vista meccanico. Normalmente c’è un certo intervallo tra
l’eccitamento (potenziale d’azione) e l’insorgenza della contrazione (scossa muscolare). Bisogna
sottolineare che il picco della contrazione, quindi la massima forza di contrazione della cellula si
ottiene quando la cellula è ancora in un periodo di refrattarietà assoluta. Questo è importante perché
ovviamente se noi eccitiamo nuovamente la cellula è necessario perché la cellula risponda
all’eccitamento che si sia arrivati almeno nel periodo di refrattarietà relativa. Il periodo di
refrattarietà relativa comincia quando ormai la forza di contrazione si sta riducendo, quindi la
cellula si sta rilasciando; di conseguenza, anche se noi stimoliamo con frequenze molto elevate
quindi con potenziali di azione molto ravvicinati che daranno luogo a contrazioni di natura
meccanica molto ravvicinate, non potremo mai avere quello che viene definito tetano muscolare,
modalità muscolare caratteristica della fibra muscolare scheletrica in cui c’è la fusione delle
contrazioni al massimo della forza di contrazione. Nel cuore, proprio per la sua funzione di pompa,
questo tipo di contrazione (tetano) è invece assolutamente deleterio perché il cuore quando si
contrae deve spingere il sangue e per fare ciò necessita che ci sia sangue nel ventricolo che si deve
essere rilasciato, riempito di sangue per poter spingere di nuovo il sangue in circolo.
I potenziali di azione che insorgono spontaneamente nel nodo seno-atriale tendono a propagarsi, la
conduzione avviene in modo analogo a quello della conduzione nella fibra nervosa cioè tramite la
formazione di correnti elettrotoniche che fanno si che si sposti il potenziale d’azione dalla cellula
attivata alla cellula ancora a riposo. La velocità di conduzione dipende dalla intensità di queste
correnti: tanto più sono intense, tanto maggiore sarà la zona di tessuto ancora a riposo che viene
portato a soglia. In generale possiamo dire che la velocità di conduzione dipende prima di tutto
dalle caratteristiche fisiche della membrana e in particolare dal rapporto tra le resistenze trasversali
(resistenza di membrana) e le resistenze longitudinali al passaggio delle correnti, caratteristiche
legate alle dimensioni delle fibre: quanto più le fibre sono grosse, tanto minore è la resistenza e
quindi maggiore la velocità. Poi la velocità di conduzione dipende anche dalla presenza di canali del
sodio che siano allo stato attivo e dallo stato di refrattarietà della fibra. La velocità di propagazione
dipende anche dalla differenza di potenziale tra la zona a riposo e la zona attivata.
11
Fisiologia, lezione del 21 ottobre 2005
PROPAGAZIONE DEL POTENZIALE D’AZIONE
La propagazione del potenziale del potenziale d’azione avviene nel cuore seguendo delle vie che
sono dette vie del sistema di conduzione che stabilisce un determinato ordine nella propagazione del
segnale nel tessuto miocardico, è anche possibile che vi siano delle anomalie sia nella attivazione
che nella propagazione e in questo caso potremo osservare dei ritmi cardiaci anomali (aritmie) e
delle modalità di attivazione anch’esse di tipo anomalo. Il sistema di conduzione ha inizio dal nodo
seno-atriale che si trova nella parete posteriore dell’atrio di destra nel punto di congiunzione tra la
vena cava superiore e l’atrio (dal nodo seno-atriale vero pace maker del cuore il potenziale d’azione
si muove all’interno della muscolatura atriale). Il nodo seno atriale è costituito da due tipi di cellule:
abbiamo delle cellule piccole, rotondeggianti che si trovano nella zona centrale del nodo e che sono
le cellule responsabili della automaticità e della ritmicità; ci sono poi altre cellule sempre all’interno
del nodo seno-atriale che sono cellule pallide, di forma allungata, sottili e sono predisposte a
trasferire il potenziale d’azione che è insorto nelle cellule rotondeggianti verso l’esterno del nodo
seno-atriale. La velocità di conduzione nel nodo seno-atriale è estremamente bassa (0,02-0,1m/s),
questa bassa velocità di conduzione è in accordo con il fatto che il potenziale è quello tipico della
risposta lenta a cui appunto corrisponde una bassa velocità di conduzione. Quando poi il potenziale
ha raggiunto la periferia del nodo comincia ad attivare la muscolatura degli atri e la velocità di
conduzione aumenta fino a 1m/s, quindi una velocità circa 10 volte superiore rispetto a quella
presso il nodo seno-atriale. Nella sua propagazione questo potenziale d’azione arriva prima ad
un’altra struttura particolare che è il nodo atrio-ventricolare, quindi abbiamo l’interessamento di
tutta la muscolatura degli atri e il potenziale d’azione che seguendo le vie muscolari raggiunge il
nodo atrio-ventricolare. Questa struttura, facente parte del sistema di conduzione, possiede
caratteristiche di automaticità e ritmicità intrinseche e presenta 3 zone: zona atrio-nodale, zona
nodale e la zona NH di transizione tra il nodo atrio-ventricolare e il fascio di His. Il nodo atrioventricolare ha una forma abbastanza allungata ed è posizionato sulla faccia destra del setto
interatriale più o meno in corrispondenza dello sbocco del seno coronario; è in una posizione di
“sentinella” tra gli atri e i ventricoli ed è l’unica zona che dal punto di vista funzionale consente il
passaggio del potenziale d’azione dall’atrio al ventricolo (strutture separate dall’anello fibroso).
Quando il potenziale d’azione raggiunge il nodo atrio-ventricolare subisce una brusca decelerazione
(da 1m/s a 0,02-0,05m/s); questa bassa velocità di conduzione è importante perché crea una sorta di
intervallo di tempo tra l’attivazione dell’atrio e il momento in cui il potenziale d’azione riesce a
passare ai ventricoli. Dal punto di vista meccanico ci sarà sempre la contrazione degli atri che
precederà la contrazione dei ventricoli. Il nodo atrio-ventricolare può variare la propria velocità di
conduzione e in particolare stimolazioni del sistema nervoso autonomo ortosimpatico e
parasimpatico possono modificare la velocità di conduzione: in particolare l’ortosimpatico aumenta
la velocità di conduzione (effetto dromotropo positivo), mentre il parasimpatico riduce la velocità di
conduzione (effetto dromotropo negativo). Le fibre della regione NH si continuano con un’altra
parte del tessuto di conduzione che è il cosiddetto fascio di His. Questo fascio di His ha una
lunghezza di circa 1cm, percorre il setto interventricolare e dà origine a 2 branche di cui la destra è
la prosecuzione del fascio stesso e decorre sulla faccia destra del setto interventricolare, mentre la
branca di sinistra parte come un ramo disposto in senso perpendicolare rispetto al tronco comune
del fascio di His, attraversa lo spessore del fascio interventricolare e si sposta sul lato sinistro del
setto, quando arriva alla superficie subendocardica si suddivide in ulteriori 2 branche: una più
sottile decorre anteriormente al ventricolo e una più spessa decorre posteriormente (sottobranche
anteriore e posteriore). La propagazione attraverso le fibre del fascio di His e le branche destra e
sinistra è molto veloce, dalle branche destra e sinistra si originano poi le fibre cosiddette del
Purkinje che sono fibre particolarmente grosse (hanno un diametro intorno a 70-80μ, mentre le fibre
muscolari cardiache più grosse hanno un diametro di 10-20μ) e presentano una velocità di
12
conduzione elevatissima (1-4m/s), la velocità di conduzione massima all’interno del cuore. Quindi
queste fibre portano sulla superficie endocardica il potenziale d’azione all’interno dei ventricoli e
poi dalle fibre del Purkinje che ancora fanno parte del sistema di conduzione i potenziali d’azione si
spostano ad attivare le cellule del moiocardio comune che hanno una velocità di conduzione
relativamente bassa (0,3-0,5m/s). Nell’attivazione del ventricolo c’è lo spostamento del potenziale
all’interno dello spessore della parete del ventricolo dalla superficie interna (endocardica) verso la
superficie esterna (epicardica). Durante l’attivazione dei ventricoli, a causa del differente spessore
della parete ventricolare del ventricolo destro (più sottile) rispetto a quello sinistro (più spesso)
succede che la superficie epicardica del ventricolo di destra viene attivata prima rispetto alla
superficie epicardica del ventricolo di sinistra, si tratta comunque di tempi estremamente piccoli,
non rilevanti dal punto di vista meccanico. Quando i potenziali sono giunti all’apice del cuore e
sulla superficie epicardica l’attivazione si porta posteriormente in una regione del miocardio che è
l’ultima ad essere attivata e corrisponde alla base dei ventricoli. Tenete conto che, se per caso c’è
un’anomalia nel processo di attivazione, cioè momentaneamente una certa parte del tessuto
miocardico non può essere attivata dal potenziale d’azione che segue la sua via normale, comunque
viene sempre alla fine raggiunto dal potenziale d’azione che segue un’altra direzione. Dopo
l’attivazione della muscolatura cardiaca si ha un periodo in cui essa risulta completamente
depolarizzata, cioè con polarità opposta rispetto a quella del cuore a riposo, siamo nella fase di
plateau del potenziale d’azione. Se noi durante questo eccitamento mettiamo degli elettrodi sulla
superficie corporea possiamo registrare una attività elettrica, attività elettrica che naturalmente
rappresenta la somma delle attività elettriche che insorgono nella iriade di cellule che costituiscono
la muscolatura cardiaca. L’attività elettrica che noi possiamo registrare con degli elettrodi
superficiali dipenderà dal fatto che durante l’eccitamento avremo delle zone di miocardio eccitate
quindi che sono depolarizzante e delle superfici di miocardio che invece sono ancora a riposo, noi
registriamo la differenza tra queste cariche di superficie, facciamo una registrazione di tipo
extracellulare. Noi possiamo effettuare queste registrazioni perché i fenomeni elettrici interessano
un compartimento liquido che è il liquido extracellulare che è in contatto con la superficie corporea
sulla quale noi possiamo porre gli elettrodi. Questa registrazione è il cosiddetto
elettrocardiogramma caratterizzato da un insieme di onde, quindi variazioni di potenziale, e tratti
isoelettrici, cioè momenti in cui non registriamo nessun tipo di attività elettrica. L’ampiezza di
queste onde è molto piccola perché è una registrazione extracellulare oltretutto a distanza rispetto al
tessuto che determina questa attività elettrica. Sul tracciato si osserva per prima cosa l’onda P che
corrisponde alla attivazione degli atri (è importante ricordare che l’elettrocardiogramma registra
eventi elettrici perciò l’onda P non corrisponde alla sistole che è un evento meccanico, ma alla
depolarizzazione che la genera). L’onda P è di piccola ampiezza e ciò è dovuto al fatto che
l’ampiezza delle onde registrate dipende strettamente dalla massa di tessuto interessato dall’evento
elettrico (la muscolatura degli atri è sottile). Dopo l’onda P abbiamo un tratto isoelettrico, questo
tratto isoelettrico che viene detto intervallo PQ è il periodo in cui l’eccitamento interessa il nodo
atrio-ventricolare ed essendo questa struttura quantitativamente piccola non darà origine ad una
variazione di potenziale significativa che possa essere registrata da elettrodi superficiali. Questo
intervallo PQ è detto tempo di conduzione atrio-ventricolare e indica il tempo impiegato dal
potenziale d’azione per passare dagli atri ai ventricoli; in alcune condizioni patologiche per esempio
questo tempo di conduzione atrio-ventricolare può essere enormemente allungato e in questo caso si
parla di blocco di conduzione atrio-ventricolare (blocco di conduzione di I°grado). Dopo il tratto
isoelettrico abbiamo un complesso di onde, quello che viene definito complesso QRS che
corrisponde alla attivazione della muscolatura ventricolare. Durante l’attivazione della muscolatura
ventricolare queste tre onde dipendono dalla direzione globale dell’onda di eccitamento all’interno
della muscolatura dei ventricoli: l’onda Q si registra durante la attivazione del setto
interventricolare, l’onda R corrisponde all’attivazione del grosso della muscolatura ventricolare,
infine l’onda S indica l’attivazione della porzione posteriore. In seguito al complesso QRS si ha un
tratto isoelettrico corrispondente alla fase di refrattarietà, di plateau del potenziale d’azione. In
13
seguito ha inizio la ripolarizzazione, fase in cui le cellule riacquistano il loro potenziale, evento
elettrico opposto rispetto a quello precedente. Nonostante ciò noi abbiamo ancora un’onda che è
l’onda T che è verso l’alto, questo è legato al fatto che l’onda di ripolarizzazione percorre la strada
in senso opposto in particolare nel senso che le cellule epicardiche della superficie del ventricolo
hanno una durata in generale del potenziale d’azione inferiore rispetto alle cellule endocardiche e
quindi cominciano a ripolarizzarsi prima. Dopo la ripolarizzazione l’elettrocardiogramma presenta
di nuovo una linea isoelettrica. Nel tracciato elettrocardiografico il fatto che l’onda vada verso l’alto
o verso il basso dipende esclusivamente da come sono messi gli elettrodi sulla superficie del corpo;
diciamo che se l’elettrodo che registra ha vicino a sé delle cariche positive segna un’onda verso
l’alto, mentre quando ha vicino a sé delle cariche negative registra un’onda verso il basso. Il
tracciato cambia a seconda della posizione dell’elettrodo registrante. (vedi derivazioni ECG).
Noi parliamo di asse cardiaco elettrico medio per indicare qual è complessivamente la direzione che
viene percorsa dal potenziale d’azione durante un determinato evento elettrico del cuore. L’asse
cardiaco elettrico medio in generale viene descritto per quanto riguarda l’attivazione dei ventricoli
che hanno la massa muscolare preponderante che influenza maggiormente la propagazione
dell’attività elettrica. Questo asse cardiaco medio ha una direzione che in generale va da destra a
sinistra, può essere rappresentato come un vettore la cui direzione ci dice grosso modo qual è la
posizione del cuore all’interno del torace. Ci sono delle condizioni in cui l’asse cardiaco può essere
deviato ad esempio per una ipertrofia, quindi un ispessimento, di una determinata zona del cuore.
abbiamo detto che l’ampiezza dell’onda dipende dalla quantità di tessuto quindi una zona di
miocardio che sia ipertrofica tenderà a far spostare la propagazione dell’onda verso di sé, viceversa
una zona di tessuto infartuato non viene attivata, è una zona attraverso la quale il potenziale
d’azione non passa, quindi anche in questo caso avremo una deviazione dell’asse dalla sua
posizione normale. L’asse cardiaco medio viene espresso in gradi, viene riferito a un sistema di
coordinate polari l’asse 0°-±180° è la linea orizzontale che passa per il centro del cuore, gli angoli
piatti che si vengono a formare sopra e sotto questa linea sono a loro volta divisi in angoli di 30°
con valori progressivamente negativi procedendo in senso antiorario e positivi in senso orario.
Fisiologicamente l’asse cardiaco medio è compreso nell’ambito che va da -30° a +110°. Se il valore
dell’asse supera questi valori si parla di deviazione dell’asse cardiaco.
14
Fisiologia, lezione del 27 ottobre 2005
ARITMIE
L’elettrocardiogramma ha un grosso significato per il medico in quanto innanzitutto è una
registrazione extracellulare quindi di tipo non cruento, non invasivo, non comporta nessun tipo di
disagio per il paziente; inoltre permette al medico di valutare la modalità di eccitamento del cuore,
perciò se c’è un ritmo normale, quindi un intervallo tra due onde R regolare oppure se si è in
presenza di un ritmo che non è regolare. Per quanto riguarda le aritmie ricordiamo che esiste una
aritmia sinusale fisiologica, quindi una modificazione della durata del ciclo fisiologica in base alla
frequenza respiratoria, al ritmo respiratorio: l’alternanza di inspirazione ed espirazione può
modificare in qualche modo il ritmo. Possiamo avere altre anomalie del tracciato
elettrocardiografico: possiamo vedere anomalie nella propagazione del potenziale, abbiamo parlato
di blocchi (di I°,II°,III° grado), possiamo anche mettere in evidenza nel tracciato l’esistenza di
blocchi nella conduzione a livello della branca di destra oppure dell’emibranca anteriore o
posteriore che provengono dalla branca di sinistra del fascio di His (in quest’ultimo caso si parlerà
di emiblocco anteriore o posteriore). In alcune condizioni l’insorgenza di una aritmia origina in
quanto si crea una condizione che prende il nome di rientro. Il rientro è una condizione anomala in
cui l’onda di eccitamento non si esaurisce ma ripercorre in maniera continuativa una determinata
zona del tessuto cardiaco. (vedi Berne-Levy a pag.322).
Questa possibilità di rientro naturalmente può dare origine a ritmi assolutamente imprevedibili a
livello del cuore durante l’attivazione del cuore. Per es. si può avere quella che viene definita
tachicardia parossistica quindi una frequenza di attivazione particolarmente elevata che insorge in
maniera del tutto imprevedibile. Queste tachicardie parossistiche possono interessare sia la zona
atriale del cuore (sopraventricolari) oppure i ventricoli (ventricolari); il significato delle due è
completamente differente, nel senso che la tachicardia parossistica atriale ha conseguenze cliniche
molto minori rispetto a quella ventricolare in quanto nella tachicardia parossistica atriale comunque
il cuore, in particolare i ventricoli, riescono ad andare incontro ad una certa ciclicità nella loro
attivazione e quindi continuano a funzionare da pompe in maniera abbastanza efficace; mentre nella
tachicardia parossistica ventricolare naturalmente l’attivazione dei ventricoli è assolutamente
imprevedibile, l’attività di pompa è fortemente compromessa e in genere questa condizione poi
trapassa in quella che viene detta fibrillazione ventricolare. La fibrillazione è una modalità di
attivazione assolutamente irregolare caratterizzata da una modificazione del potenziale di riposo
delle cellule a frequenza elevatissima che, nel caso interessi l’atrio anche qui non compromette la
salute del paziente, nel senso che la fibrillazione atriale potrà dare una sensazione fastidiosa al
soggetto ma il cuore comunque batte. Mentre la fibrillazione ventricolare è una situazione
estremamente grave del paziente, è caratterizzata da una attività elettrica assolutamente irregolare
che non può essere seguita da un’attività contrattile meccanica efficace, quindi il cuore si contrarrà
e si distenderà in maniera estremamente variabile e la fase di contrazione di pompa non sarà
adeguata. La fibrillazione ventricolare porta alla perdita di coscienza e alla morte del soggetto.
Se noi andiamo a registrare i potenziali d’azione nelle cellule che costituiscono il miocardio
vediamo che questi potenziali d’azione hanno una forma che è diversa a seconda della zona del
cuore che noi prendiamo in considerazione e, se riferiti ad un tracciato elettrocardiografico, anche
da un punto di vista temporale questi potenziali d’azione insorgono in tempi via via successivi
proprio perché esprimono l’attivazione delle varie parti del cuore.
Una volta che il miocardio si è eccitato,e si eccita automaticamente, l’eccitamento si propaga
seguendo le vie di conduzione e sfruttando il fatto che, come abbiamo già visto, queste cellule
miocardiche nella loro zona terminale sono ramificate e presentano quelle profonde invaginazioni
della membrana (i dischi intercalari) che aumentano notevolmente la superficie di contatto tra
cellula e cellula facendo sì che l’evento elettrico si sposti rapidamente da una cellula muscolare a
un’altra in modo che il miocardio, anche se è formato da fibre che sono distinte l’una dall’altra, dal
15
punto di vista funzionale è un sincizio. A livello dei dischi intercalari ci sono delle particolari
strutture (le gap junction) che sono responsabili della comunicazione libera tra una cellula e l’altra
tramite connessoni. Nel caso in cui il ph della cellula si abbassi (situazione di acidosi) il connessone
si chiude e interrompe la comunicazione tra cellule; questa è una difesa del tessuto sano rispetto a
un tessuto che è andato incontro a un qualsiasi evento lesivo.
Il potenziale d’azione è responsabile della successiva contrazione delle fibrocellule, quindi
dobbiamo vedere come avviene l’accoppiamento eccitazione-contrazione. Il meccanismo contrattile
è rappresentato dai miofilamenti actina e miosina che costituiscono la struttura del sarcomero,
l’accorciamento delle fibrocellule avviene per scorrimento dei filamenti di actina su quelli di
miosina. Bisogna capire come è possibile che da una condizione di riposo in cui le fibrocellule sono
rilasciate a un certo punto questi miofilamenti interagiscono tra loro determinando l’accorciamento
dei sarcomeri e conseguentemente del miocardio. Questo avviene perché la troponina C si lega al
calcio, libera dei siti attivi della molecola di tropomiosina che interagiscono con i filamenti di
actina. Il calcio si lega alla troponina C quando la sua concentrazione intracellulare cresce, quindi
l’evento scatenante della contrazione sarà l’aumento della concentrazione intracellulare del calcio.
Questo aumento si determina in quanto quando arriva il potenziale d’azione che viaggia lungo la
membrana cellulare, depolarizza la membrana e determina l’apertura dei canali del calcio(canali L);
l’apertura dei canali del calcio consente un passaggio di calcio dal liquido extracellulare al liquido
intracellulare. Quando nel tessuto muscolare scheletrico arriva il potenziale d’azione è questa
variazione di potenziale che determina la liberazione di calcio a livello intracellulare, mentre nel
caso del tessuto miocardico il calcio entra dal liquido extracellulare ma non è sufficiente quello che
entra attraverso i canali L per determinare l’attivazione del meccanismo della contrazione. Tuttavia
questo calcio che entra si lega a dei recettori della membrana del reticolo sarcoplasmatico e
determina il rilascio di calcio da questi depositi intracellulari. Il rilascio di questo calcio presente nel
reticolo sarcoplasmatico fa sì che la sua concentrazione intracellulare aumenti in maniera
estremamente elevata diventando sufficiente per legarsi alla troponina C e quindi attivare il
meccanismo della contrazione. Per la fibrocellula miocardica si parla di rilascio del calcio indotto
dal calcio. La quantità di calcio che viene rilasciata non è in grado in generale di generare la
massima risposta: una volta che c’è l’attivazione della contrazione la risposta contrattile nel
miocardio può essere modulata, questa è una caratteristica completamente differente rispetto alla
muscolatura scheletrica in cui la quantità di calcio che viene liberata è più che sufficiente per
attivare in maniera massimale la contrazione. A livello del tessuto miocardico invece la quantità di
calcio che viene librata non è detto che attivi in maniera massimale il meccanismo contrattile. Il
meccanismo contrattile può modificare la propria forza di contrazione in risposta a varie situazioni
in cui si può trovare. I fattori che fanno aumentare la contrattilità sono detti inotropi positivi mentre
i fattori che riducono la contrattilità sono detti inotropi negativi.
Il miocardio si rilascia quando la concentrazione di calcio intracellulare diminuisce. Per diminuire
la concentrazione di calcio esistono più modalità. Prima di tutto esiste una pompa ATPasica a
livello del reticolo sarcoplasmatico, una pompa che fa parte della famiglia definita SERCA
(Sarcoplasmic Endoplasmic Reticulum Calcium ATPase) attraverso cui il calcio viene pompato
attivamente e accumulato nel reticolo sarcoplasmatico. In parte il calcio fuoriesce dalla cellula
attraverso la membrana cellulare grazie ad uno scambiatore calcio-sodio che porta fuori dalla
cellula il calcio quando la concentrazione del sodio intracellulare è bassa, questo gradiente internoesterno di sodio dipende dalla attività della pompa sodio-potassio ATPasica. Ci sono anche delle
pompe ATPasiche calcio-attivate sulla membrana luminale responsabili dello spostamento verso
l’esterno di una piccola quantità di calcio. Infine vanno ricordate anche delle pompe ATPasiche
calcio-attivate a livello mitocondriale la cui attività è limitata a quando la concentrazione
intracellulare di calcio è particolarmente elevata.
16
Fisiologia, lezione del 28 ottobre 2005
CONTRATTILITA’
Durante il processo di abbassamento della concentrazione di calcio attraverso la pompa ATPasica
calcio-attivata presso il reticolo sarcoplasmatico interviene una proteina con azione inibitoria nei
confronti della pompa stessa, il fosfolambano. La fosforilazione del fosfolambano porta ad una
riduzione della sua attività inibitoria, quindi come risultato finale aumenterà la velocità di
funzionamento della ATPasi. Questo è uno dei meccanismi con cui agisce la noradrenalina,
mediatore chimico del sistema nervoso ortosimpatico che, nel momento in cui si lega ai β-recettori
determina un aumento dell’attività dell’adenilato ciclasi con un aumento del cAMP, aumento che fa
sì che vengano fosforilate varie proteine, per esempio il canale del calcio che è modulabile, con
ingresso di più calcio e aumento della forza di contrazione (effetto isotropo positivo); la
noradrenalina determina la fosforilazione inoltre del fosfolambano velocizzando il processo di
rilasciamento cellulare (effetto lusitropo positivo). La noradrenalina aumenta anche la fre3quenza
cardiaca (effetto cromotropo positivo).
Le cellule miocardiche non sono inserite su strutture ossee come quelle scheletriche, e ne contrarsi
agiscono sulle fibre attigue e sulla rete connettivale che circonda queste fibrocellule muscolari.
Quando le cellule miocardiche si contraggono non si parla di accorciamento del cuore ma di
restringimento della cavità cardiaca. Inoltre quando sviluppa forza la cellula muscolare miocardica
causa un aumento della pressione sul sangue che si trova all’interno della cavità ventricolare.
La muscolatura scheletrica può andare incontro a due modalità di contrazione: isometrica (con
aumento di tensione) o isotonica (con accorciamento del muscolo). Nel muscolo cardiaco si parla di
contrazione isometrica ma no c’è una vera e propria contrazione isotonica: quando il cuore si
contrae modifica la propria tensione (contrazione auxotonica).
In una cellula miocardica raggiunta la lunghezza ottimale lo sviluppo di tensione risulta aumentato,
al di sopra e al di sotto di questa lunghezza lo sviluppo di tensione si riduce.
Il cuore si trova di solito a la volare con lunghezze del sarcomero inferiori alla lunghezza ottimale,
questo fa sì che si possa sviluppare maggiore tensione attiva (forza di contrazione) allungando le
fibre muscolari, perciò se arriva nel ventricolo un maggior volume di sangue questo volume
distende le pareti ventricolari e il cuore riesce a sviluppare la forza necessaria ad espellere
nell’albero circolatorio quel volume di sangue in più. Caratteristica del miocardio sta nel fatto che la
curva di tensione isometrica massima (vedi appunti) è modulabile.
La capacità di sviluppare tensione viene definita come contrattilità , lo sviluppo della contrattilità
dipende dallo stato attivo del miocardio e con stato attivo o attivazione noi intendiamo il numero di
ponti che si possono formare tra actina e miosina. I fattori che possono modificare la contrattilità
sono rappresentati dalla concentrazione intracellulare di calcio, la affinità di legame tra il calcio e la
troponina C (questi due fattori modificano lo stato attivo in maniera fasica, possono intervenire ad
ogni singolo battito). Un fattore di tipo tonico richiede più tempo per agire e richiede delle
modificazioni della attività ATPasica nell’interazione actina-miosina, modificazioni di questo tipo
si hanno nel caso di invecchiamento, ipotiroidismo-ipertiroidismo.
La tensione a riposo (passiva) dipende dallo stato di allungamento del sarcomero e non varia
aggiungendo noradrenalina. La curva di tensione isometrica massima invece se si aggiunge
noradrenalina si sposta verso l’alto rispetto alla curva di base e il cuore in queste condizioni ha una
contrattilità maggiore: la noradrenalina agisce con effetto inotropo positivo per qualsiasi lunghezza.
La relazione tensione/lunghezza è una relazione fondamentale nel tessuto miocardico e dipende dal
grado di sovrapposizione dei miofilamenti. Questa relazione tensione/lunghezza per il miocardio è
anche detta legge di Frank-Starling: il miocardio si contrae con forza maggiore all’aumentare della
lunghezza delle sue pareti fino ad un valore massimo ottimale superato il quale si riduce.
La legge di Laplace afferma che la tensione sviluppata durante la contrazione a livello delle pareti è
uguale al prodotto della pressione sul sangue per il raggio (considerando il cuore di forma cilindrica
17
quindi con un raggio che tende all’infinito: τ = P x r). Aumentando il raggio aumenterà anche il
lavoro compiuto dal cuore e una maggiore richiesta di ossigeno da parte del cuore.
Nel miocardio la relazione tensione/lunghezza non dipende esclusivamente dalla sovrapposizione,
cioè da un fattore di tipo geometrico come è nel muscolo scheletrico; sembra anche che la
distensione faccia aumentare la affinità della troponina C per il calcio, ancora una volta il calcio
interviene come modulatore della forza di contrazione. Sembra però che a distanza di 2 minuti dalla
distensione ci sia una ulteriore liberazione di calcio probabilmente legata alla modificazione di
alcuni canali meccano-dipendenti. Quando noi parliamo di modificazioni della forza di contrazione
per effetto di una variazione di lunghezza noi parliamo di una regolazione eterometrica; quando
invece c’è un aumento della contrattilità a parità di lunghezza per effetto delle variazioni della
concentrazione di calcio si parla di regolazione omeometrica.
18
Fisiologia, lezione del 4 novembre 2005
CICLO CARDIACO
Per quanto riguarda la contrattilità essa può essere modificata da fattori detti inotropi,
rispettivamente gli inotropi positivi fanno aumentare la contrattilità e gli inotropi negativi la fanno
diminuire. Tra i fattori inotropi positivi in assoluto il più importante è rappresentato dalle
catecolamine circolanti (adrenalina dalla midollare del surrene e noradrenalina derivante da una
scarica di ortosimpatico); un altro fattore inotropo positivo è rappresentato dalla frequenza di
stimolazione quindi il numero di battiti al minuto (all’aumentare della frequenza aumenta la
contrattilità); infine farmaci come la digitale. Per quanto riguarda i fattori inotropi negativi, in realtà
l’unico fattore fisiologico è la bradicardia cioè la riduzione della frequenza cardiaca; altri fattori
inotropi negativi possono essere situazioni patologiche che coinvolgono il miocardio come ad
esempio necrosi del tessuto, una situazione di ipossia o anossia oppure un aumento della
concentrazione dell’anidride carbonica; infine i farmaci come i barbiturici. Il vago ha un effetto
inotropo di scarso significato nel senso che induce bradicardia ma le sue terminazioni sui ventricoli
sono poco numerose.
Valutazione della contrattilità (vedi pag. 343 Berne Levy). Esiste una proporzionalità inversa che
lega la velocità di accorciamento delle fibre e la forza di contrazione. Idealmente a carico 0 si
raggiunge quella che viene definita velocità massima la quale non è misurabile direttamente; questa
vmax è parametro che esprime la contrattilità quindi lo stato di attivazione del sistema actinamiosina. La vmax dipende dalla attività ATPasica acto-miosinica.
A parità di concentrazioni di calcio la forza sviluppata è maggiore per lunghezze maggiori di
sarcomero. Il fattore lunghezza è legato al fattore contrattilità nel senso che sembra che il fattore
lunghezza consenta lo sviluppo di una maggior forza di contrazione in quanto aumenta la affinità
della troponina per il calcio.
Un altro metodo per valutare la contrattilità è la valutazione dello sviluppo di pressione nel tempo,
quello che viene definito come Δp/Δt cioè la variazione di pressione in funzione del tempo che
indica la velocità di sviluppo della tensione.
Dal punto di vista clinico può essere utilizzato anche come espressione della contrattilità la frazione
di eiezione, cioè il rapporto tra il volume telesistolico e il volume telediastolico, il che ci dice
quanto sangue è stato espulso durante la contrazione dal ventricolo del sangue totale che era
presente nel ventricolo prima della sistole (in genere ha un valore compreso tra 0,55 e 0,65).
Cosa succede nel cuore durante un ciclo cardiaco?
Innanzitutto il ciclo cardiaco è l’insieme delle fasi di rilasciamento e contrazione del cuore. Le fasi
di sistole e diastole coinvolgono sia l’atrio che il ventricolo. La sistole atriale è compresa nella fase
di diastole ventricolare. Per descrivere il ciclo cardiaco seguiamo l’andamento di alcuni parametri
che sono le variazioni di pressione all’interno della camera ventricolare, la pressione nell’aorta e nel
tronco polmonare, le variazioni del volume di sangue all’interno del ventricolo.
(Vedi figura a pag.343 Berne Levy Ciclo cardiaco).
19
Fisiologia, lezione del 10 novembre 2005
CICLO CARDIACO
La sistole e la diastole ventricolare comprendono la sistole e la diastole atriale.
La sistole atriale immette una piccola quantità di volume nel ventricolo in condizioni di riposo.
Cuore destro e cuore sinistro sono due pompe che funzionano in serie, una dopo l’altra, però devono
eiettare contemporaneamente la stessa quantità di sangue. Il ciclo cardiaco del cuore di destra è
esattamente sovrapponibile come fasi al ciclo cardiaco del cuore di sinistra; le differenze sono di
tipo quantitativo. Infatti le pressioni che sviluppa il ventricolo di destra sono molto minori rispetto
alle pressioni sviluppate dal ventricolo di sinistra. Il ventricolo sinistro è una pompa di pressione, il
ventricolo destro è una pompa di volume (a bassa pressione).
Se noi aumentiamo la quantità di sangue che passa all’interno del ventricolo le cellule cardiache si
allungheranno di più ma ci sarà lo sviluppo della stessa tensione perché non è modificata la
resistenza da superare; si ha un accorciamento maggiore delle cellule cardiache e di conseguenza
l’espulsione di una quantità maggiore di sangue.
Se la pressione all’interno dell’aorta (postcarico) è maggiore succede che il ventricolo deve
contrarsi e sviluppare una forza maggiore raggiungendo valori di tensione superiori. In questo
secondo caso l’accorciamento delle fibrocellule sarà minore perché la resistenza contro cui il cuore
ha dovuto spingere il sangue è maggiore, di conseguenza il ventricolo espellerà un minor volume di
sangue.
Possiamo avere una condizione in cui si ha un aumento della contrattilità, cioè sono stati applicati
dei fattori inotropi positivi come ad es. una stimolazione ortosimpatica (noradrenalina) che fanno
aumentare la contrattilità. In questo caso la lunghezza di partenza rimane invariata, lo sviluppo di
tensione rimane uguale ma l’accorciamento è maggiore. Il ventricolo contraendosi di più espellerà
una maggior quantità di sangue a parità di lunghezza iniziale.
Possiamo ancora esprimere il ciclo cardiaco non tanto in termini di tensione e lunghezza iniziale,
quanto in termini di pressione e volume, nel senso che la lunghezza iniziale delle fibrocellule
essendo il ventricolo un organo cavo si esprime come una variazione di volume, anche
l’accorciamento si esprimerà come una riduzione del volume ventricolare; così come lo sviluppo di
tensione a livello delle pareti si potrà esprimere e più facilmente misurare anche come sviluppo di
pressione all’interno del ventricolo. Allora noi possiamo costruire una curva (vedi quaderno) per
esprimere il ciclo cardiaco: curva pressione-volume. L’area sottesa dalla curva risultante
rappresenta il lavoro cardiaco (Vxp).
Durante l’attività cardiaca compaiono dei rumori che sono auscultabili o applicando l’orecchio sulla
superficie del torace o utilizzando uno stetoscopio o un fonendo, questi rumori prendono il nome di
toni cardiaci. Questi toni cardiaci sono 4 di cui realmente udibili con lo stetoscopio in condizioni
fisiologici solo 2. I toni si possono registrare utilizzando lo sfigmografo.
Toni fisiologici:
I° tono- all’inizio della sistole: chiusura delle valvole atrio-ventricolari, rimbalzo del sangue
all’interno del ventricolo, apertura della valvola semilunare,efflusso di sangue
II° tono- alla fine della sistole: chiusura valvole semilunari, movimento retrogrado del sangue
Toni non udibili normalmente:
III° tono- riempimento rapido del ventricolo: apertura valvola atrio-ventricolare
IV° tono- presistolico: sistole atriale
Quando sono udibili i toni III° e IV° danno origine ai cosiddetti ritmi di galoppo.
Quando il ventricolo si contrae si determinano delle ripercussioni sui vasi, sia su quelli arteriosi che
su quelli venosi; queste ripercussioni sono dovute al fatto che durante la sistole ventricolare viene
immesso un certo volume di sangue in breve tempo all’interno di un vaso a livello del bulbo aortico,
20
questo volume di sangue causa una distensione a livello dei vasi arteriosi; inoltre si verificano delle
variazioni cicliche di pressione in relazione all’andamento del ciclo cardiaco a livello dell’atrio,
variazioni di pressione che si ripercuotono sulle vene tributarie dell’atrio dando luogo anche qui a
variazioni di pressione durante il ciclo cardiaco. Queste variazioni di pressione prendono il nome di
polso arterioso nel caso del sangue che passa nel bulbo aortico e di polso venoso quando invece
parliamo di variazioni di pressione a livello dell’atrio e delle grosse vene (ad es. la giugulare).
Innanzi tutto vediamo il polso arterioso. Il polso arterioso è una distensione delle pareti del bulbo
aortico per effetto del passaggio di sangue indotto dalla sistole ventricolare: 70ml di sangue
vengono spinti all’interno del bulbo aortico e incontrano una certa resistenza e non defluiscono
subito lungo il vaso ma inizialmente si accumulano nel primo tratto dell’aorta determinando una
distensione delle pareti e un aumento di pressione. La differenza tra pressione sistolica e pressione
diastolica viene detta pressione differenziale. La morfologia del polso lungo l’albero arterioso
cambia a causa di onde riflesse. La distensione della parete arteriosa a livello del bulbo tende a
spostarsi lungo la parete arteriosa per effetto del ritorno elastico della parete. Lo spostamento di
questa distensione dà origine a quello che prende il nome di onda sfigmica che viaggia con una
velocità molto elevata soprattutto se confrontata alla velocità reale del sangue a livello del vaso
(esempio delle palline da biliardo-1h5min.). La velocità massima del sangue a livello dell’aorta è di
30-40cm/sec.; la velocità dell’onda sfigmica è di 4-5m/sec. La velocità di propagazione dell’onda
sfigmica non è un parametro legato alla funzione cardiaca, dipende esclusivamente dalla
distensibilità delle pareti: quanto meno è distendibile la parete tanto più velocemente viaggia l’onda
sfigmica. Man mano che un soggetto invecchia la distensibilità delle pareti arteriose tende a
diminuire con conseguente aumento di velocità di propagazione dell’onda sfigmica. Per quanto
riguarda invece il cosiddetto polso giugulare, il polso giugulare è la registrazione delle variazioni
pressorie a livello della vena giugulare in relazione sempre al ciclo cardiaco, questo polso giugulare
è caratterizzato da tre onde positive: l’onda A è dovuta alla sistole atriale, l’onda C è in coincidenza
con la sistole ventricolare isovolumica (tendenza alla protrusione delle valvole atrio-ventricolari
verso l’atrio), l’onda B dovuta al fatto che l’atrio si riempie progressivamente di sangue che
proviene dalla periferia; e due onde negative: l’onda X che si registra durante l’accorciamento delle
fibrocellule ventricolari ed è dovuta al fatto che c’è uno stiramento verso il basso durante la sistole
ventricolare delle valvole atrio-ventricolari; l’onda Y è determinata dalla apertura della valvola
atrio-ventricolare quindi compare soprattutto nel primo periodo di diastole ventricolare. L’intervallo
AB corrisponde alla diastole ventricolare, l’intervallo BC corrisponde alla sistole ventricolare.
Il cuore abbiamo detto che ha come funzione principale quella di pompare il sangue all’interno del
circolo per rifornire di sangue e quindi di ossigeno i tessuti periferici (il cuore sinistro) e per
pompare il sangue nel circolo polmonare affincheè il sangue venoso si arricchisca di ossigeno (il
cuore destro). La necessità di ossigeno da parte dei vari tessuti varia dalla situazione basale a
situazioni di lavoro particolari, per cui il cuore deve adattarsi alle varie richieste dei tessuti
modificando la quantità di sangue che espelle e che pompa all’interno del circolo. Innanzi tutto noi
definiamo come gettata cardiaca la quantità di sangue che viene espulsa dal ventricolo nell’unità di
tempo; la gettata cardiaca del ventricolo destro sarà uguale alla gettata cardiaca del ventricolo
sinistro. La gettata cardiaca, proprio per quello che abbiamo detto, sarà uguale alla frequenza
cardiaca, cioè al numero di battiti in un minuto, per la gettata sistolica, cioè il volume di sangue
espulso dal ventricolo nel singolo battito. In condizioni basali la gettata cardiaca ha un valore di
5 litri/min. Per modificare questa gittata noi potremo si modificare la frequenza sia modificare la
gittata sistolica. La frequenza cardiaca ha un duplice controllo: il controllo principale della
frequenza è di tipo nervoso da parte del sistema nervoso autonomo (parasimpatico-fibre del nervo
vago, ortosimpatico-nervi cardiaci). Inoltre la frequenza può anche essere modificata da un
controllo di tipo ormonale quindi prevalentemente dalle catecolamine (noradrenalina e adrenalina)
secrete dalla midolla surrenale; questo controllo ormonale è più lento rispetto a quello di tipo
nervoso. Per quanto riguarda le gettata sistolica, cioè il volume di sangue espulso nel singolo
21
battito, dobbiamo distinguere due meccanismi diversi: abbiamo un meccanismo che viene definito
intrinseco del cuore per cui interviene nel cuore indipendentemente dal controllo per esempio di
tipo nervoso per cui è il meccanismo che controlla la gittata cardiaca ad es. nel cuore dei trapiantati
(cuore denervato). Il meccanismo di tipo intrinseco è basato su due fattori principali: uno è il
meccanismo di Frank-Starling basato sulla lunghezza iniziale delle fibre (relazione tensionelunghezza); l’altro meccanismo è basato sulle modificazioni della contrattilità legate alle variazioni
di frequenza. Questi due meccanismi sono i responsabili della cosiddetta capacità di
autoregolazione del cuore. L’altro sistema di controllo è definito estrinseco, sta fuori dal cuore e
anche qui abbiamo un controllo di tipo nervoso e uno di tipo ormonale.
22
Fisiologia, lezione dell’11 novembre 2005
GITTATA CARDIACA
Dunque, la gittata cardiaca è uguale alla frequenza per il volume eiettato in un singolo battito cioè la
gittata sistolica ed ha un valore a riposo di circa 5 l/min. Questa gittata cardiaca però bisogna
saperla misurare e i metodi che abbiamo a disposizione per misurare la gittata cardiaca sono diversi.
Uno dei metodi si basa sul principio di Fick e permette di valutare il flusso di sangue attraverso un
qualsiasi organo purché ci sia una sostanza che passando attraverso quell’organo modifichi la sua
concentrazione. Noi possiamo utilizzare il principio di Fick per misurare la gittata cardiaca
misurando il flusso di sangue attraverso il polmone, con riferimento alla variazione di
concentrazione di ossigeno. (vedi formula sul quaderno) Questo metodo permette di fare calcoli con
un errore approssimativo di circa il 10%.
Un altro metodo che viene utilizzato è il cosiddetto metodo che ricorre alla tecnica della diluizione
dell’indicatore. La tecnica della diluizione ci permette di misurare un volume incognito conoscendo
la quantità di un indicatore, un marcatore e di misurarne poi la concentrazione perché la
concentrazione di una sostanza è data dal rapporto tra la quantità della sostanza e il volume uin cui
mettiamo la sostanza stessa. La tecnica della diluizione è in genere utilizzata per volumi statici
mentre il flusso del sangue è dinamico (vedi curva conc.-tempo sul quad.). Un metodo oggi
utilizzato per calcolare la gittata cardiaca si basa sulla termo-diulizione che esclude la necessita di
iniettare soluzioni coloranti all’interno del torrente circolatorio perché viene introdotto solamente
un piccolo volume di soluzione fisiologica con effetti irrilevanti per il soggetto.
La gettata cardiaca può essere modificata intervenendo sulla frequenza e la gittata sistolica.
Per quanto riguarda la frequenza ha un duplice controllo: uno di tipo nervoso e uno di tipo
ormonale; entrambi agiscono in maniera tonica sulla attività cardiaca modificando quella che è la
frequenza intrinseca del cuore.
Il sistema nervoso parasimpatico dal nucleo motore dorsale del vago e/o dal nucleo ambiguo e sono
due dei nervi da cui origina il nervo vago, si trovano localizzati a livello del midollo allungato, a
livello del bulbo. Da qui partono fibre che si portano a un ganglio posto nelle vicinanze del cuore
detto plesso da cui si dipartono le fibre postgangliari destinate alla muscolatura atriale: il vago di
destra si porta prevalentemente alla struttura del nodo seno-atriale (avrà quindi effetto cronotropo
positivo), mentre il nervo vago di sinistra si porta prevalentemente al nodo atrio-ventricolare (avrà
effetti sulla velocità di conduzione). Sono poche le terminazioni vagali che arrivano a livello della
muscolatura ventricolare. Inoltre c’è da aggiungere che la fibra pregangliare nel parasimpatico è
mielinizzata mentre la fibra postgangliare è amielinica.
Per quanto riguarda il sistema nervoso ortosimpatico, esso origina dalle colonne intermedio-laterali
del midollo spinale nel tratto dei primi 5 segmenti toracici e degli ultimi 2 segmenti cervicali, le
fibre pregangliari si portano a livello dei gangli cervicale medio e stellato, da qui partono le fibre
postgangliari; la trasmissione del segnale dalla fibra pregangliare e quella postgangliare avviene in
posizione ben più distante dal cuore rispetto alla fibra vagale. I nervi cardiaci (fibre postgangliari)
arrivano al plesso cardiaco (lo stresso a cui giungono le fibre pregangliari vagali) e qui prendono
contatto con interneuroni che vanno ad innervare riccamente la muscolatura ventricolare con effetti
molto importanti sulla sua contrazione. L’ortosimpatico ha come mediatori chimici l’acetilcolina a
livello delle fibre pregangliari, come il parasimpatico, ma a livello della fibra postgangliare libera
la noradrenalina che per agire sul cuore si lega a recettori β adrenergici.
Dal punto di vista funzionale dobbiamo innanzitutto dire che il parasimpatico ha un effetto di tipo
cronotropo negativo, quindi diminuisce la frequenza cardiaca: l’acetilcolina liberata si lega ai
recettori di tipo muscarinico e determina direttamente l’apertura di canali ad esempio per il
potassio, questo fa sì che la velocità con cui si ha una risposta in seguito alla stimolazione vagale è
23
estremamente elevata, inoltre la presenza di abbondanti enzimi acetilcolinesterasici responsabili
della degradazione dell’acetilcolina fa in modo che il suo effetto venga rapidamente eliminato e
cessata la stimolazione vagale cessa anche l’effetto della stimolazione stessa. In questo modo il
controllo da parte del sistema nervoso vagale si esplica battito per battito. Il sistema nervoso
ortosimpatico invece presenta una latenza molto maggiore perché la noradrenalina si deve legare ai
recettori β adrenergici e gli effetti della liberazione della noradrenalina dipendono dalla attivazione
della adenilato cilasi che è proteina di membrana con conseguente formazione di AMPc, quindi la
risposta alla stimolazione ortosimpatica richiede un certo tempo per mettere in attività e stimolare
queste varie attività enzimatiche. Inoltre la noradrenalina una volta liberata viene o ricaptata dalle
cellule stesse delle terminazioni nervose oppure allontanata col torrente circolatorio, tuttavia anche
questo meccanismo di allontanamento della noradrenalina è un meccanismo relativamente lento
soprattutto se confrontato alla degradazione enzimatica dell’acetilcolina: una volta che cessa la
stimolazione ortosimpatica l’effetto si prolunga nel tempo, quindi ikl sistema nervoso ortosimpatico
difficilmente può controllare la gittata cardiaca battito per battito, al contrario del sistema nervoso
parasimpatico. Abbiamo detto che il sistema nervoso vagale ha scarso effetto sul ventricolo tuttavia
una qualche azione, anche se indiretta, sulla forza di contrazione dei ventricoli sembra che ci sia e
questa azione sembra dovuta alla liberazione di un altro messaggero cellulare che è l’ossido nitrico
(NO): la liberazione dell’ossido nitrico è stimolata dal sistema vagale. L’NO da una parte potenzia
l’effetto dell’acetilcolina per esempio sulla frequenza cardiaca (con effetto bradicardizzante);
dall’altra parte sembra che agisca con effetti, diciamo così, inibitori su alcune azioni della
noradrenalina contrastando l’effetto della scarica simpatica (sembra che riduca la liberazione di
calcio dal reticolo sarcoplasmatico con riduzione della forza di contrazione). In questo modo anche
il parasimpatico riesce ad intervenire almeno parzialmente sul controllo della forza di contrazione
del ventricolo.
La frequenza oltre che dal sistema nervoso autonomo può essere controllata anche da alcuni ormoni
circolanti, tra i più importanti ricordiamo le catecolamine che sono liberate dalla midolla surrenale
(adrenalina e noradrenalina). Questi due ormoni intervengono sul controllo della attività cardiaca in
un tempo successivo rispetto al controllo operato dall’ortosimpatico e i loro effetti si manifestano
quando le loro concentrazioni aumentano in maniera sufficiente nel torrente circolatorio.
Per quanto riguarda invece il controllo della gittata sistolica esso è operato con due meccanismi
differenti: abbiamo un controllo di tipo intrinseco presente anche nel cuore denervato, questo
controllo intrinseco si basa sulla lunghezza delle fibre (legge di Frank-Starling-controllo
eterometrico) e dipende anche dalla frequenza di scarica (controllo omeometrico). La gettata
cardiaca può essere controllata anche in maniera estrinseca dal sistema nervoso autonomo (orto e
para-simpatico) e da ormoni circolanti (glucocorticoidi, ormoni steroidei, insulina, glucagone).
Il cuore è in grado di adattarsi a modificazioni sia del precarico, cioè il ritorno venoso di sangue, sia
del postcarico, ad es. la pressione arteriosa, in maniera autonoma. Il cuore riesce ad espellere
sempre la quantità di sangue che gli arriva, quindi si adatta a variazioni del ritorno venoso
modificando la gettata sistolica, in modo che non ci sia accumulo di sangue all’interno del
ventricolo. In questo caso c’è stata una distensione delle cellule, quindi un aumento del precarico.
Quando invece viene modificata la pressione arteriosa si ha un aumento del postcarico. All’aumento
del postcarico inizialmente il cuore si trova in una condizione sfavorevole nel senso che si trova a
dover superare un valore di pressione maggiore rispetto a quello normale, risultato: non riesce ad
espellere la stessa quantità di sangue perché deve sviluppare una tensione maggiore per poter aprire
la valvola e poi una pressione maggiore per espellere il sangue contro un’aumentata resistenza,
espellerà perciò un volume di sangue inferiore rispetto alla normale gittata sistolica. La gettata
sistolica sarà al primo battito ridotta mentre risulterà aumentato il volume ventricolare di fine sistole
cioè il volume di sangue che rimane all’interno del ventricolo alla fine della contrazione. Nel
momento in cui il ventricolo si riempie e il ritorno venoso rimane costante noi aggiungeremo la
stessa quantità di sangue ad un volume maggiore a causa del ristagno, perciò il volume di sangue
24
telediastolico assumerà un valore maggiore e per effetto di questo aumento di dimensioni quindi di
distensione di nuovo il cuore riuscirà a sviluppare una tensione maggiore e al 2°-3° battito tornerà
ad espellere la gettata sistolica originaria. Questo riesce a farlo perché si sono allungate le
fibrocellule e si è sviluppata una maggior forza di contrazione. Il cuore si è adattato all’aumento del
postcarico ma non ha modificato la gettata sistolica. (vedi quaderno curve di Frank).
Questi meccanismi intrinseci sono quelli che per esempio vengono messi in atto dal cuore dei
soggetti trapiantati. In essi c’è un aumento del ritorno venoso per effetto dell’attività muscolare
scheletrica. Il meccanismo di regolazione intrinseca in un soggetto normale non ha una grande
rilevanza, tuttavia sembra che questo meccanismo intrinseco, basato sulla legge di Frank-Starling,
sia responsabile dell’adattamento della gettata cardiaca da parte dei due ventricoli, cioè fa in modo
che il ventricolo destro e il ventricolo sinistro espellano lo stesso volume di sangue impedendone
l’accumulo.
25
Fisiologia, lezione del 17 novembre 2005
CONTROLLO ATTIVITA’ CARDIACA
Esiste una disparità tra le gettate del ventricolo destro e del ventricolo sinistro (pag 364 B&L).
A parità di precarico i due ventricoli espellono una quantità di sangue differente, in particolare il
ventricolo di destra espelle una gittata sistolica maggiore rispetto al ventricolo di sinistra. Questa
quantità in più espulsa dal ventricolo di destra torna attraverso le vene all’atrio di sinistra, perciò al
ventricolo di sinistra torna un volume maggiore di sangue e questo volume maggiore di sangue
distenderà le fibrocellule del ventricolo di sinistra fino ad equilibrare il valore delle gittate sistoliche
del ventricolo destro e di quello sinistro. In questa condizione le gittate dei due ventricoli sono
uguali, di differente c’è la pressione atriale e in effetti la pressione dell’atrio di sinistra è
leggermente maggiore rispetto alla pressione dell’atrio di destra. Questo si vede per esempio in
alcune condizioni patologiche come la pervietà del forame presente a livello del setto interatriale in
cui si ha un passaggio di sangue dall’atrio sinistro all’atrio destro (per la differenza di pressione tra i
due atri).
La forza di contrazione, in particolare la contrattilità del cuore è strettamente correlata alla
frequenza con cui il cuore si eccita. Per ogni frequenza cardiaca esiste un valore massimo, ottimale
di contrattilità(pag 366 B&L).
La gettata cardiaca può modificare in varie condizioni:
-Non varia durante il sonno e quando la temperatura ambientale cambia di poco
-Aumenta in condizioni come l’ansietà, l’eccitamento, durante i pasti, durante il lavoro muscolare,
quando la temperatura ambientale aumenta di parecchio, in gravidanza e per liberazione di
adrenalina
-Diminuisce nel passaggio dalla posizione clinostatica alla posizione ortostatica (passando dalla
posizione orizzontale a quella verticale la gravità determina una riduzione del ritorno venoso quindi
tenderà ad accumularsi del sangue a livello degli arti inferiori e di conseguenza questo minor ritorno
venoso riempirà di meno i ventricoli e determinerà una riduzione della gettata cardiaca); in caso di
aritmie rapide e in caso di malattie cardiache.
Il sangue viene distribuito nelle varie parti dell’organismo in maniera da soddisfare le esigenze
metaboliche di ciascun organo.
Si è visto che la attività cardiaca nel senso della frequenza ma anche in parte della contrattilità può
modificare per stimolazione di alcune parti centrali, quindi c’è un controllo da parte di centri
superiori che sono localizzati preferibilmente nella parte anteriore del cervello. Tra questi centri
ricordiamo: lobi frontali, corteccia orbitaria, corteccia motoria o premotoria, parte anteriore del lobo
temporale, insula, giro cingolato, nuclei della linea mediana ventrali e laterali del talamo, regione
posteriore e posterolaterale dell’ipotalamo.
L’aumento della gittata cardiaca precede di poco l’aumento del lavoro cardiaco.
La frequenza cardiaca cambia in relazione alle modificazioni della pressione arteriosa, c’è una
stretta corrispondenza tra modificazioni della pressione e modificazioni della frequenza cardiaca
(vedi immagini sul quaderno) all’aumentare della pressione arteriosa la frequenza cardiaca
diminuisce quindi c’è una relazione di tipo inverso tra frequenza e pressione. Questa correlazione
tra pressione e frequenza è dovuta alla diversa attività del sistema nervoso simpatico e
parasimpatico, nel senso che per valori medi di pressione la frequenza dipende dall’interazione tra i
due sistemi nervosi autonomi: all’aumentare della pressione arteriosa aumenta la scarica del
parasimpatico e contemporaneamente si riduce la scarica dell’ortosimpatico. Questo non vale più
quando i valori di pressione sono o molto bassi (attività vagale nulla, simpatica massima) o molto
alti (attività simpatica bassa, vagale massima).
26
Questa relazione tra pressione arteriosa e frequenza cardiaca dipende dalla attivazione di recettori
che sono definiti barocettori e sono localizzati a livello dell’arco aortico e del seno carotideo. Questi
recettori risentono della maggiore o minore distensione delle pareti per effetto dell’ingresso del
sangue quindi della gittata sistolica all’interno del torrente circolatorio e quando aumenta la
distensione questi recettori scaricano con frequenza maggiore controllando tramite un circuito
neuronale l’attività vagale e l’attività simpatica.
Esistono altri recettori a livello degli atri che risentono le variazioni di volume (volocettori atriali) e
aumentano la frequenza cardiaca. Questo aumento di frequenza prende il nome di riflesso di
Bainbridge (pag 357 B&L). L’entità della risposta dipende dal valore della frequenza di partenza,
perciò non è sempre uguale. Quando c’è l’attivazione di questi recettori atriali la risposta a livello
cardiaco è specifica sulla frequenza, nel senso che la risposta è caratteristicamente un aumento della
frequenza cardiaca, ma non c’è un aumento della scarica simpatica generalizzata, quindi non c’è
risposta a livello arteriolare periferico. La stimolazione dei volocettori atriali ha un altro effetto
sull’organismo: un aumento del volume delle urine che vengono eliminate. L’aumento del volume
urinario dipende dal fatto che per via nervosa viene inibita la liberazione di un ormone ipofisario
che è la vasopressina detta anche ormone antidiuretico, è l’ormone che serve per riassorbire acqua a
livello dei tubuli renali e quindi ridurre il volume delle urine che vengono formate. A livello viene
anche liberato un altro ormone che è il cosiddetto peptide natriuretico atriale (ANP) che agisce a
livello renale facilitando l’allontanamento con le urine di sodio.
L’attività cardiaca può essere modificata in relazione alla attività respiratoria. Si osserva soprattutto
nei bambini, ma anche negli adulti quella che viene detta aritmia sinusale respiratoria: variazione
del ritmo cardiaco in sincronia con l’attività respiratoria. In particolare la frequenza aumenta
durante la inspirazione, mentre diminuisce durante la espirazione. (vedi grafico pag 359 B&L).
La frequenza cardiaca dipende anche dalla attività di altri recettori che sono i cosiddetti
chemocettori localizzati a livello periferico che risentono variazioni nella pressione parziale di
ossigeno e di CO2. L’attivazione di questi chemocettori dà importanti risposte a livello del sistema
respiratorio, quindi sono fondamentali nel modulare, modificare l’attività respiratoria in base alla
pressione parziale dei gas respiratori ed eventualmente alla concentrazione di idrogenioni; però si è
visto che possono anche modificare l’attività cardiaca. Tuttavia l’importanza di questo effetto
nell’organismo in toto è molto scarsa.
27
Fisiologia, lezione del 18 novembre 2005
LAVORO CARDIACO
Il cuore quando si contrae compie un lavoro per espellere un certo volume di sangue all’interno del
distretto circolatorio. Questo lavoro è dato dal prodotto della pressione per la gittata sistolica
(L=PxGS), in fisica il lavoro è dato dal prodotto di una forza per uno spostamento(L=Fxs)
P= F/s2; GS=s3 → L=PxGS= F/s2xs3=Fxs.
Il lavoro totale del cuore possiamo definirlo come L= PxV + ½ mv2 dove PxV è la componente
potenziale e ½ mv2 è la componente cinetica (trascurabile in condizioni di riposo, sotto sforzo
assume un valore percentuale più rilevante nel ventricolo destro). I due ventricoli svolgono un
lavoro diverso: mentre il volume di sangue che entrambi i ventricoli espellono è uguale, la pressione
che deve essere impressa a questo sangue dal ventricolo sinistro è molto maggiore rispetto alla
pressione del ventricolo destro (il lavoro del ventricolo destro è circa 6-7 volte maggiore rispetto a
quello del destro). Dalle formule scritte si deduce che in fisica si compie lavoro quando si produce
una forza che determina uno spostamento; in fisiologia un muscolo compie lavoro anche senza che
ci sia uno spostamento perciò parleremo di un lavoro di tipo dinamico (lavoro esterno utile) e di un
lavoro di tipo statico compiuto per sviluppare una determinata tensione.
Lt=PxV + Et (energia per mettere in tensione la struttura muscolare). Mentre è facile determinare il
valore di PxV, risulta molto più difficile determinare il valore del lavoro statico e per questo motivo
è stato introdotto il concetto di rendimento che è il rapporto tra il lavoro esterno utile e il lavoro
totale svolto: rendimento= (PxV)/( PxV + Et). Per determinare il parametro al denominatore si
valuta il consumo di ossigeno da parte del muscolo cardiaco considerando la differenza
arterovenosa dell’ossigeno per il flusso coronario per un numero che è 2,05 che non è altro che
l’equivalente calorico di 1 ml di ossigeno con un quoziente respiratorio pari a 0,8
(A─V)ossigeno x Fc x 2,05.
Il rendimento nel lavoro cardiaco è molto basso, si aggira intorno al 18-20% del lavoro totale,
perciò l’80% della spesa energetica totale è utilizzato per mantenere in tensione le strutture
muscolari.
Se aumenta il lavoro cardiaco il rendimento cambia:
- aumento gittata sistolica – aumento del rendimento (numeratore aumenta rispetto al
denominatore)
- aumento di frequenza – non c’è aumento del rendimento (numeratore e denominatore
aumentano entrambi)
- aumento di pressione – il rendimento non migliora (aumenta anche il parametro Et)
- aumento di contrattilità – diminuzione rendimento (l’aumento di contrattilità è, in un certo
senso, uno spreco energetico).
Il cuore ha un metabolismo di tipo aerobio, ciò significa che deve ricavare ATP consumando
ossigeno. Il metabolismo anaerobio nel cuore può fornire il 5% dell’energia. Il cuore a differenza
del muscolo scheletrico non può contrarre un debito di ossigeno. Questo fatto è documentato
innanzitutto dalla particolare ricchezza di mitocondri nelle cellule miocardiche e dalla presenza a
livello cardiaco della mioglobina che è un deposito di ossigeno che interviene quando il consumo di
ossigeno aumenta notevolmente; inoltre dobbiamo ricordare che il cuore è un tessuto che estrae dal
sangue che gli arriva già in condizioni basali una quantità elevata di ossigeno (la differenza
arterovenosa di ossigeno a livello cardiaco è di circa 10ml per 100ml di sangue, mentre
nell’organismo in toto è di 5ml su 100ml di sangue).
L’ATP viene prodotto a livello dei mitocondri tramite il processo della fosforilazione ossidativi
tramite il ciclo di Krebs. I substrati energetici che vengono utilizzati dal cuore sono glucidi e lipidi.
Il 35% di ossigeno è usato per ossidare substrati glucidici; il 65% per substrati di origine lipidica.
28
Queste percentuali cambiano a seconda delle situazioni. In condizioni di digiuno il glucosio entra
nelle cellule miocardiche solo se la sua concentrazione plasmatici è superiore a 60mg/100ml,
diversamente viene risparmiato a favore di tessuti come il nervoso che hanno un metabolismo
prettamente glucidico e il cuore utilizza sostanze grasse; nel periodo postprandiale quando la
disponibilità di glucosio è maggiore il cuore utilizza preferibilmente i carboidrati e molto meno le
sostanze di natura lipidica. L’insulina riduce la soglia per il passaggio del glucosio all’interno del
miocardio fino a valori di 40mg/100ml.
Il cuore funziona come pompa e spinge il sangue all’interno del circolo, in particolare possiamo dire
che il sistema cardiovascolare è costituito da due circoli che sono disposti in serie (il cuore destro e
il cuore sinistro). Le gittate dei due ventricoli sono uguali e in condizioni basali hanno un valore
intorno ai 5litri/min. Bisogna sottolineare il fatto che il cuore di sinistra pompa il sangue nel circolo
sistemico che è suddiviso in diversi circoli che sono disposti in parallelo tra di loro, questi circoli
sono definiti circoli distrettuali (vedi schema sul quaderno). Il fatto che questi circoli siano disposti
in parallelo consente di modificare l’apporto in uno di questi circoli, quindi deviare il sangue da un
circolo a favore di un altro senza influire sulla gettata cardiaca. All’interno del circolo sistemico
così come in quello polmonare abbiamo una serie di vasi, quindi di condotti all’interno dei quali
scorre il sangue. Questi vasi hanno diverse caratteristiche che li distinguono in arterie (vasi di
distribuzione), capillari (vasi di scambio) e vene (vasi di raccolta). Le pareti di questi vasi
presentano in genere una organizzazione in 3 tonache: abbiamo una tonaca più interna che prende il
nome di intima ed è costituita da un monostrato di cellule endoteliali che poggiano su una
membrana basale, queste cellule endoteliali non sono semplici cellule di rivestimento, ma sono
cellule metabolicamente attive, producono anche dei fattori che possono partecipare al controllo del
diametro vasale e fattori di crescita; al di sotto dell’intima abbiamo la tonaca media che è costituita
da muscolatura liscia, l’entità di questa muscolatura è diversa a seconda dei vasi che si prendono in
considerazione, essa ha la capacità di rispondere a variazioni della concentrazione del calcio con
fenomeni di contrazione o rilasciamento; infine abbiamo la tonaca più esterna detta avventizia che
contiene nel suo interno sia fibre di tipo collagene (vene) che fibre di tipo elastico (arterie di grosso
e medio calibro), inoltre nella avventizia si trovano i vasa vasorum.
In base alle caratteristiche anatomiche della parete di questi vasi possiamo distinguere delle
funzioni differenti dei vasi stessi. Innanzitutto parliamo di arterie di grosso e medio calibro: questi
vasi hanno la parete particolarmente ricca di fibre elastiche che ha la caratteristica di distendersi per
un aumento di volume del sangue in esse spinto dalla contrazione cardiaca, ma una volta che cessa
la forza che ha determinato il passaggio di sangue le fibre elastiche tendono a tornare nella loro
posizione originaria, quindi restituiscono l’energia che si era immagazzinata durante la distensione.
Queste fibre elastiche perciò facilitano l’avanzamento del sangue all’interno del torrente
circolatorio.
Abbiamo poi dei vasi definiti vasi precapillari di resistenza caratterizzati da una particolare
ricchezza nello strato muscolare, sono quei vasi che possono in maniera particolarmente efficace
modificare il loro calibro e conseguentemente variare la resistenza all’interno del condotto
(arteriose e metaarteriole). Vi sono anche vasi postcapillari che offrono una resistenza inferiore
(venule). I vasi pre- e postcapillari offrono un doppio controllo del flusso nei capillari. Appena
prima del letto capillare sono posti dei vasi denominati sfinteri precapillari caratterizzati da una
ricca muscolatura che contraendosi e rilasciandosi può determinare la chiusura o l’apertura del
capillare che si trova a monte regolando il flusso nel letto del capillare che immediatamente fa
seguito ad esso.
Abbiamo poi i vasi capillari che sono i vasi di scambio veri e propri caratterizzati dal solo strato di
endotelio che poggia sulla membrana basale, a seconda dei tessuti presi in considerazione i capillari
possono avere un endotelio continuo, fenestrato oppure discontinuo o rivestito da strutture
differenziate che ne riducono ulteriormente la permeabilità (si pensi a questo riguardo alla barriera
emato-encefalica).
29
Poi abbiamo le vene, vasi caratterizzati da una particolare ricchezza di fibre collagene e quindi
definiti vasi di raccolta, di capacità. Perciò le vene possono fungere da serbatoio dinamico.
All’interno del nostro circolo, sia sistemico che polmonare cambia la cosiddetta area della sezione
traversa. La sezione traversa è una sezione trasversale del vaso. Questa sezione è minima a livello
dell’aorta e man mano che ci allontaniamo dal cuore questa area della sezione traversa tende ad
aumentare perché, nonostante i vasi presentino via via un calibro più piccolo, essi aumentano di
numero e di conseguenza l’area, passando da circa 4,5cmq a circa 4800cmq.
La velocità del sangue varia in modo inverso rispetto all’area della sezione traversa perché in effetti
il flusso di sangue in ogni sezione è sempre lo stesso ed è sempre di 5 litri/min, ma assume velocità
differenti perché la velocità media del sangue è: v = F/πr2 (dove F indica il flusso).
La velocità media a livello dell’aorta è di circa 30-40cm/s, e livello dei capillari, invece ha un
valore di 0,5mm/s. La bassa velocità a livello dei capillari è importante dal punto di vista funzionale
perché maggiore sarà il tempo di contatto e più facili gli scambi tra il sangue e il tessuto. La velocità
però non è uniforme, soprattutto a livello delle arterie di grosso e medio calibro e a livello delle
vene. A livello dell’aorta la velocità può arrivare addirittura durante la fase di sistole fino a un
valore di 120cm/s e scendere poi durante la diastole a 0 o assumere valori negativi (a causa di un
flusso in senso retrogrado). Questa differenza di velocità tende progressivamente a scomparire man
mano che ci si allontana dal cuore e il flusso del sangue da pulsatile si trasforma in flusso continuo
una volta superati i vasi di resistenza precapillari.
La velocità del sangue cambia anche all’interno del singolo vaso, non è uniforme in tutta la sezione
dello stesso, ma presenta un andamento che può essere rappresentato da una parabola con valore
massimo presso l’asse centrale del vaso e praticamente nullo a ridosso della parete del vaso. Questo
si verifica in particolare nei vasi di grosso e medio calibro nel caso in cui il flusso del sangue sia di
tipo laminare cioè caratterizzato dallo scorrimento di lamine cilindriche concentriche l’una sull’altra
Questo particolare andamento della velocità a parabola è responsabile nei vasi sanguigni della
disposizione assiale delle emazie, cioè del fatto che i globuli rossi e gli elementi corpuscolari del
sangue tendono a disporsi preferibilmente in quelle lamine che scorrono con la maggiore velocità
perciò nella zona centrale del vaso. Questo fa sì che nel momento in cui dai vasi di maggiori
dimensioni originano vasi più piccoli si verifica il fenomeno della cosiddetta scrematura del sangue:
la maggior parte del sangue che devia nel nuovo vaso p sangue che proviene dalla regione laterale
del condotto originario che si presentava povera si elementi corpuscolari.
30
Fisiologia, lezione del 24 Novembre 2005
FLUSSO SANGUIGNO
Il sangue scorre nei vasi con un flusso di tipo laminare, è come se all’interno del vaso scorressero
una sopra l’altra delle lamine di liquido a forma circolare con velocità crescente dalla parete all’asse
del condotto delineando una velocità ad andamento parabolico.
Occasionalmente il flusso da laminare diventa di tipo turbolento e in queste condizioni si creano
come dei vortici all’interno del vaso per cui non c’è più lo scorrimento delle lamine una sull’altra
ma c’è anche un moto in senso retrogrado. Questo flusso turbolento ha delle rilevanze mediche
abbastanza significative, innanzitutto è un flusso di tipo rumoroso e quindi si può ascoltare a livello
dei vasi applicando uno stetoscopio, inoltre questo tipo di flusso richiede al cuore un maggior
lavoro, in quanto si crea un maggiore ostacolo allo scorrimento del sangue, infine la velocità
durante il flusso turbolento risulta ridotta a causa del flusso retrogrado.
La probabilità che si passi da un moto laminare a uno turbolento è data da un numero che è il
cosiddetto numero di Reynolds che dipende da parametri inerenti alle caratteristiche del liquido
stesso e del vaso in cui esso scorre.
R = (ρ/η)*v*r
(ρ= densità ; η=viscosità; v=velocità ; r=raggio)
La tendenza a passare da un flusso laminare a un flusso turbolento si ha quando il numero di
Reynolds supera il valore di 2000 (per R>2000 si ha meggiore probabilità che si verifichi un moto
turbolento nel condotto). Nell’apparato cardiovascolare sembra si verifichino episodi di moto
turbolento anche per valori di R inferiori a 2000.
Il flusso turbolento si può verificare in condizioni fisiologiche quali per es. all’uscita del sangue dal
ventricolo a causa dell’elevata velocità. Si può avere flusso turbolento per variazioni delle
caratteristiche del sangue, in particolare una riduzione della viscosità a causa di una anemia; oppure
quando il calibro di un vaso aumenta in seguito ad un restringimento causato magari da placche
ateromatosiche. Il flusso di tipo turbolento può più facilmente danneggiare la parete dei vasi; inoltre
può esserci la tendenza alla formazione di trombi.
La pressione del sangue all’interno dei vasi, in tutto il circolo, modifica passando dall’aorta fino ad
arrivare alle vene cave, quindi all’atrio di destra. Questa pressione del sangue ha la caratteristica di
essere all’inizio di tipo pulsatile proprio perché strettamente dipendente dalla attività cardiaca
caratterizzata dall’alternanza di sistole e diastole. Tuttavia quando noi descriviamo l’andamento
della pressione all’interno del circolo in genere ci riferiamo ad un valore di pressione media. La
pressione media a livello dell’aorta ha un valore di circa 95mmHg. La pressione cala poco passando
per le arterie di grosso e medio calibro; quando il passa nelle arteriole la pressione cala molto
bruscamente, quindi il maggior gradiente pressorio lungo il circolo sistemico si registra a livello del
distretto delle arteriose. Presso le arteriose si riduce la differenza tra pressione sistolica e pressione
diastolica e il flusso da pulsatile diviene continuo. Il sangue arriva all’imbocco dei capillari con una
pressione che è intorno ai 30-35mmHg, passando pio per i capillari il valore pressorio tende
ulteriormente a scendere con una differenza di pressione tra l’inizio e la fine del capillare di circa
20mmHg (da 35 a 15mmHg). Passando poi attraverso le venule e le vene di medio e grosso calibro
la pressione del sangue scende progressivamente fino ad arrivare ad essere presso l’atrio destro di
circa 0-2mmHg. Quindi la pressione del sangue tende sempre a decrescere man mano che ci si
allontana dal cuore non in maniera graduale ma in maniera differente a seconda del distretto che noi
consideriamo: il maggior calo di pressione di osserva a livello delle arteriole che per questo motivo
sono dette vasi di resistenza del circolo sistemico. La caduta di pressione a livello delle arteriole si
modifica a seconda che queste arteriole siano in uno stato di vasocostrizione o vasodilatazione.
Le arteriole sono i vasi che offrono la maggior resistenza al passaggio del sangue perché sono vasi
caratterizzati da un piccolo calibro e sono poco numerosi per cui l’area totale della loro sezione
31
traversa è relativamente piccola (i vasi capillari sono più piccoli ma molto più numerosi); inoltre le
arteriole sono vasi che presentano una abbondante muscolatura in grado di modificarne in maniera
attiva il calibro.
Il distretto capillare è molto importante per quanto riguarda il circolo in quanto è responsabile degli
scambi portando ossigeno e sostanze nutritive ai tessuti e allontanare da essi l’anidride carbonica e
le scorie metaboliche. La superficie di tutti i capillari ha un valore estremamente elevato, in
condizioni di riposo si aggira intorno ai 300m2, in condizioni di riposo sono pervi solo 1/3 dei
capillari che potrebbero essere disponibili; tant’è vero che in condizioni di massima dilatazione la
superficie totale di questi capillari può arrivare addirittura a 1000m2 (superficie elevatissima che
facilita i processi di scambio). Nel circolo polmonare la superficie dei capillari è inferiore a 100m2
in condizioni di massima dilatazione.
Per quanto riguarda il circolo polmonare, in esso l’andamento della pressione è qualitativamente
relativamente simile all’andamento della pressione nel circolo sistemico, tuttavia nel circolo
polmonare la pulsatilità si mantiene fino alla fine, non si ha la progressiva riduzione della differenza
tra pressione sistolica e pressione diastolica, inoltre la caduta di pressione è graduale lungo il circolo
polmonare, la maggior resistenza è data dai vasi capillari perché le arteriole con il calibro minore
sono prive di tonaca muscolare e restano caratterizzate dal solo endotelio. Nel circolo polmonare i
valori pressori sono molto più bassi, la massima presso l’arteria polmonare si aggira intorno a
20-25mmHg. Il basso valore di pressione media (13mmHg) fa sì che a livello dei capillari
polmonari la pressione sanguigna sia in genere di 8mmHg fondamentale per evitare che ci sia
passaggio di liquido dal letto capillare al liquido interstiziale quindi al parenchima polmonare (in
questo modo il tessuto polmonare rimane asciutto facilitando gli scambi gassosi).
La quantità di sangue che è contenuto nel circolo polmonare è una quantità bassa, si aggira intorno
ai 400ml contro i circa 4800ml contenuti nel circolo sistemico.
Se noi dobbiamo descrivere il flusso del sangue a livello dei vasi ricorriamo ad alcune leggi
dell’emodinamica, leggi fisiche che descrivono il flusso di liquidi diciamo di tipo newtoniano
all’interno di condotti con pareti rigide. Applicando queste leggi dell’emodinamica noi facciamo
naturalmente delle approssimazioni.
Il flusso all’interno dei vasi dipende da una differenza di pressione alle estremità del condotto ed è
ostacolato dalla resistenza perciò: Ғ= Δp/R
La resistenza dipende da diversi parametri: quali la viscosità del sangue, il raggio del vaso, la
lunghezza del vaso.
Ғ=(p1−p2)*π*r4/8*η*l (legge di Poiseuille). Gli unici parametri della formula che non possono
variare sono π e 8.
Vista questa nuova formula la resistenza risulta quindi essere: R=8*η*l/π*r4
8*l/πr4 = H rappresentano le caratteristiche geometriche del vaso
In conclusione R=H*η
Il raggio è presente alla quarta potenza e ciò significa che piccole variazioni di r (raggio)
comportano grandi modificazioni di R (resistenza).
Il circolo sistemico è costituito da vasi disposti in serie e vasi disposti in parallelo tra loro. La
resistenza offerta complessivamente al flusso del sangue è data dalla somma di queste resistenze
che come nei circuiti elettrici vengono sommate direttamente se in serie (R=R1+R2) o nei loro
reciproci se in parallelo (1/R=1/R1+1/R2). 1/R=C (conduttanza).
Per cui la resistenza del singolo circolo distrettuale è sempre inferiore alla resistenza complessiva.
Il sangue essendo composto da una componente liquida (il plasma) e da una componente
corpuscolata (eritrociti, leucociti, piastrine) è un liquido non omogeneo; perciò la viscosità
ricavabile dalla formula di Poiseuille per quanto riguarda il sangue è detta apparente. Spesso si fa
riferimento a una viscosità che viene definita relativa data dal rapporto tra la viscosità apparente del
sangue e la viscosità del plasma (considerabile come liquido di tipo newtoniano)
32
La viscosità η è stata definita da Poiseuille come quella sorta di frizione che si crea tra le lamine di
liquido quando scorrono una sull’altra, quindi dipende dalle caratteristiche del liquido stesso.
η=τ/γ (dove τ rappresenta la forza di taglio e γ la velocità di taglio).
Per quanto riguarda la viscosità il sangue si comporta in modo diverso a seconda dei vasi in cui
scorre: all’interno dei grossi vasi possiamo considerare il sangue come un liquido omogeneo in cui
abbiamo una caratteristica parabola di velocità data dal flusso di tipo laminare e in questi vasi di
grosso calibro si osserva un accumulo assiale degli elementi corpuscolati del sangue, quindi il
plasma che si mantiene nelle zone periferiche a contatto della parete vasale ha una viscosità che
tende a rimanere costante. Se noi prendiamo in considerazione dei vasi più piccoli con calibro
inferiore ai 500μm si osserva un comportamento particolare: al diminuire del calibro vasale
diminuisce anche la viscosità. Il motivo per cui la viscosità si riduce non è ancora sicuro al 100%,
sono state fatte varie ipotesi, una di queste è per esempio, considerata questa disposizione assiale
degli elementi corpuscolati, quando abbiamo dei vasi di calibro più piccolo che si diramano da
questi vasi grossi avviene la cosiddetta scrematura dei globuli rossi.
Quando si arriva in corrispondenza dei capillari quindi quando i vasi hanno un diametro inferiore a
6μm la viscosità aumenta in maniera estremamente rapida perché la dimensione dei globuli rossi è
tale da occupare completamente il calibro del vaso capillare. Nei capillari più piccoli i globuli rossi
avanzano con un movimento a cingolo di carrarmato subendo delle deformazioni.
Infine la viscosità varia anche al variare della velocità del sangue perché al variare della velocità
modifica la tendenza dei globuli rossi ad impilarsi nei cosiddetti roleau.
33
Fisiologia, lezione del 29 novembre 2005
LA PRESSIONE DEL SANGUE
Per basse pressioni le pareti dei vasi non essendo rigide tendono a collabire; in corrispondenza della
pressione critica di chiusura (P.C.) il vaso si apre. Non bisogna considerare solamente la pressione
interna al vaso ma anche le pressioni esterne dovute ad esempio alla muscolatura delle arteriole che
tende a far chiudere il vaso e modifica il valore di P.C. Quando la pressione è al di sotto della
pressione critica di chiusura la resistenza aumenta all’infinito, quando si supera la P.C. la resistenza
tende progressivamente a scendere fino ad assumere un andamento costante quando il vaso è
completamente aperto.
La pressione che determina il flusso è la pressione di spinta o perfusione dipendente dal lavoro del
cuore.
Dobbiamo prendere in considerazione un’altra pressione all’interno dei vasi che è la cosiddetta
pressione transmurale e viene definita come la differenza tra la pressione interna del vaso e la
pressione esterna. La differenza tra queste due pressioni condiziona la distensione delle pareti dei
vasi, per cui se la pressione all’interno del vaso è molto maggiore della pressione dell’ambiente
circostante la pressione transmurale tende ad aumentare e questo causerà un aumento del calibro
vasale; viceversa se la pressione esterna cresce tenderà a restringere il calibro dei vasi e a far
diminuire quindi la pressione transmurale. Questa pressione transmurale va tenuta in considerazione
in quanto può modificare il flusso del sangue all’interno dei vasi non tanto perché lo determina
direttamente (il flusso dipende dalla pressione di perfusione) ma in quanto, modificando il calibro,
può modificare la resistenza. Saranno soprattutto le vene che possono risentire le variazioni di
pressione transmurale e modificare in maniera significativa il proprio calibro.
Un’altra legge da prendere in considerazione è la cosiddetta legge di Laplace.
La legge di Laplace mette in relazione la tensione a livello delle pareti con la pressione all’interno
dell’organo; questa legge si applica in maniera differente a seconda della forma dell’organo preso in
considerazione. La legge di Laplace dice che la pressione distendente è uguale alla tensione delle
pareti fratto il raggio dell’organo.
Legge di Laplace: p=t/r
Formula generale per un viscere a pareti sottili: p=t(1/r1+1/r2)
Nel caso di organo sferico [r1=r2]: p=2t/r
Nel caso di organo cilindrico [r2 → ∞]: p=t/r1
La resistenza è quella forza che si oppone al flusso e perciò deve essere vinta dalla pressione per
determinare il flusso. Noi possiamo definire una unità empirica di resistenza che può essere
considerata come quella resistenza che richiede il consumo di 1mmHg per determinare un flusso
pari a 1ml/s (RS). Se consideriamo nel complesso tutto il sistema circolatorio possiamo definire una
resistenza periferica totale (RPT) che sarà data dalla differenza di pressione tra il letto arterioso e il
letto venoso in mmHg (differenza pari a circa 90mmHg) fratto il flusso che corrisponde a circa
90ml/s
RPT=90mmHg / 90ml/s = 1 Questa resistenza periferica totale è data dalla somma di tutte le
resistenze che sono offerte al flusso del sangue in tutto il nostro organismo, quindi risulterà dalla
somma delle resistenze dei circoli distrettuali posti in parallelo e delle resistenze dei vasi che
all’interno di ogni circolo distrettuale sono posti in serie.
Abbiamo due circoli distrettuali come il cutaneo e il muscolo-scheletrico che di base hanno un
elevato valore di resistenza periferica, quindi se noi abbiamo bisogno di ridurre la resistenza
causeremo prevalentemente una vasodilatazione a questo livello; viceversa se abbiamo bisogno di
aumentare la resistenza andremo a determinare una vasocostrizione in quei distretti che hanno
34
normalmente una resistenza molto bassa, quindi a livello del distretto epato-portale e a livello del
distretto renale.
All’interno del letto arterioso la pressione del sangue è di tipo pulsatile. Le arterie grazie alle loro
pareti elastiche trasformano la pressione da pulsatile a uniforme facendo diventare il flusso
continuo. Perciò man mano che ci si allontana dal cuore il flusso diventa sempre più di tipo
continuo e diminuisce la differenza tra pressione sistolica e pressione diastolica.
Noi parliamo di pressione arteriosa media per indicare il valore di pressione che mediamente c’è
all’interno del letto arterioso durante tutto il ciclo cardiaco. Tuttavia la media aritmetica dei valori ci
darebbe un valore di pressione errato in quanto la diastole ha una durata maggiore rispetto alla
sistole; la pressione media viene calcolata perciò con la seguente formula:
Pm = Pd + 1/3(Ps − Pd) (dove con ‘d’ si indica diastolica e con ‘s’ sistolica)
Come facciamo a misurare la pressione arteriosa? La pressione arteriosa può essere misurata con
due metodi fondamentalmente. Uno è un metodo diretto che prevede l’introduzione di un catetere
all’interno del circolo arterioso e la connessione di questo catetere direttamente con un manometro,
un misuratore di pressione; questo tipo di misurazione si effettua nel caso in cui il paziente debba
essere monitorato in maniera continua e particolarmente accurata (sicuramente un paziente
ospedalizzato). Un secondo metodo, indiretto, si effettua tramite lo sfigmomanometro.
La pressione arteriosa è un parametro che può modificare nel tempo non solo in condizioni
patologiche, ma anche per effetto dell’invecchiamento delle arterie, per cui invecchiando il soggetto
le arterie perdono parte della loro elasticità e quindi parte della loro distensibilità e diventano più
rigide e quindi il valore della pressione all’interno del vaso tende ad aumentare.
Il distretto capillare riveste un ruolo centrale dal punto di vista funzionale in quanto è solamente a
livello del letto capillare che avvengono gli scambi tra il sangue e i tessuti. Il distretto capillare ha
una organizzazione abbastanza differente a seconda dei tessuti in cui noi lo prendiamo in
considerazione, comunque in genere abbiamo l’arteriola che porta il sangue a livello del letto
capillare e in uscita la venula che raccoglie il sangue in uscita. dall’arteriola parte un vaso, la
cosiddetta metarteriola, che presenta una gran muscolatura liscia e dalla metarteriola parte un vaso
che inizialmente presenta ancora muscolatura liscia che poi perde distalmente essendo rivestito
esclusivamente da endotelio, questo vaso prende il nome di canale preferenziale. Questo canale
preferenziale è il canale attraverso cui ad es. nel distretto muscolare passa il sangue in condizioni di
riposo; gli scambi tra sangue e tessuti avvengono nella parte distale del canale preferenziale. Dal
canale preferenziale si dipartono in genere ad angolo retto dei vasi che sono i cosiddetti capillari
veri che in condizioni basali sono chiusi da strutture muscolari che sono i cosiddetti sfinteri
precapillari. Solo in particolari condizioni, per aumento delle richieste del tessuto gli sfinteri
precapillari si apriranno e il flusso sarà deviato o comunque entrerà anche nei capillari veri.
I vasi capillari sono costituiti da cellule endoteliali che poggiano su una membrana basale, tra una
cellula endoteliale e l’altra ci sono delle giunzioni che possono avere una maggiore o minore
permeabilità. Rispetto a questo parametro possiamo differenziare: 1.vasi con endotelio continuo
dotati di una permeabilità relativamente bassa; 2.vasi con endotelio fenestrato (presentano una
discontinuità tra le cellule endoteliali ma continuità nella membrana basale- es. circolo intestinale,
circolo renale); 3.vasi discontinui (non solo le cellule endoteliali presentano delle giunzioni lasse tra
loro, ma è interrotta anche la membrana basale- es. sinusoidi epatici).
Il circolo celebrare presenta una permeabilità particolarmente bassa favorita dalla barriera
ematoencefalica.
35
Per quanto riguarda i processi che avvengono a livello del letto capillare per il cosiddetto scambio
sono di due tipi: -processi attivi tramite vacuoli (pinocitosi, fagocitosi)
-processi passivi: -tramite gradiente di concentrazione e gradiente di pressione.
Quantitativamente sono molto più importanti gli scambi tramite un gradiente di concentrazione
rispetto al gradiente di pressione. Nel caso di scambio tramite gradiente di pressione il meccanismo
viene definito diffusione semplice e la sostanza presa in considerazione passa da un compartimento
all’altro purché ci sia una differenza di concentrazione. Le sostanze che passano sono prima di tutto
le sostanze liposolubili (O2, CO2,…) le quali diffondo sfruttando l’intera superficie della membrana;
poi ci sono le sostanze lipoinsolubili (Na+, K+,…) che passano attraverso canali della membrana
sfruttando perciò una superficie pari alla somma di tutte le aperture dell’endotelio (l’acqua passa
sfrottando un canale specifico per l’acqua che è l’acquaporina I).
Per quanto riguarda i passaggi per gradiente di pressione si parla di processo di filtrazione, in questo
caso c’è una pressione idrostatica che spinge il liquido da un compartimento all’altro. Questo
meccanismo è quantitativamente meno importante dello scambio per diffusione. Quali sono e
pressioni che possono determinare questo passaggio del liquido in un senso e nell’altro? Le
pressioni sono fondamentalmente due e sono: una la pressione del sangue (idrostatica) Pi e l’altra è
la pressione colloidoosmotica dovuta alla presenza delle proteine (oncotica) π. La pressione
oncotica tende a trattenere liquido nei vasi ed ha un valore di circa 25mmHg sostanzialmente
costante che potrà variare per modificazioni dell’attività epatica in quanto il fegato è responsabile
della sintesi delle proteine plasmatiche. L’altro parametro è la pressione idrostatica del capillare la
quale spinge ed è presente sia nel letto capillare si a nel liquido interstiziale. La pressione idrostatica
all’interno del vaso ha un valore che non rimane costante perché è la pressione che spinge il sangue
all’interno del vaso e man mano che il sangue procede all’interno del capillare si consuma pressione
per vincere la resistenza offerta dal capillare al flusso del sangue. Pi passerà perciò da un valore di
32mmHg a uno di 12mmHg. Man mano il sangue passa all’interno del capillare succede che in
bilancio tra le due pressioni π (che trattiene liquido) e Pi (che spinge fuori dal letto capillare il
liquido) si modifica per il variare della pressione idrostatica. All’estremità arteriolare del capillare
Pi>π quindi si ha l’uscita del liquido dal capillare (filtrazione); mentre all’estremità venulare del
capillare π>Pi quindi si ha movimento di liquido dal liquido interstiziale al letto capillare
(riassorbimento). In genere non c’è un perfetto equilibrio tra la quantità di liquido che fuoriesce e la
quantità di liquido che rientra e il liquido che esce in eccesso (circa 4litri/die) viene recuperato
attraverso i vasi linfatici per poi rientrare nel circolo sistemico a livello delle vene cave.
La pressione a livello dei capillari dipende dalla pressione venosa, dalla pressione arteriosa e dal
rapporto delle resistenze venulari e arteriolari come evidenziato dall’espressione di Pappenheimer:
Pc=[PA∙ (RV/RA)+PV]/
???
36
Fisiologia, lezione del 02 dicembre 2005
RITORNO VENOSO
Se la resistenza a livello venulare aumenta, c’è un aumento di pressione anche nel letto capillare;
mentre se aumenta la resistenza a livello arteriolare, si riduce la pressione nel letto capillare. Non
c’è mai un equilibrio perfetto tra la quantità di liquido che filtra e quindi abbandona il letto capillare
per passare nel liquido interstiziale e il liquido che dal tessuto interstiziale torna nel letto capillare,
ma c’è sempre una certa quantità di liquido che tende a non tornare nel letto capillare direttamente.
Il volume di questo liquido ammonta nel corso delle 24 ore a 2-4 litri, perciò 2-4 litri di plasma
filtrando non rientrano poi a livello del letto capillare ma tornano nel torrente circolatorio tramite il
sistema dei vasi linfatici. I vasi linfatici sono dei vasi che iniziano a fondo cieco come il dito di un
guanto, hanno la caratteristica di essere circondati da un monostrato di cellule piuttosto permeabile.
Occasionalmente si possono verificare delle condizioni in cui la filtrazione e quindi il passaggio di
liquido nel tessuto interstiziale aumenta, si forma una raccolta di liquido nel tessuto interstiziale che
dà origine a quello che prende il nome di edema. Edema si può osser4vare caratteristicamente a
livello degli arti inferiori, in particolare presso piedi e caviglie, durante lungi viaggi in aereo; edema
si può verificare anche in condizioni patologiche quali ad es. per insufficienza venosa cardiaca
congestizia in cui si verifica aumento della pressione a livello venoso; oppure nel caso di bloccho
del deflusso linfatico (linfedema) osservabile per processi infettivi o come conseguenza di
asportazione di linfonodi.
Meccanismi responsabili del ritorno venoso.
Il ritorno venoso è fondamentale per garantire la funzione del cuore. Le vene hanno pareti più
distendibili rispetto ai vasi arteriosi, questo fa sì che possano modificare più facilmente il loro
calibro a seconda della quantità di liquido che in esse è presente e a seconda della pressione
tessutale all’esterno di questi vasi venosi. La contrazione della muscolatura liscia nel distretto
venoso ha come effetto, modificando il calibro, quello di modificare la quantità di sangue, quindi il
volume di sangue contenuto nel distretto venoso, quindi una venocostrizione mobilizzerà una
maggiore quantità di sangue verso il cuore, mentre una venodilatazione al contrario farà sì che un
maggior volume di sangue venga accumulato nel distretto venoso. La muscolatura delle arterie
agendo sul calibro delle stesse modifica la resistenza al flusso e quindi la pressione del sangue.
Secondo il principio di Bernoulli l’energia totale di un liquido è data dalla somma di tre forme
diverse di energia: una è l’energia cosiddetta potenziale (PV) che deriva dalla contrazione del cuore,
responsabile dell’avanzamento del sangue; poi abbiamo un’energia che è detta gravitazionale (mgh)
che determina un movimento di liquido nel caso in cui due punti di un condotto siano posti ad
altezze differenti; infine abbiamo un’altra forma di energia che è la cosiddetta energia cinetica
(1/2mv2). Secondo Bernoulli in un liquido di tipo newtoniano che scorre in un condotto che sia
privo di resistenza l’energia totale è sempre la stessa, ci possono essere solo delle variazioni nei tipi
di energia.
ET = PV + mgh + 1/2mv2 Th. di Bernoulli (applicazione in caso di stenosi e aneurisma)
La forza di gravità modifica il valore pressorio. In posizione ortostatica vi è una riduzione della
pressione sanguigna di 0,73 mmHg/cm al di sopra del piano del cuore. Nei distretti al di sotto del
cuore questo valore di pressione va sommato.
La pressione di profusione, responsabile dell’avanzamento del sangue nel torrente circolatorio, non
cambia; il parametro che modifica è la pressione transmurale: un suo aumento, quindi un aumento
della pressione interna al vaso rispetto a quelle fuori dallo stesso, determina un aumento del calibro
vasale, questo si ripercuoterà in particolare sul distretto venoso (vasi con maggiore distensibilità
delle pareti). Questo può essere un ostacolo al ritorno del sangue al cuore.
37
Meccanismi che aiutano il ritorno del sangue al cuore.
- la differenza di pressione tra quella arteriosa media e la pressione all’interno dell’atrio di
destra (vis a tergo).
- pompa muscolare importante soprattutto nel soggetto in posizione ortostatica per aiutare il
ritorno del sangue dalle parti più inferiori del corpo (i vasi venosi sono a pareti distendibili e
possono essere facilmente compressi dai tessuti che li circondano, le vene di solito
decorrono tra un muscolo e l’altro, di conseguenza durante la contrazione muscolare la
contrazione del muscolo si ripercuote sui vasi venosi aumentando la pressione esterna sul
vaso e agevolando il ritorno del sangue.
- all’interno dei vasi venosi ci sono delle strutture che sono le cosiddette valvole venose a
nido di rondine che impediscono il reflusso di sangue garantendone l’unidirezionalità. Negli
arti inferiori il flusso venoso va dalle vene superficiali a quelle profonde. Per eccessiva
distensione delle vene i lembi valvolari potrebbero non ostacolare il reflusso di sangue
comportando una insufficienza venosa con formazione delle cosiddette vene varicose
evidenziabili come caratteristici rigonfiamenti delle vene superficiali.
- pompa respiratoria, può agire con due meccanismi differenti che partecipano
contemporaneamente: durante la inspirazione contraiamo il diaframma, la contrazione del
diaframma determina lo spostamento dello stesso verso il basso quindi fa sì che aumenti la
pressione a livello della cavità addominale con compressione dei vasi venosi (come avviene
a livello degli arti inferiori) e facilitazione del ritorno venoso del sangue; inoltre durante
l’inspirazione c’è una riduzione della pressione a livello toracico, quindi i grossi vasi venosi
che passano a livello del torace vengono distesi facilitando ulteriormente il ritorno venoso
del sangue al cuore.
- vis a fronte, forza aspirante: durante la sistole ventricolare c’è uno stiramento del setto
interventricolare verso il basso con diminuzione della pressione atriale e quindi richiamo di
sangue.
I vasi che si trovano al di sopra del piano cardiaco per effetto della forza di gravità hanno un valore
di pressione che è negativo, questo potrebbe essere un problema per la circolazione del sangue
perché le pareti tendono a collabire, tuttavia i vasi che si trovano all’interno della scatola cranica
sono adesi alla superficie ossea, quindi non possono collabire in realtà e rimangono distesi, possono
collassate i vasi che si trovano fuori dalla scatola cranica, infatti si può valutare anche da un punto
di vista clinico l’altezza a cui il vaso venoso collassa: ponendo il soggetto semi-sdraiato,
mantenendo la testa ad un angolo di circa 45° possiamo valutare l’aspetto delle vene giugulari che
normalmente non si vedono. Se la pressione venosa a livello dell’atrio aumenta queste vene si
gonfiano e diventano più appariscenti, noi possiamo misurare l’altezza in corrispondenza della
quale la vena si vede e questa distanza dal cuore ci permette di valutare la pressione venosa
centrale. Dato che la pressione che c’è nell’atrio di sinistra è circa 2mmHg corrispondenti ad una
altezza di 7cmH2O, se l’altezza misurata non corrisponde a 7cm ma è 8-10cm signfica che la
pressione venosa centrale è aumentata.
Compito del cuore e del circolo è quello di far arrivare ai vari tessuti la quantità necessaria di
ossigeno e nutrienti per le attività metaboliche, perciò a livello dei vari circoli distrettuali c’è la
possibilità di modificare il flusso in modo da adattare la quantità di sangue che arriva e quindi
adattare la quantità di ossigeno e i nutrienti necessari. Questo si può determinare modificando il
calibro dei vasi e in particolare il calibro delle arteriole che sono i vasi di resistenza che possono o
vasocostringersi o vasodilatarsi in modo da o ridurre o aumentare il flusso in quel particolare
distretto. In generale dobbiamo dire che il sistema vascolare è organizzato in modo da opporsi a
variazioni di flusso, quindi cerca di mantenere il più costante possibile il flusso attraverso un
determinato organo o tessuto; adattandosi però alle diverse esigenze del tessuto stesso.
Come si fa a variare il calibro? Il calibro viene variato grazie alla presenza di muscolatura liscia che
è presente nella parete vasale, più o meno sviluppata; muscolatura liscia che contraendosi determina
38
una riduzione di calibro. Nella contrazione della muscolatura si parla di accoppiamento elettromeccanico analogamente al muscolo scheletrico per cui ci sarà una variazione del potenziale di
membrana con apertura di canali del calcio voltaggio dipendenti. Nel muscolo liscio c’è anche un
meccanismo di accoppiamento farmaco-meccanico cioè può essere sufficiente la presenza di
sostanze di natura chimica con caratteristiche differenti per determinare l’apertura di canali del
calcio e innescare il meccanismo della contrazione.
La muscolatura liscia dei vasi rimane contratta per un tempo estremamente lungo ed è caratterizzata
da scarso affaticamento.
Il distretto arteriolare è caratterizzato da uno stato di contrazione tonica che prende il nome di tono
vasale, questo stato di contrazione tonica fa si che ci possano essere degli stimoli che possono
determinare un aumento di questa contrazione e quindi una vasocostrizione, ma ci potranno essere
anche degli stimoli che determinano un rilasciamento, una riduzione di questo tono vasale con
conseguente vasodilatazione. Per quanto riguarda il distretto venulare, in generale le venule hanno
uno scarso tono vasale e questo fa sì che su questa componente saranno più efficaci gli stimoli
vasocostrittori (venocostrizione) e saranno molto meno efficaci gli stimoli dilatanti e la dilatazione
della venula è dovuta soprattutto all’accumulo di sangue nel suo interno.
Non esiste una innervazione con azione vasodilatante, la vasocostrizione è a carico
dell’ortosimpatico. Non esiste un’innervazione parasimpatica dei vasi; la vasodilatazione si otterrà
per riduzione della scarica ortosimpatica.
Il tono basale si pensa essere una risposta della muscolatura liscia alla distensione delle pareti.
Sul calibro intervengono tre grosse categorie di fattori: i fattori locali, i fattori di tipo nervoso e i
fattori ormonali (fattori nervosi e ormonali possono essere definiti sistemici).
Tra i fattori locali ricordiamo il fattore metabolico di scambio tra tessuto e liquido interstiziale: le
arteriole immerse nel liquido interstiziale del tessuto stesso, le cellule del tessuto scambiano con il
liquido interstiziale vari tipi di sostanza quindi le sostanze passano indifferentemente dalla cellula
che lavora nel tessuto al liquido interstiziale. Il liquido interstiziale bagna queste arteriole. Saranno
le modificazioni nella composizione di questo liquido interstiziale che possono modificare il calibro
dei vasi. Le sostanze con effetto vasodilatante agiscono sulla muscolatura liscia dei vasi e fanno sì
che la muscolatura liscia dei vasi si rilasci, una volta che essa si rilascia aumenta il flusso di sangue
in questi vasi e, con l’aumento del flusso vi è l’eliminazione delle sostanze metaboliche che hanno
agito determinando la vasodilatazione (meccanismo di autocontrollo). Tra le sostanze che possono
intervenire sul calibro dei vasi ricordiamo: - l’ossigeno: riduzione [O2]→vasodilatazione,
aumento [O2]→vasocostrizione; l’anidride carbonica (CO2); l’idrogeno ione (H+); il potassio (K+).
A livello della muscolatura liscia ci sono dei canali per il potassio ATPdipendenti: in un tessuto che
sta lavorando se si verifica una riduzione del flusso (ipoperfusione) si riducono i livelli di ATP e
come conseguenza si aprono dei canali del potassio dipendenti dall’ATP (KATP); l’apertura di questi
canali facilita il passaggio del potassio dall’interno all’esterno della cellula con conseguente
iperpolarizzazione della cellula, iperpolarizzazione che determina la chiusura dei canali del calcio,
quindi riduzione dei livelli intracellulari del calcio e di conseguenza si riduce il livello di attivazione
della muscolatura, i vasi si dilatano ed infine aumenta il flusso ematico per soddisfare esigenze
metaboliche.
Alcuni tessuti durante l’attività metabolica formano adenosina, potente sostanza vasodilatante.
Dobbiam tener presente anche che oltre a questi fattori di tipo metabolico sono importanti anche dei
fattori che vengono rilasciati dall’endotelio: si è visto che l’acetilcolina applicata ai vasi ha un
effetto vasodilatante in condizioni normali, tuttavia se l’endotelio dei vasi risulti danneggiato
l’effetto dell’acetilcolina non è più vasodilatante ma è di tipo vasocostrittore; ciò significa che c’è
qualcosa che viene liberato dall’endotelio e media la risposta nell’effetto vasodilatante in questo
caso. Questo fattore vasodilatante era stato indicato come il fattore rilasciante prodotto
dall’endotelio (EDRF) ed è stato scoperto in seguito che si tratta dall’ossido nitrico (NO) che si
forma all’interno delle cellule endoteliali a partire dall’arginina in risposta a vari tipi di stimoli, per
esempio l’acetilcolina, la bradichinina e anche la forza di taglio quindi quella tensione che viene
39
esercitata dal flusso di sangue sulle cellule endoteliali stesse. Questi vari fattori hanno come effetto
quello di attivare l’enzima che è la ossido nitrico sintetasi determinando la formazione di NO. L’NO
è liposolubile e passa facilmente dalla cellula endoteliale, dove si è formato, alla cellula della
muscolatura dove determina l’attivazione della guanilil-ciclasi con aumento della concentrazione
intracellulare dl GMPc il quale causa poi vasodilatazione. Sembra che ci sia una produzione basale
di NO responsabile del mantenimento di un determinato tono basale della muscolatura liscia dei
vasi. Ci sono altre sostanze prodotte dalle cellule endoteliali, per esempio le prostaglandine, i
trombossani provenienti da una sostanza comune che l’acido arachidonico tramite il processo di
cicloossigenasi. Le prostaglandine hanno effetto duplice: esse si liberano nel corso di processi
infiammatori e la somministrazione di un farmaco che è l’acido acetilsalicilico che riduce la sintesi
delle prostaglandine ha come effetto la riduzione della risposta infiammatoria; al cune
prostaglandine vengono liberate invece dalle piastrine durante le risposte di tipo vasocostrittore e
aggregante piastrinico, risposte vasali alla lesione tissutali, quindi sono fattori importanti nei
processi di emostasi.
L’acido arachidonico può determinare la formazione di altre sostanze sempre con azione vasoattiva,
i leucotrieni, nel caso in cui venga metabolizzato da enzimi del tipo lipoossigenasi.
40
Fisiologia, lezione del 12 Gennaio 2006
CONTROLLO DEL CALIBRO VASALE
Per controllo del calibro basale si intende la possibilità di modificare il calibro dei vasi in modo di
innanzitutto adeguare il flusso ai vari organi a seconda delle necessità degli organi stessi ed inoltre
controllare la costanza di alcuni parametri emodinamici come ad esempio la pressione arteriosa. Ci
sono tanti meccanismi che collaborano al controllo del calibro vasale. Quando noi parliamo di
calibro vasale ci riferiamo anzitutto alle arteriole che sono i vasi del distretto circolatorio
maggiormente dotati di muscolatura liscia e che poi immettono nei vasi di scambio che sono i
capillari, quindi una modificazione del calibro delle arteriole comporta una modificazione del flusso
a livello del sistema capillare, quindi a livello del sistema di scambio. Modificazioni del calibro si
hanno anche a livello del distretto venoso, esse modificheranno più che il flusso a livello
dell’organo o la pressione arteriosa, la quantità di sangue che circola all’interno del sistema
circolatorio.
Esistono dei fattori locali che possono modificare il calibro dei vasi a seconda della attività
metabolica del tessuto, in quanto il tessuto che lavora modifica la composizione sia ematochimica
del sangue (ossigeno, anidride carbonica, idrogeno ioni) e produce altre sostanze che sono dette
vasoattive in quanto possono possono determinare vasodilatazione o eventualmente anche
vasocostrizione. Quando il tessuto lavora c’è un aumento di queste sostanze ad azione vasodilatante
che agiscono sulla muscolatura liscia dei vasi determinando la vasodilatazione e come conseguenza
ci sarà un aumento del flusso che avrà il significato di apportare una maggiore quantità di sangue
richiesto dal tessuto e nel contempo allontanare le sostanze ad azione vasodilatante e questo farà sì
che il calibro dei vasi, al termine dell’attività lavorativa, ritorni alla situazione di partenza. Non
esiste una sostanza metabolica che sia vasodilatante per eccellenza. Abbiamo poi detto anche che ci
sono sostanze che vengono prodotte dalle cellule endoteliali, in particola re la sostanza con azione
vasodilatante principale è l’ossido nitrico (NO) che viene liberato dalle cellule endoteliali per
effetto di vari tipi di stimoli (tensione radente del flusso sull’endotelio, acetilcolina, bradichinina).
L’NO è prodotto a partire dall’arginina e diffonde liberamente dalla cellula endoteliale alla
muscolatura liscia e qui determina la attivazione della guanilil ciclasi con formazione del GMPc,
l’aumento del GMPc è il messaggero responsabile poi della vasodilatazione. L’endotelio non
produce però solamente sostanze ad azione vasodilatante ma anche ad azione vasocostrittoria come
ad esempio l’endotelina I. Sostanze come le prostacicline e i trombossani
41