Amino Acidi: Definizione
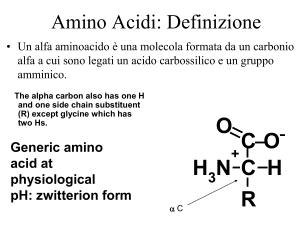
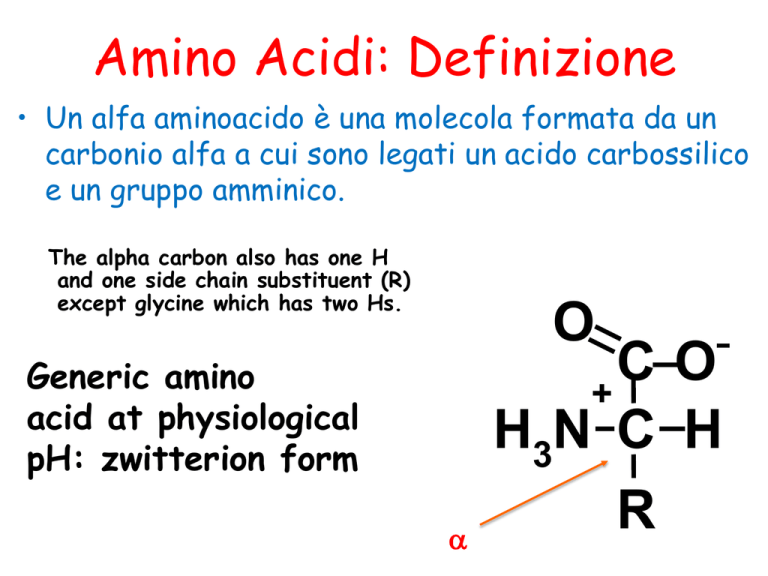
• Un alfa aminoacido è una molecola formata da un
carbonio alfa a cui sono legati un acido carbossilico
e un gruppo amminico.
The alpha carbon also has one H
and one side chain substituent (R)
except glycine which has two Hs.
O
Generic amino
acid at physiological
pH: zwitterion form
a
C
O
+
H3N C H
R
• If the R group is not H, the AA can exist in
two enantiomeric forms (mirror images)
O
C
+
H3N
a carbon
C
R1
L
O
H
O
H
Mirror plane
O
C
C
R1
D
+
NH3
AMMINOACIDI
Struttura degli amminoacidi
• Ogni amminoacido (eccetto la prolina)
possiede un carbonio centrale, chiamato
carbonio a, al quale sono legati quattro
differenti gruppi:
• un gruppo amminico basico (-NH2)
• un gruppo carbossilico acido (-COOH)
• un atomo di idrogeno (-H)
• una catena laterale, diversa per ciascun
amminoacido (-R)
Gli aminoacidi
Gruppo
acido
Idrogeno
Gruppo
amminico
Radicale
Carbonio
Anatomia di un amminoacido.
Ad eccezione della prolina e dei suoi derivati, tutti gli amminoacidi che si trovano
comunemente nelle proteine possiedono questo tipo di struttura.
Abbreviazioni e simboli degli α-amminoacidi
• Tutti gli amminoacidi (tranne la glicina) hanno
l’atomo di carbonio a legato a quattro gruppi
diversi: il carbonio a (asimmetrico) è quindi
un centro chiralico o otticamente attivo
• Gli amminoacidi che hanno un centro
asimmetrico nel carbonio a possono esistere
in due forme speculari (D ed L) dette
stereoisomeri, isomeri ottici o enantiomeri
• Le proteine contengono solo L- amminoacidi
Champe et al., Le basi della biochimica, Ed. Zanichelli
Quando un amminoacido viene sciolto in H2O
diventa uno ione dipolare (zwitterione) che può
agire sia come acido (donatore di protoni) che
come base (accettore di protoni)
Le sostanze che hanno questa doppia natura si
definiscono anfòtere o anfoliti.
Al pH fisiologico (valore attorno a 7,4) tutti gli
amminoacidi hanno:
• il gruppo carbossilico dissociato, cioè
si forma lo ione negativo carbossilato: -COO• il gruppo amminico protonato, cioè si forma lo
ione: -NH3+
Champe et al., Le basi della biochimica, Ed. Zanichelli
• Oltre alla parte funzionale, comune a tutti, ogni
amminoacido presenta un gruppo -R proprio
• La natura del gruppo -R conferisce proprietà
diverse a ciascun amminoacido
• Punto isoeletrico (pI): è il valore di pH al quale
un amminoacido ha carica netta 0 cioè è
elettricamente neutro.
Il pI è una caratteristica di ogni singolo
amminoacido
• Nelle proteine quasi tutti i gruppi carbossilici e
amminici degli amminoacidi sono uniti in legami
peptidici
• Le proprietà di ciascun amminoacido dipendono
dalle catene laterali (-R) che sono i gruppi
funzionali responsabili della struttura, delle
funzioni e della carica elettrica delle proteine
• Ciò che sostanzialmente determina il ruolo di un
amminoacido in una proteina è la natura della
catena laterale (-R)
La cisteina può formare ponti disolfuro
• Gli amminoacidi possono essere classificati in base
alle proprietà delle loro catene laterali (-R),
considerando la loro polarità o non polarità al pH
fisiologico e quindi la tendenza ad interagire con
l’acqua
• Gli amminoacidi con catene laterali cariche,
idrofiliche, sono generalmente esposti sulla
superficie delle proteine
• I residui idrofobici, non polari, si trovano in
genere all’interno delle proteine, protetti dal
contatto con l’acqua
Amminoacidi con gruppi -R alifatici
(non polari)
• Glicina, alanina, valina, leucina, isoleucina, metionina,
prolina.
• Le loro catene laterali sono costituite da una catena
idrocarburica satura: sono idrofobici.
• La metionina è uno dei due amminoacidi contenenti
zolfo.
• La prolina ha una caratteristica struttura ad anello,
formato dalla catena laterale e dal suo gruppo
amminico, e differisce dagli altri amminoacidi
perché contiene un gruppo imminico (R-NH-R’).
E’ solo moderatamente polare.
Champe et al., Le basi della biochimica, Ed. Zanichelli
Amminoacidi con gruppi -R
aromatici
•
•
•
•
Fenilalanina, tirosina, triptofano
Le loro catene laterali sono aromatiche
Sono relativamente non polari (idrofobici)
Possono partecipare tutti ad interazioni
idrofobiche
• I gruppi -OH della tirosina ed NH del triptofano
possono formare legami a idrogeno
Amminoacidi aromatici
Ionizzabile
Non polare
Non polare
Amminoacidi con gruppi -R polari,
non carichi
• Serina, treonina, cisteina, asparagina, glutammina
• Sono polari ma in condizioni fisiologiche sono privi
di carica elettrica.
• I loro gruppi -R sono più idrofilici di quelli degli AA
non polari: contengono gruppi funzionali che
formano legami idrogeno con l’acqua.
• La polarità di serina e treonina è dovuta al gruppo
ossidrilico (-OH), quella della cisteina al gruppo
sulfidrilico (-SH), quella di asparagina e glutammina
ai gruppi ammidici (-CONH2), dove sia la porzione
carbonilica che quella amminica possono entrare in
gioco.
Amminoacidi con gruppi -R carichi
positivamente (basici)
• Lisina, arginina, istidina
• Sono accettori di protoni
• Le loro catene laterali, contenenti gruppi
amminici, a pH fisiologico sono ionizzate ed
hanno carica positiva
• L’istidina è debolmente basica (pKa = 6,0)
ed a pH fisiologico l’amminoacido libero è in
gran parte non ionizzato; quando si trova
incorporata in una proteina può recare una
carica positiva o essere neutra (proprietà
molto importante!)
Struttura degli amminoacidi
Amminoacidi polari con carica
Si dispongono
all’esterno della
molecola proteica
a contatto con il
solvente
*
H
Amminoacidi con gruppi -R carichi
negativamente (acidi)
• Acido aspartico, acido glutammico
• Sono donatori di protoni.
• I gruppi carbossilici delle loro catene laterali, al pH
fisiologico, sono ionizzati ed hanno carica negativa.
PROTEINE ACIDE E BASICHE
Le proteine nelle quali il rapporto:
(lys + arg ) / (asp + glu ) >1
sono basiche.
Le proteine nelle quali tale rapporto:
(lys + arg ) / (asp + glu ) <1
sono acide
Struttura degli amminoacidi
Amminoacidi con caratteristiche particolari
Champe et al., Le basi della biochimica, Ed. Zanichelli
Dal punto di vista biochimico gli amminoacidi si
possono classificare in:
• Essenziali: quegli AA che una determinata specie non è in
grado di sintetizzare (o li sintetizza in quantità non
sufficienti *);
- devono essere introdotti con la dieta
- Phe, Val, Thr, Try, Ile, Met, Leu, Lys, His*, Arg*
Cys *Tyr *
(* sono necessari nella dieta solo durante lo stadio
giovanile di crescita)
• Non essenziali: quegli AA che una determinata specie è
in grado di sintetizzare.
neutri apolari (senza carica e idrofobici).
E
Ec
E
E
E
E
Ec
E
Ec
E= essenziale (non sintetizzabile dall’organismo umano da assumere con
la dieta
Ec = condizionatamente essenziale (la biosintesi nell’uomo non è
sufficiente)
neutri polari (senza carica e idrofilici);
E
Ec
Ec
*
Ec
*
E
Ec
E
Questa struttura ionica è in
accordo
I punti di fusione elevati (glicina
233°C)
Solubilità relativamente basse
nei solventi organici
O
C
O
+
H3N C H
R
Proprietà elettriche degli aa ai
diversi valori di pH
Amminoacido generico
a pH fisiologico : zwiterione
Non ha una carica netta
Unico Aa che
può funzionare
da tampone
L’unico Aminoacido che può funzionare da tampone è l’istidina
peptidi, polipeptidi e proteine
IMP!!! Deve
essere un
derivato acilico
legami peptidici
Avvengono tra il gruppo
carbossilico attivato di
un Aa e il gruppo
amminico di un altro Aa
Non è così anche se il
risultato finale è questo
esistono sequenze lunghe da pochi aminoacidi a migliaia di aminoacidi con peso
molecolare da 5 a 1000 KDalton (1 Dalton = 1/12 massa 12C)
# aminoacidi
peptide (oligopeptide)
<20
polipeptide
<60
proteina
>60
IMPORTANTE !!!
In realtà il legame peptidico si forma tra il gruppo carbossilico attivato
(a estere) di un aminoacido e il gruppo aminico di un altro aminoacido
(estere + ammina = amide + alcol)
Tutti i testi generalizzano questa reazione perché considerano la somma
delle reazioni che sono:
Acido + alcol = estere + acqua
Estere + ammina = amide + alcol
Tot
Acido + ammina = ammide + acqua
Ma è fondamentalmente un errore perché
un acido + una base = sale + acqua
In natura abbiamo infatti
Gli aminoacidi sono legati da un legame amidico
Gruppo carbossilico attivato
Questa tabella riporta i 20 amminoacidi ordinari ed i codoni che li codificano
acronimo iniziale codone
nome
acronimo iniziale codone
nome
Ala
A
GCU, GCC,
GCA, GCG
alanina
Leu
L
UUA, UUG,
CUU, CUC,
CUA, CUG
leucina
Arg
R
CGU, CGC,
CGA, CGG,
AGA, AGG
arginina
Lys
K
AAA, AAG
lisina
Asn
N
AAU, AAC
asparagina
Met
M
AUG
metionina
Asp
D
GAU, GAC
aspartico
Phe
F
UUU, UUC
fenilalanina
Cys
C
UGU, UGC
cisteina
Pro
P
CCU, CCC,
CCA, CCG
prolina
Gln
Q
CAA, CAG
glutammina
Ser
S
UCU, UCC,
UCA, UCG,
AGU, AGC
serina
Glu
E
GAA, GAG
glutammico
Thr
T
ACU, ACC,
ACA, ACG
treoninba
Gly
G
GGU, GGC,
GGA, GGG
glicina
Trp
W
UGG
triptofano
His
H
CAU, CAC
istidina
Tyr
Y
UAU, UAC
tirosina
Ile
I
AUU, AUC, AUA isoleucina
Val
V
GUU, GUC,
GUA, GUG
valina
AUG, GUG
stop
start
UAG, UGA,
UAA
Ogni tRNA ha legato a se un Aa con legame estere (il gruppo
carbossilico dell’Aa reagisce con l’OH del ribosio formando un
estere e poi reagisce con l’Aa dell’altro tRNA formando il
legame peptidico)
Questa è la
reazione
tRNA
P site
O
O
O
P
A site
tRNA
O CH2
O
H
O
O
Adenine
O
H
H
O
H
OH
C
O
P
O
O CH2
H
O
O
H
H
O
H
OH
C
HC R
HC R
NH
:NH2
C
HC R
NH3+
Adenine
tRNA
P site
O
O
O
P
O
The nascent
polypeptide,
one residue
longer, is now
linked to the
tRNA in the A
site.
A site
tRNA
O CH2
H
Adenine
O
H
H
OH
H
OH
O
P
O
O CH2
H
O
O
H
H
O
H
OH
C
HC R
Così si allunga
la catena
peptidica
NH
O
C
HC R
NH
O
Adenine
C
HC R
NH3+
Ripercorriamo il processo con qualche passaggio in più
Pro
1) Metionina nel
sito P e prolina in
arrivo
Met
Met
2) Arriva la prolina e si
lega con la metionina
Pro
GGC
UAC
UAC GGC
AUG CCG UAU GCU CUU UAA
AUG CCG UAU GCU CUU UAA
P
A
Met
P
Pro
3) Il tRNA presente
nel sito P si stacca
dalla metionina e si
allontana
A
Thr
Met
Pro
UAC
4) Il ribosoma,
scorrendo lungo il
filamento di mRNA,
sposta il tRNA con
la catena proteica in
allungamento dal
sito A al sito P
AUA
GGC
AUG CCG UAU GCU CUU UAA
P
A
GGC
AUG CCG UAU GCU CUU UAA
P
A
The Peptide Bond
The peptide bond is rigid and planar due to partial
double bond between C & N from resonance between
structures shown below.
C
a
O
H
C N
Ca
C
H
+
a
C N
Ca
- O
The Peptide Bond
Peptide bond is usually in trans conformation to
prevent crowding between R groups, except for Gly.
C
a
O
R1
H
C N
Ca
trans R
2
C
a
O
R1 R2
C N
Ca
H
cis
The peptide bond
The 6 atoms of the peptide group are co-planar.
The C-N bond can’t rotate due to double-bond
character.
Peptides
• The dihedral angles between
adjacent peptide groups restrict
protein conformations; only a
narrow range of F (fi) and Y (psi) (
angles are allowed).
Il singolo legame C-N infatti si comporta
per il 40% come un doppio legame, esso è
perciò rigido e non può ruotare
liberamente, limitando notevolmente i vari
tipi di conformazioni proteiche possibili.
Vi sono tuttavia altri due legami interni
agli aminoacidi che invece possono
ruotare liberamente, essi sono:
il legame C-C di un aminoacido, il
quale forma un angolo di rotazione
detto "psi" e e il legame N-C di un
altro aminoacido, con angolo di
rotazione "phi".
Legame amidico
F
Y
Ψ
Φ
Definizione degli angoli di rotazione (,)
Gli angoli
e
possono
ruotare
Catena polipeptidica
La rotazione
dipende
dall’ingombro
sterico dei
gruppi R
Legame peptidico:
possibili rotazioni degli altri legami
Ramachandran plot shows which & Y
angles are allowed for proteins
La conformazione degli atomi
di una catena polipeptidica è
perciò determinata dalla coppia
di angoli psi e phi di ciascun
aminoacido, i quali possono
ruotare fino a quando le
rispettive catene laterali degli
aminoacidi non entrano in
collisione tra loro.
Per prevedere gli angoli di
legame, si utilizza il grafico di
Ramachandran (vedi figura) in
cui ciascun punto rappresenta
una coppia osservata di angoli
psi e phi di una proteina.
Questa libertà di
conformazione permette così
alla catena polipeptidica di
ripiegarsi fino a formare
notevoli strutture regolari
Per motivi di reciproco ingombro sterico dei grossi gruppi laterali R e
affinché sia ottimizzata la stabilizzazione del peptide attraverso la
formazione di legami H intracatena, gli angoli ψ e F possono assumere
solo determinati valori.
La conformazione della catena polipeptidica è definita da questi valori.
Riportando in un grafico ψ in funzione del
corrispondente F , si ottiene il cosiddetto
grafico di Ramachandran (dal nome del
biofisico indiano che effettuò i calcoli sui
valori consentiti delle coppie degli angoli di
rotazione), in cui si individuano 3 regioni ben
definite corrispondenti alle coppie di valori
consentiti.
Le regioni sono definite β, α e L e
corrispondono rispettivamente a strutture β,
α-eliche destrorse e α-eliche sinistrorse.
In queste restrizioni non rientra la glicina
che, avendo un H come gruppo R, e quindi un
limitato ingombro sterico, può assumere angoli
non consentiti ad altri amminoacidi. La glicina
può così avere un ruolo importante nella
struttura proteica, potendo far assumere alla
catena angolazioni "insolite".
Oltre alle proprietà specifiche dei legami intraaminoacidici, vi sono
un insieme di forze deboli (non covalenti) che guidano il processo di
ripiegamento della proteina nella sua conformazione nativa; questi
legami sono: legami H, legami ionici, attrazioni di Van der Waals...
La stabilità complessiva della struttura dipende dalla somma delle
suddette forze agenti.
Durante il processo di ripiegamento, detto "folding proteico", la
driving force che guida l'intero processo è rappresentato dalle
proprietà idrofobiche delle catene laterali di alcuni aminoacidi che in
soluzione tendono spontaneamente a disporsi lontano dalla fase
acquosa, per ridurre al minimo l'energia totale del sistema.
Si ha così che i gruppi idrofobici degli aminoacidi come fenilalanina,
leucina, valina e triptofano tendono a raggrupparsi internamente alla
struttura proteica, mentre gli altri aminoacidi polari come arginino
glicina e istidina presenti nella catena tendono a porsi sulla
superficie della struttura, a diretto contatto con l'acqua (o altri
solventi polari) dove stabiliscono legami idrogeno.
In termini energetici le proteine tendono sempre a disporsi in
conformazioni con livelli di energia libera minimi (G°).
Applicazione del grafico di Ramachandran
Physiologically Interesting Small Peptides
NOME
MANIFESTAZIONE da carenza di singoli aminoacidi nell'uomo
Cistina
Cisteina
Necrosi e atrofia epatica, lesioni cutanee, tendenza agli edemi ed alle
infezioni.
Fenilalanina
Tirosina
Alterazioni della funzionalità tiroidea e surrenalica, anomalie
pigmentarie, anemia.
Isoleucina
Treonina
Alterazione dell'assorbimento dell'azoto esogeno con ipoproteinemia,
edemi, calo ponderale.
Istidina
Anemia, cataratta.
Leucina
Atrofia del fegato, testicoli, timo, surreni, ipofisi, cheratite.
Ipoproteinemia, proteinemia.
Lisina
Ritardato accrescimento staturo-ponderale, inibizione ossificazione
delle epofisi, modificazioni del ciclo mestruale, della lattazione,
dell'attività sessuale, anemia.
Metionina
Degenerazione grassa del fegato, cirrosi, diminuita resistenza alle
sostanze tossiche, anemia, cheratite, lesioni renali, atrofia muscolare,
ipoproteinemia, alopecia.
Aa molto importanti in biochimica sono:
•
•
•
•
•
•
•
•
•
Serina,
treonina,
tirosina,
lisina,
arginina,
istidina,
aspartico,
glutammico e
cisteina
oltre a saperli identificare per le loro caratteristiche