Primo principio- 1 -
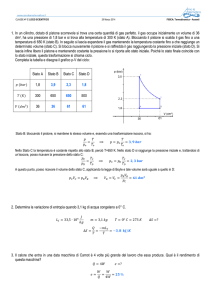
TERMODINAMICA
ENERGIA INTERNA DI UN SISTEMA
Ad ogni sistema fisico possiamo associare varie forme di energia, l’energia cinetica delle
molecole di cui è formato, energia potenziale, etc, etc. La somma di tutte queste forme di
energia che il sistema possiede prende il nome di energia interna del sistema fisico. In un
sistema termodinamico, cioè in un sistema nel quale avvengono trasformazioni di calore in
lavoro e viceversa, parte di questa energia è energia utile o energia libera, cioè energia che
può essere direttamente trasformata in lavoro verso l’esterno.
L’energia interna dipende dallo stato in cui il sistema si trova. Per esempio, in un sistema
termodinamico come una massa d'acqua contenuta in una pentola. l'energia interna dipende
dal volume, dalla pressione e dalla temperatura dell’acqua. Se riscaldiamo, raffreddiamo o
mescoliamo l'acqua, l'energia interna varia. Ma ritorna ad avere il valore iniziale quando il
volume, la pressione e la temperatura riassumono i valori di partenza. Questa proprietà
si esprime dicendo che l'energia interna è una funzione di stato.
Ciò significa che a ogni stato in cui si trova il sistema corrisponde uno e un solo valore
dell'energia interna.
Nel caso di un gas perfetto, siccome l’interazione tra le molecole è trascurabile, quindi non
c’è energia potenziale, l'energia interna coincide con la somma delle energie cinetiche delle
molecole. Anche nel caso di un gas reale che si trovi nelle condizioni di gas ideale (alta
temperatura e volume occupato molto più grande del volume complessivo delle molecole che
lo compongono) l'energia interna è praticamente solamente l’energia cinetica complessiva
delle molecole.
L’ENERGIA CINETICA DELLE MOLECOLE DI UN GAS E LA TEMPERATURA
Ogni molecola ha in media un'energia cinetica
EC
3
kT
2
dove k è la costante di Boltzmann e T è la temperatura assoluta del gas; se un gas è formato da
N molecole la sua energia cinetica complessiva, che è anche la sua energia interna, sarà:
3
NKT
2
L'energia interna di una certa quantità di gas perfetto dipende quindi soltanto dalla
temperatura, cioè da una sola delle tre grandezze che caratterizzano lo stato del gas;
queste tre grandezze sono la pressione P, il volume V e la temperatura T.
U NEC
VARIAZIONI DELL’ENERGIA INTERNA
In Termodinamica non è importante conoscere il valore dell’energia interna di un sistema. Ciò
che interessa è quanto essa varia, mentre il sistema passa da uno stato A a uno stato B. Se a
questi stati corrispondono rispettivamente le energie interne UA e UB la variazione di U U è
uguale a:
U = UB UA.
Primo principio- 2 -
Poiché l'energia interna è una funzione di stato, siamo certi che U dipende solo dallo
stato finale B e da quello iniziale A. Non dipende invece dalla particolare trasformazione
che compie il sistema per passare da A a B, cioè dalla particolare curva che rappresenta
la trasformazione nel diagramma pressione-volume.
La variazione di energia interna è legata agli scambi di energia (sotto forma di calore e di
lavoro) che il sistema ha con l'ambiente che lo circonda. Se il sistema assorbe calore, la sua
energia interna aumenta. Lo stesso accade se l'ambiente compie un lavoro sul sistema. Per
esempio, possiamo aumentare l'energia interna di una massa d’acqua sia riscaldandola sia
mescolandola con un sistema di palette (esperienza di Joule); in quest'ultimo caso l'ambiente
esterno compie un lavoro positivo sul sistema.
Invece, l'energia interna diminuisce quando il sistema cede calore oppure compie un lavoro
sull'ambiente esterno.
PRIMO PRINCIPO DELLA TERMODINAMICA
Un sistema fisico dal punto di vista della termodinamica è un sistema che può, a seconda
dei casi:
1. Ricevere calore dall’ambiente circostante (esterno);
2. Produrre lavoro verso l’esterno;
3. Fornire calore all’esterno;
4. Ricevere lavoro dall’esterno;
Chiamiamo +Q la quantità di calore che il sistema riceve dall'esterno. Q è negativo lo cede
all'ambiente.
Con - L indichiamo il lavoro che l'ambiente compie sul sistema; è il sistema che compie un
lavoro sull'ambiente esterno. Per esempio, nel caso dell'espansione di un gas L è negativo.
Se L è positivo (+L) il lavoro è compiuto sul sistema, che acquista così energia dall'esterno.
Primo principio- 3 -
Possiamo ora scrivere il bilancio energetico di un sistema nella forma
U = Q - L
In questa semplice relazione è contenuto il primo principio della Termodinamica, che
esprime in sostanza la conservazione dell'energia.
L'aumento (la diminuzione) di energia interna di un sistema è uguale alla quantità di
energia che il sistema riceve (cede) sotto forma di lavoro e di calore.
In totale l'energia del sistema più quella dell'ambiente rimane costante: tanto uno ne guadagna
quanto l'altro ne perde.
ESEMPI DI APPLICAZIONE DEL PRIMO PRINCIPIO DELLA TERMODINAMICA
Per chiarire il significato del primo principio della Termodinamica esaminiamo il bilancio
energetico di alcune semplici trasformazioni. Il sistema che prendiamo in considerazione è
costituito da un gas perfetto, contenuto in un recipiente chiuso da un pistone mobile (nelle due
figure è rappresentata una trasformazione generica)
Primo principio- 4 -
Trasformazione a volume costante, immaginiamo di riscaldare lentamente il gas
mantenendo costante il volume. Per evitare che il gas si espanda aggiungiamo dei pesi sopra il
pistone,
in
modo da
aumentare
P
B
A
VA = VB
V
gradualmente la pressione. Il sistema compie una trasformazione isocora (cioè a volume
costante), rappresentata nel diagramma pressione-volume da un segmento verticale che
congiunge lo stato iniziale A con quello finale B.
Poiché il pistone non si sposta, il gas non compie lavoro sull’ambiente esterno e quindi L è
uguale a zero. Il primo principio della Termodinamica diventa:
U = Q - PV e, poiché V =0
U = Q
Il calore che il gas assorbe dall'esterno fa aumentare la sua energia interna e si traduce in un
aumento di temperatura.
Trasformazione adiabatica (senza scambio di calore con l’esterno), in questa
trasformazione il sistema non scambia calore con l'esterno. Possiamo realizzare questa
Primo principio- 5 -
trasformazione mettendo il gas in un recipiente costituito da un materiale che è un isolante
termico perfetto. Se diminuiamo lentamente la pressione esterna, togliendo uno dopo l'altro i
pesi sopra il pistone, il gas si espande. Compie così un lavoro L positivo sull'ambiente.
Poiché Q è uguale a zero, il primo principio diventa:
U = - L
Essendo L positivo, U è negativo. Ciò significa che l'energia interna (e quindi la
temperatura) diminuisce. Il lavoro che il gas compie sull'ambiente esterno avviene a spese di
una parte dell'energia interna.
Se invece aumentiamo la pressione aggiungendo dei pesi sul pistone, è l'ambiente esterno che
compie un lavoro positivo sul gas. Poiché L è negativo, U è positivo. Il lavoro compiuto
dall’ambiente esterno ha l'effetto di aumentare l'energia interna e quindi la temperatura del
gas.
Trasformazione isoterma (a temperatura costante, legge di Boyle). Fornendogli calore
dall’esterno, il gas si espande gradatamente mentre la pressione interna diminuisce; la
trasformazione deve avvenire molto lentamente. Il gas in questo modo subisce una
trasformazione a temperatura costante, cioè una trasformazione isoterma, per la precisione,
una espansione isoterma
Dal momento che l'energia interna non cambia perché la temperatura è costante, per il primo
principio della Termodinamica si ha:
Q – L = 0, quindi Q = L
Il lavoro che il sistema compie espandendosi è uguale al calore Q che esso assorbe
dall'esterno.
Nel diagramma pressione-volume il lavoro è uguale all'area della superficie situata al di
sotto
del
grafico
che
rappresenta la trasformazione.
In una compressione isoterma
tutto succede al contrario. II
sistema passa dallo stato B allo
stato A subendo il lavoro compiuto dalle forze esterne e
cedendo calore all'ambiente. Il
lavoro che compie il sistema è
ancora uguale all'area della
superficie
colorata
nel
diagramma pressione-volume,
ma occorre aggiungervi il segno
meno.
Trasformazione ciclica.
Essa è rappresentata nel diagramma pressione-volume da una curva chiusa.
Primo principio- 6 -
Primo principio- 7 -
Al termine di questa trasformazione il sistema ritorna allo stato iniziale. Per esempio, la
trasformazione inizia in A, passa per B, C e D per poi concludersi in A.
Poiché l'energia interna è una funzione di stato, che dipende cioè dallo stato iniziale e finale
della trasformazione, se questa è ciclica
U = 0
e il primo principio della Termodinamica si scrive nella forma:
QTOT = LTOT
QTOT rappresenta la somma algebrica dei calori assorbiti (positivi) e ceduti (negativi) dal
sistema durante la trasformazione. Analogamente LTOT rappresenta la somma algebrica
dei lavori compiuti e subiti dal sistema.
Nel grafico pressione-volume LTOT è uguale alla differenza delle aree delle superfici
tratteggiate e coincide pertanto con l'area della superficie delimitata dalla curva chiusa. Poiché
l'area sotto AB è maggiore di quella sotto CD, LTOT è positivo. Il bilancio complessivo del
ciclo consiste in un assorbimento netto di calore dall'ambiente che il sistema utilizza per
produrre lavoro.
Se però il ciclo fosse percorso in senso contrario (cioè in senso antiorario) LTOT sarebbe
negativo. In questo caso il sistema assorbe lavoro dall'esterno per produrre calore.
Primo principio- 8 -
Un classico esempio di trasformazione ciclica si ottiene combinando due trasformazioni
isoterme con due trasformazioni isocore (a volume costante). La trasformazione inizia con
un'espansione isoterma (AB), a cui segue un raffreddamento a volume costante (BC), una
compressione isoterma (CD) e infine un riscaldamento a volume costante (DA).
II sistema compie lavoro soltanto durante le trasformazioni isoterme. Precisamente
compie un lavoro utile espandendosi da A a B, mentre durante la compressione da C a D, è
l'ambiente esterno a compiere lavoro sul sistema
Un sistema che compie una trasformazione ciclica si chiama macchina termica. Un
esempio di macchina termica è il motore di un'automobile; in ogni ciclo compiuto dai
pistoni esso trasforma una parte del calore che si sprigiona dalla combustione della
benzina in lavoro che serve per far avanzare l'automobile vincendo le forze di attrito.
Il ciclo termodinamico migliore teoricamente, quello cioè con il rendimento più alto, è il
ciclo di Carnot