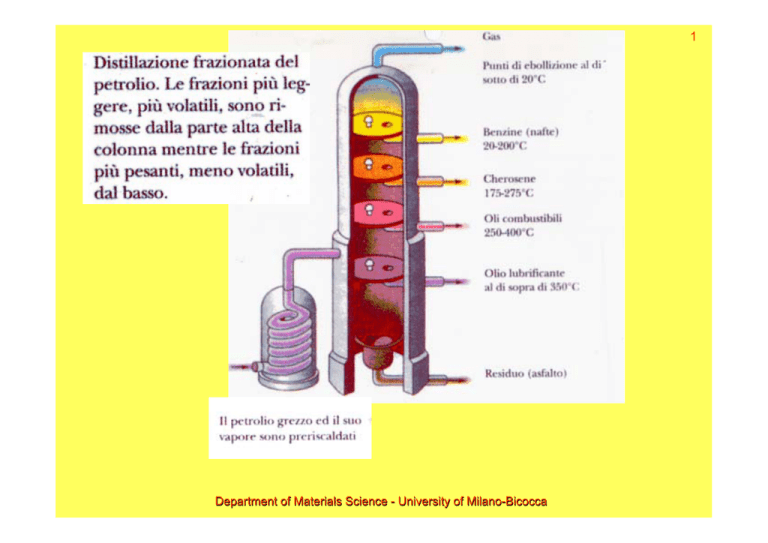
1
Department of Materials Science - University of Milano-Bicocca
2
Department of Materials Science - University of Milano-Bicocca
3
Cl
Cl
C’è forte interazione p-p π: il legame è più forte che non nel caso di un
alogeno legato a un carbonio sp3. Inoltre, a causa dell’interazione il carbonio
sp2 è assai meno elettrofilo che non nel caso di un carbonio sp3. Risultato: gli
aloenuri arilici e vinilici sono assai meno suscettibili di attacchi da parte di
nucleofili e si rivelano nei loro confronti relativamente inerti
Cl
Cl
Cl
Cl
Department of Materials Science - University of Milano-Bicocca
4
Department of Materials Science - University of Milano-Bicocca
6
2
catione cicloeptatrienilio
o catione tropilio
N = 6 sistema π deficiente
cicloottatetraenil anione
N = 8 Sistema π eccessivo
La regola di Hückel è stata successivamente estesa per definire
sistemi antiaromatici quali quelli che, planari e delocalizzati,
contengano 4 elettroni π. Il cicloottatetraene se fosse planare,
sarebbe antiaromatico. In realtà il cicloottatetraene non è planare e
quindi non è antiaromatico: semplicemente è NON AROMATICO ED
E’ UN SISTEMA CICLICO INSATURO.
cicloottatetraene
Department of Materials Science - University of Milano-Bicocca
7
DEFINIZIONE REAZIONALE
Sistemi insaturi che mantengono il tipo secondo la definizione di Sir
Robert Robinson (ca 1930)
X
X Electrophile
Electrophile
Nelle reazioni di addizione elettrofila il sistema NON mantiene il tipo
Ele ctrop hile
H
X Ele ctro p hile
+ H-X
Nelle reazioni di sostituzione elettrofila il sistema mantiene il tipo
Department of Materials Science - University of Milano-Bicocca
8
Nu
Nu - H
N
N
H
Nelle reazioni di addizione nucleofila il sistema NON mantiene il tipo
-
+
Na
N H2
+ NaH
N
H
N
N H2
Nelle reazioni di sostituzione nucleofila il sistema mantiene il tipo:
reazione di Cicibabin
DEFINIZIONE MAGNETICA
Sistemi insaturi capaci di sostenere una corrente d'anello quando
immersi in un campo magnetico
Department of Materials Science - University of Milano-Bicocca
9
La delocalizzazione dei legami π fa si che, quando il sistema sia immerso in un
campo magnetico avvenga interazione con questi generando una “corrente d’anello”
che influisce sulle proprietà magnetiche degli atomi che compongono il sistema
aromatico.
Department of Materials Science - University of Milano-Bicocca
10
Department of Materials Science - University of Milano-Bicocca
11
Department of Materials Science - University of Milano-Bicocca
12
Department of Materials Science - University of Milano-Bicocca
13
Department of Materials Science - University of Milano-Bicocca
14
ALOGENOIDRINE
in presenza di
HO-Br + HBr
Br2 + H2O
HO-Br
ACIDO IPOBROMOSO
Br
Br
HO
HO
Department of Materials Science - University of Milano-Bicocca
15
i catalizzatori di idrogenazione sono in
generale metalli nobili – Pt, Pd, Rd, di
solito lavorano a T e pressione
ambiente. Il Ni di Raney richiede
Temperature di 80-140°C e pressione
da qualche atmosfera a centinaia di
atmosfere.Il Ni Raney si prepara come
sotto indicato dalla lega di Raney.
Ni-Al + NaOH
Lega di Raney 50:50
Fessenden:
p 429-35
Ni di Raney + Al(OH)4 + H2
piroforico, ha notevole quantità di H2 adsorbito
Il Pd viene parzialmente
avvelenato da chinolina, BaSO4.
I composti solforati in basso
stato di ossidazione sono veleni
irreversibili
Department of Materials Science - University of Milano-Bicocca
16
Gli oli hanno alto contenuto di esteri insaturi, mentre i grassi sono esteri
essenzialmente di acidi grassi saturi (Butirrico C4, laurico C12, palmitico
C16, stearico C18, arachico C20)
Department of Materials Science - University of Milano-Bicocca
17
NO! IL
PERMANGANATO IN
AMBIENTE BASICO SI
RIDUCE A
MANGANATO MnO3-:
BIOSSIDO DI
MANGANESE SI
FORMA IN AMBIENTE
NEUTRO (H2SO4
STECHIOMETRICO.
+ Mn2+
Il permanganato si riduce a
Mn2+ solo in ambiente acido
e in tali condizioni è
fortemente ossidante
In ambiente acido per H2SO4
Department of Materials Science - University of Milano-Bicocca
18
Dai nitrili + Grignard
δC
R1
N
+ R2MgX
R1
C
R2
R2
R2
H2O
N
R1
MgX
C
N
H
H2O
R1
C
H
N
H
OH
R2
C
O
-NH3
R1
Dall’estere acetacetico, alchilazione in ambiente basico, idrolisi e decarbossilazione
O
O
O
O
O
O
O
BASE
H
H
H2O
OCH3
OCH3
OCH3
H
R
X
O
H
H
R
O
H
H
O
R
Department of Materials Science - University of Milano-Bicocca
R
H
19
Department of Materials Science - University of Milano-Bicocca
20
Carboidrati [es C6(H2O)6]
C6H12O6
C(H2O)6
Idrati di carbonio
Un esoso
La mutarotazione
Department of Materials Science - University of Milano-Bicocca
21
Department of Materials Science - University of Milano-Bicocca
22
Department of Materials Science - University of Milano-Bicocca
23
Department of Materials Science - University of Milano-Bicocca
24
NH2-OH
idrossilammina
Ossima dell’acetone
OH
R
R
C
C
N
H
OH
anti
N
H
sin
Department of Materials Science - University of Milano-Bicocca
25
Department of Materials Science - University of Milano-Bicocca
26
Catalizzatori: Pt: T ambiente e moderata pressione – reazione relativamente lenta;
Ni (Raney): alta T (100-150 ° C), alta pressione (da qualche a decine di
atmosfere); Pd: reazione molto lenta. Tutti non selettivi.
Fessenden:
p 551-557
Non riducono i
doppi legami C=C
Department of Materials Science - University of Milano-Bicocca
27
N
N
NH
N
H
NH
CH3
CH3
CH3
N
N
H
H
C
C
CH3
H
H
C
C
C
NH
CH3
H
Department of Materials Science - University of Milano-Bicocca
28
H
O
Stress elettronico del CH2
Department of Materials Science - University of Milano-Bicocca
O
29
cheto-enolica
H
O
O
La tautomeria cheto-enolica viene promossa sia da catalisi acida sia da catalisi
basica.
Il tautomero enolico è stabilizzato per due ragioni:
a)
avviene delocalizzazione – e quindi stabilizzazione annullando lo stress
elettronico presente nel dichetone (o nel composto dicarbonilico nel caso si
tratti ad es dell’estere acetacetico)
b)
Per la presenza di legame di idrogeno – che nel caso precedente è
intramolecolare: in altri casi può essere intermolecolare
Department of Materials Science - University of Milano-Bicocca
30
Department of Materials Science - University of Milano-Bicocca
31
Si noti come tutte le specie riportate sono più acide del DMSO.
Infatti solo per queste specie è possibile ottenere l'anione in DMSO
in quantità determinabile e quindi calcolare il pKa Ad esempio il
toluene è molto meno acido del DMSO (pKa, - 42-46): il suo pKa non
può essere misurato con esattezza in questo solvente.Sulla rilevanza
dell'acidità, riferendoci in particolare alla tabella appena riportata,
vanno fatte alcune considerazioni.
i) Piridina
Fenile La sostituzione di un anello fenilico con
un anello 4-piridico passando dal difenilmetano alla 4-benzilpiridina
comporta un incremento di acidità di ben 6 ordini di grandezza!
Analogamente si osservi come la 4-amminopiridina sia circa
10.000 volte più acida dell'anilina.
ii) Effetto solvente. In DMSO l'anione derivante dalla
deprotonazione del substrato di partenza è presente come ione
libero o, al più, vicino al controione ma separato da esso da uno
strato di molecole di solvente (solvent separated ions). Inoltre si
deve considerare che il DMSO, a causa della sua struttura
elettronica, è particolarmente adatto a solvatare il catione,
lasciando quindi l'anione sostanzialmente libero da molecole di
solvente.
Department of Materials Science - University of Milano-Bicocca
In queste condizioni sono quindi praticamente assenti, o minimizzate, interazioni tra
l'anione e il solvente. Si può quindi immaginare che specie anioniche, nelle quali sia
presente un'alta densità di carica elettronica su eteroatomi, vengano meglio
solvatate in solventi protici, i quali, tramite legami di idrogeno, possono
considerevolmente stabilizzare la specie carica.
Questo è il caso ad esempio degli anioni del nitrometano e del fenolo, i quali in
acqua sono notevolmente più stabili che in DMSO, portando ad una aumento
dell'acidità dei rispettivi precursori neutri di ben 10-100 milioni di volte.
Department of Materials Science - University of Milano-Bicocca
32
33
Merita attenzione il dato relativo al malonodinitrile: il pK, è
praticamente invariato passando dal DMSO a solventi polari quali
l'acqua o l'etanolo: pKa (DMSO) = 12, pKa (H2O)= 11. Questo
risultato è interessante: infatti potrebbe rivelare che
nell'anione corrispondente la carica negativa non viene delocalizzata
(almeno non particolarmente) sull'atomo di azoto, a differenza di
quanto si dovrebbe avere tenendo conto delle formule di risonanza
usualmente riportate nei testi di Chimica Organica. Questa
affermazione sembrerebbe pertanto confutare la tradizionale
visione del gruppo ciano come forte gruppo elettronattrattore
esercitante un effetto mesomero -M. Recenti studi,basati sullo
studio NMR 13C di un vasto numero di a-cianocarbanioni in DMSO e
sull'applicazione di relazioni shift 13C / densità elettronica π hanno
confermato tale ipotesi: la forma chetenimminica non è un buon
descrittore della struttura di questi anioni. Alla stessa conclusione
hanno condotto le analisi strutturali ai raggi X
Department of Materials Science - University of Milano-Bicocca
34
Department of Materials Science - University of Milano-Bicocca
35
propiofenone
Di scarso interesse perché reazioni
impetuose
Reazione assai
energica: va condotta
in etere anidro
Department of Materials Science - University of Milano-Bicocca
36
La riduzione con
cromito di rame,
CuCr2O4 è di interesse
industriale e poco
applicata, così come la
riduzione con Na poiché
può dare luogo a diversi
sottoprodotti. La
riduzione migliore in
laboratorio è con LiAlH4
Department of Materials Science - University of Milano-Bicocca
37
H+
H2N
H2N
C
NH2
H2N
C
H2N
La guanidina è assai basica ed è uno dei sistemi naturali più basici: questo grazie alla
ampia delocalizzazione della carica positiva nel corrispondente catione.
Department of Materials Science - University of Milano-Bicocca
NH2
38
SITO ACIDO
COOH
SITO BASICO
NH2
Ac p-amminobenzoico
PAB- fattore di crescita
O
O
S
NH2
NH2
SITO BASICO
S
O
O
S
SITO ACIDO
N
H
NH2
SULFATIAZOLO
Department of Materials Science - University of Milano-Bicocca
N
39
R
C
N + R'MgX
R-CO-R' + MgXOH + NH3
Department of Materials Science - University of Milano-Bicocca
40
Department of Materials Science - University of Milano-Bicocca
41
e 1,2
Department of Materials Science - University of Milano-Bicocca
42
Preparazione e destino dei sali di diazonio (alchildiazonio e arendiazonio)
R
H
HO
H
O
NO
2HN
NO
NO
O=N
H
N
H
H
N
R'
R
R
O
N
H
N
O
N
N
R'
R'
R'
R'
HN
R'
R
R
R
Questo carbocatione subisce il destino che gli è proprio (sostituzione,
eliminazione, trasposizione)
H
+
H
HO-N=O
N
2HN
H2 O + NO
base
- H+
N
O
H
H+
N
N=O
H
H
N
O
N
N
NH
OH
NaOH
H
diazotato
N
N
N
Department of Materials Science - University of Milano-Bicocca
N
O
-
Na+
N=O
43
Fessenden:
p 505-508
Department of Materials Science - University of Milano-Bicocca
44
Acido ipofosforoso
Riduzione ad arilidrazine, ulteriormente riducibili (legame debole N-N)
Department of Materials Science - University of Milano-Bicocca
45
-
O
O
+
N
N
N
O
N
H
H
N
HO
N
OH
H
O
-
O
N
N
N
N
Department of Materials Science - University of Milano-Bicocca
46
Copulazione con estere acetacetico
O
O
O
O
pH debolmente
OCH2 CH3
H
H
OCH2 CH3
basico
H
Estere acetacetico
H3 CH2 CO
Con aniline
terziarie
N+
N
H3 CH2 CO
N
O
FENILIDRAZONE
O
H
NH
O
O
Department of Materials Science - University of Milano-Bicocca
N
N
47
Fessenden:
p 509-515
Department of Materials Science - University of Milano-Bicocca
con intermedio di Meisenheimer di Addizione-Eliminazione
Condizione necessaria: l’arene deve essere elettronpovero. Condizione sufficiente:
l’arene deve avere il nucleofugo in posizione tale per cui il carbanione è stabilizzato
per delocalizzazione a parziale compenso della perdita di aromaticità.
intermedio di Meisenheimer
Department of Materials Science - University of Milano-Bicocca
48
49
Meccanismo di eliminazione - addizione
Department of Materials Science - University of Milano-Bicocca
50
γ
-
Nu
N
α
Nucleofugo
N
Nu
Nucleofugo = Cl-, Br -, F -, ecc. in posizione
α
N
o
γγ
NH2
H+
Na + NH 2
-
-H
-
H
N
H
N
NH2
Na +
H
N
NH
N
NH
Reazione di Cicibabin
Tutte le azine che recano nucleofughi in posizione opportuna subiscono SNAr per
addizione-eliminazione con una grande varietà di nucleofili
Department of Materials Science - University of Milano-Bicocca
51
L’acidità (pKa) dipende dal solvente: Fessenden e
specificare il solvente: in diversi solventi (H2O o
parecchie unità. Riferirsi perciò sempre ai valori
termodinamici sono però assoluti.
Fessenden riportano (pKa) senza
DMSO) i (pKa) possono differire di
dati in DMSO, i quali, sebbene non
Il metile dell’acetato d’etile è meno acido del
metile in α al carbonile dell’acetone percheè il
carbonile dell’estere è meno elettronattrattore
Fessenden:
p 690-700
Department of Materials Science - University of Milano-Bicocca
52
Fessenden:
p 705-712
CH3COCH2
H
B
O
O
CH3COCH2
O
OH a caldo
CH3CCH3
diacetonalcol
Department of Materials Science - University of Milano-Bicocca
ossido di mesitile
53
A caldo 70°C
OH
O
CH3
CH
CH CHO
H
ald crotonica
condensazione crotonica
Department of Materials Science - University of Milano-Bicocca
54
E’ possibile effettuare Claisen incrociate fra
un estere A e un estere B: se entrambi posseggono un H in α al gruppo carbonilico
dell’estere si formerànno 4 prodotti: quelli di autocondensazione di A con A (AA), di
B con B (BB), di A (come carbanione ) con B (AB),quello di B (come carbanione) con
A (BA). Per evitare tutto ciò è necessario a) che uno dei due esteri non possegga
idrigeni in α b) che uno dei due gruppi carbonilici sia estrememente più reattivo
dell’altro.
Department of Materials Science - University of Milano-Bicocca
55
Addizione secondo Michael
Department of Materials Science - University of Milano-Bicocca
56
La riduzione chimica può anche
essere compiuta con altri metalli in
ambiente acido: Zn, Sn. Inoltre puo
anche essere catalitica (3H2/NO2
con Pd/C, Pt, Ni-Raney).
Department of Materials Science - University of Milano-Bicocca
deprotona
Anione dell’acido carbammico
HO
C
O
NH2-COOH
H
CO2
+ H2O
Acido carbammico
O
Acido carbonico
RHN
-
C
O
H
RNH2 + H O
2
O
Acido N-alchilcarbammico
Department of Materials Science - University of Milano-Bicocca
57
58
Department of Materials Science - University of Milano-Bicocca
59
BASICITA’
dispersione
Il catione dell’ammina terziaria
è meno solvatato, quindi meno
stabilizzato
Department of Materials Science - University of Milano-Bicocca
60
Stabilizzata per delocalizzazione
del doppietto dell’azoto sull’anello
benzenico
Department of Materials Science - University of Milano-Bicocca
61
Composti aromatici
policiclici ed eterociclici
O
STRUTTURA
O
PORZIONE CHINOIDE
CHINOIDE
O
p-chinone e
struttura p-chinoide
Fessenden:
p 767-774
Department of Materials Science - University of Milano-Bicocca
O
o-chinone
62
Fessenden:
p 778-789
Department of Materials Science - University of Milano-Bicocca
63
Reazione di Cicibabin
(Tschitschibabin)
analogamente
Department of Materials Science - University of Milano-Bicocca
64
Department of Materials Science - University of Milano-Bicocca
65
Department of Materials Science - University of Milano-Bicocca
66
H+
H
H
N
N
N
N
H
H
Department of Materials Science - University of Milano-Bicocca
67
Fessenden:
p 961-962
Department of Materials Science - University of Milano-Bicocca









