La termodinamica
del secondo principio
2
1. Il motore termico
Come possiamo riassumere quanto detto sinora sul calore e sul lavoro?
Calore e lavoro sono due processi tramite i quali avviene trasferimento di energia fra La Controfisica
un sistema e l’ambiente. Il lavoro L rappresenta l’energia scambiata attraverso dei Trattandosi della descrizione di processi, è anche corretto parlare di
mezzi meccanici, vale a dire per effetto dello spostamento del punto di applicazione energia trasferita per lavoro ed enerdelle forze con cui il sistema interagisce con l’ambiente. Il calore Q rappresenta gia trasferita per calore.
l’energia scambiata a causa della differenza di temperatura fra il sistema e
l’ambiente. Mai si dirà che “un sistema possiede del lavoro” oppure che “un sistema
possiede del calore”. Q e L non sono proprietà dei sistemi ma piuttosto quantità in
trasferimento: il loro valore descrive il processo di scambio di energia, e varia a seconda delle modalità del trasferimento.
Cosa s’ intende con il termine motore termico?
Con il termine macchina termica o motore termico intendiamo un dispositivo che riceve energia sotto forma di calore e ne restituisce una parte sotto forma di lavoro.
Il calore può essere ricevuto dal motore sia attraverso il contatto con una sorgente
termica a temperatura maggiore della sua, sia a spese dell’energia incamerata al livello dei legami fra le molecole di qualche sostanza, e liberata durante una reazione
chimica. Un esempio di questo secondo caso è la combustione della benzina.
Come possiamo trasformare calore in lavoro?
La risposta a questa fondamentale domanda venne dallo studioso francese Sadi Carnot, nella sua opera scientifica Riflessioni sulla potenza motrice del fuoco, del 1824, e
può essere così riassunta:
L’energia ricevuta per calore può essere restituita tramite lavoro, e quindi essere in
grado di spostare il punto di applicazione di una forza, per effetto dei mutamenti
che il calore può indurre nel volume, nella forma o nella densità delle sostanze a
causa della dilatazione termica.
29
Trasferire energia attraverso il lavoro dopo averla ricevuta per calore, è più facile se
si sfruttano le sostanze aeriformi, per le quali il fenomeno della dilatazione termica è
in genere semplice da ottenere, ed è maggiore che non nei liquidi o nei solidi.
Si può dire che per produrre lavoro il motore consuma del calore?
La generazione di lavoro non è riconducibile al “consumo" di calore, che in quanto
forma di energia non può in alcun caso essere distrutta. A produrre lavoro è il passaggio di energia per calore da un corpo caldo ad uno freddo, allo scopo di provocarne la dilatazione. E poiché si ha trasferimento per calore solo in presenza di una differenza di temperatura, si può concludere che:
Per costruire un motore non è sufficiente trovare una sorgente da cui attingere energia, ma occorre una differenza di temperatura
La produzione di lavoro può essere l’unico effetto del funzionamento di un motore?
Dato che il lavoro termodinamico di cui stiamo parlando, ottenuto dal trasferimento
di calore, è il risultato delle dilatazioni termiche, appare evidente che una volta prodotto del lavoro il sistema che lo ha generato ha variato il suo volume. Questo può
essere enunciato formalmente dicendo che la produzione di lavoro non è mai l’unico effetto della trasformazione di calore in lavoro. Conseguentemente, se si vuole costruire un
motore, si dovrà anche pensare a come riportare il sistema al volume iniziale. Altrimenti si avrà un motore che funzione una sola volta, produce del lavoro, ma poi non
può essere sfruttato di nuovo, dato che alla fine del processo esso non si trova più
nelle condizioni di partenza. Si pensi, ad esempio, al lavoro che si può produrre riscaldando un cilindro contenente gas: il riscaldamento fa sollevare il pistone che
produce così del lavoro. Non è però pensabile di dilatare il gas illimitatamente, anche
perché in pratica si dovrebbe avere un cilindro di altezza infinita.
In termini pratici, quindi, di cosa ha bisogno un motore che sia efficiente?
Occorrerà che, alla fine del processo in cui si è prodotto del lavoro, il sistema che si è
dilatato sia riportato nelle condizioni iniziali. Tuttavia, rimediare alle dilatazioni a
cui la trasformazione di calore in lavoro ha dato luogo, significa compiere del lavoro dall’esterno sul sistema, per comprimerlo nuovamente. Un altro modo per dire la
stessa cosa è che il motore termico, per funzionare, deve compiere una trasformazione
ciclica. Con il termine di ciclica s’intende una trasformazione a conclusione della quale lo stato di arrivo coincide con quello iniziale. A questo punto il motore può ripartire e generare nuovo lavoro.
Allora dobbiamo far compiere al sistema esattamente gli stessi passi a ritroso?
Non è pensabile portare indietro il sistema ripercorrendo esattamente gli stessi passi che esso ha fatto per produrre lavoro. Difatti, nel caso ideale di assenza di dissipazioni, l’esatto percorso inverso richiederebbe da parte dell’ambiente lo stesso lavoro
che il sistema ha fornito nel dilatarsi.
Si pensi alla espansione isoterma reversibile di un gas perfetto che produce un lavoro
L nRT ln(Vfin /Vin ) . Ricomprimere lo stesso gas in modo isotermo, alla medesima
temperatura richiede che dall’esterno venga compiuto di nuovo sul sistema un lavoro nRT ln(Vin /Vfin ) L . Questo è l’ esempio di un motore davvero pessimo, il
quale riassorbe tutto ciò che produce. La soluzione è piuttosto quella di riportare il
sistema allo stato di partenza seguendo un percorso differente dall’andata.
Come si sceglie il percorso per tornare allo stato iniziale?
Il criterio da usare è quello di rendere minimo il lavoro necessario, dato che nel bilancio complessivo questo andrà sottratto al lavoro prodotto durante l’espansione.
30
Supponiamo che il sistema che fa da motore sia un certo quantitativo di gas perfetto
che segue trasformazioni reversibili e quindi rappresentabili da curve sul piano P,V P
(piano di Clapeyron). Come sappiamo, più bassa è la temperatura, più la linea che
rappresenta la trasformazione si trova in basso verso l’asse dei volumi, e minore sarà
il lavoro, cioè l’area sottesa1 fra due rette verticali che indicano due volumi qualunque. Se quindi il gas che in figura si sposta dallo stato 1 allo stato 2 producendo il
lavoro LA , viene poi raffreddato fino allo stato 3 , il processo di ritorno al volume
1
2
600K
LA
4
500K
3
iniziale richiede un lavoro LR minore di quello prodotto all’ andata. Come si dedu-
LR
ce dal disegno, il ciclo sarà completo solo se dopo si riporta anche la pressione al valore di partenza, riscaldando il gas (ad esempio lungo 4-1).
Vin
400K
300K
V
Vfin
Questo raffreddamento può avvenire in modo adiabatico, cioè senza cedere calore?
Nell’esempio in figura il gas cede calore in due momenti, quando si raffredda da 2 a
3 e quando viene riportato al volume iniziale da 3 a 4 . Si può tentare di ottenere lo
stesso risultato immaginando che la prima delle due trasformazioni sia adiabatica:
possiamo raffreddare il gas senza che ceda calore, semplicemente lasciandolo espandere ancora di più. Ma nella seconda, quando lo si vuole riportare al volume iniziale, l’ambiente deve compiere lavoro sul gas, ed in questa fase non possiamo evitare
fuoriuscite di calore.
Qualunque motore deve essere raffreddato?
La necessità di raffreddare i motori è del tutto generale e non riguarda solamente
l’espansione di un recipiente cilindrico ideale che contenga del gas perfetto. Questo
comporta il doversi sempre procurare una sorgente fredda alla quale cedere calore.
Si pensi al radiatore delle automobili, oppure ai grandi bacini idrici in prossimità dei
quali sono costruite le centrali termonucleari. Il raffreddamento è indispensabile se
vogliamo che il motore sia di utilità pratica, cioè:
P
Tmax
Al termine del ciclo di un motore, il bilancio del lavoro deve essere positivo, deve
cioè essere prodotto più lavoro in espansione di quanto ne sia poi richiesto durante
la compressione.
Tmin
V
Come si rappresenta un motore a gas perfetto nel piano P, V?
Durante il ciclo vi saranno in generale delle sorgenti dalle quali il motore assorbe calore e sorgenti verso le quali lo cede. Se indichiamo con Tmax la temperatura della
P
espansione
più calda delle sorgenti e con Tmin la più fredda di esse, i cicli operanti fra tali temperature estreme saranno compresi tra le isoterme reversibili di gas perfetto corrispondenti. Se poi il motore a gas perfetto segue solo trasformazioni reversibili possiamo anche raffigurare il suo percorso: trattandosi di un ciclo, esso sarà costituito da
una linea chiusa.
V
A cosa corrisponde nel piano P,V il lavoro di un ciclo di un motore reversibile?
Come sappiamo, il lavoro termodinamico compiuto durante le trasformazioni reversibili è espresso dall’area sottesa dalle curve. Essa andrà presa con il segno positivo oppure negativo a seconda del fatto che il volume aumenti o diminuisca, cioè a seconda
del fatto che la trasformazione proceda da sinistra verso destra nel piano ( L 0 )
oppure da destra verso sinistra ( L 0 ). Poiché in qualunque ciclo vi sarà una parte
della trasformazione durante la quale il sistema si espande, ed una parte in cui si ricontrae, il lavoro complessivo è alla fine dato solo dall’area racchiusa entro il ciclo
stesso. Il segno di L sarà positivo (cioè eseguito dal gas) se il gas si espande (reversi1
Si noti che questa identificazione del lavoro con l’area sottesa nel piano di Clapeyron perde di significato nel caso di
trasformazioni irreversibili
31
P
contrazione
V
bilmente) a temperature maggiori di quelle a cui si ricontrae, cioè il ciclo è percorso in
verso orario, viceversa sarà negativo, cioè subito dal gas se il ciclo è percorso in verso antiorario:
ciclo in senso orario L 0 cioè eseguito dal gas
ciclo in senso antiorario L 0 cioè subito dal gas
lavoro del ciclo
L0
P
Come possiamo calcolare il lavoro compiuto durante un qualunque ciclo?
Si fa uso del primo principio della termodinamica. Dato che lo stato finale è uguale a
quello iniziale la variazione di energia interna in un ciclo deve essere zero perché
l’energia interna è una funzione di stato. Se quindi E int 0 avremo che alla fine
del ciclo risulterà Q L . Il calore Q complessivamente scambiato dal sistema sarà
dato dalla somma di quello entrante, QC , ricevuto dalle sorgenti calde, e di quello
V
uscente, QF , ceduto alle sorgenti fredde. Ne risulta che:
L Q QC QF QC |QF |
P
espansione
avendo esplicitato il segno del calore ceduto QF , sicuramente negativo.
Come si interpreta questo risultato?
La formula L QC |QF | può essere letta così: poiché devo raffreddare il sistema
prima di poterlo riportare allo stato iniziale, non tutto il calore QC assorbito viene
contrazione
V
ciclo motore
sorgenti calde
trasformato in lavoro. Una parte di esso, QF , esprime l’energia spesa per raffreddare e ricomprimere il sistema, e va ceduto alle sorgenti a temperatura fredda con le
quali il motore deve essere in contatto, e quindi non viene convertito in lavoro.
Questo dà informazioni anche sull’efficienza del motore?
Quel che si può concludere, è che il motore sarà tanto migliore quanto più QF risul-
QC
M
L QC|QF |
ta piccolo. Infatti, quanto più QF è piccolo tanto più grande è la porzione di QC che
viene trasformata in lavoro. Per quantificare la bontà di un motore si introduce un
parametro, detto rendimento, che si indica solitamente con la lettera greca eta: . Il
rendimento esprime numericamente quanto si è appena detto, cioè quale frazione
QF
sorgenti fredde
del calore assorbito viene trasformata in lavoro. L’espressione matematica di è
quindi il rapporto fra ciò che si è ricevuto dal motore, cioè il lavoro L , e quello che
si è dato al motore, cioè il calore QC :
lavoro prodotto
calore assorbito
Q | QF |
|Q |
L
C
1 F
QC
QC
QC
Come si vede, risulta sempre 0 1 . Leggendo la frazione come quantitativo del
numeratore associato ad un’unità del denominatore, diremo che per ogni Joule ricevuto in forma di calore, il rendimento esprime la frazione di esso che il motore è in
grado di restituire in forma di lavoro.
E’ possibile costruire un motore perfetto?
Un motore ideale trasformerebbe tutto il calore assorbito in lavoro. Il suo rendimento
sarebbe 1 . Ma abbiamo visto che non possiamo fare a meno di cedere calore alla
sorgente fredda. Quindi, nessun motore può essere ideale. Ci sono allora due possibilità per un dispositivo che produca lavoro a partire dal calore, sfruttando la dilatazione di un fluido. Se trasforma tutto il calore in lavoro, non si tratta di un motore,
perché ne risulterebbe uno stato finale diverso da quello iniziale. Se invece lo stato
finale coincide con quello iniziale, allora il dispositivo è un motore, perché ha com32
piuto un ciclo, ma una parte del calore risulta non utilizzata ai fini della trasformazione in lavoro, in quanto ceduto alla sorgente fredda. Se ne può concludere che:
Per i motori reali si ha sempre un rendimento 1
Esercizi
1. A un certo quantitativo di gas perfetto monoatomico che si trova a pressione
P 2.50 105 Pa e volume V 2.00 m 3 , viene fatto compiere il ciclo reversibile
12341 in figura. Trovare il lavoro eseguito dal gas ed il calore scambiato, sia durante
ciascuna trasformazione, sia complessivamente. Calcolare il rendimento del ciclo.
P
1
2
Q12
2
2
L12
4
3
2V
V
int
E12
3 PV
3 PV
3 (P 2V PV ) 3 PV
2 2
1 1
int
E12
2
P
Il gas compie lavoro esclusivamente lungo le isobare 1-2 (positivo) e 3-4 (negativo)
in cui il volume cambia. Lungo la prima trasformazione risulta:
L12 P (V2 V1 ) P (2V V ) PV
2
1
2
5 PV
2
Lungo la trasformazione isocòra 2-3 abbiamo L23 0 J ed inoltre:
int
E23
3 P3V3 3 PV
3 ( 1 P 2V P 2V ) 3 PV
2 2
2
Q23
2
int
E23
2 2
2
L23 3 PV
2
La Controfisica
Come si vede il gas riceve calore
solo nei tratti 1-2 e 4-1 perché in
entrambi la temperatura aumenta
(entrambi tagliano isoterme via via
più in alto nel piano) e quindi per
entrambi cresce l’energia interna.
Inoltre per entrambi il gas o non
lavora (4-1) oppure esegue lavoro
positivo (1-2). Quindi l’apporto
energetico per l’incremento di energia interna gli può venire solo dal
calore. Con analoghi ragionamenti si
conclude che il gas cede calore nei
tratti 2-3 e 3-4.
Lungo la trasformazione isòbara 3-4:
L34 1 P (V3 V4 ) P 1 (V 2V ) 1 PV
2
int
E 34
2
3 PV
2 4 4
3 PV
2 3 3
2
3 ( 1 PV
2 2
1 P 2V ) 3 PV
2
4
int
Q34 E 34
L34 5 PV
4
infine lungo l‘isocòra 4-1 abbiamo L41 0 J ed inoltre:
int
E 41
3 PV
3 P4V4 3 (PV 1 PV ) 3 PV
1 1
2
Q41
2
int
E 41
2
L41
2
4
3 PV
4
Il lavoro totale sarà quindi:
L L12 L34 PV 1 PV 1 PV 1 (2.50 105 2.00)J 2.50 105 J
2
2
2
corrispondente, come si verifica subito, all’area del rettangolo di base V ed altezza
P /2 che individua il ciclo. Trattandosi di un ciclo si ha E int Q L 0 J quindi
dal primo principio risulta che il calore complessivamente scambiato è:
Q L 2.50 105 J
il valore positivo indica che nel complesso il gas ha ricevuto energia per calore. Il risultato può verificarsi addizionando i quattro calori trovati:
Q Q12 Q23 Q34 Q41 ( 5 3 5 3 )PV 1 PV
2
2
4
4
2
Per il calcolo del rendimento del ciclo ci occorre il calore assorbito QC , che si ottiene
addizionando i soli calori in ingresso, cioè quelli positivi:
QC Q12 Q41 ( 5 3 )PV 13 PV
2
4
4
Sostituendo nell’espressione per :
L
QC
1
2
13
4
P
PV
1 4
2
2
13
13
PV
1
2
1
2
P
5
3
2. Una quantità di gas perfetto monoatomico inizialmente a P 3.00 10 Pa e vo3
lume V 6.00 m segue il ciclo reversibile 1231 in figura, a forma di triangolo rettangolo. Si calcoli il lavoro del ciclo ed il suo rendimento.
33
[R: 4.50 105 J, 2/5 ]
V
2V
2
P2
P1
3. Una quantità n 1.50mol di gas perfetto monoatomico segue un ciclo reversibile
a forma di triangolo isoscele 1231 costituito dalla trasformazione 1-2, dalla 2-3 ed infine dall’isobara 3-1 che ne riporta il volume al valore iniziale. Sapendo che
1
3
P1 P 4.00 105 Pa , P2 2P , V1 V 3.50 102 m 3 ,
[R: 2 /15, 4.55 M J ]
rendimento del ciclo e il calore ceduto.
V1
V3
V3 2V , calcolare il
4. Un motore termico che ha un rendimento 0.250 deve erogare una potenza di
400W . Calcolare quanto calore occorre fornirgli ogni ora.
[R: 5.76 MJ/h ]
5. Un motore termico ha un rendimento 1/ 5 e ad ogni ciclo preleva
3P
600J in
calore dalla sorgente calda. Sapendo che un ciclo dura 5.00 s calcolare la potenza
erogata dal motore.
[R: 24.0W ]
P
5V
V
6. Un certo quantitativo di gas perfetto monoatomico segue un ciclo reversibile che
nel piano pressione-volume ha la forma di un’ellisse (area ab , con a, b semiassi),
come in figura. Calcolare il rendimento del ciclo.
[R: 0.271 ]
7. Fra i due cicli reversibili A e B, a forma rettangolare nel piano pressione-volume
che un gas perfetto monoatomico può seguire, si scelga quello più conveniente dal
3P
B
[R: A 2/13, B 2/21 ]
punto di vista del rendimento.
A
P
8. Una quantità n 2.50mol di gas perfetto monoatomico segue un ciclo reversibile
1231 formato da un’isocora 1-2, un’espansione isoterma 2-3 ed infine un’isobara 3-1
3V
V
P2
P1
V1 2.00 102 m 3 e V3 5.00 102 m 3 , calcolare T1 , T3 , P2 ed il rendimento del
2
[R: 337K, 842K, 8.75 105 Pa, 0.17 ]
ciclo.
1
9. Una quantità di n moli di gas perfetto monoatomico segue il ciclo reversibile 1231,
formato da un’isobara 1-2, un’isocòra 2-3 e chiuso da un’isoterma 3-1 che riporta il
sistema allo stato iniziale. Si calcoli il rendimento.
[R: (2 ln 3)/ 5 0.180 ]
3
V1
V3
1
2
3P
P
3
V
P
che ne riporta il volume al valore iniziale. Sapendo che P1 3.50 105 Pa ,
1
10. Trovare una formula generale per il rendimento di un ciclo rettangolare di due
isoterme e due adiabatiche di un gas perfetto monoatomico, come quello in figura,
in cui il rapporto 1 fra la massima e la minima pressione sia uguale al rapporto
fra il massimo ed il minimo volume. Trovare il limite superiore al rendimento di
questo tipo di cicli.
[R: (2 2)/(5 3), 2/5 ]
3V
2
2. Il secondo principio della termodinamica
P
4
V
3
V
La conclusione cui si è giunti sulle caratteristiche dei motori, venne espressa in forma di principio fondamentale da parte del fisico britannico William Thomson (poi divenuto Lord Kelvin, 1824 –1907):
Secondo Principio della termodinamica nella forma di Kelvin
Non esiste la macchina termica ideale, quella cioè che trasforma tutto il calore assorbito da una sola sorgente in lavoro.
34
Trattandosi appunto di un principio, quanto esposto nel paragrafo precedente non è
la sua dimostrazione, ma solo una serie di ragionamenti (circoscritti fra l’altro ai soli
motori che seguono trasformazioni reversibili), volti a facilitarne la comprensione. Il
fatto che il motore ideale non esista è una legge della fisica, e come tale frutto della
sperimentazione ripetuta secondo il metodo galileiano. E come per tutte le leggi della
fisica, basterebbe anche un solo caso in cui essa non valesse per falsificarla.
P contrazione
Q
Q
Quali legami ha il secondo principio con i fenomeni naturali del quotidiano?
Esiste una formulazione alternativa del secondo principio della termodinamica, dovuta al fisico prussiano Rudolph Clausius (1822 -1888). Invece dei problemi connessi
con la realizzazione di una macchina termica, Clausius prese in considerazione un
fenomeno naturale apparentemente senza alcuna relazione con quanto esposto fino
ad ora: il verso di scorrimento del calore. Come si osserva quotidianamente, il rilascio spontaneo di energia per effetto della differenza di temperatura ha una sola direzione: procede, infatti, da corpi a temperatura superiore verso corpi a temperatura
inferiore. Il punto sul quale riflettere è che, sebbene sarebbe perfettamente compatibile con il primo principio, un flusso spontaneo di calore da bassa verso alta temperatura non ha mai luogo:
Il calore fluisce spontaneamente solo da corpi a temperatura superiore verso corpi a
temperatura inferiore
Si può realizzare uno spostamento di calore contro la direzione naturale?
Certamente si può, ma occorre una macchina frigorifera, una macchina, cioè, che
consumando energia trasferisce calore da oggetti freddi verso oggetti caldi. Proprio
come il frigorifero di casa: trasferisce calore dal cibo freddo (a bassa temperatura)
all’ambiente (a temperatura più alta) rendendo il cibo ancora più freddo. Tutto questo, beninteso, consumando energia. Infatti i frigoriferi hanno un spina connessa alla
rete elettrica e se questa si stacca il trasferimento di calore dal freddo al caldo cessa.
Come si rappresenta un frigorifero reversibile nel piano P, V?
Il principio di funzionamento del frigorifero è inverso a quello del motore: riceve lavoro per sottrarre calore ad una o più sorgenti fredde e cederlo ad una o più
sorgenti calde. Anche la macchina frigorifera, per funzionare con continuità, deve
seguire una trasformazione ciclica che, nel caso in cui sia reversibile, può essere raffigurata da una linea chiusa nel piano P,V.
Come possiamo esprimere l’efficacia di una macchina frigorifera?
Un frigorifero funziona tanto meglio quanto più calore QF riesce a prelevare dalle
sorgenti fredde a parità di lavoro L ricevuto. Trattandosi di un ciclo, avremo anche
in questo caso Q L 0 , da cui L Q QC QF . Il lavoro è subìto dal frigorifero,
quindi di segno negativo, così com’è negativo il calore uscente (QC 0) , mentre è positivo quello entrante (QF 0) . Esplicitando il segno negativo di QC , si ha
L |QC | QF 0 cioè |L | L |QC | QF . La prestazione di un frigorifero è al-
lora espressa bene dal seguente rapporto fra il calore prelevato e il lavoro ricevuto:
k
QF
calore prelevato QF
lavoro ricevuto
L
QC QF
Il rapporto k si dice efficienza (o anche coefficiente di prestazione) e rappresenta il
numero di joule in forma di calore che il frigorifero può sottrarre alle sorgenti fredde
per ognuno dei joule in forma di lavoro ricevuti. Più grande è k , meno lavoro richiede la macchina per funzionare. Un frigorifero ideale sottrarrebbe tutto il calore
35
espansione
V
ciclo frigorifero
sorgenti calde
QC
L
|QC | |QF |
F
QF
sorgenti fredde
prelevato (cioè QC QF ) senza richiedere lavoro esterno: per esso si avrebbe efficienza infinita. Ne concludiamo che 0 k . Una macchina frigorifera può essere anche utilizzata al contrario, cioè per riscaldare un ambiente prelevando calore
QF dall’esterno, a temperatura più bassa, e cedendo all’ambiente interno (a temperatura più alta) calore QC . In questa disposizione la macchina si dice pompa di calore ed
essa sarà tanto più efficiente quanto maggiore è il rapporto |QC | /L 1 k .
Cosa mostrano le osservazioni riguardo al funzionamento del frigorifero ideale?
Il fatto che il trasferimento di calore da bassa ad alta temperatura non avvenga spontaneamente, ma solo se si compie lavoro dall’esterno, ha delle conseguenze sui limiti
di funzionamento delle macchine frigorifere, così riassunte da Clausius:
Secondo Principio della termodinamica formulato da Clausius:
Non esiste la macchina frigorifera ideale, cioè non è possibile effettuare una trasformazione il cui unico risultato sia quello di trasferire calore da una sorgente a temperatura inferiore ad una sorgente a temperatura più alta.
Come si interpreta per Clausius il funzionamento del frigorifero reale ?
L’enunciato di Clausius del secondo principio sostiene semplicemente che un frigorifero non funziona senza attaccare la spina. Ovviamente ogni frigorifero reale trasferisce calore da bassa ad alta temperatura, ma non è questo l’unico effetto della sua azione. Il
lavoro compiuto dall’esterno sul sistema comporta tutta una serie di modificazioni
ambientali, ad esempio quelle che ha prodotto la centrale elettrica che ci fornisce
l’energia necessaria affinché il frigo funzioni.
TC
QF
QC
QF
L
Il principio di Clausius esprime la stessa legge di quello formulato da Kelvin?
QC |QF |
La formulazione di Clausius è perfettamente equivalente a quella di Kelvin e viceversa. Dimostriamo dapprima che se si può violare l’enunciato di Clausius (tecnicamente diremo “se si può costruire una macchina anti-Clausius”), allora si viola anche
quello di Kelvin. In figura è schematizzato un motore termico A che assorbe calore
QC da una sorgente a temperatura calda TC e cede calore QF ad una sorgente a
TF
temperatura fredda TF . Esso produrrà un lavoro L che, come si è dedotto dal primo
da anti -Clausius
ad anti -Kelvin
principio, sarà pari alla differenza fra il calore ricevuto e quello ceduto:
B
A
QF
L QC QF . Se ora disponessimo di una macchina B che violasse il postulato di
Clausius potremmo usarla per riportare QF dalla sorgente fredda a quella calda senza che sia necessario alcun apporto di lavoro dall’esterno. La sorgente fredda sarebbe
allora inutile: essa riceverebbe QF e poi cederebbe di nuovo QF , ed è come se non
avesse preso parte al processo. In conclusione la macchina combinata A+B assorbirebbe calore solo dalla sorgente a TC e produrrebbe il lavoro L QC QF , violan-
TC
do così il postulato di Kelvin.
Q
L
B
A
E se si violasse il postulato di Kelvin, violeremmo Clausius ?
Se, viceversa disponessimo all’inizio di una macchina che violasse il postulato di
Kelvin (tecnicamente diremo “se si può costruire una macchina anti-Kelvin”), indicata con la lettera B nella figura a lato, la potremmo utilizzare per estrarre calore Q
da una sorgente a temperatura TF e convertirlo integralmente in lavoro L . Dato che
Q
TF
da anti -Kelvin
ad anti -Clausius
non esistono limiti alla conversione di lavoro in calore (ad esempio per attrito), potremmo prendere una macchina qualunque A che ritrasformi il lavoro L in un calore
avente caratteristiche di tali da poterlo agevolmente trasferire ad una sorgente a
temperatura TC TF . Per esempio potremmo prendere come macchina A un dispo36
sitivo simile a quello di Joule che metta in agitazione delle pale dentro ad un certo
quantitativo di acqua ad una opportuna temperatura. In conclusione la macchina
combinata A+B assorbirebbe calore da una sorgente fredda TF e lo trasferirebbe ad
una sorgente calda TC senza nessun altro effetto, violando così il postulato di Clausius. Si è dimostrato quindi che se non esiste il motore ideale non esiste nemmeno il
frigorifero senza spina, e, viceversa, che se non esiste il frigorifero ideale non esiste
nemmeno il motore ideale.
Quali conseguenze ha avuto il secondo principio nello sviluppo della civiltà?
Il secondo principio della termodinamica costituisce un formidabile ostacolo, con il
quale la civiltà umana ha dovuto e deve confrontarsi. Mentre scambiare energia per
calore è un processo di facile realizzazione, in quanto è l’effetto del movimento caotico delle molecole stesse, solo uno spostamento ordinato su scala macroscopica di
miliardi di molecole produce lavoro meccanico. La trasformazione di calore in lavoro
è essenziale per il progredire dell’intelligenza e delle strutture organizzate socialmente. Qualche studioso sostiene che l’invenzione del motore a vapore, avvenuta
verso al fine del XVIII secolo, rappresentò il passo in avanti più importante in assoluto della civiltà: grazie ad esso l’uomo si affrancò dalla schiavitù dell’utilizzare la
propria forza muscolare o quella animale e dalle bizzarrie della natura. Ma il fatto
che vi siano dei vincoli a tale conversione, in particolare la necessità di utilizzare almeno due sorgenti a temperatura differente, rende tutto il processo complicato. Sarebbe semplice produrre energia elettrica (e quindi lavoro meccanico) se, ad esempio,
si potesse estrarre calore dal terreno. Riscalderemmo le nostre case diminuendo la
temperatura dell’enorme massa della crosta terrestre di così poco, che nemmeno se
ne potrebbe rivelare l’effetto. Oppure, se si potesse alimentare una nave risucchiando
calore dal mare e trasformandolo in lavoro. O ancora: far correre un’auto o far volare
un aereo assorbendo calore dall’aria. Ma in tutti queste ipotesi fantasiose, il terreno,
il mare e l’aria rappresentano quella che, nella nostra schematizzazione, sarebbe la
sorgente calda. Nella pratica comune, invece, questi enormi bacini di calore si utilizzano come sorgenti refrigeranti: a essi i motori – anche quello delle auto - cedono calore per raffreddarsi. Per estrarre calore dall’oceano avremmo bisogno di un altro
oceano a temperatura più bassa: per ottenere da sorgenti termiche energia in forma di
lavoro, occorre disporre di una differenza di temperatura.
Può eseguire del lavoro un motore al quale non si fornisca energia?
Un motore deve compiere dei cicli, e a ogni ciclo deve risultare E int 0 . In conseguenza avremo che L Q , e quindi se Q 0 non possiamo sperare di ricavare del
lavoro da un simile meccanismo. Nel corso dei secoli molti sono stati i tentativi di
realizzare un motore che lavorasse senza somministrazione di energia (ad esempio
tramite un combustibile). I fallimenti puntualmente registrati indicano chiaramente
che l’energia non può essere creata, ma solo convertita da una forma ad un’altra.
Poiché una macchina capace di creare energia potrebbe seguire dei cicli per un tempo indefinito, questa via di conferma della validità del primo principio della termodinamica va sotto il nome di impossibilità del moto perpetuo di prima specie.
Può eseguire del lavoro un motore che scambi calore con un’unica sorgente?
No, perché un simile dispositivo violerebbe il secondo principio della termodinamica. Un ciclo che potesse alimentarsi traendo calore dall’ambiente circostante, come ad
esempio quello del motore di una nave che estrae la sua energia dal solo oceano,
avrebbe a disposizione una sorgente di calore praticamente inesauribile, dando così
vita ad un moto per un tempo indefinito. Questo tipo di violazione del secondo principio è detta impossibilità del moto perpetuo di seconda specie.
37
Esercizi
11. Un frigorifero ha un’efficienza k 4.00 e ad ogni ciclo sottrae 200J alla sorgente fredda. Si calcoli il lavoro che occorre fornirgli per ciclo, il calore che sottrae con un
joule di lavoro, e il calore che cede all’ambiente in ogni ciclo. Sapendo che il lavoro
gli viene fornito da un motore di potenza 300W , si trovi quanto dura un ciclo e
quanto calore sottrae ogni ora.
Dalla definizione di efficienza risulta:
calore prelevato QF
k
4.00
lavoro ricevuto
L
Quindi, il frigorifero sottrae 4.00J in calore con un joule di lavoro. Il lavoro da fornire per ogni ciclo è invece:
L QF /k (200 / 4.00)J 50.0 J
Ricordiamo che quando, applichiamo il secondo principio, il soggetto è il frigorifero,
per cui essendo il lavoro subìto dal frigorifero, il suo segno è negativo: L 50.0J .
Il calore QF 200 J è invece positivo perché ricevuto dal frigorifero, mentre negativo dev’essere il segno di QC , ceduto dal frigo all’ambiente, che funge da sorgente
calda. Abbiamo dunque in un ciclo:
E int Q L QC QF L 0
QC L QF (50.0 200)J 250 J
Un motore di potenza L /t 300W 300 J /s per fornire il lavoro di 50.0J che
serve per un ciclo impiega un tempo:
L
50.0 J
t
(1/ 6) s
300W
300 J /s
In questo stesso intervallo temporale viene sottratto alla sorgente fredda il calore
QF 200 J , che diviso per t ci dà il calore sottratto ogni secondo, e da questo otteniamo il calore sottratto in un’ora:
QF
200 J
1800 J /s (1800 J /s 3600 s/h) 6.48 106 J/h
t
(1/ 6) s
QF
stanza
50.4k J
12. Un condizionatore sottrae 7000J ogni ora a un certo ambiente. La pompa ha un
coefficiente di prestazione k 5.00 . Calcolare la potenza richiesta per alimentarlo
ed il calore che in media cede all’esterno ogni secondo.
12.0k J
7
W, 21 J /s ]
[R: 18
9
13. Sul libretto di istruzioni di una pompa di calore si legge che il dispositivo consuma una potenza di 790 W e può fornire 9000 BTU/h . Calcolare l’efficienza di questo
elettrodomestico, sapendo che l’unità di misura di energia inglese, il British Thermal
Unit, vale: 1BTU 1055 J .
[R: k 3.34 ]
14. Il condizionatore in figura raffredda una stanza spostando ad ogni ciclo 50.4 kJ in
calore all’esterno, ed utilizzando 12.0 kJ di energia forniti dalla rete casalinga. Calcolare il calore prelevato in un ciclo, l’efficienza del dispositivo e la potenza dissipata,
sapendo che ogni ciclo dura 20.0 s .
[R: 38.4k J, k 3.20, 600 W ]
15. Un frigorifero mantiene sottozero un ambiente, scaricando il calore prelevato in
una miscela di acqua e ghiaccio che va progressivamente fondendo
(Lf 334 k J /kg ) . Ogni ora che trascorre una massa m 18.5 kg di ghiaccio diventata liquida e il contatore casalingo segnato un consumo aggiuntivo di 0.600 kWh .
Calcolare il calore prelevato e l’efficienza.
38
[R: 4.02 103 k J,1.86 ]
3. Il lavoro irreversibile
Come influiscono le irreversibilità sul rendimento di un motore?
Pe
Tutte le irreversibilità riducono il rendimento. Considerando ad esempio il sistema
semplificato costituito da un quantitativo di gas racchiuso entro un cilindro dotato
di stantuffo mobile, abbiamo che:
Pin
(1) Una trasformazione reversibile, allo scopo di evitare turbolenze, prevede la situazione irreale in cui è possibile uno scambio di calore senza che vi sia differenza di temperatura, o meglio in presenza di un T infinitesimo fra il sistema e la sorgente di calore.
Se ipotizziamo che vi siano irreversibilità dovute alla presenza di differenze di temperatura fra sorgenti e sistema, poiché il calore scambiato aumenta proprio con T ,
il rendimento L /QC diminuisce perché è cresciuto il calore ricevuto QC senza
a
che a ciò corrisponda un maggiore esecuzione di lavoro L sull’esterno.
(2) Se è la presenza di attrito a causare irreversibilità, questo impedisce che tutto il
lavoro eseguibile dal motore reale sia applicato all’ambiente: una frazione di esso
serve per vincere l’attrito, con la conseguente riduzione del rendimento. Inoltre le
parti meccaniche che subiscono attrito si riscaldano e ne seguono rilasci irreversibili
di calore verso l’esterno.
(3) Se avvengono altri processi rapidi e turbolenti, durante i quali non sono definibili
le variabili di stato, ed in particolare non lo è la pressione interna, come vedremo nel
seguito è sempre possibile trovare un processo reversibile che, compatibilmente con
lo stato del gas, svolga un lavoro maggiore.
Cosa succede al pistone durante un’espansione irreversibile?
Poniamo che all’interno del gas vi sia una pressione Pi maggiore di quella Pe che
esercitata dall’esterno sul pistone (includendo in essa anche l’effetto del suo peso), e
che a mantenere fissa la parte mobile provveda un meccanismo di blocco. Se si libera
il blocco, poiché l’intensità della forza Fgas che il gas esercita sul pistone verso l’alto
supera l’intensità Pe A della forza che lo spinge in basso il pistone si mette in moto
con accelerazione verso l’alto data da:
ma Fgas Pe A .
Quando la salita è molto brusca, gli strati di gas vicini al pistone divengono più rarefatti rispetto a quelli prossimi al fondo. La pressione che esiste all’interno è ora differente da quella che il gas esercita sulla superficie del contenitore: per far coincidere i due valori lo stantuffo dovrebbe alzarsi con velocità piccola rispetto a quella con cui la rarefazione si propaga nel gas (cioè la velocità del suono). A meno che ciò non avvenga, durante l’espansione non è più possibile definire un valore unico Pi per tutto il
gas. Se quindi la trasformazione non è reversibile siamo costretti ad usare le “coordinate termodinamiche” dell’ambiente (in particolare il valore Pe della pressione
esterna) perché quelle del sistema non sono definite.
Quanto lavoro può complessivamente compiere il gas durante un’espansione?
Per ogni tratto di spostamento s , così piccolo da considerare la forza costante, il
lavoro elementare svolto sul pistone dalle due forze Fgas s e Pe As che agiscono
su di esso è pari alla variazione della sua energia cinetica Ec :
Fgas Pe A s Ec
39
Pe
s
Pfin
ed introducendo la variazione di volume V As , ricaviamo che il lavoro elementare Lgas Fgas s svolto dal gas sull’esterno vale:
Lgas Pe V Ec
In assenza del pistone, ad esempio per una reazione chimica fra liquidi che avviene
alla pressione atmosferica, il ragionamento fatto si applica allo strato di molecole
d’aria immediatamente a contatto con le sostanze.
Pe Pi
Come possiamo sfruttare al massimo questo lavoro?
Dobbiamo osservare che la parte utile di lavoro è solo Pe V , cioè quella che il gas
esegue per contrastare la pressione esterna. E’ grazie ad essa che si sollevano pesi e si
muovono bielle, e quanto più è grande tanto meglio stiamo facendo fruttare
l’espansione. Viceversa il lavoro svolto per incrementare l’energia cinetica del pistone è chiaramente sprecato ai fini pratici. Per massimizzare il primo effetto e minimizzare il secondo, non serve diminuire la massa del pistone, perché in tale caso esso andrà semplicemente più veloce mantenendo invariata l’energia cinetica finale. La
soluzione è quella di ridurre la sua accelerazione aumentando la forza di contrasto
esterna Pe A fino al valore massimo consentito. Come si vede l’accelerazione diver-
Pin
Pe Pi
s
rebbe nulla se, aggiungendo pesi sul pistone si arrivasse a Pe A Fgas , tuttavia non
Pfin
possiamo richiedere l’uguaglianza esatta fra le due forze perché così si impedirebbe
all’espansione di iniziare. Quando però la pressione esterna diviene tale per cui
Pe A è solo di pochissimo inferiore a Fgas siamo vicini ad ottenere il massimo lavoro
utile. Ora il pistone si solleva con velocità molto bassa e praticamente costante. Se
queste condizioni sono verificate in ogni istante, la trasformazione è reversibile ed il
sistema rimane sempre in equilibrio termodinamico. E’ quindi definibile anche la
pressione interna, ed il suo valore è Pi Fgas /A . Possiamo immaginare di realizzare
il processo asportando di volta in volta dei granelli di sabbia posti sopra al coperchio
in modo da mantenere sempre verificata la condizione di reversibilità Pe Pi .
utilizzabile solo
se è reversibile
Come distinguiamo nel piano P-V il lavoro irreversibile da quello reversibile?
Quando il gas si espande bruscamente contro un valore costante di pressione esterna
Pe , partendo da un volume Vin fino ad unoVfin , il lavoro irreversibile è l’area del
Pi Pe
rettangolo verde in figura Lirr Pe (Vfin Vin ) . In condizioni di reversibilità, invece,
Pf Pe
noti in ogni istante i valori della temperatura e del volume del gas dobbiamo imporre alla pressione esterna di assumere i valori forniti per la pressione interna
dall’equazione di stato, descritti dall’andamento della curva blu. Se pazientemente si
segue questo profilo, attraverso l’aggiunta o la rimozione dei granellini sabbia dal
coperchio, al lavoro irreversibile si aggiunge l’area in giallo, ed in queste condizioni
stiamo sfruttando al massimo il lavoro che il gas può compiere sull’ambiente, compatibilmente con i suoi valori istantanei di temperatura e di volume.
Pe
Vin
Lirr Pe Vfin Vin
Vfin
Ci sono anche svantaggi nell’eseguire lavoro in condizioni di reversibilità?
A mano a mano che ci si avvicina alla condizione Pe Pi diminuisce la velocità di
espansione e, nel caso limite di perfetta reversibilità, il tempo richiesto per
l’espansione sarebbe infinito. Ad un processo così lento corrisponde la minima potenza
(cioè il minor quantitativo di lavoro svolto nell’unità di tempo). Il lavoro reversibile è
quindi un espediente per sondare le massime possibilità teoriche delle macchine, ma
non presenta vantaggi pratici.
40
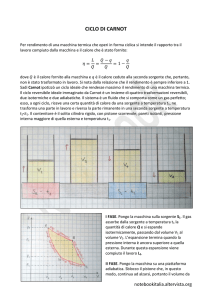
4. Il motore di Carnot
A
B
Il rendimento di un motore non è mai 1 a causa delle irreversibilità?
Non è questa una formulazione soddisfacente del punto fondamentale. Dire che i
motori disperdono per irreversibilità (attriti, salti di temperatura, turbolenza) significa che essi cedono calore alle sorgenti fredde che li circondano: aria, acqua, od
energia cinetica alle strutture dello stesso motore. I primissimi motori termici, proprio a causa delle dispersioni, avevano un bassissimo rendimento. Ad esempio la
macchina a vapore dell’ingegnere inglese T. Newcomen (1705) aveva 0.005 , così La Controfisica
che il 99.95% dell’energia andava sprecato. Un poco più efficiente era quella dello
scozzese J.Watt (1763), il quale, portando il meccanismo di raffreddamento fuori dal
motore, riuscì a far salire fino a 0.04 . Le macchine attuali sono sicuramente migliori, tuttavia anche una moderna centrale nucleare non supera di molto 0.35 .
Che è come dire che il 65% calore sprigionato dalle reazioni nucleari se ne va a riscaldare i pesci di un qualche laghetto o qualche fiume usati come sorgente fredda.
Si faccia attenzione che quando sono
assegnati due stati termodinamici A
e B, non è detto che una trasformazione reversibile fra A e B compia il
lavoro massimo: lo fa solo se il lavoro ha sempre lo stesso segno durante
la trasformazione, cioè se il pistone
si sposta sempre nello stesso verso.
Nella figura un esempio di trasformazione in cui i lavoro cambia segno
muovendoci da A in B..
Quanto è ampio il margine di miglioramento nel rendimento di un motore?
Si potrebbe pensare che, con idee ingegnose che eliminassero tutti gli attriti, le turbolenze, e le irreversibilità, insieme al raffinamento dei meccanismi, potremmo sperare di costruire la macchina perfetta, che restituisca integralmente in forma di lavoro l’energia ricevuta come calore. Ma questa possibilità è nella pratica negata perché,
fra le cause che abbassano il rendimento di un motore, vi è quella intrinseca, ineliminabile, legata alle conseguenze del secondo principio della termodinamica, che
prevede la cessione di un certo quantitativo di calore ad una sorgente fredda. Per indagare in questa direzione, lo scienziato francese Sadi Carnot (1796 –1832), nella sua
opera Riflessioni sulla potenza motrice del fuoco, (1824) fece alcune ipotesi semplificatrici per individuare il problema fondamentale. Il suo punto di arrivo fu ricavare il
rendimento del miglior motore che si possa immaginare, oggi detto il ciclo di Carnot.
Quali sono le caratteristiche di un motore ideale secondo Carnot?
Come si è visto, il fatto che durante una trasformazione reale, un aeriforme non attraversi
solo stati di equilibrio, ma, in generale, in un punto esso avrà una temperatura e un poco
più a destra una temperatura diversa, in una zona una certa pressione e più a sinistra una
pressione differente, comporta un’esecuzione di lavoro inferiore a quello massimo ottenibile in quelle condizioni. Il primo dei miglioramenti di Carnot rispetto ai processi reali fu
di limitarsi alle trasformazioni reversibili, cioè successioni di stati di equilibrio e con
l’assenza di qualunque attrito. Tuttavia questa non è l’unica semplificazione possibile,
perché se vogliamo un motore che funzioni rispettando il secondo principio della termodinamica, non si può fare a meno di cedere calore, oltre che riceverlo. In particolare la
formulazione di Kelvin stabilisce che il motore che scambia calore con una sorgente sola
non può funzionare. Carnot pensò allora alla cosa più semplice dopo il motore – impossibile - ad una sola sorgente: il motore che scambia calore con due sole sorgenti. Due ma
non più di due: una calda ed una fredda.
Ma in linea di principio quante sorgenti può avere un motore reversibile?
Supponiamo di avere un gas perfetto che compie un ciclo reversibile compreso fra
due isoterme, una alla temperatura di 300K e l’altra a 400K . Chiedersi qual è il
numero di sorgenti con cui il gas scambia calore durante il ciclo, è come domandarsi
quante isoterme sono comprese fra quella a temperatura massima e quella a temperatura minima. In effetti, è possibile un numero infinito di tali trasformazioni, proprio come infiniti sono i numeri reali compresi fra 300 e 400 . E siccome le trasformazioni seguite non sono adiabatiche, il sistema deve scambiare calore durante tutto
41
Ciclo di
Carnot
P
due sole
sorgenti
trasformazioni
reversibili
ogni isoterma fra
la max e la min
è una sorgente
400 K
300 K
V
il tragitto e deve scambiarlo mentre varia la sua temperatura. E se vogliamo che gli
scambi di calore siano reversibili anche la temperatura della sorgente deve variare,
perché, lo si è visto, uno scambio di calore fra oggetti a temperatura diversa comporta irreversibilità. Il sistema deve quindi necessariamente interagire con infinite sorgenti a temperatura diversa.
Anche nella realtà le sorgenti di calore sono infinite?
Con il termine sorgente intendiamo un’astrazione, un sistema immaginario la cui
temperatura si mantiene uniforme e costante nonostante gli scambi di calore. In molte applicazioni, il terreno, l’aria atmosferica, l’acqua di un fiume o del mare possono
essere assimilati a sorgenti. Nella realtà si hanno motori che scambiano calore con
tre, quattro sorgenti. Ma per uno scambio reversibile di calore è indispensabile che
non vi siano differenze di temperatura tra sistema e sorgenti: se quindi sono infinite
le temperature che il sistema attraversa, infinite debbono di necessità essere anche le
sorgenti di scambio. Nel caso reversibile è, infatti, indifferente parlare di temperatura del sistema o di temperatura della sorgente.
V1 V2
TC
Espansione isoterma: il gas riceve calore alla
temperatura TC e
compie lavoro
V3 V4
V2 V3
Come possiamo schematizzare la prima fase di questo semplice motore ideale?
Assumiamo quindi due sole sorgenti di scambio, una calda ed una fredda. Vi sarà
una fase iniziale durante la quale il motore produce lavoro ricevendo calore dalla
sorgente calda a temperatura TC . La sostanza che compie il ciclo all’interno del mo-
tore dovrà dilatarsi ma, al tempo stesso, rimanere a temperatura costante. Se, infatti,
la sua temperatura variasse, dovendo essere il sistema in equilibrio con la sorgente
per avere uno scambio reversibile di calore, sarebbe necessario mutare anche la
temperatura di quest’ultima. Come risultato comparirebbero nuove sorgenti con cui
Raffreddamento interagire, una per ogni salto di temperatura. La fase di assorbimento di calore e geadiabatico: il gas nerazione di lavoro deve pertanto essere un’espansione isoterma.
compie lavoro a
spese della pro- Cosa succede dopo che il motore ha compiuto lavoro?
pria energia in- Il sistema va ora raffreddato fino alla temperatura T della sorgente fredda. L’unico
F
terna
modo per passare da TC a TF senza che avvengano scambi di calore, (che richiede-
V4 V1
rebbero ulteriori sorgenti a temperature intermedie), è attraverso un’espansione
adiabatica.
Nella fase successiva è l’ambiente a compiere lavoro sul sistema?
Adesso che il sistema è alla temperatura TF devo ricomprimerlo per riportarlo al vo-
TF
lume iniziale, quindi dobbiamo lavorare su di esso dall’esterno. Valgono ancora le
considerazioni fatte sopra: per avere scambi reversibili di calore, il lavoro necessario
a ridurre il volume deve essere eseguito mantenendo il sistema a temperatura coRiscaldamento stante. La trasformazione sarà ancora un’isoterma, questa volta in compressione.
Compressione
isoterma: il gas
subisce lavoro e
cede calore alla
temperatura TF
adiabatico: il gas
subisce lavoro a Affinché il sistema si ritrovi nelle condizioni di partenza ora va riscaldato?
vantaggio della Sì, per chiudere il ciclo è necessario riportare il fluido alla temperatura TC , ma quepropria energia
sto senza ulteriori scambi di calore, altrimenti occorrerebbero ancora delle sorgenti
interna
intermedie ulteriori. L’unica via percorribile è quella di una compressione adiabatica.
Il ciclo di Carnot è dunque un ciclo motore reversibile a due sole sorgenti, costituito
da due isoterme e due adiabatiche
Qual è il fluido che compie il ciclo?
Non vi sono indicazioni circa la natura del fluido impiegato: qualunque sostanza che
svolga reversibilmente un ciclo di due isoterme e due adiabatiche sta seguendo un
ciclo di Carnot. Solo allo scopo di calcolare il rendimento, possiamo supporre che si
tratti di un gas perfetto. In questo caso è anche nota la rappresentazione del motore
42
sul piano di Clapeyron, che rappresentiamo nella figura successiva. Resterà poi da
capire cosa accade variando la natura della sostanza.
P
1
Quanto Q ed L scambia un motore a gas perfetto che compie un ciclo di Carnot?
Nel piano P-V il gas si trova inizialmente nello stato di equilibrio 1, e da qui si
espande reversibilmente, in una prima fase mantenendo costante la sua temperatura
fino a che non raggiunge lo stato 2, in una seconda fase senza scambiare calore,
lungo l’adiabatica che lo conduce allo stato 3. Successivamente viene compresso,
sempre reversibilmente, prima di nuovo a temperatura costante fino allo stato 4, poi
ancora in modo adiabatico fino a ritornare nello stato iniziale 1. Una sorgente calda a
temperatura TC deve fornire al gas il calore necessario a mantenere isoterma
l’espansione 1 2. Ricordiamo che, in un gas perfetto, durante ogni isoterma anche
l’energia interna rimane costante, cioè E int 0 . Allora, per il primo principio, tut-
2
TC
4
TF
3
Il motore di Carnot V
a gas perfetto
to il calore QC assorbito dal gas viene sfruttato per l’esecuzione di lavoro nella fase
La Controfisica
1 2 :
QC L12 nRTC ln
V2
V1
Poiché lungo l’adiabatica 23 non avviene scambio di calore, al lavoro L23 che
viene compiuto dal gas sull’ambiente deve corrispondere un calo nell’energia interna, alla quale il gas attinge per espandersi, e quindi abbiamo una diminuzione della
temperatura. Durante l’isoterma 3 4 viene compiuto lavoro sul gas, e se vogliamo
che questo non vada ad incrementare il livello di energia interna (elevando così la
temperatura), deve esserci una sorgente fredda TF ad impedire il riscaldamento. Il calore QF che esce dal gas è, in valore assoluto, uguale al lavoro L34 negativo che il
gas esegue:
QF L34 nRTF ln
V4
V3
nRTF ln
V3
V4
.
Per eliminare il modulo si è tenuto conto che nRTF 0 . Inoltre, poiché risulta
V4 /V3 1 , questo comporta ln(V4 /V3 ) 0 , da cui:
ln
V4
V
V
ln 4 ln 3 .
V3
V3
V4
L’ultima fase 41 prevede che il gas, che diminuisce in volume senza scambiare calore, si riscaldi di nuovo fino alla temperatura iniziale. A questo processo il primo
principio fa corrispondere un aumento di energia interna uguale, in valore assoluto,
al lavoro negativo compiuto dal gas. Al termine del ciclo, il gas avrà dunque assorbito calore QC nRTC ln(V2 /V1 ) ad alta temperatura e ne avrà ceduto una parte
QF nRTF ln(V3 /V4 ) a bassa temperatura. In base al primo principio il lavoro
compiuto sarà pari alla differenza fra i due calori: L QC QF .
Quanto vale il rendimento di un motore di Carnot a gas perfetto?
Il rendimento di un motore dipende dal rapporto fra i calori scambiati:
1 QF /QC . Secondo quanto detto, per un ciclo di Carnot si trova:
| QF |
QC
| L34 |
L12
nRTF ln
nRTC ln
43
V3
V4
V2
V1
.
Potrei mettere nella mia auto un motore di
Carnot?
Sarebbe del tutto sconsigliabile: si
tratta di un dispositivo ideale, privo
di qualsiasi utilità pratica. Non potremmo mai realizzare isoterme ed
adiabatiche reversibili, ma anche se
ci riuscissimo il processo di ingresso
ed uscita del calore sarebbero così
lenti che otterremmo macchina certamente molto economica, ma che
non supererebbe la velocità di una
lumaca. Detto diversamente, sarebbe
bassissima la potenza erogata, visto
che il lavoro prodotto, pur essendo
il massimo possibile, viene reso disponibile in un tempo molto lungo
Ora abbiamo che lungo la trasformazione adiabatica 2 3 risulta TCV2 1 TFV3 1 ,
e durante l’adiabatica 4 1 è invece TCV1 1 TFV4 1 . Se queste due relazioni vengono divise membro a membro, si ha:
TC V21
P
TC V11
cicli di Carnot a gas
perfetto che fanno uso
di differenti quantità
di gas ma hanno
uguale rendimento
TF V31
TF V41
V2 V3
.
V1 V4
Sostituendo questa relazione in quella che dà il rapporto fra i calori scambiati si
semplificano i due logaritmi a numeratore e denominatore:
| QF | TF
.
QC
TC
Ne deriva che, nel caso di un gas perfetto, il rendimento di un ciclo di Carnot risulta:
C 1
TF
TC
V
Cosa dice questo risultato sulle proprietà del rendimento di un ciclo di Carnot?
Abbiamo dimostrato che quando un gas perfetto esegue un ciclo di Carnot il rendimento dipende solo dalla temperatura delle due sorgenti. La posizione che hanno, sulle
isoterme nel piano di Clapeyron, i vertici del ciclo, indica solamente quanto grande
stiamo costruendo il motore, cioè quanto lavoro L QC QF il ciclo può fornirci,
ma non dà informazioni sulla sua efficacia, cioè sulla relazione fra L ed il calore assorbito QC . Inoltre quanto più la temperatura TF della sorgente fredda diventa piccola rispetto alla temperatura TC della sorgente calda, tanto più il rendimento cresce. Se TF fosse zero kelvin, il rendimento assumerebbe il suo valore ideale pari ad 1
e tutto il calore assorbito dalla sorgente calda verrebbe restituito in forma in lavoro.
Quel è invece l’efficienza di un ciclo frigorifero di Carnot?
Per un ciclo frigorifero di Carnot, cioè una macchina ideale che, tramite trasformazioni
reversibili, sottrae calore a un’unica sorgente fredda per cederlo a un’unica sorgente calda,
tenuto conto dei segni dei calori, e che le temperature in kelvin sono sempre positive, la relazione |QF |/QC TF /TC diventa ora QF /|QC | TF /TC ed è:
kC
calore prelevato
lavoro ricevuto
QF
L
QF
QC QF
QF
QC
1
QF
QC
TF
TC
TF
1 T
TF
TC TF
C
5. Un “supercarburante” per il motore di Carnot
Se a compiere il ciclo di Carnot non è un gas perfetto, il rendimento cambia ?
Abbiamo calcolato il rendimento del motore di Carnot nel caso specifico in cui a
compiere il ciclo di due isoterme e due adiabatiche sia un gas perfetto, ottenendo
C 1 TF /TC , un risultato indipendente dalle posizioni dei vertici del ciclo (dove
si incontrano adiabatiche ed isoterme), cioè indipendente dalle quantità di calore
scambiate. Vogliamo ora dimostrare che se a compiere il ciclo di Carnot è una qualunque altra sostanza, ad esempio un gas reale, oppure una miscela di più gas, come
l’aria, un insieme di gas e vapori, o altro ancora, oppure se variamo le dimensioni
del motore, il rendimento rimane lo stesso:
44
Tutti i cicli reversibili che scambiano calore solo con due sorgenti, una a TC ed
T
una a TF , sono detti cicli di Carnot, ed il loro rendimento è sempre 1 F quaT
C
lunque sia il sistema fisico che compie il ciclo.
Fissate TC e TF , cosa può ancora variare nel motore di Carnot a gas perfetto?
Supponiamo di avere un motore di Carnot a gas perfetto, C A , che operi fra due
sorgenti a TC ed a TF , ed il suo rendimento, fissato dalle temperature, sia, ad
TC
100J
esempio, A 1/ 5 . Osserviamo che si può ottenere A costruendo un motore
CA
della dimensione che vogliamo: quello in figura preleva QC 100 J e produce
20J
L 20 J cedendo QF 80 J : come risultato abbiamo A 1 80/100 1/ 5 . Ma
il rendimento sarebbe lo stesso se il motore fosse più grande (e lavorasse quindi
con un maggior quantitativo di gas), ad esempio prelevando QC 150 J , producendo L 30J
80J
e cedendo QF 120 J . Anche in questo caso avremmo
TF
A 1 120 /150 1/5 .
Cosa rispondere a qualcuno che sostenesse di poter superare il nostro motore?
Poniamo che qualcuno si presenti sostenendo di aver scoperto un super carburante.
Utilizzandolo per alimentare il suo motore di Carnot C B , egli è convinto di poter
battere il rendimento del nostro a gas perfetto, pur lavorando fra le stesse temperature. In formule dovremmo dire che per assurdo si sta ipotizzando l’esistenza di un
C B con B A . Assumiamo dunque che il motore C B faccia fruttare molto meglio
TC
100J
del nostro il calore QC 100 J prelevato dalla sorgente calda, trasformandone in lavoro una parte più consistente, diciamo L 40J e che di conseguenza sia più piccola l’energia rimanente che viene ceduta alla sorgente fredda sotto forma di calore,
cioè QF 100 J 40 J 60 J . Il rendimento sarebbe in questo caso esattamente il
CB
40J
60J
doppio: B 1 60 /100 2/ 5 . Ma come si è visto, anche se il rendimento è fissato,
TF
possiamo fare il nostro C A grande come vogliamo. Tariamolo allora in modo che produca anche lui gli stessi 40 J di lavoro. Per fare questo, siccome è per ipotesi meno efficiente, pretenderà di ricevere maggior calore dalla sorgente calda rispetto a C B ,
nello specifico servono QC 200 J ,
e ne cederà di più alla sorgente fredda:
QF 160 J . In questo modo infatti si ha L QC QF 200 J 160 J 40 J .
E facendo questo si mette in difficoltà il motore sfidante?
Per porre in difficoltà C B sfruttiamo la reversibilità del motore di Carnot e facciamo
funzionare il nostro C A al contrario. C A diventa una macchina frigorifera che, ricevendo 40 J di lavoro, è in grado di prelevare 160 J dalla sorgente fredda e di spostarli in quella calda. Ora chiediamo al padrone di C B di fornirci lui i 40 J di lavoro
necessari per far funzionare il frigorifero. Possiamo stare certi di aver smascherato
l’impostore perché se davvero fosse possibile alimentare C A in questo modo
avremmo costruito un frigorifero senza spina. Guardiamo, infatti, l’azione combinata delle due macchine racchiuse entro la linea tratteggiata C A C B . Dalla sorgente
fredda esce un calore che complessivamente vale 160 J 60 J 100 J , e lo stesso
quantitativo entra nella sorgente calda: 200J 100J 100J . Il dispositivo combinato
C A C B sarebbe allora una macchina che, senza ricevere lavoro dall’esterno, può
spostare calore da una temperatura bassa ad una più elevata, in piena violazione del
postulato di Clausius.
45
TC
200J 100J
CA
40J
160J
CB
60J
TF
Ma questa dimostrazione numerica ha una validità generale?
Quanto detto non è limitato dal fatto che si sono scelti particolari valori. Quali che
siano il rendimento ed il lavoro prodotto, è sempre possibile ripetere il ragionamento contro chiunque sostenesse di poter fare meglio di un motore di Carnot fra due
temperature fissate: è sufficiente ingrandire il nostro motore finché non arriva a fornire lo stesso lavoro del suo, quindi trasformarlo in un frigorifero e poi chiedere a lui
di alimentarlo.
Possiamo concludere che i due rendimenti sono uguali?
Dai ragionamenti sopra, si conclude soltanto che non può essere vera l’ipotesi
B A . Deve allora valere per forza la relazione a essa complementare, e cioè che:
B A . A questo punto potremmo ripetere l’intero ragionamento scambiando i
ruoli di C A e di C B : partendo dall’ipotesi A B e facendo adesso funzionare a
rovescio C B si ottiene che non può essere nemmeno vero che A B e che quindi
varrà la sua complementare, cioè A B . Dovendo essere vero sia B A , sia
La Controfisica
Tutti i motori reversibili hanno lo stesso
rendimento di quello di Carnot?
No, per uguagliare il ciclo di Carnot
un motore, anche se reversibile, deve
scambiare calore con due sole sorgenti, altrimenti ne esce inesorabilmente sconfitto.
A B , l’unico modo in cui ciò può avvenire è che:
A B
e quindi abbiamo dimostrato tutti i cicli di Carnot che lavorano fra le medesime
temperature hanno lo stesso rendimento, indipendentemente dalla sostanza che
adoperano.
E se la macchina B non fosse reversibile?
Se poi la macchina B non è di Carnot, ma una qualunque macchina irreversibile a due
sorgenti allora varrà solo la prima metà della dimostrazione, non essendo ora più
possibile invertire il funzionamento di una macchina irreversibile semplicemente
cambiando di segno alle quantità di calore. Pertanto è dimostrato anche che:
per una macchina qualunque, che scambia calore con due sole sorgenti, il rendimento
non supera mai quello di una macchina di Carnot fra le stesse temperature:
Carnot
e se la seconda macchina è anch’essa di Carnot vale il segno di uguaglianza.
Analogamente si può dimostrare che l’efficienza di un frigorifero, che scambia calore
con due sole sorgenti, non supera mai l’efficienza di una macchina frigorifera di
Carnot che lavora fra le stesse temperature k kCarnot .
Esercizi
16. Una macchina termica produce in ogni ciclo un lavoro L 100J scambiando calore
con due sole sorgenti a TC 500K e TF 300K . Sapendo che 0.250 si dica se la
macchina è reversibile, e si trovino i calori scambiati con ciascuna sorgente.
Se la macchina fosse reversibile, avendo due sole sorgenti di scambio il suo rendimento
sarebbe quello di un motore di Carnot che opera fra le stesse due temperature:
T
300 K 2
C 1 F 1
0.400
TC
500 K
5
La macchina è quindi irreversibile essendo 0.250 0.400 . Per il calcolo dei calori scambiati dalla formula per il rendimento si ha:
L
100 J
100
0.250
QC
J 400 J
QC
QC
0.250
e dal primo principio:
L QC QF
QF 400 J 100 J 300 J
46
17. Si deve svolgere un lavoro L 250 J utilizzando un motore termico che funziona
fra la temperatura di fusione del ghiaccio e quella di ebollizione dell’acqua. Calcolare la
minima quantità di calore da fornire.
[R: 933J ]
18. Nelle centrali nucleari si produce la scissione dei nuclei atomici, che sprigiona frammenti dei nuclei di Uranio dotati di grande energia cinetica. Questi frammenti veloci sono
usati per riscaldare acqua, formando vapore che raggiunge una temperatura di 260C . Si
consideri dunque un impianto che ha un rendimento 0.330 , ed è costruito nelle
prossimità di un fiume, che per la sua temperatura media 13C è sfruttato per il raffreddamento. Dovremmo incolpare gli ingegneri di aver progettato un macchinario altamente inefficiente?
[R]
19. Un motore di Carnot funziona fra una sorgente a 20.0C ed una ad 80.0C . Calcolare di quanto dobbiamo aumentare la temperatura della sorgente calda se vogliamo raddoppiare il rendimento.
[R: TC 91C ]
20. Un motore di Carnot esegue 150 J di lavoro prelevando 600J di calore da una sorgente calda. Calcolare di che percentuale dev’essere aumentata la temperatura della sorgente calda se vogliamo che il motore esegua lo stesso lavoro prelevando solo due terzi
del calore. Calcolare il rendimento del motore nei due casi.
[R: 20%, 1 , 3 ]
4 8
21. Stimare la minima quantità di lavoro necessaria ad un frigorifero per trasformare in
gelato a 4.00°C un chilogrammo di latte che si trova alla temperatura ambiente di
35.0°C . Si assumano per il latte tutte le caratteristiche dell’acqua, in particolare il calore
specifico c 4186 J /kg K
ed il calore latente di fusione/solidificazione
3.34 105 J /K .
[R: 7.43 104 J ]
22. Sulla base dei principi della termodinamica, si dica se la macchina A illustrata è un
dispositivo che possa realmente funzionare.
[R: no]
23. Sulla base dei principi della termodinamica, si dica se la macchina B illustrata è un
dispositivo che possa realmente funzionare.
[R: si]
24. Sulla base dei principi della termodinamica, si dica se la macchina C illustrata è un
dispositivo che possa realmente funzionare.
[R: no]
25. Un condizionatore da 750 W è in grado di raffreddare al ritmo di 5000 BTU
(1 BTU 1055 J) all’ora. Si valuti la sua efficienza, confrontandola con quella di un frigorifero ideale che debba mantenere una temperatura interna di 20.0 °C quando
all’esterno si hanno 30.0 °C .
[R: k 1.954; kCarnot 29.3 ]
26. Un motore irreversibile funziona fra due sorgenti a T1 350 K e T2 650 K compiendo 200J di lavoro ogni ciclo, cedendo alla sorgente fredda il doppio del calore che
cederebbe un motore di Carnot utilizzando le stesse sorgenti. Calcolarne il rendimento.
[R: 0.300 ]
27. Un ciclo frigorifero di Carnot mantiene una stanza a temperatura 10.0C riversando
ogni ciclo 200J nell’ambiente esterno a 40.0C . Calcolare il calore prelevato ogni ciclo e
l’efficienza del dispositivo.
[R: 19.2 J; kC 9.43 ]
47
600K
600K
50J
50J
A 40J
B 40J
10J
10J
300K
300K
600K
40J
C 60J
20J
300K
28. Un motore reversibile compie cicli di durata 15.0 s prelevando calore da una sorgente a TC 400 K e cedendo calore ad una miscela di acqua e ghiaccio a Pat . Sapendo
che ogni secondo si fondono mediamente m 4.00 g di ghiaccio ( Lf 334 k J /kg )
calcolare il calore prelevato in un ciclo e la potenza erogata.
[R: 4.31 104 J ,2.87 kW ]
29. Un chiosco deve mantenere del gelato a temperatura costante 4.00C quando fuori
sono 35.0C . La radiazione solare giunge al suolo in ragione di 1000 W/m 2 ed il frigo
ha la forma di un cubo di spigolo 1.00 m , di cui solo tre facce sono esposte al Sole. Se un
sesto del calore incidente giungesse al gelato, quanta dovrebbe essere la minima potenza
necessaria al frigorifero per funzionare?
[R: 3.45 kW ]
30. Un motore di Carnot riceve 700 cal ogni ciclo dalla sorgente calda, alla temperatura
di 440 K , mentre la sorgente fredda ha una temperatura di 310 K . Calcolare il lavoro
eseguito dal motore ogni ciclo ed il calore ceduto alla sorgente fredda.
[R:]
31. Un motore di Carnot cede alla sorgente fredda il 70% del calore ricevuto dalla sorgente calda. Si calcoli l’efficienza del dispositivo e il lavoro eseguito ad ogni ciclo, sapendo che
dalla sorgente calda riceve 1500 cal
[R:]
32. Un motore di Carnot usa del gas perfetto che inizialmente occupa un volume di
2.20 103 m 3 alla temperatura di 400 K ed alla pressione di 8.50 atm . Dopo
l’espansione isoterma, il volume è diventato 5.40 103 m 3 , e dopo la successiva espan-
P2
sione adiabatica è 8.50 103 m 3 . Trovare il valore di pressione al quale l’isoterma e
l’adiabatica si incontrano, e calcolare il lavoro eseguito nel ciclo.
[R:]
P1
33. Un gas perfetto segue un ciclo costituito da due isocore e da due isobare, in cui il volume passa da V1 20.0 m 3 a V2 40.0 m 3 , e la pressione da P1 3.00 atm a
P2 6.00 atm . Si calcoli il rapporto fra il rendimento di questo ciclo e quello di un moto-
V1
V2
re di Carnot che lavori fra la massima e la minima temperatura di questo ciclo.
[R:]
34. Un frigorifero di Carnot preleva calore da un corpo alla temperatura di 15.0C e lo
trasferisce ad uno alla temperatura di 22.0C e per eseguire ogni ciclo necessita di
40000 J . Calcolare l’efficienza del dispositivo, il calore sottratto al corpo freddo e quello
ceduto al corpo caldo ogni ciclo.
[R:]
35. Una pompa di calore di Carnot preleva calore da una stanza a 5.0C e lo trasferisce
all’esterno dove l’aria ha una temperatura di 30.0C . Si calcoli l’efficienza di questa macchina, e il rapporto fra il calore trasferito all’esterno e quello prelevato dalla stanza per
ogni ciclo eseguito.
[R:]
36. Un frigorifero di Carnot preleva del calore da una miscela di acqua e ghiaccio a 0C e
lo trasferisce ad un bollitore dove è contenuta dell’acqua a 100C . Calcolare quanta acqua
è congelata nella miscela a 0C quando nel bollitore sono evaporati 0.600 kg .
(Lfus 334 k J /kg , Lev 2260 k J /kg) .
P2
2
3
37.
4
P1
1
V1 V3
5
V4
[R:]
Un certo quantitativo di gas perfetto inizialmente nello stato 1 in figura, con
T1 400K , esegue il ciclo 123451, dove il tratto 3-4 è una trasformazione isoterma. Sa-
pendo che V1 0.600 , V3 0.800 ,V4 1.40 , P1 1.20 atm , P1 4.40 atm , calcolare il rendimento del ciclo, ed il rendimento massimo che si può ottenere lavorando fra
la massima e la minima temperatura raggiunte.
[R:]
48
6. La temperatura termodinamica
T
Q1
Possiamo usare il ciclo di Carnot come termometro?
Come sappiamo, i termometri a mercurio, o che in genere fanno uso di liquidi, presentano disaccordo a causa dei differenti coefficienti di dilatazione. Quelli a gas (perfetto) mostrano maggiore omogeneità, però non sono più utilizzabili alle bassissime
temperature, quando il gas reale condensa. Un ciclo di Carnot, invece, può essere
svolto da una qualunque sostanza, anche in fase condensata. Poiché il suo rendimento è indipendente dal fluido utilizzato, e legato solo alle temperature, possiamo
allora trasformare il ciclo di Carnot in un termometro nel modo che ora descriveremo. Si sceglie una temperatura di riferimento, quella del punto triplo dell’acqua, e si
assegna ad essa il valore misurato con la scala termometrica a gas perfetto:
C
Q2
C
T
Ttriplo
Q
Qtriplo
Q
T 273.16
Qtriplo
La temperatura T così definita, è in sostanza una misura di calore, e si dice temperatura termodinamica del corpo. I suoi valori coincidono con quelli della scala Kelvin
già introdotta tramite il gas perfetto, ovviamente solo nella regione in cui questa si
può materialmente misurare.
Perché esiste uno zero per la temperatura termodinamica?
Supponiamo di avere una sorgente a temperatura T da cui sia prelevato del calore
Q1 per opera del primo di una serie di cicli di Carnot, posti in maniera che il calore
ogni volta uscente venga immesso nel ciclo successivo. Se calibriamo i cicli in modo
che ognuno esegua lo stesso lavoro L , a ciascun passo deve corrispondere un calore
in uscita sempre minore, e nel contempo il quantitativo complessivo Q1 inizialmente
prelevato va progressivamente ad esaurirsi. Alla fine dovremo giungere ad un ultimo passo in cui, per produrre lo stesso lavoro L , tutto il calore entrante viene utilizzato e niente è ceduto. La temperatura così prodotta da questi cicli è ritenuta di zero
assoluto: scendere al di sotto richiederebbe un rendimento maggiore di 1 cioè più
lavoro in uscita che non calore in ingresso, violando il primo principio.
E’ possibile raggiungere lo zero della scala della temperatura termodinamica?
Il secondo principio della termodinamica vieta espressamente la possibilità 1 , in
quanto implicherebbe QF 0 , ossia potremmo fare a meno della sorgente fredda.
Ora, nel motore di Carnot si ha 1 quando TF 0 K , e dunque dobbiamo concludere che non è mai possibile non solo scendere sotto a 0 K , ma nemmeno raffreddare la materia fino ad un tale valore di temperatura.
49
L
Q3
Ttriplo 273.16 K . Fatto questo possiamo stabilire qual è la temperatura di un corpo
semplicemente misurando il rapporto fra i calori scambiati da una qualunque sostanza che svolga un ciclo di Carnot fra la temperatura di riferimento
Ttriplo 273.16 K , e la temperatura T dell’oggetto:
L
QN
C
L
7. Il teorema di Clausius per i cicli
A
T1
T2
...
Tn
Consideriamo un sistema A che compia una trasformazione ciclica. Durante la trasformazione, in generale A scambierà calore, reversibilmente od irreversibilmente,
con un certo numero di sorgenti, T1,T2 , Tn . Consideriamo il rapporto Qi /Ti fra il
calore Qi scambiato con ciascuna di esse e la temperatura della sorgente stessa. Vogliamo valutare il segno della somma di questi rapporti, cioè il segno di
Q1 /T1 Q2 /T2 Q3 /T3 ... . Non conoscendo né il valore dei calori né il loro verso
di scambio, e neanche le temperature delle sorgenti, non appare evidente se una tale
quantità debba essere positiva, negativa oppure nulla. Tuttavia un risultato dovuto a
Clausius mostra che:
Disuguaglianza di Clausius
in una trasformazione ciclica, cioè che alla fine del processo riporta le funzioni di stato
del sistema al valore iniziale, la somma dei rapporti fra calori scambiati e tempera-
…
ture delle sorgenti di scambio Q1 /T1 Q2 /T2 Q3 /T3 ... non può mai essere positiva.
A
Come si può giungere ad una tale conclusione ?
T1
T2
Tn
Immaginiamo delle macchine di Carnot C1 , C 2 , C n , motori o frigoriferi, che lavo-
C1
C2
Cn
che durante ogni ciclo, ciascuna di esse scambi con le T1 , T2 , Tn gli stessi calori
T0
rino fra le temperature Ti e la temperatura di una sorgente esterna T0 . Supporremo
(ma in verso opposto), che queste sorgenti scambiano con A .
Questo è possibile sebbene il rendimento di Carnot sia fissato dalle temperature?
Sebbene il rendimento della macchina sia fisso, la dimensione può essere scelta a
piacimento. Possiamo costruirla grande in modo da farle produrre il lavoro che vogliamo, ma anche della dimensione giusta per farle scambiare il quantitativo di calore che desideriamo. Se quindi Qi è uscito dalla sorgente Ti per entrare in A , costruiremo la macchina Ci della dimensione necessaria affinché ceda a Ti la stessa
quantità Qi . Se viceversa è Ti ad aver acquistato calore da A , faremo Ci abbastanza grande affinché glielo sottragga nuovamente tutto.
In un ciclo quanto calore viene complessivamente scambiato con la sorgente T0 ?
Consideriamo un ciclo del nuovo sistema composto dall’unione di A con C1 ,
C 2 , C n : esso scambia calore unicamente con la sorgente T0 . Ovviamente non sappiamo se nel complesso il calore sia entrato od uscito da T0 . Chiamiamo Q0 il suo
valore e diciamo L0 il lavoro prodotto dalle macchine. Come accade al termine di
ogni ciclo, anche qui non sarà mutato il contenuto energetico interno del sistema
A C 1 ... C n , cioè E int 0 . Dal primo principio segue che Q0 L0 0 ,
quindi tutto il calore scambiato deve uguagliare il lavoro prodotto: Q0 L0 .
Ma così non si sta violando il secondo principio nella forma di Kelvin?
In base al secondo principio nella forma di Kelvin, un sistema come A C 1 ... C n
che riceve calore da una sola sorgente, non può avere come unico risultato la sua trasformazione integrale in lavoro. L’unica possibilità di evitare la contraddizione col postulato di Kelvin è che il sistema non stia ricevendo dalla sorgente T0 il calore Q0 per tramutarlo in lavoro L0 , ma che lo stia cedendo ad essa. Dobbiamo cioè concludere che,
grazie al lavoro L0 , il calore Q0 viene ceduto alla sorgente T0 dal sistema composto
50
A C 1 C 2 C n . E poiché un calore uscente dal sistema ha segno negativo si
ha:
Q0 0
.
Abbiamo mostrato che Q0 è negativo , ma come possiamo ricavare il suo valore ?
Indicando con Q0i il calore che ciascuna macchina scambia con la sorgente T0 , sfruttando le proprietà dei cicli di Carnot risulta per ognuno Q0i /Qi T0 /Ti , da cui
Q0i T0 (Qi /Ti ) . Sommando i vari Q0i si ottiene Q0 :
Q
Q
Q0 Q01 Q02 ... T0 1 2 ... 0
T1 T2
e poiché T0 è espressa in kelvin e non può essere negativa, si conclude che per le trasformazioni cicliche vale la disuguaglianza di Clausius già annunciata:
Q
1 Q2
... 0
T1 T2
E se la trasformazione ciclica di A fosse anche reversibile?
In tal caso il sistema A potrebbe seguire lo stesso ciclo anche al contrario. Chiamando
Qi* i nuovi calori scambiati, il ragionamento fatto per giungere alla disuguaglianza
di Clausius continuerebbe a valere, cioè dovrebbe ancora essere Q0 0 per non
violare il postulato di Kelvin, da cui, come prima possiamo dedurre che anche i nuovi calori soddisfano la disuguaglianza Q0 T0 (Q1* /T1 Q2* /T2 ...) 0 . Ma percorrendo al contrario un ciclo reversibile, i calori hanno solo mutato il verso di scorrimento e non il valore, e quindi risulta Qi* Qi , che inserita nella nuova disuguaglianza di Clausius produce:
Q * Q *
Q
Q
1
2 ... 1 2 ... 0
T2
T1
T1 T2
Ora si deve osservare che le due relazioni trovate, quella con la macchina reversibile
che funziona in un verso (Q1 /T1 Q2 /T2 ...) 0 , e quest’ultima con la macchina
reversibile azionata in verso opposto (Q1 /T1 Q2 /T2 ...) 0 , possono essere contemporaneamente vere solo se la somma fra le parentesi è nulla:
Teorema di Clausius
In un ciclo reversibile la somma dei rapporti fra calori scambiati e temperature delle
sorgenti di scambio è nulla
Q1 Q2 Q3
... 0
T1 T2
T3
il teorema di Clausius mostra come il segno di uguale nella precedente disuguaglianza
di Clausius si trova solo quando le trasformazioni sono reversibili.
51
P
Quale proprietà fisica corrisponde al teorema di Clausius?
Il teorema di Clausius estende la proprietà già trovata per i cicli di Carnot,
|QF | /QC TF /TC , (e cioè QC /TC QF /TF 0 ) ad un ciclo reversibile con più di due
sorgenti. Ciò significa che è sempre possibile una scomposizione di un ciclo reversibile in tanti tratti di isoterma ed adiabatica, cioè è lecita un’approssimazione tramite
cicli di Carnot. La figura illustra il caso particolare del ciclo di un gas perfetto, sovrapposto ad un insieme di cicli di Carnot a gas perfetto anch’essi, aventi temperature di poco differenti fra di loro. L’approssimazione può essere resa tanto migliore
quanto più fitta si fa la suddivisione.
V
Quando il ciclo reversibile, a cosa si riferiscono le temperature nella sommatoria?
Uno scambio reversibile di calore deve avvenire senza differenze di temperatura.
Quindi nella disuguaglianza di Clausius, oltre a valere il segno di uguale, le temperature delle sorgenti al denominatore sono uguali a quelle del sistema.
Come possiamo enunciare a parole queste due relazioni dovute a Clausius?
Se al termine di un ciclo irreversibile di un sistema che scambia calore con n
sorgenti, si fa la somma dei rapporti fra i calori scambiati e le temperature delle
sorgenti di scambio, si ottiene sempre un numero negativo. Se il ciclo è invece
reversibile, tale somma vale zero, ed inoltre le temperature da riportare nella
sommatoria coincidono con quelle assunte dal sistema durante il ciclo.
Esercizi
38. Una macchina termica preleva calore Q1 500 J da una sorgente a temperatura
T1 600 K e cede sia calore Q2 una sorgente a temperatura T2 400 K sia calore
Q3 200 J ad una sorgente a temperatura T3 300 K . Calcolare il rendimento
massimo possibile per questo ciclo e confrontarlo con quello di un ciclo di Carnot
che lavori fra la massima e la minima temperatura.
Il rendimento è definito come:
Q QF
Q Q2 Q3
L
C
1
QC
QC
Q1
Come abbiamo visto tutte le irreversibilità riducono il rendimento, quindi il massimo si ha quando la macchina è reversibile. In queste condizioni si può applicare il
teorema di Clausius e calcolare il valore incognito Q2 :
Q1
T1
Q2
T2
Q3
T3
0
Q
Q
500 200
Q2 T2 ( 1 3 ) 400 (
)J 66.7 J
T1 T3
600 300
da cui si ottiene il rendimento massimo:
Q Q2 Q3
500 66.7 200
1
0.467
Q1
500
Il ciclo di Carnot che lavora fra T3 300 K e T1 600 K ha rendimento ancora
maggiore:
T
300
C 1 F 1
0.500
TC
600
52
8. Il teorema di Carnot
P
Si è già visto già per i cicli irreversibili a due sole sorgenti si ha: Carnot . E’ tempo
ora di far gareggiare il ciclo di Carnot con motori a più di due sorgenti, reversibili od
irreversibili che siano. In generale, anche se le sorgenti sono in numero infinito, si potrà sempre individuare quella con la più alta temperatura, Tmax , e quella con la
temperatura più bassa, Tmin . Diremo allora che il motore sta operando fra Tmin e
Tmax . Un caso particolare è quello di un ciclo reversibile, ad infinite sorgenti, compiuto da un gas perfetto: la sua rappresentazione sul piano di Clapeyron è compresa fra le isoterme corrispondenti alle due temperature estreme. Evidenzieremo ora
la superiorità del motore di Carnot rispetto a qualunque concorrente, dimostrando
che nessun motore può avere un rendimento superiore al suo:
Teorema di Carnot:
il massimo rendimento fra tutti i cicli termici che operano fra la stessa temperatura
minima Tmin e massima Tmax compete ai cicli reversibili che scambiano calore solo
con due sorgenti, una a Tmin ed una a Tmax . Essi sono detti cicli di Carnot, ed il loro
rendimento è sempre 1 (Tmin /Tmax ) qualunque sia la natura del sistema fisico che
compie il ciclo e la dimensione del motore.
Quanto vale il rendimento di un ciclo con più di due sorgenti?
Durante il ciclo vi saranno momenti durante i quali entra calore nel sistema e momenti in cui ne esce. Indicando il calore complessivamente uscente con QE 0 ed il
calore complessivamente entrante con QU 0 , dalla definizione di rendimento, usando il modulo per il calore totale uscente in modo da esplicitarne il segno, si ha:
1
|QU |
QE
Cosa dice la disuguaglianza di Clausius riguardo ad un ciclo a più sorgenti ?
La disuguaglianza di Clausius assicura che per i cicli con un numero qualunque di
sorgenti si ha (Q1 /T1 Q2 /T2 ...) 0 , dove il segno di uguale vale solo nel particolare caso di ciclo reversibile. Distinguendo ora, in tale espressione, i calori entranti
QE 1,QE 2 ,... da quelli uscenti QU 1,QU 2 ,... , ed introducendo i moduli per esplicitare il
segno, riscriviamo la disuguaglianza di Clausius nella forma:
Q
|Q |
|Q |
E 1 QE 2
... U 1 U 2 ... 0 .
TU 2
TE 1 TE 2
TU 1
Possiamo far figurare le temperature massima e minima in queste sommatorie?
Se ora i calori QE 1,QE 2 ,... della prima sommatoria fra parentesi, invece che per le
temperature delle sorgenti dalle quali entrano, li dividiamo per la più alta di esse,
Tmax , otteniamo di certo un numero più piccolo, avendo aumentato il denominatore.
Raccogliendo Tmax a fattor comune e scrivendo QE come somma dei calori entranti
si ha quindi:
53
Tmax
Tmin
V
Q
Q
(Q Q ...)
Q
Q
E 1 QE 2
E2
... E 1 E 2 ... E 1
E .
Tmax
Tmax
TE 1 TE 2
Tmax Tmax
Allo stesso modo, se nella seconda sommatoria dividiamo i calori uscenti anziché per
le temperature delle sorgenti a cui sono ceduti, per il valore Tmin corrispondente alla
sorgente a temperatura più bassa fra esse, otteniamo una quantità più grande, avendo diminuito il denominatore:
Q
E 1 ... |QU 1| ... 0
T
1 T1
QE /Tmax è
più piccolo
di questo
termine
|QU |/Tmin è
più grande
di questo
termine
|Q |
|Q |
( |Q | |Q | ...)
|QU 2|
|Q |
|Q |
U 1
U1
U2
U 1 U 2 ...
...
U
TU 2
Tmin
Tmin
Tmin
TU 1
Tmin
.
Se quindi sostituiamo nella disuguaglianza di Clausius QE /Tmax al posto della prima
parentesi, e |QU | /Tmax al posto della seconda stiamo sottraendo ad una quantità più piccola di quella originale una quantità più grande di quella originale, col risultato di diminuire il valore di tutta l’espressione, che quindi diviene strettamente negativa:
QE
Tmax
| QU |
Tmin
0
| QU |
QE
Tmin
Tmax
E se inseriamo il risultato trovato nella formula per il rendimento del motore?
Se ora nella formula per il rendimento, al posto del rapporto fra i calori |QU | /QE sottraiamo la quantità Tmin /Tmax che abbiamo dimostrato essere più piccola, otteniamo
un numero più grande del rendimento stesso. Come si vede, questo numero coincide
con l’espressione trovata per il rendimento di un motore di Carnot:
1
| QU |
QE
1
Tmin
Tmax
Carnot
La relazione trovata è proprio il teorema di Carnot già enunciato, e mostra che il
rendimento di un qualunque ciclo reversibile, è minore di quello di un ciclo di Carnot che scambia calore solo con sorgenti alle temperature massima e minima fra cui
il ciclo sta lavorando2.
2
Per i cicli irreversibili si può invece mostrate che il rendimento non è mai maggiore di quello di Carnot.
54