PROGRAMMA DI SCIENZE
Classe I sez. B
anno scolastico 2015/2016
Prof.ssa Lucilla Cerio
SCIENZE DELLA TERRA
La forma e l’aspetto della Terra
− La forma e le dimensioni della Terra (ellissoide, geoide)
− La distribuzione delle acque e delle Terre emerse
− La geografia e l’orientamento
− L’orizzonte e i punti cardinali
− Le carte geografiche e la posizione dell’Italia
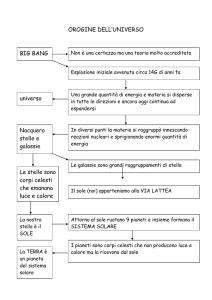
L’Universo intorno a noi
− Il posto della Terra nell’Universo
− Osservare il cielo: la sfera celeste (costellazioni, elementi di riferimento sulla sfera celeste)
− L’orizzonte astronomico e l’altezza delle stelle
− Le stelle sembrano muoversi intorno a noi
− Il cielo visto dall’Italia
− Stelle: luminosità apparente e assoluta, magnitudine apparente e assoluta, il colore e la temperatura
delle stelle, il diagramma H-R, evoluzione delle stelle, come muore una stella, i resti stellari: nane
bianche, stelle di neutroni, buchi neri.
− Le galassie: i tipi di galassie (a spirale, ellittiche, irregolari), la Via Lattea.
− Le sorti dell’Universo: l’Universo in espansione, l’effetto Doppler, lo spostamento verso il rosso e la
legge di Hubble, l’evoluzione dell’Universo: inizio dell’Universo (Big bang) e fine dell’Universo.
− Le distanze astronomiche (unità astronomiche e anno luce).
Il Sistema Solare intorno a noi
− Il Sistema Solare: origine del Sistema Solare (ipotesi nebulare), il Sole (struttura e attività), principali
caratteristiche dei pianeti terrestri e dei pianeti gioviani, i pianeti nani, i corpi minori del Sistema
Solare (satelliti, asteroidi, comete, meteore e meteoriti). Le leggi di Keplero e la legge di
gravitazione universale.
I moti della Terra e le loro conseguenze
− Il moto di rotazione e sue conseguenze: giorno, dì e notte; la forza centrifuga e la forza di Coriolis;
Variazioni di accelerazione di gravità e peso dei corpi; Guglielmini e Foucault dimostrano che la
Terra ruota
− Il moto di rivoluzione e sue conseguenze: giorno solare, le stagioni astronomiche, equinozi e solstizi
− I moti millenari: moto conico dell’asse, la precessione degli equinozi
− L’astronomia e la misura del giorno solare e giorno civile, l’ora civile e i fusi orari.
La Luna
− Il sistema Terra-Luna: caratteristiche della superficie lunare, i moti della Luna (moto di rotazione, di
rivoluzione e di traslazione), le fasi lunari, il mese sinodico e il mese sidereo, le eclissi.
Libro di testo:
C. Pignocchino Feyles – Scienza della Terra (primo biennio) – Ed. SEI
CHIMICA
La materia
− Sistema
− Miscele: omogenee ed eterogenee. Separazione dei componenti di una miscela: filtrazione,
centrifugazione, distillazione, estrazione con solventi, cristallizzazione, cromatografia.
− Sostanze pure: elementi e composti, miscele e composti.
− Passaggi di stato, curve di riscaldamento e di raffreddamento,
L’Atomo
− Leggi ponderali: legge di conservazione della massa (legge di Lavoiser), legge della composizione
costante (legge di Proust), legge delle proporzioni multiple (legge di Dalton).
− Teoria atomica di Dalton
− Natura elettrica della materia: particelle subatomiche (elettrone, protone), raggi catodici, raggi
canale.
− Modello atomico di Thomson
− Modello atomico di Rutherford: esperimento di Rutherford, Numero atomico, limiti della teoria di
Rutherford.
− Modello atomico di Bohr
− Modello quanto-meccanico: orbitali atomici
− Numeri quantici: principale, secondario, magnetico, di spin. Forma e simboli degli orbitali atomici.
Principio di esclusione del Pauli.
− Energia degli orbitali: ordine di riempimento degli orbitali, configurazione elettronica.
− Il Neutrone: numero di massa, isotopi.
− Massa atomica: unità di massa atomica, massa atomica relativa.
Tavola periodica degli elementi
−
−
−
−
−
Tavola periodica di Mendeleev
Sistema periodico: struttura a blocchi, periodi e gruppi
Elementi chimici: nomi, simboli, stato fisico
Configurazione elettronica esterna nello stato fondamentale
Proprietà periodiche degli elementi: densità, raggio atomico, energia di ionizzazione, affinità
elettronica, elettronegatività.
− Metalli, non metalli e semimetalli: carattere metallico e non metallico degli elementi
Legami chimici
−
−
−
−
Il legame chimico
Legame ionico
Molecole e legge di combinazione dei volumi, Principio di Avogadro
Legame covalente: omopolare o puro, polare o eteropolare, dativo e di coordinazione, parametri del
legame covalente
− Ibridazione: configurazione esterna nello stato eccitato, orbitali ibridi (sp, sp2, sp3), ibridazione del
Carbonio.
Libro di testo:
V. Posca – Dimensione chimica: Atomi e molecole. Ed. G. D’Anna