Le trasformazioni chimiche
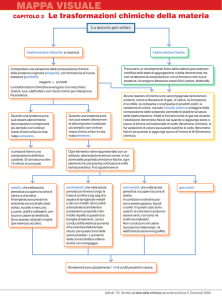
Tutte le trasformazioni che non alterano la composizione chimica di una sostanza si chiamano
TRASFORMAZIONI FISICHE O FENOMENI FISICI.
LE TRASFORMAZIONI FISICHE PROVOCANO UN CAMBIAMENTO FISICO REVERSIBILE DELLA
MATERIA E NON PRODUCONO NUOVE SOSTANZE.
Le trasformazioni chimiche sono cambiamenti che comportano la formazione di nuove
sostanze con proprietà anche molto diverse da quelle dei materiali originari.
TRASFORMAZIONE CHIMICA: le reazioni chimiche sono trasformazioni che comportano una
variazione della composizione chimica delle sostanze originarie= reagenti, con formazione di
nuove sostanze= prodotti.
Per rappresentare una reazione chimica si scrivono a sinistra i REAGENTI e a destra i PRODOTTI
collegati con una FRECCIA es: reagenti→ prodotti
Idrogeno+ ossigeno→ acqua
La freccia spiega l’andamento della reazione e ci informa che i reagenti si trasformano nei
prodotti.
Una reazione chimica avviene se la trasformazione comporta:
Formazione di bollicine
Cambiamento di colore
Formazione o scomparsa di un solido
Riscaldamento o raffreddamento del recipiente in cui avviene la reazione,
senza che sia sottratto o fornito calore dall’esterno.
Per distinguere con certezza se sia avvenuta o meno una reazione chimica bisogna ricorrere ad
un’analisi chimica
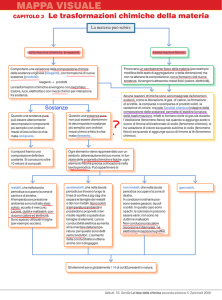
Gli elementi e i composti
(sostanze pure non separabili con mezzi fisici)
Elementi: si definisce elemento una sostanza pura che non può essere trasformata, con gli
ordinari mezzi chimici, in altre sostanze ancora più semplici. Es: se si prova a fare l’analisi di un
oggetto in ferro puro si vedrà che esso è costituito solo da ferro
COMPOSTI: si definisce composto ogni sostanza pura che può essere decomposta, con gli
ordinari mezzi chimici, in altre sostanze pure più semplici. I composti hanno una
composizione ben definita e costante. (acqua distillata, zucchero,cloruro di sodio…)
L’acqua formata dagli elementi idrogeno e ossigeno può essere divisa negli elementi che lo
costituiscono attraverso l’elettrolisi , decomponendola formando idrogeno gassoso e ossigeno
gassoso ACQUA(l)→ IDROGENO(g)+ OSSIGENO(g)
gassoso.
i pedici (l) (g) stanno a significare liquido e
I miscugli
(Possono essere separati con mezzi fisici)
Si dividono in:
Omogenei: SOLUZIONI= acqua potabile, cognac, aria, bronzo…
Eterogenei: sabbia, legno, roccia, sangue…
La tavola periodica
Nel 1869 il chimico russo Dmtrij Mendeleev scoprì che gli elementi potevano essere classificati e
ordinati sulla base delle loro proprietà chimiche e fisiche costituì una TAVOLA PERIODICA DEGLI
ELEMENTI.
Gli elementi a oggi conosciuti sono 118
92 presenti in natura per lo più sotto forma di composti e raramente nella forma
elementare.
26 sono stati scoperti nel corso di ricerche sull’energia atomica oppure con reazioni
nucleari
Per indicare gli elementi si utilizzano delle abbreviazioni SIMBOLI, costituiti da una, due, tre
lettere, la prima scritta in maiuscolo la terza e la seconda, se ci sono, in minuscolo. Nella lettura va
nominata una lettera alla volta. Gli elementi della tavola periodica sono organizzati in:
Righe= PERIODI
Colonne= GRUPPI
All’interno della tavola periodica distinguiamo tre classi di elementi:
METALLI
NON METALLI
SEMIMETALLI
I metalli
Le proprietà fisiche caratteristiche dei metalli sono
Lucenti
Buoni conduttori di calore
Buoni conduttori di elettricità (fili elettrici in genere sono di rame o alluminio)
Duttili= si possono ridurre in fili
Malleabili = possono essere modellati in lamine sottili con uno stampo a pressione o
martello
A temperatura ambiente, 20°C, i metalli sono solidi tranne il MERCURIO. Gli oggetti metallici usati
spesso non sono costituiti da metalli puri ma da leghe metalliche cioè miscugli omogenei es: ghisa,
acciaio inossidabile.
Non metalli
Occupano la parte destra della tavola periodica, le caratteristiche sono:
Variamente colorati
Gassosi ma anche liquidi e solidi
Cattivi conduttori di calore e di elettricità
Né duttili né malleabili si frantumano se colpiti
Il CARBONIO ha un comportamento particolare: sotto forma di grafite è un discreto conduttore di
corrente elettrica ma non di calore; sotto forma di diamante il contrario
I semimetalli
Presentano proprietà intermedie fra i metalli e i non metalli:
A temperatura ambiente sono solidi
Sono semiconduttori (né conduttori né isolanti) quando contengono impurezze degli
elementi vicini es germanio e silicio impuri.