Introduzione all’Epidemiologia
"While the individual man is an insoluble puzzle, in the aggregate he becomes a mathematical certainty.
You can, for example, never foretell what any one man will do, but you can say with precision what an
average number will be up to."
A. Conan Doyle
Sherlock Holmes: The Sign of Four
Etimologia del termine
Il termine Epidemiologia deriva dall’unione di tre parole della lingua greca: Epi, demos, logos
Il termine evoca l’immagine di epidemie dovute ad agenti infettivi. Ciò deriva dal contesto in cui la
disciplina si sviluppò, l’Inghilterra del 19° secolo.
Oggi l’epidemiologia si occupa ancora di malattie infettive, ma il suo ambito di interesse si è allargato allo
studio dei fenomeni salute-malattia nelle popolazioni
Definizione
È lo studio della frequenza delle malattie
E' lo studio della frequenza e della distribuzione dei fenomeni salute/malattia nelle popolazioni e dei
fattori e le circostanze che le determinano
Cenni storici
Nell’antichità misure di Sanità Pubblica furono istituite sulla base di osservazioni relative alla frequenza di
determinate malattie in gruppi di individui (isolamento per i lebbrosi, proibizione dell’assunzione di carne
di maiale, leggi contro i matrimoni tra consanguinei)
Nel XVIII secolo d.C. Lind descrive l’occorrenza dello scorbuto in relazione a condizioni ambientali e
nutrizionali, dimostrando come esso potesse essere prevenuto aggiungendo alla dieta arance e limoni
(primo trial)
Nel XIX secolo, Snow effettua studi sulla diffusione del colera, ipotizzando che l’acqua contaminata fosse
la causa delle epidemie
2
L’epidemiologia e la pratica clinica
Pratica clinica
Epidemiologia
Individuo
Popolazione
Descrizione
Caratteristiche uniche della malattia
Caratteristiche comuni della malattia in più
della malattia
nel singolo individuo
individui
Metodo di
Semeiotica
Studi descrittivi
Diagnosi
Studi costruttivi o analitici
Conoscenze epidemiologiche utili per
L’osservazione clinica e l’utilizzo degli esami
elaborare una diagnosi di malattia e
strumentali e di laboratorio contribuiscono alla
valutare la prognosi
conoscenza epidemiologica della malattia
Oggetto di
interesse
osservazione
Metodo di
analisi
Interscambio
Elementi distintivi dell’epidemiologia
1) Focus sulla popolazione e non sul singolo individuo
2) Confronto tra gruppi
1) Focus sulla popolazione e non sul singolo individuo
L’epidemiologia ci consente di fare previsioni affidabili per l’intero gruppo ma non per il singolo individuo
Es. popolazione di 200,000 donne
Tasso di tumore alla mammella: 150 casi/100,000 donne per anno
Se il tasso rimane costante, ci aspetteremo circa 300 nuovi casi ogni anno.
Non possiamo dire quali tra le 200,000 svilupperanno la malattia. A livello individuale parleremo di
probabilità (o rischio)
Rischio ad 1 anno: 300/200,000= 0.0015 = 1.5‰
2) Confronto tra gruppi
Per indagare sulle cause di una malattia, l’ideale è realizzare un confronto tra ciò che si osserva in
presenza dell’esposizione e ciò che sarebbe avvenuto se l’esposizione fosse stata assente. Tale approccio
è evidentemente irrealizzabile. Si utilizza quindi un approccio contro-fattuale (contrario alla realtà),
ovvero si effettua un confronto tra gruppi di individui che differiscono per l’esposizione.
Es. in un gruppo di 100 lavoratori esposti a polveri sottili per 10 anni, 5 si sono ammalati di tumore delle
basse vie respiratorie. Cosa sarebbe successo se questi lavoratori non fossero stati esposti alle polveri
sottili? È impossibile rispondere a tale domanda (dovremmo infatti tornare indietro nel tempo).
Confronteremo allora l’esperienza dei 100 lavoratori “esposti” con quella di altri lavoratori “non esposti” a
tali polveri.
3
Misure di frequenza
L’ epidemiologia studia la frequenza e la distribuzione dei fenomeni salute-malattia.
Per studiare la frequenza di un fenomeno è necessario:
-
definire il fenomeno in maniera univoca (definizione del caso)
-
definire la popolazione nella quale si intende contare le occorrenze
-
definire le fonti dei dati
“Misurare” la frequenza di una patologia
Frequenza assoluta: conta del numero di eventi che si sono verificati
-
Definizione dell’ evento da contare
Es. quanti tra i pazienti ricoverati hanno un’infezione sintomatica del tratto urinario?
Un’infezione sintomatica del tratto urinario deve rispettare almeno uno dei seguenti criteri (CDC):
Criterio 1: il paziente ha almeno uno dei seguenti segni o sintomi senza altra causa riconosciuta: febbre
(>38° C), urgenza nella minzione, frequente minzione, disuria, … e il paziente ha un’urinocoltura positiva,
cioè >= 10^5 microorganismi per cm^3 …
Criterio 2: il paziente ha almeno due dei seguenti segni o sintomi senza altra causa riconosciuta: febbre
(>38° C), urgenza nella minzione, frequente minzione, disuria, … e almeno uno dei seguenti:
a. striscia per urine positiva per leucocite esterasi …
b. piuria (campione di urine con >=10 wbc/mm^3 …
c. almeno due urino-colture con isolamento dello stesso patogeno (batteri Gram-negativi o S.
saprophyticus) …
Dopo aver raccolto informazioni su segni e sintomi dei pazienti ricoverati e sui risultati delle analisi di
laboratorio, è possibile fare una conta di eventi.
Frequenza relativa: conta del numero di eventi che si sono verificati, rapportati ad un totale di riferimento
-
Definizione dell’ evento da contare (il numeratore)
-
Definizione del totale di riferimento (il denominatore)
Studio della frequenza relativa di una patologia
Prevalenza
Incidenza
Numeratore
Casi esistenti
Nuovi casi
Denominatore
totale soggetti
totale soggetti “a rischio” nel periodo considerato
4
Relazione tra prevalenza ed incidenza di una malattia
In alcune situazioni (stato stazionario) la relazione tra prevalenza ed incidenza di una malattia può essere
rappresentata con l’equazione P = I x D
P : prevalenza
I : incidenza
D : durata media della malattia
Prevalenza
Calcolo della prevalenza di una malattia
Occorre valutare per ognuno degli N soggetti in studio la presenza o meno di una malattia. Immaginiamo
di osservare a casi
Prevalenza = a/N
È un quantità priva di dimensioni (non ha unità di misura)
Assume valori compresi tra 0 e 1
È di solito espressa come n° di soggetti malati per 100, 1000 …
È irrilevante da quanto tempo la malattia sia presente.
È calcolata negli studi trasversali
La prevalenza è una proporzione, ed esprime il numero di soggetti che presentano una particolare
caratteristica come percentuale di tutti i soggetti che compongono la popolazione. È nota anche come
proporzione di Prevalenza
Morbosità (prevalente)= N° malati / N° persone in un dato istante o periodo di tempo
La prevalenza puntuale è la proporzione di una popolazione che è affetta da una malattia in un
determinato istante
La prevalenza periodale è la proporzione di una popolazione che è affetta da una malattia in un intervallo
di tempo
Esempio di prevalenza puntuale
In uno studio sulle condizioni di salute degli abitanti di un quartiere, su 431 persone di età uguale o
superiore a 65 anni, 52 avevano insufficienza cardiaca
prevalenza puntuale = 52/431 = 0.12 = 12%
Esempio di prevalenza periodale
Un’azienda sanitaria locale ha bisogno di informazioni per organizzare un programma di assistenza
domiciliare per persone disabili non autosufficienti. All’inizio del 2001 erano 96 i disabili, 40 altre persone
lo divennero nel corso dell’anno (pop= 25000)
prevalenza periodale = (96+40)/25000= 0.54 %
5
Incidenza
Se la prevalenza è una misura di stato, l’incidenza misura il cambiamento di stato (non malato-›malato)
È possibile calcolare la proporzione d’incidenza (in popolazioni chiuse) ed il tasso d’incidenza (in
popolazioni chiuse ed in popolazioni aperte)
Proporzione di incidenza (incidenza cumulativa, rischio)
È la proporzione della popolazione che contrae la malattia in un determinato intervallo di tempo. Si
misura solo in popolazioni chiuse
Morbosità (incidente)= N° persone che si ammalano nell’intervallo t0-t1 / N° persone a rischio a t0
Calcolo dell’incidenza cumulativa
Immaginiamo di osservare N soggetti che sono “a rischio” di contrarre una determinata malattia in un
certo intervallo di tempo. Alcuni diventeranno malati (n) nell’intervallo t0-t1
Incidenza cumulativa = n/N nell’intervallo ∆T
È di solito espressa come n° di soggetti che sviluppano la malattia per 100, 1000 a rischio a t0
È una quantità priva di dimensioni
Assume valori compresi tra 0 e 1
Richiede che sia specificato l’intervallo di tempo
È irrilevante quando la malattia si verifichi nell’intervallo t0-t1
A livello individuale si usa il termine rischio (è la probabilità che un individuo sviluppi un determinato
evento nell’arco di un periodo di tempo definito)
Esempio di incidenza cumulativa
In uno studio su 81 pazienti con lesioni traumatiche della cornea, ammessi al Pronto Soccorso, 49 non
lamentano più dolore ed irritazione dopo 24 ore
Incidenza di guarigione a 24 ore = 49/81 = 0.40 = 40%
Dopo 2 giorni i soggetti guariti sono diventati 61
Incidenza di guarigione a 48 ore = 61/81 = 0.75 = 75%
6
Tasso di incidenza (densità d’incidenza)
È il numero di nuovi casi di malattia diviso per il tempo-persona nella popolazione osservata. Può essere
misurato sia per popolazioni aperte che per popolazioni chiuse. Spesso viene misurato un massimo di un
evento per persona.
Morbosità (incidente)= N° persone che si ammalano nell’intervallo t0-t1 / N° unità tempo-persona
È il rapporto tra numero di nuovi eventi (n) ed il periodo di tempo totale durante il quale i soggetti sono
stati a rischio di contrarre l’evento
Si utilizza come denominatore 100, 1.000, 100.000 unità tempo-persona (anni-persona, mesi-persona,
giorni-persona)
Ha come unità di misura t-1
Tasso d’incidenza = n/Σ(tempo-persona a rischio)
Es. L’incidenza, standardizzata per età, di tumore della cervice uterina a metà degli anni ’90 è stata pari a
15/100000 anni-persona
Tasso d’incidenza: esempio di calcolo
In un reparto di Medicina generale, sono stati posizionati degli accessi venosi centrali a 170 pazienti nel
corso di 6 mesi. Tale procedura può essere associata a diverse complicazioni, quale la comparsa di
flebite, la dislocazione del catetere o l’ostruzione. In funzione delle necessità terapeutiche ogni paziente
sarà “esposto” a tale procedura per un periodo di tempo differente
Come calcolare la frequenza di complicazioni?
Sono stati eseguiti 358 accessi venosi centrali
Totale del tempo di esposizione: 1560 giorni
Media di esposizione 4 giorni (min=1; max=15)
Si sono verificate 97 flebiti
Tasso d’incidenza=97/1560=0.062= 62/1000 giorni ago-cannula
7
Studio di un’epidemia
Uno dei pochi casi in cui si impiega la frequenza assoluta è la rappresentazione della curva epidemica.
Nella curva epidemica l’asse delle ordinate riporta il numero di eventi, mentre l’asse delle ascisse
rappresenta il tempo, che viene suddiviso in piccoli intervalli di tempo. Il grafico è un istogramma.
Dalla forma del grafico possiamo ricavare informazioni sul tipo di fonte e sulla modalità di trasmissione
della malattia
Esempio di una curva epidemica
Outbreak di gastroenterite da Norovirus nei soldati di leva dell’esercito statunitense nel 1998
Fonte singola, esposizione puntuale
Fonte singola, esposizione prolungata nel tempo
Trasmissione inter-umana
8
Esposizione ed effetto
In epidemiologia, si è spesso interessati a conoscere quale sia l’effetto di una determinata “esposizione”.
-
Es. 1. qual è l’effetto di una dieta vegetariana sulla salute? La dieta vegetariana rappresenta
l’esposizione, il risultante stato di salute è l’effetto.
-
Es. 2. qual è l’effetto dell’uso del telefono cellulare sull’occorrenza di tumori cerebrali? L’uso di
telefono cellulare rappresenta l’esposizione, il tumore cerebrale è l’effetto
-
Es. 3. qual è l’effetto della vitamina C nella prevenzione del raffreddore comune? L’assunzione di
vitamina C rappresenta l’esposizione, il raffreddore comune è l’effetto.
In tutti e 3 gli esempi, siamo interessati a studiare una relazione tra due variabili, una variabile è
l’esposizione (var. indipendente), l’altra variabile è l’effetto (var. dipendente). Altre variabili possono
alterare o modificare la relazione tra queste 2 variabili: sono le variabili confondenti e le variabili
modificatrici di effetto.
Per valutare la relazione esposizione-effetto, utilizziamo studi di epidemiologia analitica (studio delle
cause delle malattie) e studi sperimentali (studio dell’efficacia di un intervento sanitario). In entrambi i
casi, effettueremo un confronto tra la frequenza dell’effetto in diversi gruppi, nel caso più semplice in 2
gruppi (esposti e non esposti)
L’esposizione è la presunta causa
L’effetto è lo stato di salute (o di malattia) risultante
L’esposizione è la situazione in cui agente (o fattore di rischio) ed ospite sono presenti insieme. Può
essere di diversa durata ed intensità (istantanea, intermittente, cronica)
Esempi di esposizione: fumo, alcool, obesità, dieta, farmaco, gene, inquinamento, radiazioni
L’effetto è il risultato dell’interazione tra agente (o fattore di rischio) ed ospite. Si può verificare a diversa
distanza nel tempo dall’esposizione
Esempi di effetto: morte, malattia, pressione arteriosa, glicemia, disabilità, piaghe da decubito, dolore,
infezione della ferita chirurgica
9
Lo studio delle cause delle malattie
Il nesso di causalità è ciò che mette in relazione le cause con gli effetti che esse producono.
Gli studi di epidemiologia costruttiva o analitica valutano nessi di causalità. Le “prove” epidemiologiche
non sono sufficienti a stabilire un nesso di casualità, ma costituiscono solo elementi circostanziali.
Definizione di Causa
Possiamo definire la causa di uno specifico evento di malattia come un evento, una condizione o una
caratteristica che ha preceduto l’evento di malattia, e senza il quale la malattia non si sarebbe verificata o
si sarebbe verificata in un tempo successivo.
In realtà, nessun evento, condizione o caratteristica specifiche è sufficiente di per sé a produrre l’effetto.
Questa definizione non si riferisce al complesso del meccanismo causale, ma soltanto ad un suo
componente.
Esistono diverse tipologie di cause
-
cause necessarie
-
cause sufficienti
-
cause non necessarie né sufficienti
Ogni evento non ha un’unica causa, ma più di una. Inoltre, ogni evento può verificarsi attraverso diversi
meccanismi d’azione. Diversi fattori possono contribuire in ognuno dei meccanismi d’azione.
Quasi tutte le malattie sono determinate dall’interazione tra fattori genetici e fattori ambientali.
Modello a torta di Rothman
Es. la carenza di glucosio-6-fostato-deidrogenasi è un’anomalia congenita del metabolismo. Se la persona
affetta da tale carenza (per la quale si effettua lo screening neonatale) assume una dieta contenente
fenil-alanina, si può verificare un ritardo mentale.
Come misurare un effetto causale
L’approccio ideale per misurare un effetto causale non è realizzabile: confrontare l’esperienza dei soggetti
esposti con quella degli stessi soggetti in assenza dell’esposizione, quando ogni altra condizione rimane
costante, non è infatti possibile.
Si utilizza quindi un approccio indiretto per studiare l’effetto di una particolare esposizione: ad es.
confronteremo l’esperienza in termini di salute o di malattia di gruppi di individui che differiscono per
l’esposizione.
Se è impossibile, per ogni singolo caso di malattia, conoscere quali ne siano state le cause, possiamo
invece stimare quali siano le cause di una malattia in un gruppo di individui malati.
Es. fumo e tumore del polmone
10
Misure di effetto
Esistono diversi tipi di misure di effetto
-
misure di effetto relativo
-
misure di effetto assoluto
-
misure di effetto attribuibile
Misure di effetto relativo
Esprimono l’aumento o la riduzione della frequenza della malattia in una popolazione esposta rispetto ad
una popolazione di riferimento (non esposta) in termini relativi. Si costruiscono dividendo la frequenza
della malattia nella popolazione esposta per la frequenza della malattia nella popolazione non esposta
Il Rischio Relativo (RR)
È un termine generico che indica un rapporto tra:
-
il tasso di incidenza tra gli esposti ed il tasso di incidenza tra i non esposti
-
la proporzione di incidenza tra gli esposti e la proporzione di incidenza tra i non esposti
-
(la prevalenza tra gli esposti e la prevalenza tra i non esposti)
È una misura adimensionale (non ha unità di misura)
Il valore di 1 rappresenta l’assenza di effetto. Valori più grandi di 1 indicano un aumento del rischio
associato all’esposizione. Valori più piccoli di 1 indicano una diminuzione del rischio associato
all’esposizione
N.B. Il rischio relativo non è un rischio. È una misura di effetto, non una misura di frequenza
Calcolo del Rischio Relativo
Trial clinico IBIS-I (prevenzione del cancro della mammella). Follow-up di 5 anni
RE = 69/3578 = 0.019
RNE = 101/3566 = 0.028
RR = RE/RNE = 0.019/0.028 = 0.68
la riduzione del rischio di tumore della mammella nel gruppo di soggetti trattati con il farmaco rispetto al
gruppo trattato con placebo, è del 32% (1.00-0.68=0.32)
Uno studio di coorte durato 19 anni tra 5.135 medici giapponesi ha studiato la relazione tra il consumo di
alcolici e la mortalità; la mortalità standardizzata per età per malattia coronarica è stata di 26,3 morti per
10.000 anni-persona nei non-bevitori e pari a 16,2 per 10.000 anni-persona nei bevitori occasionali. Il
rapporto tra tassi d’incidenza (RR) è 26,3/16,2=1,62.
Il tasso di mortalità è stato del 62% superiore nei non-bevitori rispetto ai bevitori occasionali (1.621=0.62)
Quando i gruppi messi a confronto sono più di due, un gruppo fa da riferimento. Gli altri gruppi vengono,
uno per uno, confrontati con il gruppo di riferimento
11
Doll & Hill (BMJ 1964)
Lung cancer mortality
Rate (R) per 1,000
RR
Myocardial infarction mortality
Rate (R) per 1,000
person-years
RR
person-years
Non-smokers
0.07
1.00
3.61
1.00
1-14 cig/day
0.57
8.1
4.65
1.29
15-24 cig/day
1.39
19.9
4.57
1.27
25+ cig/day
2.27
32.4
5.16
1.43
All
0.94
-
4.50
-
L’Odds Ratio (OR)
È un rapporto di odds e non un rapporto tra misure di incidenza (densità d’incidenza o proporzione
d’incidenza) come nel caso del Rischio Relativo. Ha la stessa interpretazione del RR
Se l’evento è “raro”, il valore dell’OR è simile a quello del corrispondente RR
Viene calcolato negli studi caso-controllo
Episodi di infezioni respiratorie superiori
Modalità di nutrizione
Uno o più
Nessuno
Totale
Artificiale
207
238
445
Allattamento materno
34
72
106
Totale
241
310
551
OR=(207*72)/(34*238)=1.84
L’odds di infezione è dell’84% più alto nei neonati che utilizzano latte artificiale rispetto ai neonati che
sono allattati al seno.
12
Misure di effetto assoluto
Esprimono l’aumento o la riduzione della frequenza della malattia in una popolazione esposta rispetto ad
una popolazione di riferimento (non esposta) in termini assoluti. Si costruiscono sottraendo alla frequenza
della malattia nella popolazione esposta la frequenza della malattia nella popolazione non esposta
Il Rischio Differenziale (RD)
È un termine generico che indica la differenza tra:
-
il tasso di incidenza tra gli esposti ed il tasso di incidenza tra i non esposti
-
la proporzione di incidenza tra gli esposti e la proporzione di incidenza tra i non esposti
-
(la prevalenza tra gli esposti e la prevalenza tra i non esposti)
La differenza tra proporzioni è adimensionale (non ha unità di misura). La differenza tra densità
d’incidenza ha come unità di misura t-1
Il valore di 0 rappresenta l’assenza di effetto. Valori positivi indicano un aumento del rischio associato
all’esposizione. Valori negativi indicano una diminuzione del rischio associato all’esposizione
Calcolo del Rischio Differenziale
Confronto tra placebo e Raloxifene nella prevenzione del tumore al seno (follow-up 4 anni)
RE = 13/1771=0.7%
RNE = 26/879=3.0%
RD = RE-RNE = 0.7%-3.0%= -2.3%
la differenza assoluta nel rischio tra i due interventi è di 2 eventi per 100 soggetti trattati
Number Needed To Treat (NNT)
Esprime il numero di soggetti che è necessario trattare per evitare un evento (negativo) per la salute
Quanto più piccolo è tale valore (sempre positivo) tanto maggiore è l’efficacia dell’intervento in esame
rispetto all’intervento di riferimento
Calcolo del NNT
Confronto tra placebo e Raloxifene nella prevenzione del tumore al seno (follow-up 4 anni)
RE = 13/1771=0.7%
RNE = 26/879=3.0%
RD = RE-RNE = 0.7%-3.0%= -2.3%
NNT = 1/(RD) = 1/0.023 = 43
Occorre trattare 43 soggetti con Raloxifene per evitare un singolo caso di tumore al seno
13
Misure di effetto attribuibile
Esprimono la proporzione di casi di malattia che possiamo considerare attribuibili cioè causati
dall’esposizione
-
Frazione attribuibile all’esposizione negli esposti (o Rischio Attribuibile all’esposizione negli Esposti
- RAE)
-
Frazione attribuibile all’esposizione nell’intera popolazione (esposti e non esposti) (o Rischio
Attribuibile all’esposizione nella Popolazione- RAP)
RAE = (RE-RNE)/RE = (RR-1)/RR
RAP = (R-RNE)/R = [(REp+RNE(1-p)-RNE]/[(REp+RNE(1-p)] =
[REp+RNE-RNEp-RNE]/(REp+RNE-RNEp) = (REp-RNEp)/[p(RE-RNE)+RNE] =
= p(RE-RNE)/[p(RE-RNE)+RNE] =p(RR-1)/[p(RR-1)+1]
Doll & Hill (BMJ 1964)
Lung cancer mortality
p
Rate (R) per 1,000
RR
person-years
Myocardial infarction mortality
Rate (R) per 1,000
RR
person-years
Non-smokers
0.29
0.07
1.00
3.61
1.00
Smokers
0.71
1.30
18.6
4.86
1.35
All
1.00
0.94
-
4.50
-
Mortalità per tumore al polmone
RAE=(18.6-1)/18.6=0.95
Il 95% dei casi di tumore al polmone tra i fumatori sono attribuibili, cioè causati, dal fumo
RAP=0.71(18.6-1)/[0.71(18.6-1)+1]=0.93
Il 93% dei casi di tumore al polmone nell’intera popolazione (fumatori e non fumatori) sono attribuibili,
cioè causati, dal fumo
14
Il disegno dello studio
Per identificare delle cause di malattia, abbiamo bisogno di metodi che ci consentano di evidenziare delle
relazioni e stabilire l’esistenza di leggi. In alcune situazioni (es. in laboratorio), il ricercatore può
manipolare le condizioni in esame e valutare il risultato dei cambiamenti introdotti. In epidemiologia,
spesso il ricercatore non può intervenire modificando l’esposizione dei soggetti. La maggior parte degli
studi epidemiologici sono studi “osservazionali” -> maggior complessità (bias!)
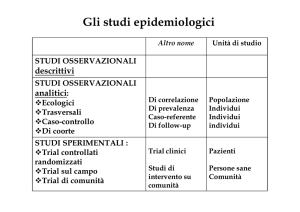
Le strategie dell’epidemiologia clinica
-
Epidemiologia osservazionale
o
o
o
Studi descrittivi
Case-report
Case-series
Studi costruttivi
Trasversali
Caso-controllo
Coorte
Studi sperimentali
Trial Clinici Randomizzati (RCT)
Studi case-report e case-series
Descrivono l’esperienza e le caratteristiche di un singolo paziente, o di un gruppo di pazienti con la stessa
diagnosi. L’analisi delle caratteristiche dei casi osservati può portare alla formulazione di nuove ipotesi
sulla causa delle malattie. Osservazioni mediche insolite possono essere il primo indizio di una nuova
malattia, di effetti nocivi di un’esposizione o di efficacia di un trattamento.
Svantaggi: mancano di un gruppo di controllo. La presenza del fattore di rischio e della malattia può
essere una coincidenza
Case report: dettagliata descrizione di segni e sintomi o risultati di laboratorio relativi ad un “caso tipico”
Esempio di case report
Case series: dettagliata descrizione di segni e sintomi o risultati di laboratorio relativi ad una serie di casi
Esempio di case-series. Prima del 1980, il sarcoma di Kaposi era un tumore molto raro negli USA (3 casi
al New York Cancer Research Centre tra il 1960 ed il 1979). La polmonite da Pneumocystis Carinii era
rarissima se non in casi di immunodeficienza
Tra ottobre 1980 e maggio 1981 5 giovani omosessuali furono ricoverati in tre ospedali di Los Angeles
per polmonite da Pneumocystis Carinii. A luglio 1981 furono identificati 26 casi di sarcoma di Kaposi in
omosessuali a New York e in California. Nell’agosto 1981 108 casi di sarcoma di Kaposi e polmonite da
Pneumocystis Carinii, di cui 96 in omosessuali
15
Studi trasversali
Lo studio trasversale misura la frequenza dei fenomeni di salute-malattia e dei fattori ad essi correlati in
un determinato istante, che non è necessariamente lo stesso per tutti gli individui (es. prevalenza di
malformazioni congenite)
Secondo l’obiettivo che si prefiggono, gli studi trasversali possono essere distinti in:
Studi descrittivi (surveys)
Studi eziologici
Lo studio trasversale permette il calcolo della prevalenza degli eventi di salute-malattia, non permette di
calcolare i valori di incidenza (es. nuovi casi di malattia in una popolazione in un intervallo ∆t), poiché i
soggetti in esame vengono osservati una sola volta
Poiché esposizione e malattia sono rilevati nello stesso istante in molti casi non è possibile stabilire se
l’esposizione ha preceduto la malattia, oppure se ne è stata una conseguenza. Inoltre, poiché vengono
studiati i casi prevalenti e non quelli incidenti, i dati ottenuti rifletteranno sempre i determinanti della
sopravvivenza, oltre agli eventuali fattori causali
esempio
Immaginiamo di voler studiare la relazione tra rumorosità del luogo di lavoro (esposizione) e sordità
(effetto). Alcuni lavoratori, alla comparsa dei primi segni di sordità, potrebbero aver ottenuto un nuovo
lavoro in un ambiente meno rumoroso e quindi, al momento dello studio di prevalenza, risultare non
esposti ad un luogo rumoroso.
Se ciò fosse avvenuto, la prevalenza di sordità sarà quindi più bassa nel luogo rumoroso e più alta nel
luogo non rumoroso. Si avrà quindi una sottostima del rischio associato all’esposizione.
Potrebbe anche avvenire che solo i lavoratori con un certo grado di sordità ottengano posti di lavoro
rumorosi, mentre i lavoratori “sani” potrebbero tendere ad evitare questi mestieri
In questo caso, la prevalenza di sordità sarà più alta nel luogo rumoroso e più bassa nel luogo non
rumoroso. Si avrà quindi una sovrastima del rischio associato all’esposizione
Gli studi trasversali sono relativamente facili da condurre e sono utili per valutare l’effetto di quelle
esposizioni che sono caratteristiche fisse degli individui (ad es. caratteristiche genetiche)
Vantaggi: Non è richiesto un periodo di follow-up, né è necessario selezionare un gruppo di controllo.
L’informazione sull’esposizione attuale è spesso migliore rispetto al ricordo di una esposizione passata
Svantaggi: Non può essere determinato il tempo di esposizione
16
Studi di coorte
Il termine “Coorte” deriva dalle coorti romane. Le coorti sono definite in base ai valori della variabile di
esposizione. Alla fine del follow-up, l’occorrenza della malattia viene confrontata tra le coorti. Di solito,
vengono prese in esame almeno 2 gruppi (coorti). Negli studi con una singola coorte, i soggetti vengono
poi suddivisi in diversi gruppi a seconda della presenza/assenza di un determinato fattore.
Gli studi di coorte consentono di calcolare il rischio (popolazioni chiuse, follow-up fisso ed uguale per
tutti) o il tasso di incidenza (popolazioni aperte, follow-up variabile).
Gli studi di coorte sono utili a valutare gli effetti di esposizioni rare. È possibile infatti osservare nel tempo
l’esperienza di coorti di individui esposti a situazioni infrequenti (ad es. militari esposti ad uranio
impoverito nelle zone di guerra).
Negli studi coorte si possono misurare una varietà di outcome (mortalità generale, mortalità specifica per
causa, recidiva, metastasi, infarto, angina, diabete, insorgenza di un tumore, crisi d’asma, episodio di
raffreddore, …)
Possono essere prospettici o retrospettivi
Studio di coorte: un esempio
È stato condotto uno studio per valutare la relazione tra esposizione durante il primo trimestre di una
gravidanza a farmaci ACE inibitori e frequenza di malformazioni congenite. È stata studiata una coorte di
29,507 neonati nati tra il 1985 ed il 2000 arruolati nel programma Tennesse Medicaid. Sono stati
identificati 209 neonati le cui madri erano state esposte ad ACE inibitori durante il primo trimestre, 202
neonati le cui madri erano state esposte ad altri farmaci anti-ipertensivi, e 29,096 neonati le cui madri
non erano state esposte ad alcun farmaco anti-ipertensivo. L’occorrenza di malformazioni alla nascita è
stata identificata collegando diversi archivi di dati e attraverso la revisione delle cartelle cliniche.
ACE Inibitori
(n=209)
Altri farmaci antiipertensivi (n=202)
Nessun farmaco antiipertensivo (n=29,096)
N° neonati con malformazioni
18
4
834
% neonati con malformazioni
7.1%
1.7%
2.6%
RR
2.71
0.66
1
(1.72, 4.27)
(0.25, 1.75)
IC 95%
Il principale limite dello studio di coorte consiste nel costo elevato, soprattutto quando la durata del
follow-up è grande.
Strategie per ridurre i costi:
-
Utilizzare sistemi di monitoraggio esistenti
-
Realizzare studi retrospettivi
-
Utilizzare la popolazione generale come gruppo di confronto
-
Condurre uno studio caso controllo “nested” (letteralmente annidato)
17
Studi caso-controllo
Piuttosto che misurare l’esperienza di un’intera popolazione per ottenere il tasso (o il rischio) di incidenza
di un evento come negli studi di coorte, alcuni soggetti (controlli) sono selezionati dall’intera popolazione
che dà origine ai casi, consentendo una stima del rischio relativo
Ogni studio caso-controllo può essere immaginato come uno studio di coorte in cui:
Vengono studiate le caratteristiche dei soggetti affetti dalla malattia (è il gruppo dei casi)
Al posto di seguire nel tempo l’intero gruppo di soggetti a rischio, ne viene selezionato un
campione (è il gruppo dei controlli)
Possono essere prospettici o retrospettivi
Uno studio caso-controllo è uno studio più efficiente di un analogo studio di coorte: il costo cioè
necessario ad ottenere l’informazione sulle cause di una malattia è più basso. Lo studio caso-controllo è
l’unico disegno utile a valutare le cause di malattie rare: in tali circostanze, infatti, uno studio di coorte
dovrebbe reclutare un numero elevatissimo di soggetti.
Lo studio caso-controllo consente di calcolare l’Odds Ratio, che è una stima del rischio relativo
Nell’Odds Ratio, l’odd dell’esposizione è confrontato attraverso un rapporto tra il gruppo dei casi e quello
dei controlli
Regole per la scelta del gruppo di controllo
La selezione dei controlli dalla popolazione da cui originano i casi deve essere indipendente
dall’esposizione. Il gruppo di controllo fornisce una stima di come l’esposizione è distribuita nella
popolazione da cui provengono i casi. In altri termini, il gruppo di controllo sostituisce il denominatore del
tasso (o rischio) di incidenza, che non è disponibile negli studi caso-controllo
Studio caso-controllo: un esempio
È stato condotto uno studio per valutare se il tumore della vescica urinaria fosse associato ad esposizione
a trialomentani (THM), sottoprodotti della colorazione dell’acqua, attraverso l’ingestione di acqua,
l’inalazione e l’assorbimento trans-cutaneo durante la doccia, il bagno ed il nuoto in piscina. Sono state
raccolte informazioni sul consumo di acqua e sulle abitudini correlate all’acqua per 1,219 casi e 1,271
controlli. Sono inoltre stati misurati i livelli di THM nelle aree in esame.
Concentrazione media THM (µg/l)
Casi
Controlli
ORadj
<8
137
172
1
8-26
140
158
1.53
(0.95, 2.48)
26-49
183
160
2.34
(1.36, 4.03)
>49
158
180
2.53
(1.23, 5.20)
N.B. l’Odds Ratio è aggiustato per età, sesso, istruzione, fumo, area geografica
18
IC 95%
Studi sperimentali
Trial clinici
o
Randomizzati
o
Non randomizzati
Field trial
Community trial
I Trial clinici sono studi sperimentali che riguardano pazienti. Hanno lo scopo di mettere in evidenza il
trattamento più appropriato per futuri pazienti con una data condizione clinica. Utilizziamo i risultati
provenienti da un campione limitato di pazienti per identificare qual è il miglior trattamento per la
popolazione generale di pazienti che richiederanno un trattamento in futuro per quella patologia.
I Field trial sono studi sperimentali in cui l’intervento è assegnato a persone sane, allo scopo di prevenire
la comparsa di una malattia. Es. vaccino Polio Salk
I Trial di comunità sono l’equivalente dei trial clinici in Sanità Pubblica. Sono studi, il più delle volte quasisperimentali, in cui diverse comunità (e non singoli individui) vengono sottoposte ad interventi di Sanità
Pubblica differenti. Es fluorazione delle acque, interventi di promozione della salute che utilizzano i massmedia
Aspetti etici (Dichiarazione di Helsinki, 1960)
Il trattamento A può essere confrontato con il trattamento B solo se si è realmente indecisi su quale sia
l’intervento migliore (equipoise). Non è etico condurre una ricerca che è mal programmata od eseguita.
Non è etico condurre un trial che ha scarse possibilità di raggiungere una qualsiasi conclusione (bassa
numerosità, disegno dello studio carente)
Necessità del consenso informato
La validità nel metodo sperimentale risiede nel controllo diretto da parte del ricercatore sulla
assegnazione dei soggetti ai gruppi di studio. Negli studi osservazionali, invece, il ricercatore accetta
essenzialmente la situazione così come si presenta
Gli individui sono assegnati dal ricercatore ad (almeno) due gruppi:
-
gruppo sperimentale
-
gruppo di controllo
Nel gruppo sperimentale viene effettuato l’intervento (es. viene somministrato il farmaco in esame)
Nel gruppo di controllo non viene effettuato l’intervento, o viene effettuato uno pseudo-intervento, o
comunque non si fa nulla di nuovo (es. viene somministrato il farmaco in uso nella pratica corrente, o un
placebo, cioè una sostanza inerte come una pillola di zucchero o soluzione fisiologica)
19
Trial Controllato Randomizzato (RCT)
Un esperimento epidemiologico nel quale soggetti tratti da una popolazione sono assegnati a caso a
gruppi al fine di essere sottoposti o meno ad un trattamento o procedura preventiva o terapeutica
I Trial Clinici Randomizzati (RCT) rappresentano il “gold standard”, ossia la standard di riferimento, nella
valutazione di efficacia di un intervento sanitario.
Può essere utilizzato per diversi tipi di outcome (binari, continui)
Alla fine del follow-up viene effettuato un confronto dei tassi dell’outcome scelto
il disegno controlla per i “confondenti”, che risultano distribuiti in maniera simile tra i diversi gruppi. I
soggetti trattati non sono cioè più giovani, ricchi, in salute…..
Fasi di un RCT
-
Selezionare i partecipanti
-
Effettuare misurazioni baseline
-
Randomizzare (ad 1 o a più trattamenti)
-
Effettuare l’intervento
-
misurare l’outcome durante il Follow-up
Svantaggi degli RCT: costosi, possono rispondere ad una sola domanda
Cecità e placebo
Tre sono gli attori che potrebbero alterare la validità dello studio venendo a conoscenza del regime di
trattamento:
-
Il paziente (Singolo cieco)
-
L’ equipe di trattamento (Doppio cieco)
-
Il valutatore (“Triplo” cieco o cecità parziale)
Esempio di RCT
Uno studio randomizzato a doppio cieco ha confrontato l’effetto della pravastatina (40 mg/die) rispetto al
placebo in 9,014 pazienti con infarto del miocardio o angina instabile. La mortalità per malattia coronarica
è risultata pari a 6.4% nel gruppo sperimentale e 8.3% nel gruppo di controllo (RR=0.65)
20
Disegni alternative al RCT
Studi Cross-over
Nel disegno “classico” del RCT il confronto è tra pazienti diversi (es. Quelli sottoposti ad A e quelli
sottoposti a B).
Nello studio cross-over, il confronto è invece realizzato tra gli stessi pazienti. Entrambi i trattamenti sono
somministrati successivamente a tutti i soggetti (prima A e poi B, oppure prima B e poi A). Ogni soggetto
agisce da controllo di sé stesso, cambia solo l’ordine in cui ciascun soggetto riceve i due trattamenti
(l’ordine è casuale)
Esempio - Diuretici vs. beta-bloccanti per l’ipertensione arteriosa
Metà pazienti assumono diuretici ed in seguito beta-bloccanti
Metà pazienti assumono beta-bloccanti ed in seguito diuretici
Limiti dello studio cross-over: può essere utilizzato solo nel caso di variabili di effetto continue, nessun
effetto carry-over, necessità di una risposta rapida ed altrettanto rapida risoluzione, periodo di “wash
out” utile
21
Esercizi
1. Costruisci una curva epidemica utilizzando i dati riportati nella tabella seguente
Giorno
Numero casi
2-1-2008
1
3-1-2008
2
4-1-2008
1
5-1-2008
12
6-1-2008
11
7-1-2008
2
8-1-2008
3
9-1-2008
2
10-1-2008
1
2. osserva la seguente tabella
a.
calcola la prevalenza del diabete nel seguente campione di soggetti (n=200)
b.
Ripeti l’operazione calcolando la prevalenza del diabete specifica per fascia d’età
Età (anni)
Numero casi
Numero individui
15-34
2
50
35-59
3
60
60-89
11
90
Totale
16
200
3. In un reparto di chirurgia generale, è stata osservata l’incidenza di infezioni della ferita chirurgica. Dei
120 pazienti sottoposti ad intervento chirurgico nel periodo settembre-ottobre 2008, 10 hanno avuto
un’infezione del sito chirurgico nel giro di 2 settimane. Entro 1 mese dall’intervento in totale 15
pazienti hanno sviluppato un’infezione. Calcola l’incidenza cumulativa di infezione della ferita
chirurgica a 15 e 30 giorni
22
4. Utilizzando i dati della seguente tabella, calcola il tasso d’incidenza di complicazioni
Paziente
Data inser.
Data rimoz.
Complicazione
A
15-9-2008
25-9-2008
1
B
30-9-2008
5-10-2008
0
C
10-9-2008
15-9-2008
1
D
5-9-2008
25-9-2008
1
E
8-9-2008
10-9-2008
0
F
12-9-2008
22-9-2008
0
G
14-9-2008
18-9-2008
0
H
1-9-2008
22-9-2008
1
I
13-9-2008
18-9-2008
0
L
18-9-2008
20-9-2008
1
23
5. Il disegno dello studio
L'esercitazione sarà svolta attraverso un lavoro di gruppo. Ogni gruppo avrà il compito di costruire il
disegno dello studio più adatto per lo studio di un determinato problema (ca. 30'). Al termine del lavoro,
ogni gruppo sarà chiamato ad esporre al resto della classe il disegno dello studio prescelto (ca. 10'), che
sarà quindi discusso dagli altri gruppi (ca. 10').
Ogni gruppo ha il compito di definire:
- il disegno dello studio (Studio trasversale, caso-controllo, coorte, ecologico, trial clinico randomizzato,
trial di comunità)
- il campione richiesto per studiare il problema in esame
- le fonti dei dati
- la variabile di esposizione e la variabile d'effetto
- le misure di frequenza e misure di effetto
a.
Iniezione i.m. e dolore percepito
Nella pratica clinica sono due le tecniche con cui è possibile eseguire la preparazione e somministrazione
di un farmaco per via intramuscolare: si può utilizzare lo stesso ago sia per aspirare il farmaco sia per
iniettarlo, oppure si può cambiare l’ago dopo aver aspirato il farmaco e prima dell’iniezione. Obiettivo
della ricerca è valutare se c’è differenza nella percezione del dolore quando l’iniezione viene fatta con le
due differenti tecniche
b.
Programma di prevenzione delle cadute
Questo studio ha il fine di valutare l’efficacia di una serie articolata di interventi nella riduzione delle
cadute nelle case di riposo per anziani
c.
Prevalenza delle infezioni respiratorie nei pazienti ospedalizzati
L’obiettivo di tale studio è di misurare la prevalenza delle infezioni del tratto respiratorio contratte in
ospedale ed i fattori ad essa associati
d.
Vaccinazione anti-epatite B e sclerosi multipla
Descrizioni di casi di sclerosi multipla in seguito a vaccinazione anti-epatite B hanno portato ad ipotizzare
che il vaccino possa essere una causa della malattia. Scopo dello studio è valutare se esista
un’associazione tra vaccinazione anti-epatite B e sclerosi multipla.
24