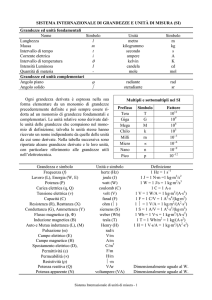
Cifre significative: le cifre significative sono un metodo per esprimere l’errore nelle misurazioni.
Si basano sul principio di non indicare più precisione di quella giustificabile dalla misurazione.
Le cifre significative sono nate dall’idea di leggere in una misurazione un grado al di sotto della
sensibilità dello strumento: ad esempio se in una scala millimetrata riusciamo a vedere che l’oggetto
da misurare arriva tra 6 e 7 millimetri e si trova approssimativamente a 2/3 tra le due tacche una
misura accettabile può essere 6.7 o 6.6, ma non 6.66666666 mm.
Il conteggio delle cifre significative si basa su alcune regole: ad esempio
Tutte le cifre diverse da zero sono cifre significative, tutti gli zeri che si trovano tra due non-zeri
sono cifre significative. Gli zeri che seguono la virgola in numeri più piccoli di 1 non vengono
conteggiati (0.00057 ha 2 cifre significative).
Per indicare esattamente il numero di cifre significative bisogna esprimere il numero in notazione
scientifica. Ad esempio
Se indicassimo 5.13 per un numero, sapremmo che il valore reale si trova tra 5.1349 e 5.125
Se indicassimo 3.12 x 10 , sapremmo che il valore reale si trova tra 31.249 e 31.15
Se indicassimo 1.060 x 10^2, sapremmo che il valore reale si trova tra 106.049 e 105.95
Il metodo della fisica: il metodo scientifico è stato introdotto da Galileo, che ha avuto il grande
merito di capire che la natura non sempre fornisce risposte precise alle domande che gli vengono
fatte: ad esempio la caduta di 2 oggetti come un foglio e una pietra sembra molto differente, ma se il
foglio viene appallottolato sarà quasi uguale; questo perché la caduta è legata a due leggi, quella
dell’attrazione gravitazionale e quella della resistenza dell’aria. Per studiare bene i due fenomeni
bisogna separarli, cioè fare un esperimento che costringa la natura a dare risposte semplici, ad
esempio mettere gli oggetti in una stanza senza aria. Prima di Galileo l’interpretazione dei fenomeni
era basata sulle idee dei filosofi antichi o sulle credenze religiose, non si faceva una verifica
accurata delle teorie. Il metodo scientifico si basa proprio su questo: dall’osservazione si crea per
induzione una regola, poi si realizza un esperimento, cercando di escludere tutti i fenomeni di
disturbo, per cercare di accertarla. Solo se una teoria sopravvive alla prova sperimentale a quel
punto diventa legge.
Grandezze fondamentali e derivate: vengono assunte come grandezze fondamentali la massa, il
tempo, la lunghezza, la mole e la temperatura, tutte le altre sono derivate da esse, cioè sono
convenzioni con cui vengono chiamati particolari rapporti delle grandezze fondamentali. Ad
esempio noi scegliamo di chiamare velocità il rapporto tra una grandezza di spazio e una di tempo,
o volume il prodotto di tre grandezze di lunghezza.
Grandezze intensive ed estensive: le grandezze estensive sono additive, nel senso che se ho un
sistema A caratterizzato da E(a) grandezza estensiva e un sistema B caratterizzato da E(b) allora
E(a + b) = E(a) + E(b). Al contrario per le grandezze intensive è necessario mediare i valori dei 2
sistemi, magari pesando la media. Grandezze estensive possono essere il volume, la massa, la mole,
l’angolo… grandezze intensive sono la temperatura, la pressione ecc… il valore puntuale delle
grandezze intensive si ottiene facendo tendere a zero la porzione di sistema considerato
La termodinamica: la termodinamica studia i fenomeni di riscaldamento in relazione con i
fenomeni meccanici, si occupa quindi di sistemi di n corpi non rigidi, quindi non risolvibili tramite
la cinematica. Per questo i sistemi termodinamici vengono caratterizzati con parametri di stato
macroscopici come la temperatura, la pressione, ottenuta sulla base di quelli microscopici delle
singole particelle sulla base di considerazioni matematiche e statistiche.
Funzioni di stato: in termodinamica le funzioni di stato sono tutte quelle proprietà del sistema che
dipendono solo dallo stato in cui si trova il sistema e non dal percorso fatto dal sistema per arrivarci.
Sono funzioni di stato temperatura, pressione, entropia, entalpia, energia libera ecc.
Temperatura, termometri: la temperatura è la grandezza che descrive lo stato termico di un corpo,
una prima misurazione della temperatura può darcela il nostro corpo attraverso le sensazioni che ci
fornisce di caldo e freddo. Ci si rende conto che alcuni fenomeni avvengono sempre alla stessa
temperatura, utilizzando questo si costruisce una scala che ha come riferimenti 2 di questi fenomeni
e che sfrutta come indicatore un qualsiasi fenomeno dipendente dalla temperatura (altre influenze
trascurabili). Si crea così un termometro. I termometri possono essere molto differenti a seconda
del range di temperature da misurare: se vogliamo misurare temperature comuni basta un
termometro a dilatazione termica di liquidi, se le temperature salgono si può ricorrere alla
dilatazione termica dei solidi (attacchi 2 solidi con dilatazione diversa e misuri l’incurvamento),
oppure per temperature ancora maggiori si possono utilizzare termometri basati sull’irraggiamento.
Tutto ciò che serve è un fenomeno basato sulla temperatura e dei riferimenti.
Scale Celsius e Fahrenheit: La scala Celsius delle temperature era progettata perché il punto di
congelamento dell'acqua fosse a 0 gradi, e il punto di ebollizione a 100 gradi, entrambi alla
pressione atmosferica standard. Anche se i valori per il punto di congelamento e di ebollizione
dell'acqua rimangono approssimativamente corretti, la definizione originale non è adatta per essere
uno standard: dipende dalla definizione di pressione atmosferica standard, la quale dipende a sua
volta dalla definizione di temperatura. La definizione ufficiale corrente della scala Celsius pone
0,01 °C come il punto triplo dell'acqua, e un grado come 1/273,16 della differenza di temperatura
tra il punto triplo dell'acqua e lo zero assoluto.
Fahrenheit stabilì che il punto zero della sua scala (0°F) doveva essere la temperatura alla quale un
ugual mistura di ghiaccio e sale si scioglie (alcuni sostengono che prese la mistura fissa dei due che
produceva la temperatura più bassa). Fissò inoltre il punto di 96°F alla temperatura del sangue,
usando inizialmente del sangue di cavallo. La sua scala conteneva originariamente solo 12
suddivisioni, ma in seguito divise ognuna di queste in 8, dando così un totale di 96 suddivisioni.
Stati termodinamici: Con stato della materia si intende una classificazione convenzionale della
materia a seconda delle sue proprietà meccaniche. Sono stati individuati 3 stati: solido, in cui le
molecole sono legate tra loro molto saldamente ed il corpo ha forma e volume propri; liquido, in cui
le molecole mantengono distanze fisse ma sono libere di muoversi, ha volume ma non forma
propria; aeriforme, in cui ci sono forze attrattive ma sono troppo deboli per tenere le molecole a
distanze fisse, non ha ne forma ne volume proprio
Trasformazioni: per passare da uno stato all’altro il sistema deve compiere una trasformazione,
che può essere di vario tipo: irreversibile se non passa per stati di equilibri, non sappiamo cosa è
successo istante per istante e non possiamo ripeterla al contrario. Se la trasformazione è talmente
lenta da essere composta da una serie infinita di stati di equilibrio si dice quasistatica. Una
trasformazione reversibile è una trasformazione che oltre a essere quasistatica non ha subito effetti
dissipativi o dispersioni di energia. Una trasformazione spontanea è una trasformazione che parte da
uno stato di non equilibrio per raggiungerne uno di equilibrio.
Rappresentazione grafica del lavoro: se un sistema termodinamico è racchiuso in un volume le
forze sul contorno sono in equilibrio, se il corpo si espande, le forze spostano il loro punto di
applicazione compiendo un lavoro. In un piano di clapeyron l’area sottesa dalla curva che indica la
trasformazione rappresenta il lavoro, perché un area può rappresentare il lavoro? In realtà quando
noi disegniamo il piano di clapeyron facciamo un'altra operazione senza rendercene conto:
assegniamo una corrispondenza tra una misura di lunghezza e una di pressione e tra un'altra misura
di lunghezza e una di volume.
Calore: mettendo in contatto due corpi a temperatura diversa essi dopo un po’ arrivano ad una
temperatura comune intermedia: qualcosa è passato da un corpo all’altro. Questa cosa, che i fisici in
principio chiamavano fluido calorico è in realtà il calore. Il calore è anch’esso una forma di energia,
infatti il primo principio stabilisce un’equivalenza tra calore e lavoro, solamente più disordinata. Lo
strumento per misurare il calore si chiama calorimetro, il più comune dei quali è il calorimetro a
ghiaccio: il calorimetro a ghiaccio è composto da una mistura di ghiaccio e acqua (quindi a zero
gradi), messo a contatto con un sistema più caldo la quantità di calore ceduta è misurata dal
ghiaccio che si è sciolto. Per definizione una caloria è la quantità di calore necessaria a far alzare di
un grado la temperatura di un grammo d’acqua a 14.5 gradi
Mole: una mole è definita come la quantità di sostanza che contiene un numero di Avogadro di
particelle (6,02 x 1023)
Gas perfetto: si riscontra sperimentalmente che i parametri che caratterizzano lo stato di un gas
P V
cos t . Questa costante misurata
non sono slegati tra loro: in particolare il rapporto
n T
J
sperimentalmente è risultata avere un valore R 8.314
quindi possiamo scrivere
mol K
PV nRT . È questa l’equazione di stato dei gas perfetti, alcuni gas seguono perfettamente questa
legge e vengono detti gas perfetti, altri le si avvicinano solamente per alte temperature e basse
pressioni. Questo succede perché il modello di gas perfetto è un modello in cui le particelle non
hanno interazioni tra di loro ed hanno dimensioni puntiformi: questo è ben approssimato da un gas
molto rarefatto, in cui l’energia cinetica sovrasta quella potenziale di attrazione tra le molecole ed il
volume totale delle molecole del gas è trascurabile rispetto a quello occupato dal gas stesso.
Scala Kelvin: la scala kelvin utilizza come zero lo zero assoluto, cioè la temperatura alla quale
cessa ogni moto di agitazione delle molecole. Essendo la temperatura proprio una misura della
velocità del moto delle molecole non è ovviamente possibile scendere al di sotto di tale temperatura.
Lo zero assoluto corrisponde a -273, 15 °C e il grado kelvin è 1/273,16 della temperatura
termodinamica del punto triplo dell’acqua (0,01 °C)
Termometro a gas perfetto: i gas perfetti seguono perfettamente l’equazione di stato PV nRT ,
bloccando uno dei 2 parametri P o V si ha quindi una dipendenza lineare dalla temperatura T, ed è
quindi semplice costruire una scala per la misurazione di temperature