PROTOCOLLO DI STUDIO CLINICO
Valutazione dell’effetto adiuvante di Interferone alfa nella vaccinazione
contro l’epatite B
Fase: II
Prodotti in studio: Interferone alfa leucocitario (Alfaferone) e
Vaccino anti-epatite B ricombinante (Engerix-B)
Coordinatore dello studio: Filippo Belardelli, M.D.
Dirigente di ricerca – Dipartimento di Biologia Cellulare e
Neuroscienze - Istituto Superiore di Sanità
Viale Regina Elena, 299 - 00161 Roma, Italia
Sperimentatore principale: Pietro Andreone, M.D.
Dipartimento di Medicina Interna,
Cardioangiologia, Epatologia
Azienda Ospedaliera S. Orsola-Malpighi
Universita’ di Bologna
Via Massarenti 9, 40138, Bologna, Italia
Sponsors: •
•
Alfa Wassermann S.p.A.
Institute for Infectious Diseases – Spallanzani
on behalf of all partners of Demonstration Project
Studio clinico finanziato dalla Comunita’ Europea
Codice dello studio: QLRT-2000-02114/01
Importanza
L'epatite B è una malattia grave del fegato causata da un virus chiamato HBV. Si contrae attraverso
il contatto con secrezioni fisiologiche infette. A seguito dell'infezione alcuni individui diventano
portatori cronici del virus. I portatori cronici sono più a rischio di sviluppare malattie quali la cirrosi
epatica e il cancro del fegato (HCC= carcinoma del fegato) e sono una fonte di infezione per gli
altri.
L’epatite B costituisce un grosso problema di salute pubblica a livello mondiale. Si calcola che il
5% della popolazione mondiale, circa 350 milioni, sono portatori cronici del virus dell'epatite B e il
virus è responsabile di 1 milione di decessi all'anno.
Questa malattia può essere prevenuta con la vaccinazione. In Italia la vaccinazione contro l’epatite
B è stata resa obbligatoria dal 1991 per tutti i nuovi nati. Ancora oggi una fetta consistente di
popolazione adulta risulta non coperta dalla vaccinazione. Inoltre, il 40-50 % di individui che si
sottopone alla vaccinazione volontaria (soprattutto categorie a rischio) non termina il ciclo di
vaccinazione, costituito da tre dosi di vaccino somministrato nell’arco di sei mesi. Questi individui
risultano ancora suscettibile all’infezione. A ciò si aggiunge il fatto che il 5-10% dei soggetti sani
che ricevono le tre dosi di vaccino previste non sviluppano una immunità protettiva nei confronti
dell’HBV (non responder).
Quindi lo sviluppo di un vaccino in grado di conferire un’immunità protettiva dopo una o due
somministrazioni di vaccino rappresenta un obiettivo sanitario molto importante, soprattutto per i
soggetti a rischio. Inoltre, una tale prospettiva avrebbe ricadute notevoli per i programmi di
vaccinazione nei paesi del terzo mondo, dove la malattia è endemica.
Questo studio si propone di sperimentare se la vaccinazione contro l’epatite B effettuata con una o
due dosi del vaccino attualmente in uso in associazione con IFN-α come adiuvante è altrettanto
efficace della vaccinazione standard effettuata con tre dosi.
Perché l’interferone alfa?
Gli interferoni α sono le citochine più largamente impiegate nell’uomo, soprattutto per il
trattamento di pazienti affetti da alcune infezioni virali o neoplasie. Nonostante molti anni di
ricerca, solo recentemente si è iniziato a comprendere come gli effetti esercitati da queste citochine
su cellule specializzate del sistema immune svolgano un ruolo fondamentale nella azione antivirale
e antitumorale. Un insieme di studi, in gran parte realizzati da ricercatori dell'ISS, ha rivelato che
queste citochine agiscono come fattori naturali chiave nel collegare l'immunità innata con
l'immunità acquisita, grazie soprattutto ai loro effetti, solo recentemente identificati, sulle cellule
dendritiche. Inoltre, dati ottenuti in modelli sperimentali animali hanno mostrato che queste
citochine sono in grado di agire come un potente adiuvante del vaccino anti-influenzale umano.
Dall’insieme di questi dati emerge il razionale per un diverso utilizzo di IFN-α in campo clinico, e
cioè non più come farmaco antivirale ma come sostanza in grado di potenziare la risposta immune
ai vaccini. Nel caso specifico dello studio clinico proposto sarà valutata efficacia di IFNα come adiuvante nella vaccinazione contro l’epatite B.
Vaccino anti-epatite B come vaccino antitumorale
Il cancro del fegato rappresenta il quinto tipo di tumore più diffuso nel mondo (560,000 nuovi casi
all’anno di cui l’80% nei paesi in via di sviluppo) e la terza causa di morte di cancro (8,8%, ). Circa
il 60% dei casi è associato ad infezione cronica con HBV.
E’ stato stimato che i portatori cronici di HBV nel mondo sono circa 350 milioni, di cui 70 milioni
con una alta probabilità di morire per patologie gravi al fegato, quali cirrosi e HCC. La
distribuzione geografica dell’infezione è sovrapponibile alla diffusione dell’HCC. L’HBV è oggi
riconosciuto come il più importante agente eziologico dell’HCC. L’attuale vaccinazione contro il
virus dell’epatite B è pertanto riconosciuta come l’unico mezzo in grado di prevenire l’insorgenza
di tale tumore, è considerato cioè un vaccino antitumorale.
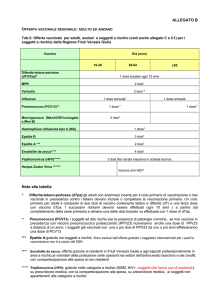
SINOSSI
Titolo dello studio: Valutazione dell’effetto adiuvante di Interferone alfa leucocitario nella
vaccinazione contro l’epatite B: studio randomizzato, aperto, verso placebo, multicentrico, di fase
II, in soggetti sani non vaccinati. Parte I: Studio di ricerca della dose; Parte II: Studio di conferma.
Fase dello studio: II
Indicazioni: Interferone alfa leucocitario (LE-IFN-α) come adiuvante nella vaccinazione contro il
virus dell’epatite B in adulti sani non vaccinati.
Disegno sperimentale: Studio randomizzato, aperto, verso placebo, multicentrico, di fase II.
Obiettivi dello studio:
Parte I: Valutare l’efficacia di due differenti dosi di LE-IFN-α somministrato come adiuvante nella
vaccinazione contro l’epatite B. Questo studio è necessario per determinare la dose migliore di LEIFN-α da usare nella Parte II.
Parte II:
1) Valutare l’efficacia di LE-IFN-α somministrato come adiuvante nella vaccinazione
contro l’epatite B nel ridurre il numero di dosi di vaccino necessario per ottenere
correlati immuni della protezione comparabili a quelli conferiti dal ciclo standard di
tre dosi in adulti sani non vaccinati.
2) Valutare l’efficacia di LE-IFN-α, somministrato come adiuvante nella vaccinazione
contro l’epatite B, nell’ indurre risposte immuni (umorali e cellulari) più precoci e
qualitativamente migliori.
Popolazione: Soggetti sani non vaccinati per HBV (di età compresa fra 18 e 65 anni)
Numero di individui: Parte I +Parte II = 206 (Parte I= 78; Parte II =128)
Farmaco in studio: LE-IFN-α (Alfaferone®) in associazione con Engerix-B®
Somministrazione e dosaggio del farmaco:
Parte I: Engerix-B: 20µg/1.0ml in associazione con LE-IFN-α (1 o 3 MU) o con placebo.
Gruppo A: Il regime di immunizzazione consiste di tre dosi di vaccino (la prima e la
seconda dose di vaccino saranno somministrate in combinazione con placebo) secondo il
seguente schema: I dose: al tempo 0 (T0); II dose: un mese dopo al prima dose(T1m); III
dose: sei mesi dopo la prima dose (T6m).
Gruppo B e C: Il regime di immunizzazione consiste di due dosi di vaccino somministrato
in associazione con LE-IFN-α (1 o 3 MU) (Gruppo B: 1MU; Gruppo C 3MU). I dose: al
tempo 0 (T0); II dose: un mese dopo la prima dose (T1m).
Parte II: Engerix-B: 20µg/1.0ml in associazione con LE-IFN-α (1 o 3 MU a seconda dei risultati
ottenuti nella Parte I) o con placebo.
Gruppo A: come per il Gruppo A della Parte I
Gruppo B o C: come per il Gruppo B o C della Parte I. La dose di Alfaferone (1MU o
3MU) che sarà somministrata in combinazione con Engerix-B dipenderà dai risultati
ottenuti nella Parte I.
Tutti i soggetti (Parte I e II) appartenenti al Gruppo B/C che non avranno raggiunto livelli
anticorpali sieroprotettivi un mese dopo la fine del ciclo di vaccinazione, riceveranno al tempo
T6m, una dose richiamo del vaccino.
Valutazione dell’efficacia
Endpoints di efficacia primari:
• Parte I: Valutare il tasso di sieroprotezione raggiunto un mese dopo la seconda dose di vaccino,
per ogni dose di LE-IFN-α somministrato in adulti non vaccinati.
• Parte II: Valutare il tasso di sieroprotezione (un mese dopo la seconda dose) in seguito a
somministrazione del vaccino in associazione con LE-IFN-α (somministrato alla dose stabilita
nella Parte I dello studio) rispetto al vaccino + placebo in adulti non vaccinati.
Gli endpoints saranno valutati mediante analisi dei titoli anticorpali.
Endpoints di efficacia secondari:
Parte II.
• Valutare il tasso di sieroprotezione un mese dopo la I dose e un mese dopo la II dose, il tasso
di sieroconversione dopo ogni somministrazione, la media geometrica dei titoli anticorpali
(GMT) contro l’antigene di superficie dell’epatite B (anti-HBs) e la percentuale di individui,
nei due gruppi, che raggiungerà un titolo anticorpale maggiore di 1000IU/l.
• Dimostrare che le risposte immuni al vaccino somministrato in associazione a LE-IFNα come adiuvante differiscono qualitativamente
da quelle indotte dal vaccino
convenzionale, promuovendo quei meccanismi cellulari che inducono l’immunità protettiva.
Come endpoints secondari dell’attività adiuvante di LE-IFN-α saranno valutati: a) i titoli anticorpali
a tempi diversi e la cinetica delle risposte anticorpali negli individui vaccinati; b) le sottoclassi di
IgG anti-HBs; c) le risposte T helper specifiche contro l’antigene HBs; d) il fenotipo/funzione delle
cellule dendritiche.
(Sieroprotezione: titolo anticorpale anti HBs>10IU/l: sieroconversione: titolo anticorpale antiHBs>1IU/l
Valutazione della sicurezza: Eventi avversi (tollerabilità locale e sistemica), segni vitali, esame
fisico, analisi dei parametri di laboratorio, adesione al trattamento.