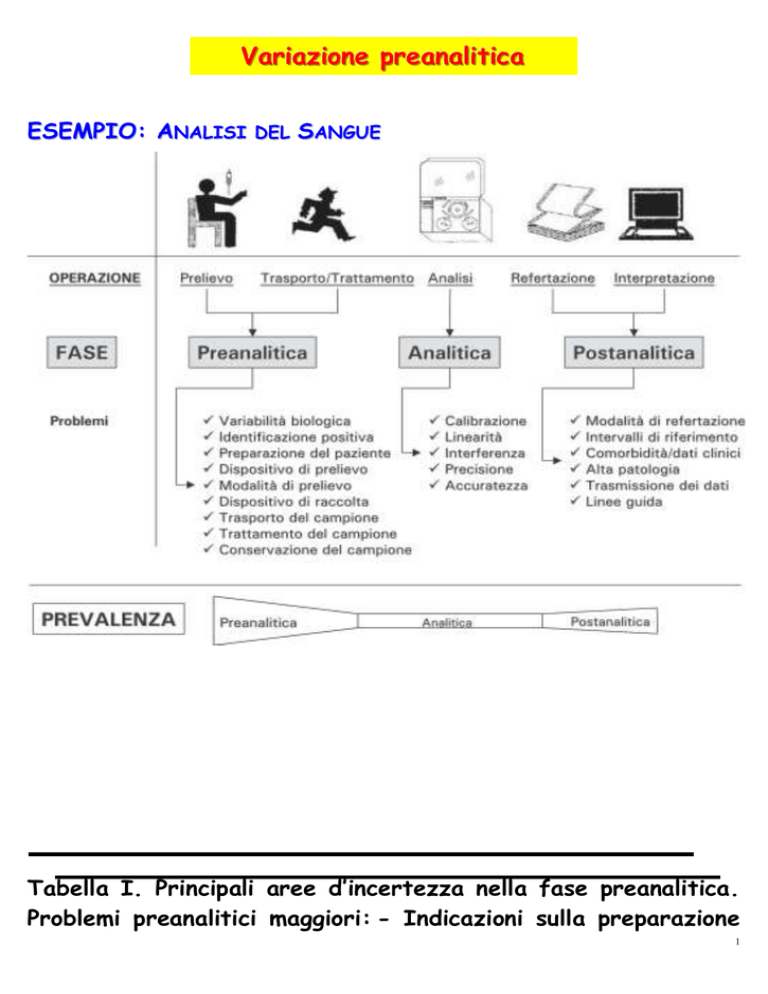
Variazione preanalitica
ESEMPIO: ANALISI DEL SANGUE
Tabella I. Principali aree d’incertezza nella fase preanalitica.
Problemi preanalitici maggiori: - Indicazioni sulla preparazione
1
del paziente al prelievo
- Digiuno
- Attività fisica/Stress
- Postura
- Indicazioni
prelievo
sulle
modalità
d’esecuzione
del
- Indicazioni sui dispositivi di prelievo e raccolta
del campione
- Indicazioni sul trattamento di campioni non idonei
- Materiale (sangue arterioso/venoso/capillare)
- Contaminazione (biologica o durante il prelievo)
- Tipo o riempimento della provetta
- Campioni emolitici, lipemici, coagulati
- Indicazioni sul trasporto del campione
- Indicazioni sul trattamento dei campioni
- Aliquotazione
- Temperatura e velocità di centrifugazione
- Indicazioni sulla conservazione dei campioni
- Indicazioni sugli standard di qualità preanalitica
da adottare
Nell’interpretazione dei risultati è importante considerare
tutta una serie di variabili che intervengono prima dell’esecuzione
del test in laboratorio e che sono note come variabili pre2
analitiche.
La variabilità preanalitica è dovuta a fattori esterni al
paziente e occorre prendere tutte le misure necessarie per
minimizzarne gli effetti, al fine di ottenere risultati accurati e
riproducibili.
Un discorso a parte merita la variabilità biologica che è
dovuta a fattori inerenti al paziente e che possono essere più o
meno controllabili.
3
Variabilità Biologica
CV (%)
50
40
30
20
10
0
TG
CO APA1 APB COHDL COLDL
Variabilità Biologica (CV) dei parametri dello stato
lipidico, valori massimi e minimi riscontrati in 23 individui.
TG:
Trigligeridi
CO:
Colesterolo
APA1:
Apolipo A1
APB:
Apolipo B
COHDL: Colesterolo HDL
COLDL: Colesterolo LDL
4
CV (%)
50
40
30
20
10
0
Ferro
FER
TFR
EMO
ERI
Variabilità Biologica (CV) dei parametri dello stato del
“FERRO”, valori massimi e minimi riscontrati in 23 individui.
FER:
Ferritina
TFR:
Transferrina
EMO:
Emoglobina
ERI:
Eritrociti
5
Individuo A
Individuo B
CONC.
1000
100
10
1
Giorni
Variabilità Biologica (CV) dei parametri:
FERRO
FERRITINA
TRANSFERRINA
6
Variazione biologica nell’escrezione urinaria (24 ore) in
un individuo (ripetibilità intra individuo)
ANALITA
COEFFICIENTE
R
Riicceerrccaa 11 R
Riicceerrccaa 22
DI VARIAZIONE (%)
R
Riicceerrccaa 33 R
Riicceerrccaa 44 R
Riicceerrccaa 55
Calcio
2
26
6,,4
4
2
24
4,,3
3
3
38
8,,0
0
Creatina
1
13
3,,3
3
2
28
8,,2
2
P-Amilasi
--
--
Fosfati
1
16
6,,9
9
3
30
0,,9
9
2
24
4,,7
7
Potassio
2
21
1,,6
6
2
29
9,,6
6
2
26
6,,4
4
Proteine
3
34
4,,4
4
--
2
23
3,,7
7
Sodio
1
16
6,,7
7
3
30
0,,3
3
2
20
0,,5
5
2
25
5,,0
0
2
27
7,,8
8
4
41
1,,0
0
6
60
0,,1
1
7
Variazione biologica nell’escrezione urinaria (24 ore) tra
diversi individui (riproducibilità biologica)
ANALITA
Calcio
Creatina
P-Amilasi
Fosfati
Proteine
Sodio
Urati
Urea
S
Seessssoo
COEFFICIENTE
R
Riicceerrccaa 11
DI VARIAZIONE (%)
R
Riicceerrccaa 22 R
Riicceerrccaa 33 R
Riicceerrccaa 44
M
M
2
25
5,,1
1
2
26
6,,2
2
2
27
7,,6
6
F
F
2
26
6,,7
7
--
M
M
1
11
1,,2
2
1
11
1,,0
0
1
15
5,,8
8
F
F
1
15
5,,5
5
1
15
5,,7
7
--
M
M
--
--
3
35
5,,8
8
F
F
--
--
--
M
M
1
16
6,,6
6
1
16
6,,9
9
2
25
5,,6
6
F
F
1
16
6,,5
5
2
22
2,,8
8
--
M
M
3
35
5,,9
9
--
3
39
9,,4
4
F
F
3
36
6,,1
1
--
--
M
M
2
28
8,,0
0
2
26
6,,5
5
2
28
8,,7
7
F
F
2
29
9,,2
2
2
27
7,,9
9
--
M
M
1
14
4,,3
3
--
2
20
0,,3
3
F
F
1
16
6,,8
8
--
--
M
M
1
12
2,,6
6
1
16
6,,9
9
1
17
7,,6
6
F
F
1
13
3,,4
4
2
20
0,,1
1
--
7
7,,6
6
--
8
Fase preanalitica (modalità di prelievo e
trasporto del campione, variabilità preanalitica).
Oltre alla malattia esistono altri fattori che possono alterare i
risultati di un esame di laboratorio.
Accettazione dei materiali e verifica della loro idoneità:
L’addetto all’accettazione deve verificare che si siano mantenute
e rispettate tutte le misure previste nelle manipolazione
preanalitiche; in caso di non idoneità il campione deve essere
respinto e richiesto l invio di nuovo materiale biologico
Tra i fattori che possono influenzare il risultato di un test di
laboratorio vi sono la dieta e l’eventuale assunzione di farmaci;
nei giorni precedenti l’esame occorre quindi avvertire il paziente
di astenersi da modifiche drastiche del regime dietetico e di
sospendere l’assunzione di medicine se queste possono interferire
in qualche modo con i risultati del test.
9
Effetto dei pasti
Analita
Effetto
Sodio
Aumento
Fosfati
Aumento negli uomini
Diminuzione nelle donne
Glucosio
Aumento
Insulina
Aumento
pH
Aumento
Bilirubina
Aumento
Urati
Aumento
Trigliceridi
Aumento
Lattato
Aumento
Colesterolo
Piccola variazione
Fosfatasi Alcalina
Aumento
10
Effetto della Caffeina
Analita
Effetto
Trigliceridi
Aumento
Acidi grassi liberi
Aumento
Cortisolo
Aumento
Colesterolo
Diminuzione
Catecolammine (urina)
Aumento
Glucosio
Piccola variazione
Insulina
Piccola variazione
Una dieta ricca di proteine e di basi puriniche ad esempio può far aumentare
la concentrazione di acido urico, urea (“azotemia”) e ammoniaca rispetto a una
dieta vegetariana.
L’età, il sesso e l’appartenenza ad un determinato gruppo
etnico possono influenzare alcuni parametri biochimici: la
fosfatasi alcalina viene prodotta dal tessuto osseo in
accrescimento e quindi tende ad avere valori più elevati nei
bambini mentre diminuisce dopo la pubertà. La creatinina e la
creatina chinasi, marcatori del tessuto muscolare, tendono ad
essere in media più elevati negli uomini, i quali hanno in genere
una massa muscolare più sviluppata rispetto alle donne.
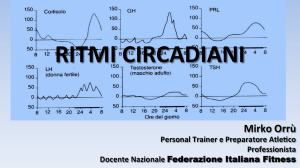
Anche il momento della giornata in cui viene effettuato il
prelievo è importante in quanto esistono delle variazioni
cosiddette “circadiane” di alcuni analiti, cioè variazioni in base
all’alternanza giorno/notte, come si vedrà in seguito, come il
cortisolo ad esempio.
11
Anche i valori glicemici ottenuti durante un test da carico
orale tendono ad essere più elevati quando l’esame viene
effettuato nel pomeriggio rispetto a quando viene effettuato di
mattina.
Alcuni ormoni sono influenzati anche da un ritmo mensile,
basti pensare agli ormoni ipofisari femminili (FSH, LH).
12
I RITMI CIRCADIANI COSA SONO?
Da un articolo di Maria Anderson dalla Rivista “The Scientist” di Febbraio 2004
Che cosa sono i ritmi circadiani?
Questi “sistemi a tempo” comandano la fioritura delle piante,
forzano le persone ad addormentarsi, sollecitano gli uccelli
migratori a volare verso paesi più caldi, etc.
Mentre i ritmi circadiani agiscono nelle 24 ore, ce ne sono altri
che sono legati alle maree, alla Luna, all’anno solare.
Su quali organismi hanno effetto?
Lieviti, cianobatteri, insetti, topi, esseri umani sono tutti
coinvolti. Ciò che vale per il topo e l’uomo può essere valido per i
mammiferi in generale. Per quanto il meccanismo basilare sia lo
stesso per tutti gli organismi, esistono differenze individuali.
Che cosa regolano i ritmi circadiani?
Sia la luce che la temperatura svolgono un ruolo. I criptocromi,
rilevatori della luce blu, che sono presenti in quasi tutti gli
organismi, trasmettono segnali ai geni circadiani ed alle proteine
che mantengono il “sistema orologio” sincronizzato.
Nei mammiferi la luce viene captata attraverso gli occhi ed inviati
al nucleo suprachiasmatico nell’ipotalamo.
Le piante invece utilizzano recettori della luce nella loro struttura.
13
Cosa provocano i ritmi circadiani?
Essi regolano molti meccanismi:
dalla fissione binaria nei batteri al ciclo del sonno nell’uomo;
dalla fissazione dell’azoto nei cianobatteri alla riproduzione
asessuata nelle spore;
dalla migrazione
degli
uccelli alla ibernazione
di
alcuni
mammiferi.
Nei vegetali regolano la fioritura, la fotosintesi, l’assimilazione
del gas, il metabolismo.
Cosa succede se i ritmi sballano”?
Aritmicità nelle piante da imputarsi a mutazione di geni o
stimoli esterni possono causare fioritura anticipata;
nell’uomo,
fluttuazioni
ormonali
causate
dall’età
alterano
l’ampiezza del ritmo modificando ad esempio gli orari del sonno,
anticipando o ritardando.
14
Ritmi cronobiologici
Classificazione dei ritmi sulla base della loro frequenza
Alte
Medie frequenze
Basse
frequenze
frequenze
0,5h<τ<20h 20h<τ<28h 28h<τ<2,5 g τ >2,5 g
τ< 0,5h
Esempi di
Esempi di
ritmi ad
ritmi a bassa
alta
frequenza
frequenza
Ritmi
-ritmi
ultradiani
-ritmo
circaseptani
Ritmi
dell’EEG
(7 g )
circadiani
(Elettroencefalogramma)
-ritmo
cardiaco
-ritmo
respiratorio
-ritmi
Ritmi
circavigintani
infradiani
(2 0 g )
-ritmi
circatrigintani
(3 0 g )
-ritmi
circannuali
(3 6 5 g )
I ritmi più diffusi in natura sono comunque quelli
circadiani che riconoscono come sincronizzatori più comuni
l’alternanza luce oscurità, sonno-veglia, l’assunzione di
cibo, la vita sociale, ecc.
15
È stata per esempio osservata una variazione ritmica
circadiana VES (velocita di sedimentazione degli eritrociti) dai livelli di
ACHT
(ormone
adrenocorticotropico),
di
cortisolo,
delle
gonadotropine, della sideremia, della cloruremia, della
calcemia, della 5-idrossitriptamina, nonché dell’escrezione
urinaria di catecolamine, sodio, potassio, fosfati, ecc.
Taluni di questi parametri (ACHT, cortisolo, sideremia)
presenta variazioni cronobiologiche di notevole entità.
Sono state inoltre osservate variazioni stagionali nei
valori del colesterolo, con concentrazioni generalmente
maggiori durante l’inverno.
INFLUENZA DEI RITMI CIRCADIANI
SULLA ATTIVITÀ QUOTIDIANA
La nostra attività giornaliera è influenzata da diversi
fattori fisiologici, psicologici, culturali che hanno effetti
sui risultati e della sicurezza del nostro lavoro.
Un parametro che spesso è sconosciuto, o quantomeno
poco considerato, riguarda i ritmi biologici naturali che
riducono le nostre capacità od attenzione almeno due volte
al giorno.
Come illustrato in figura, i valori più bassi si hanno nella
notte tra le 3 e le 4 e nel pomeriggio tra le 14 e le 15.
Gli effetti, nel pomeriggio, sono tanto più accentuati
quanto più si è in debito di sonno.
16
Durante questi periodi operazioni di importanza critica
dovrebbero essere eliminate
“ATTENZIONE”
0 2 4 6 8 10 12 14 16 18 20 22 24 ORE
Ritmo fisiologico di un organismo in relazione
all’alternarsi del giorno e della notte.
Anche l’abitudine cronica al fumo può influenzare alcuni valori, ad esempio
dell’esame emocromocitometrico: si ha un aumento dell’emoglobina, della
carbossiemoglobina, del numero e del volume dei globuli rossi, del numero di globuli
bianchi, etc.
Gli sforzi fisici, specie se prolungati, possono far aumentare l’attività degli
enzimi muscolari come creatina chinasi, lattato deidrogenasi e aspartato
amintransferasi.
Abbastanza rilevanti sono gli effetti legati alla posizione del soggetto (effetti
posturali): il volume del sangue circolante col soggetto seduto è inferiore di circa
600 ml rispetto alla posizione supina. Infatti nel soggetto seduto dai capillari
17
fuoriesce liquido privo di proteine; in posizione supina il liquido interstiziale viene
richiamato nel compartimento vascolare e il volume aumenta. Queste variazioni
avvengono in tempi compresi tra 5 e 20 minuti. Di conseguenza quando il prelievo
viene effettuato col soggetto in posizione seduta si ha un aumento del 5-15% delle
macromolecole (albumina!) e degli elementi cellulari. Ciò non si verifica
ovviamente per le piccole molecole (glucosio!) che possono passare tranquillamente
attraverso la parete vasale. Questi effetti posturali sono particolarmente
accentuati nei pazienti edematosi.
Postura, riposo fisico
Pazienti ambulatoriali e degenti ospedalizzati
Pazienti ambulatoriali Valori più alti di:
Emoglobina (Hb),
Proteine Totali,
Ca2+,
colesterolo,
Acidi grassi non esterificati (NEFA),
Bilirubine.
Pazienti immobili,
Aumentano nelle urine:
Attività
Ca2+,
Fosforo
4-idrossi prolina.
fisica, Aumentano gli enzimi
scheletrica:
Creatina fosfochinasi (CPK),
della
muscolatura
Aspartato Amino transferasi (AST o GOT),
18
Lattato deidrogenasi (LDH),
Acido lattico,
Acido piruvico,
Ammoniaca (NH3).
Emozione e stress
Colesterolo ,
Ormoni tiroidei,
adrenalina e noradrenalina
Stress mentale
Escrezione Urinaria delle catecolammine
Vasopressina
Traumi chirurgici
Creatina fosfochinasi (CPK) ,
AST (o GOT)
Dopo il prelievo entrano in gioco altre variabili che possono influenzare il
risultato dell’esame: l’uso di un anticoagulante appropriato, la conservazione del
campione e il suo trasporto al laboratorio.
È importante evitare stress meccanici, per esempio l’applicazione di un laccio
emostatico troppo stretto o troppo a lungo durante il prelievo, oppure l’agitazione
delle provette durante il trasporto del campione. Questo tipo di stress meccanici
possono dar luogo ad emolisi, cioè alla rottura dei globuli rossi con fuoriuscita di
emoglobina e di altre sostanze.
Se il sangue deve essere conservato allo stato fluido è importante usare
provette contenenti un appropriato anticoagulante (EDTA, citrato, eparina, NaF).
Alcuni di questi anticoagulanti possono determinare importanti artefatti.
19
CONSERVAZIONE DEI CAMPIONI DI SANGUE E MODIFICAZIONI
PREANALITICHE
Luigi Spandrio, Piccin Editore.
L’intervallo di tempo che intercorre, anche normalmente, fra l’esecuzione del
prelievo e l’effettuazione delle analisi, può causare una modificazione nella
concentrazione dell’analita o nell’attività biologica o biocatalitica del sistema che si
intende misurare.
Le cause di questo fenomeno possono essere di tipo fisico, chimico-fisico e
biologico o biometabolico.
Le cause di tipo fisico interessano soprattutto l’evaporazione, la solubilità,
l’adsorbimento e la diffusione.
L‘evaporazione del campione risulta strettamente legata alla temperatura
ambiente, all’umidità relativa, alla tensione superficiale e alla superficie (sezione) di
esposizione del liquido all’aria, nonché alla distanza fra la superficie di esposizione e
l’aria libera e, infine, al tempo di conservazione.
L’incremento nella concentrazione dell’analita per evaporazione risulta inoltre
correlato, a parità di altre condizioni, al volume del campione liquido.
Senza volere entrare nei dettagli dei vari parametri si può affermare che le
variazioni indotte dal fenomeno dell’evaporazione sono tutt’altro che trascurabili,
specie nella stagione calda e per tempi di esposizione prolungati.
La solubilità dei composti chimici presenti nei liquidi biologici può alterarsi
drasticamente nel tempo, non tanto per il sangue, il siero o il plasma (dove la matrice
proteica funge da ottimo stabilizzatore), quanto, piuttosto, per le urine; in questo
caso il semplice abbassamento della temperatura a livello ambiente o di frigorifero
(nel caso della raccolta delle urine delle 24 ore), o la modesta modificazione del pH
dovuta alla non sterilità del materiale (fermentazione batterica), possono indurre
ampie riduzioni nella solubilità di taluni costituenti, con abbondante precipitazione
dei medesimi (es. calcio, fosfato, calcio ossalato, acido urico, metaboliti di farmaci,
ecc.).
L’analisi di questi componenti esige la previa solubilizzazione del materiale
precipitato, operazione non sempre semplice ed immediata e che richiede un
trattamento particolare in funzione di ogni singolo composto; sarà allora
indispensabile l’acidificazione a valori di pH di 1,5-2,0 per solubilizzare l’ossalato di
calcio seguita da agitazione e riscaldamento; l’alcalinizzazione del mezzo per l’acido
urico, ecc.
In mancanza di idonei trattamenti i risultati analitici possono essere
20
grossolanamente errati rispetto alla situazione biologica originaria.
L‘adsorbimento alle pareti del contenitore può interessare soprattutto i cationi,
con particolare riferimento a calcio, magnesio, ferro, ecc. e dipende dalla natura del
materiale (vetro, vari tipi di plastica), dal tempo di contatto e dalla temperatura;
questo fenomeno, salvo casi di lunga conservazione in frigorifero, non induce
variazioni rilevanti.
La diffusione fisica esplica importanti conseguenze in due situazioni:
a)
quando il siero o il plasma viene conservato in presenza del coagulo o degli
eritrociti; la fuoriuscita di costituenti endoeritrocitari (potassio, esteri
fosforici organicb ecc.) aumenta la concentrazione dei medesimi creando un
tipico gradiente di diffusione.
Pertanto si evidenzieranno misure analitiche differenti in funzione della
distanza del punto di prelievo del liquido da analizzare dalla superficie del
coagulo stesso;
b)
quando un campione (siero, plasma, urine, ecc.) viene congelato; durante la fase
di congelamento si può creare, in funzione del tempo e delle modalità del
congelamento stesso, un gradiente di concentrazione, anche molto elevato.
Se lo scongelamento non è seguito da mescolamento, tale gradiente, può,
almeno in parte, permanere e causare sensibili variazioni di concentrazione
sempre a seconda del punto di prelievo del liquido da sottoporre ad analisi.
Tra i processi chimico-fisici, quelli che possono indurre maggiori modificazioni
nella composizione o nella natura di importanti costituenti biochimici, sono l’effetto
fotochimico, la denaturazione e l’aggregazione.
L‘effetto fotochimico è dovuto alle radiazioni attiniche della luce solare, che è in
grado, agendo su molecole a struttura chimica particolare, in genere sostanze
fotoassorbenti, di alterarne più o meno ampiamente la struttura stessa, in modo da
renderle non più misurabili con i comuni metodi analitici; le condizioni generali del
mezzo (pH, presenza di sostanze riducenti, ossidanti, ecc.), il tempo di esposizione
alle radiazioni e l’intensità di queste ultime (luce solare diretta, luce diffusa, ecc.)
sono fattori molto importanti nel condizionare l’intensità del fenomeno.
In tal modo si spiega la variabilità di risposta da campione a campione “coeteris
paribus”.
Le sostanze più importanti, dal punto di vista chimico-clinico che subiscono questo
tipo di alterazione sono la bilirubina e le varie porfirine.
Il modo per evitare tale alterazione consiste nel conservare le sostanze al buio e,
21
se necessario, come per le porfirine, alcalizzando il pH moderatamente e congelando.
La denaturazione e le modificazioni conformazionali, in genere, riguardano
alterazioni steriche o strutturali dei siti attivi di molecole complesse (proteine
semplici o coniugate), che si riflettono nella modificazione di qualche proprietà
biochimica della molecola originaria (attività catalitica, specificità o avidità
immunologica o, comunque, proprietà di legame; tale fenomeno dipende dal tempo,
dalla temperatura, dal pH e, più in generale, dalla composizione biologica del mezzo.
In certi casi il fenomeno può essere accelerato da processi di ossidazione quando
alla costituzione del sito attivo partecipano radicali tiolici.
Come conseguenza si riscontra una perdita progressiva di intensità della proprietà
biologica tipica della molecola, perdita che può essere, in certe condizioni, molto
marcata come nel caso di attività enzimatiche.
Per ovviare, almeno in parte, a questa perdita di attività nel tempo, il mezzo più
semplice è rappresentato dalla refrigerazione, unita, in qualche caso, alla
modificazione del pH, per esempio con citrato o acetato nel caso della fosfatasi
acida prostatica e alla aggiunta di sostanze con gruppi sulfidrilici liberi nel caso della
creatinfosfochinasi.
Al contrario i detergenti, i solventi organici, i microorganismi e talvolta anche il
congelamento, alterano notevolmente la stabilità delle proteine.
Le proteine del plasma, durante la conservazione, possono andare incontro anche a
fenomeni di polimerizzazione o, più in generale, di aggregazione; come conseguenza
possono risultare alterate le misure delle proteine stesse.
Le cause di tipo biochimico o biometabolico agiscono immediatamente in vitro” su
tutte quelle sostanze che nell’organismo si trovano in uno stato dinamico dal punto
di vista metabolico; le modificazioni nel tempo di tali sostanze, dopo il prelievo,
possono essere di entità drammatica, sia in aumento (acido lattico, acido piruvico,
NH4+, ADP, AMP, H+), sia in diminuzione (glucosio, ATP); è evidente che, se non si
adottano opportuni accorgimenti immediatamente al momento del prelievo, si
otterranno dei risultati analitici privi di qualunque significato medico.
I cambiamenti nella concentrazione di queste sostanze sono così rapidi che
normalmente non si può aspettare neppure che si verifichi il processo di
coagulazione; pertanto si dovrà effettuare il prelievo con anticoagulante idoneo e
procedere, poi, in maniera diversa da caso a caso; talvolta basterà un’immediata
refrigerazione del campione (pH ed emogasanalisi) fino al momento della misura,
oppure il congelamento del plasma (NH4+) quando il differimento nel tempo
dell’analisi è più prolungato.
22
In altri casi anche questi provvedimenti risultano insufficienti e si richiede la
immediata deproteinizzazione, magari con soluzione deproteinizzante (acido
perclorico) raffreddata, come nel caso della misura dell’acido lattico e dell’acido
piruvico.
Per la misura della glicemia, infine, si può ricorrere all’uso di una sostanza
glicostatica (fluoruro, monoiodoacetato), insieme alla refrigerazione quando i tempi
di conservazione sono lunghi.
D’altro canto non si può dimenticare che il blocco del sistema glicolitico
(glicostatici, raffreddamento) comporta un rapido esaurimento del tenore di ATP
endoeritrocitario e il venir meno di questo sistema energetico porta di pari passo
alla progressiva inefficienza dei sistemi di “pompa” e quindi dei gradienti a livello
della membrana eritrocitaria; la conseguenza sarà rappresentata dalla fuoriuscita di
potassio e di esteri fosforici dagli eritrociti e dall’aumento della loro concentrazione
nel plasma.
Per ovviare a questi inconvenienti e per rimediare a queste esigenze, talora
contrastanti, sarà allora necessario procedere alla tempestiva separazione del
plasma dagli eritrociti.
Contenitori dei campioni
Un contenitore per i campioni di sangue dovrebbe avere i seguenti requisiti
teorici:
essere perfettamente pulito,
essere chimicamente inerte e trasparente,
avere una buona resistenza meccanica e termica;
essere a perfetta tenuta ed avere tacche di taratura volumetrica di buona
approssimazione;
essere di basso costo per non richiedere la riutilizzazione (“disposable”).
Attualmente il vetro è ancora molto usato, nonostante taluni seri inconvenienti
legati alla necessità del lavaggio, alle possibilità di scambi ionici, ed all’effetto di
attivazione dei sistemi emocoagulativi, particolarmente marcato per vetri riusati e
rigati.
Caratteristiche più soddisfacenti hanno alcuni materiali sintetici, come il
polipropilene, il polimetacrilato ed il polistirene.
VALUTAZIONE DEI CONTENITORI
23
Valutazione della facilità di apertura dei diversi tipi di
provette (giudizio concorde degli 8 operatori)
Tipo di provetta
Caratteristica
valutata
Apertura
A
B
C
D
E
F
Media
Media
facile
facile
facile
Facile
rara
rara
rara
rara
frequente
frequente
rara
rara
difficoltà difficoltà
Contaminazione
esterna tappi
rara
rara
Contaminazione frequente frequente
interna tappi
Controllo tra i risultati analitici ottenuti con diverse provette
L’ANOVA fattoriale e i successivi confronti multipli eseguiti sui risultati analitici ottenuti
con i diversi tipi di provette ha consentito di evidenziare l’influenza del tipo di provetta:
differenze statisticamente significative tra i vari tipi di provette sono realizzate per i
dosaggi di
glucosio,
LDH,
Bilirubina,
Aptoglobina,
comunque contenute al di sotto del 2% e quindi al di sotto dei valori di imprecisione
dei metodi di dosaggio.
TEMPERATURA: Alcuni costituenti serici rimangono stabili a temperatura
ambiente per 4 ore, o a 4 °C per 24 ore
Occorre invece il rapido raffreddamento (miscela di acqua e ghiaccio), ma senza
congelamento per analiti quali la gastrina, insulina e renina oppure ammoniaca e acido
lattico.
LIOFILIZZAZIONE: è molto efficace per la conservazione di sistemi biologici
delicati. Viene molto usata dall’industria farmaceutica e di prodotti diagnostici.
Trasporto dei campioni
Viene
generalmente
eseguito
manualmente,
senza
previo
trattamento
o
24
separazione dei campioni; per eventuale trasporto o spedizione a distanza, può
essere indispensabile procedere alla separazione del siero o plasma ed alla eventuale
refrigerazione con ghiaccio secco posto in adatti contenitori isolati.
Il corretto trasporto del materiale biologico è fondamentale per la riuscita delle
determinazioni analitiche al fine di ridurre al minimo i rischi di errori nella
valutazione
Il trasporto dall’interno o dall’esterno della struttura addetta alla lavorazione del
materiale biologico segue indicazioni diverse
Il trasporto intramurale prevede il trasferimento del materiale dal sito di
prelievo a quello di analisi e viene effettuato da infermieri o da personale
specializzato che utilizzano provette o appositi contenitori sistemati in alloggiamenti
idonei e accompagnati da fogli ed etichette di identificazione
Nel trasporto extramurale invece si effettuano indagini molto specialistiche
con l’uso di, per esempio, contenitori a tappo a vite infrangibili; contenitori a ghiaccio
sintetico o azoto liquido, contenitori schermati per prodotti radioattivi
Intervalli e valori di riferimento.
L’interpretazione dei risultati di laboratorio è un caso speciale di decisione
fatta per confronto con un valore decisionale, un valore precedente o un
intervallo di riferimento.
Nel caso del valore decisionale non c’è un intervallo di valori, esistono invece
valori soglia (cut-off) ovvero valori limite dei parametri misurati oltre ai quali tali
parametri sono considerati anormali e comportano delle decisioni cliniche.
Nel caso del criterio del valore precedente la decisione medica si prende per
confronto con i risultati di un test eseguito in precedenza sul paziente.
Nel caso dell’intervallo di riferimento si definisce di un insieme di valori
ottenuto dall’osservazione o dalla misura di un particolare analita su individui di
riferimento, vale a dire individui selezionati per confronto usando criteri ben
definiti indicati da organismi internazionali.
Devono essere soggetti sani, che non presentano patologie.
Per ciascuno dei parametri presi in esame ciò che viene fornito al medico
curante è un valore numerico che va confrontato con un intervallo di valori compresi
tra un limite inferiore ed un limite superiore, entro cui si fa rientrare la “normalità”:
al di fuori dei limiti fissati dall’intervallo di riferimento il risultato è da
considerare patologico.
La cosiddetta normalità dei parametri di laboratorio è un concetto astratto:
oggi si preferisce perciò il termine, già menzionato, di valori di riferimento,
cioè valori relativi ad una popolazione di riferimento.
25
I valori patologici sono quelli che eccedono l'intervallo di valori di riferimento e
che sono riconosciuti come tali per la loro plausibilità clinica.
26