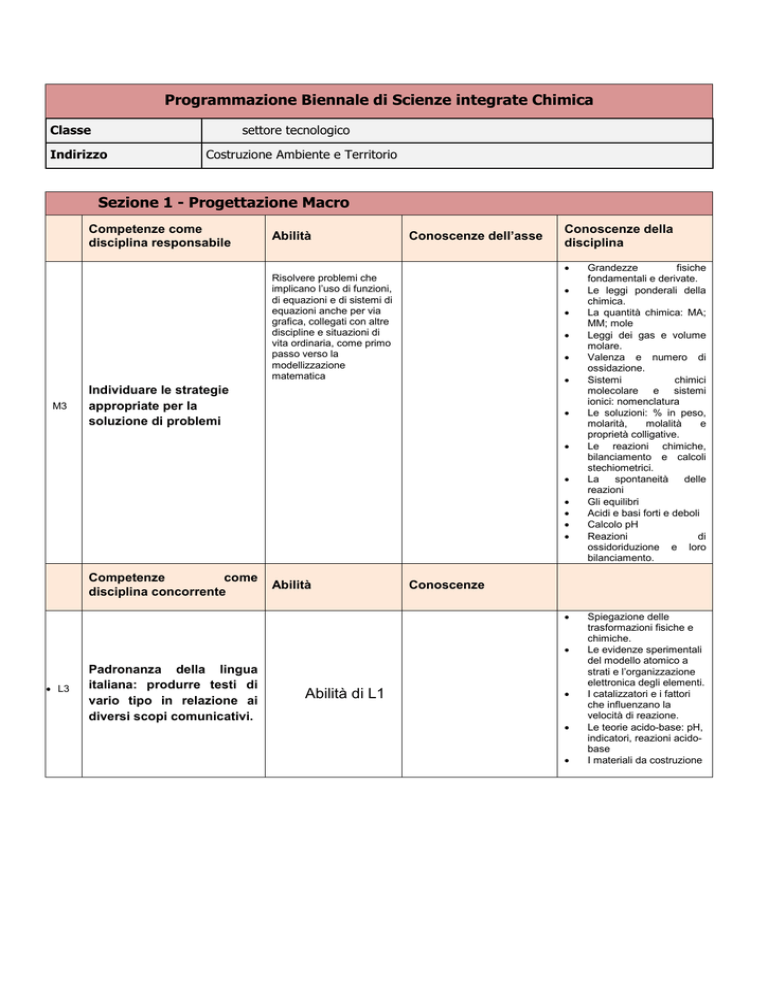
Programmazione Biennale di Scienze integrate Chimica
Classe
settore tecnologico
Indirizzo
Costruzione Ambiente e Territorio
Sezione 1 - Progettazione Macro
Competenze come
disciplina responsabile
Abilità
Conoscenze dell’asse
Conoscenze della
disciplina
Risolvere problemi che
implicano l’uso di funzioni,
di equazioni e di sistemi di
equazioni anche per via
grafica, collegati con altre
discipline e situazioni di
vita ordinaria, come primo
passo verso la
modellizzazione
matematica
M3
Individuare le strategie
appropriate per la
soluzione di problemi
Competenze
come
disciplina concorrente
Abilità
Conoscenze
L3
Padronanza della lingua
italiana: produrre testi di
vario tipo in relazione ai
diversi scopi comunicativi.
Abilità di L1
Grandezze
fisiche
fondamentali e derivate.
Le leggi ponderali della
chimica.
La quantità chimica: MA;
MM; mole
Leggi dei gas e volume
molare.
Valenza e numero di
ossidazione.
Sistemi
chimici
molecolare e sistemi
ionici: nomenclatura
Le soluzioni: % in peso,
molarità,
molalità
e
proprietà colligative.
Le reazioni chimiche,
bilanciamento e calcoli
stechiometrici.
La
spontaneità
delle
reazioni
Gli equilibri
Acidi e basi forti e deboli
Calcolo pH
Reazioni
di
ossidoriduzione e loro
bilanciamento.
Spiegazione delle
trasformazioni fisiche e
chimiche.
Le evidenze sperimentali
del modello atomico a
strati e l’organizzazione
elettronica degli elementi.
I catalizzatori e i fattori
che influenzano la
velocità di reazione.
Le teorie acido-base: pH,
indicatori, reazioni acidobase
I materiali da costruzione
S1
Osservare, descrivere ed
analizzare fenomeni
appartenenti alla realtà
naturale ed artificiale e
riconoscere nelle sue varie
forme il concetto di sistema e
di complessità
Individuare le
grandezze che
cambiano e quelle
che rimangono
costanti in un
fenomeno.
Effettuare misure di
massa, volume,
temperatura, densità,
Effettuare
separazioni tramite
filtrazione,
distillazione,
cristallizzazione,
centrifugazione,
cromatografia,
estrazione con
solventi.
Determinare la
quantità chimica in un
campione di una
sostanza ed usare la
costante di Avogadro.
Usare il concetto di
mole come ponte tra
il livello macroscopico
delle sostanze ed il
livello microscopico
degli atomi, delle
molecole e degli ioni
Preparare soluzioni di
data concentrazione
(percento in peso,
molarità,molalità).
Riconoscere
sostanze acide e
basiche tramite
indicatori, anche di
origine vegetale, e
misure di pH.
Bilanciare le reazioni
di ossido riduzione
col metodo ionico
elettronico
Le leggi ponderali della
chimica e l’ipotesi
atomico-molecolare.
Le evidenze sperimentali
di una sostanza pura
La quantità chimica: MA,
MM, mole e costante di
Avogadro.
L’organizzazione
microscopica del gas
ideale, le leggi dei gas e il
volume molare.
Le particelle fondamentali
dell’atomo: numero
atomico, numero di
massa e isotopi.
Forme e proprietà del
sistema periodico:
metalli, non metalli e
semimetalli.
Legami chimici: regola
dell’ottetto, principali
legami chimici e forze
intermolecolari, valenza,
numero di ossidazione,
scala di elettronegatività,
forma delle molecole.
Le soluzioni: % in peso,
molarità.
Le reazioni chimiche:
bilanciamento
Le teorie acido-base: pH,
indicatori, reazioni acidobase.
Materiali da costruzione
S2
Analizzare qualitativamente
e quantitativamente
fenomeni legati alle
trasformazioni di energia a
partire dall’esperienza.
S3
Essere consapevole delle
potenzialità delle tecnologie
rispetto al contesto culturale
e sociale cui vengono
applicate.
Effettuare misure
della temperatura di
fusione, temperatura
di ebollizione (da
usare per identificare
le sostanze).
Utilizzare il modello
cinetico – molecolare
per spiegare le
evidenze delle
trasformazioni fisiche
e chimiche e
costruire grafici
temperatura /tempo
per i passaggi di
stato.
Spiegare la forma a
livelli di energia
dell’atomo sulla base
delle evidenze
sperimentali, come il
saggio alla fiamma.
Spiegare le
trasformazioni
chimiche che
comportano scambi
di energia con
l’ambiente.
Disegnare e
descrivere il
funzionamento di pile
e celle elettrolitiche
Conoscere i simboli
di pericolosità
presenti sulle
etichette dei materiali
per un loro utilizzo
sicuro.
Effettuare
investigazioni in scala
ridotta con materiali
non nocivi, per
salvaguardare la
sicurezza personale
e ambientale.
Spiegare la forma
delle molecole e le
proprietà delle
sostanze.
Utilizzare le regole
della nomenclatura
IUPAC.
Determinare la
costante di equilibrio
di una reazione dalle
concentrazioni di
reagenti e prodotti.
Spiegare l’azione dei
catalizzatori e degli
altri fattori sulla
velocità di reazione
Descrivere le
proprietà fisiche e
chimiche di
idrocarburi, dei
diversi gruppi
funzionali e delle
biomolecole
Il modello particellare
(concetti di atomo,
molecola e ione) e le
spiegazioni delle
trasformazioni fisiche e
chimiche.
Il modello atomico ad
orbitali.
La termodinamica
chimica
Nozioni sulla lettura delle
etichette e sui simboli di
pericolosità di elementi e
composti.
Elementi di nomenclatura
chimica.
Cinetica chimica
Gli equilibri chimici
Elettrochimica
I materiali da costruzione
Sezione 2: Processo di lavoro classe 1°
n.
1
2
3
4
ore
Titolo
15
La materia e
le sue
trasformazioni
15
Lavorare con
gli atomi: la
mole
27
22
All’interno
dell’atomo
Legami
chimici e
struttura delle
molecole
Attività docente
Misure
e
grandezze;
atomi,
molecole, composti e miscele; le
trasformazioni fisiche e chimiche
della materia; le leggi ponderali
La quantità chimica: la mole.
Massa atomica e molecolare.
Reazioni chimiche e bilanciamento.
Uso del coefficiente stechiometrico.
La struttura dell’atomo: da Dalton a
Bohr.
Natura dualistica della luce e atomo
di Bohr. Il modello atomico ad
orbitali. Configurazione elettronica
degli
atomi.
Caratteristiche
periodiche
Legami molecolari e
intermolecolari. La geometria delle
molecole.
Metodologia
Prestazioni studenti
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
5
20
Gli stati della
materia
I gas perfetti. Le soluzioni e le
proprietà colligative. I solidi.
Conoscere gli stati di
aggregazione ed i passaggi di
stato utilizzando la teoria
cinetico-molecolare della
materia. Conoscere la differenza
e distinguere un elemento da un
composto.
Sapere calcolare il Peso
Molecolare di composti. Sapere
calcolare la mole. Bilanciare una
reazione chimica secondo il
metodo per tentativi. L’uso del
coefficiente stechiometrico.
Conoscere le particelle
subatomiche e le loro
caratteristiche. Conoscere i
modelli atomici di Thomson,
Rutherford, Bohr, Schrodinger.
Sapere scrivere la configurazione
elettronica esterna. Sapere
correlare la scrittura esterna con
la tavola periodica.
Conoscere e sapere utilizzare le
grandezze periodiche.
Conoscere i legame: ionico,
covalente puro e polare, dativo e
di coordinazione. Conoscere le
forze di Van der Waals e il
legame idrogeno. Conoscere la
teoria VSEPR.
Conoscere e sapere utilizzare il
modello di gas perfetto.
Conoscere e sapere applicare la
legge di Boyle, Charles, GayLussac, generale ed equazione
di stato.
Conoscere cosa si intende per
soluzione. Comprendere i
fenomeni legati alla dissoluzione
di un soluto in un solvente.
Conoscere e sapere utilizzare la
concentrazione delle soluzioni: %
in peso, molarità, molalità.
Conoscere e sapere calcolare gli
effetti del soluto sulle proprietà
chimico-fisiche del solvente.
Conoscere le caratteristiche dello
stato solido e i diversi tipi di
solidi.
Conoscere i difetti dei reticoli
cristallini.
Conoscere cosa sono e come si
comportano e cristalli liquidi.
Sezione 2: Processo di lavoro classe 2°
n.
ore
Titolo
Attività docente
Metodologia
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
Prestazioni studenti
1
15
Il controllo
delle reazioni
chimiche
Termodinamica chimica e
cinetica chimica
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
2
13
L’equilibrio
chimico
L’equilibrio chimico
L’equilibrio in soluzione
L’idrolisi salina
3
12
Le reazioni
che
coinvolgono gli
elettroni
Le ossidoriduzioni
Elettrochimica
Lezione frontale,
partecipata, esercizi
guidati in classe,
laboratorio di chimica,
problem solving.
Distinguere una reazione
esotermica da una endotermica.
Enunciare e spiegare il 1
principio della termodinamicaDefinire le grandezze energia
interna ed entalpia con le sue
proprietà. Collegare il calore di
reazione con le variazioni di
energia interna e di entalpia.
Enunciare il 2 principio della
termodinamica e applicarlo alle
reazioni chimiche.
Definire le grandezze entropia
ed energia libera.
Usare le grandezze
termodinamiche per prevedere la
spontaneità delle reazioni.
Definire la velocità di reazione.
Conoscere e sapere utilizzare i
fattori che influenzano la velocità
di una reazione.
Conoscere e sapere scrivere
l’espressione cinetica di una
reazione.
Sapere in quale rapporto sta la
temperatura con la velocità di
reazione.
Conoscere la teoria degli urti e
del comp0lesso attivato.
Conoscere con quale
meccanismo agiscono i
catalizzatori.
Definire il concetto di equilibrio
dinamico
Sapere scrivere ed interpretare
la costante di equilibrio
Definire la legge dell’azione di
massa.
Conoscere e sapere utilizzare il
concetto di equilibrio omogeneo
ed eterogeneo.
Conoscere e sapere applicare il
principio di Le Chatelier.
Definire il prodotto ionico
dell’acqua e il pH.
Conoscere la relazione
fondamentale tra pH e pOH.
Conoscere e sapere utilizzare la
scala del pH.
Conoscere e sapere utilizzare le
teorie di Arrhenius e di BronstedLowry
Conoscere cosa si intende per
reazione di neutralizzazione.
Conoscere e sapere interpretare
il fenomeno dell’idrolisi salina.
Definire una reazione redox e
saperla bilanciare.
Descrivere il funzionamento di
una cella elettrolitica: la pila
Daniell
Descrivere l’elettrodo a idrogeno
e conoscerne l’utilizzazione.
Impiegare nei calcoli la serie dei
potenziali redox.
Conoscere il funzionamento di
4
5
6
Materiali da
costruzione:
materiali
lapidei
Materiali da
costruzione:
leganti aerei
Materiali da
costruzione:
leganti idraulici
conglomerati
cementizi
Rocce ignee, sedimentarie,
metamorfiche.
Principali materiali ottenuti dai vari
tipi di rocce.
Materiali lapidei incoerenti
La degradazione
Impatto ambientale e sicurezza sui
luoghi di lavoro
Leganti
Calce aerea
Gesso
Degradazione
Impatto ambientale e sicurezza sui
luoghi di lavoro
Cemento Portland
Presa ed indurimento
Caratteristiche ed impieghi
Cementi speciali normalizzati
Cementi speciali non normalizzati
Degradazione
Calcestruzzo e calcestruzzo
armato.
Impatto ambientale e sicurezza sui
luoghi di lavoro
Lezione frontale,
partecipata, problem
solving.
7
Materiali da
costruzione:
leganti organici
Lezione frontale,
partecipata, problem
solving.
Lezione frontale,
partecipata, problem
solving.
Lezione frontale,
partecipata, problem
solving.
Bitumi,catrami ed asfalti.
Prodotti commerciali derivati dal
bitume.
Conglomerati bituminosi.
Degradazione
Impatto ambientale e sicurezza sui
luoghi di lavoro
8
Materiali da
costruzione:
materiali
ceramici
Argille e materiali argillosi come
materie prime.
La produzione di materiali ceramici.
I laterizi
Prodotti diversi dai laterizi:
maioliche, gres, terraglia e
porcellana
I refrattari
La degradazione
Impatto ambientale e sicurezza sui
luoghi di lavoro
Lezione frontale,
partecipata, problem
solving.
altri tipi di pile.
Descrivere il funzionamento di
una cella elettrolitica.
Conoscere le leggi di Faraday.
Conoscere come avviene la
raffinazione dei metalli, la
galvanostegia, galvanoplastica
ed elettroforesi.
Conoscere le fasi di produzione
della calce aerea e del gesso.
Conoscere i pregi e i difetti dei
leganti aerei.
Conoscere gli usi dei leganti
aerei.
Conoscere quale impatto
ambientale hanno.
Quali precauzioni bisogna
applicare per garantire la
sicurezza sul luogo di lavoro
Conoscere le fasi di produzione
della calce aerea e del gesso.
Conoscere i pregi e i difetti dei
leganti aerei.
Conoscere gli usi dei leganti
aerei.
Conoscere quale impatto
ambientale hanno.
Quali precauzioni bisogna
applicare per garantire la
sicurezza sul luogo di lavoro
Conoscere il ciclo di produzione
del cemento Portland. Pregi e
difetti. La degradazione e la
prevenzione. Conoscere Il
cemento pozzolanico,d’altoforno,
alluminoso e cemento ferrico,
cemento bianco, cemento a
basso sviluppo di calore.
Conoscere il loro utilizzo.
Conoscere il loro impatto
ambientale.
Quali precauzioni bisogna
applicare per garantire la
sicurezza sul luogo di lavoro
Conoscere l’origine e la
composizione del petrolio
Conoscere le differenze tre
bitumi, catrame ed asfalto.
Conoscere i principali prodotti
commerciali derivati dai bitumi.
Conoscere i bitumi modificati.
Conoscere i conglomerati
bituminosi.
I manti impermeabili.
La degradazione
Conoscere il loro impatto
ambientale.
Quali precauzioni bisogna
applicare per garantire la
sicurezza sul luogo di lavoro
Conoscere la struttura dei
minerali argillosi. Conoscere il
ciclo di lavorazione di materiali
ceramici in genere e dei laterizi.
Conoscere le differenze esistenti
tra prodotti ceramici diversi dai
laterizi ed il rispettivo uso.
Conoscere i diversi tipi di
refrattari ed il loro uso.
La degradazione.
Conoscere il loro impatto
ambientale.
Quali precauzioni bisogna
9
Materiali da
costruzione:
acqua
Acqua come materiale da
costruzione.
Inquinamento dell’acqua.
Impianto di depurazione delle
acque di scarico civile ed
industriale
Trattamenti biologici di
depurazione.
Impatto ambientale e sicurezza sui
luoghi di lavoro
Lezione frontale,
partecipata, problem
solving.
Lezione frontale,
partecipata, problem
solving.
10
Materiali da
costruzione:
metalli e leghe
Caratteristiche dei materiali
metallici
La siderurgia: ghisa ed acciaio
Il rame e le sue leghe
Lo zinco e le sue leghe
L’alluminio e le sue leghe
La corrosione e la protezione
Impatto ambientale e sicurezza sui
luoghi di lavoro
Lezione frontale,
partecipata, problem
solving.
10
Materiali da
costruzione:
legno
La cellulosa
La struttura del legno
Pregi e difetti del legno
Prodotti commerciali a base di
legno, loro utilizzo e
commercializzazione
Impatto ambientale e sicurezza sui
luoghi di lavoro
applicare per garantire la
sicurezza sul luogo di lavoro
Conoscere il ciclo dell’acqua e le
sue caratteristiche in relazione al
suo impiego
Conoscere le problematiche
legate all’uso ed inquinamento
delle acque civili ed industriali.
Conoscere un impianto di
depurazione delle acque di
grandi dimensioni.
Conoscere e comprendere la
complessità dei trattamenti
biologici delle acque.
Quali precauzioni bisogna
applicare per garantire la
sicurezza sul luogo di lavoro
Conoscere il legame metallico e
le caratteristiche peculiari dei
metalli.
Conoscere il processo
siderurgico.
Conoscere i diversi tipi di ghise
ed il loro impiego.
Conoscere le diversità che
esistono tra ghisa ed acciaio. La
conversione della ghisa in
acciaio.
Conoscere i diversi tipi di acciaio
ed i loro usi.
Conoscere le caratteristiche del
rame, dello zinco e l’alluminio e
delle loro leghe ed il relativo uso
in base alle caratteristiche.
Conoscere come avviene e
come possiamo contrastare la
corrosione dei materiali metallici
e delle loro leghe.
Conoscere il loro impatto
ambientale.
Quali precauzioni bisogna
applicare per garantire la
sicurezza sul luogo di lavoro
Conoscere la struttura e la
composizione del legno.
Conoscere il ciclo di lavorazione
dei prodotti derivati dal legno.
Conoscere le principali
alterazioni e trattamenti de
legno.
Conoscere i principali prodotti
artificiali del legno, le
caratteristiche e gli usi.
Conoscere il loro impatto
ambientale.
Quali precauzioni bisogna
applicare per garantire la
sicurezza sul luogo di lavoro