Qualche spunto di riflessione
sul secondo principio della termodinamica,
l’entropia e le macchine termiche
1
Il secondo principio
Il secondo principio della termodinamica descrive una fondamentale asimmetria della natura. Da un lato, non tutte le trasformazioni termodinamiche
che conservano l’energia (e che quindi sono possibili sulla base del primo
principio della termodinamica) possono avvenire in maniera spontanea; dall’altro, quando si realizza una trasformazione non spontanea, mentre è sempre possibile trasformare completamente energia meccanica in calore, non è
vero il contrario, non è cioé possibile trasformare completamente in energia
meccanica il calore assorbito da una sorgente.
Nell’usuale approccio didattico, il contenuto del secondo principio viene
postulato attraverso gli enunciati di Clausius e di Kelvin
Clausius - “Non è possibile realizzare una trasformazione termodinamica
il cui unico risultato sia il trasferimento di energia da un corpo più freddo ad
uno più caldo”
Kelvin - “Non è possibile realizzare una trasformazione termodinamica il
cui unico risultato sia la completa conversione in lavoro del calore assorbito
da un’unica sorgente”
L’enunciato di Clausius ha un contenuto intuitivamente chiaro per ciò che
riguarda le trasformazioni spontanee: non ci capita mai di mettere a contatto
due corpi a temperature differenti e di osservare una trasmissione spontanea
di energia da quello più freddo a quello più caldo. L’esperienza ci dice il contrario e cioé che in un tempo opportunamente lungo i due corpi si porteranno
alla stessa temperatura (ossia all’equilibrio termodinamico), dopo che il corpo
caldo avrà ceduto parte della sua energia a quello freddo. Dal punto di vista
1
delle trasformazioni non spontanee, l’enunciato di Clausius ci dice che per
realizzare una macchina frigorifera dobbiamo inevitabilmente spendere del
lavoro (i frigoriferi che usiamo nelle nostre case sfruttano l’energia elettrica
per comprimere il freon che si trova nel circuito di alimentazione).
Il contenuto dell’enunciato di Kelvin è già un po’ più ostico da afferrare,
ma, se non altro, l’esperienza di tutti i giorni ci suggerisce che tutte le macchine che ci circondano, ed il cui funzionamento è basato sull’assorbimento di
calore da una sorgente, disperdono parte di questo calore con un qualche sistema di raffreddamento, scambiando perciò calore con una seconda sorgente
(l’ambiente esterno).
2
L’entropia
Questi enunciati esprimono il contenuto del secondo principio facendo riferimento alle trasformazioni dell’energia e alle sorgenti di calore. Una scelta
alternativa è quella utilizzare il concetto di entropia come concetto centrale
per la formulazione del secondo principio. L’entropia viene infatti introdotta
come funzione di stato S = S(T ) (ossia come una grandezza che ha un valore ben definito per ogni stato di un sistema termodinamico caratterizzato
dalla temperatura di equilibrio T), per poi procedere alla riformulazione del
secondo principio in termini entropici mediante l’uso del concetto di trasformazione reversibile e attraverso l’astratta espressione analitica dell’entropia
in termini dell’integrale di Clausius. Il secondo principio prende allora la
forma del principio dell’entropia in base al quale:
In ogni trasformazione termodinamica, l’entropia di un sistema isolato
non può diminuire. Nelle trasformazioni spontanee l’entropia aumenta.
Si può poi calcolare l’aumento di entropia utilizzando l’integrale di Clausius, calcolato lungo una trasformazione reversibile i cui stati iniziale e finale
coincidano con quelli della trasformazione in questione.
Sf in − Sin =
stato f in.
stato in.
δQ
T
(P er una trasf ormazione reversibile) (1)
Questo approccio pone il concetto di entropia ad un livello di astrazione
molto superiore relativamente a quelli di energia o di temperatura, che, pur
essendo molto più legati all’intuizione, sono almeno altrettanto astratti (e ce
ne accorgiamo quando proviamo a darne definizioni formali). Il concetto di
2
Entropia diviene di solito più chiaro solo quando si passa alla sua interpretazione in termini microscopici. Tuttavia è possibile conferire all’entropia una
dimensione intuitiva senza dover immediatamente far riferimento ad atomi e
molecole.
Cerchiamo allora di dare una definizione di entropia meno formale della (1). Nel formulare questa definizione dobbiamo tenere ben presente che
essa vale, in principio, solo nel caso di trasformazioni reversibili, ovvero
sia trasformazioni che avvengano molto lentamente (quasi-statiche, come si
dice), passando in maniera continua attraverso stati di equilibrio termodinamico. Per questo tipo di trasformazioni possiamo definire la variazione di
entropia relativa ad un sistema che scambia calore, semplicemente come
ΔS =
ΔQ
T
(2)
con la convenzione che l’assorbimento di calore corrisponda ad un ΔQ
positivo.
Questa definizione ha significato soltanto se la temperatura del sistema
rimane costante durante l’assorbimento del calore. Questo significa che, in
principio, la definizione è applicabile solo a quella che si suole chiamare una
riserva di calore, ossia ad un sistema abbastanza esteso da non subire cambiamenti sostanziali di temperatura a prescindere dalla quantità di energia che
scambia interagendo con altri sistemi (ad esempio l’acqua del mare è una riserva di calore se considerata come sistema che interagisce, scambiando calore,
con i corpi dei bagnanti che ci si tuffano).
Tuttavia è facile estendere la definizione ad un sistema qualunque. Sempre immaginando che le trasformazioni avvengano in maniera quasi-statica,
possiamo immaginare di costruire un misuratore della variazione di entropia
per un sistema arbitrario, semplicemente accoppiando un termometro con
un calcolatore che determini ΔS sommando tra loro n contributi successivi
alla variazione di entropia, determinati da piccoli scambi di calore ΔQi che
avvengono a temperature approssimativamente costanti Ti
ΔS =
n
ΔQi
i=1
Ti
(3)
In sostanza questo ipotetico misuratore di entropia fornirebbe una stima
opportunamente approssimata del risultato del calcolo dell’integrale (1). Se
uno strumento di questo genere fosse di uso comune, il concetto di entropia
potrebbe forse esserci familiare quasi quanto quello di temperatura.
Intuitivamente si è portati infatti a pensare alle sensazioni di “caldo”
e “freddo” che proviamo entrando in contatto con un corpo, come legate
3
alla temperatura: un corpo “più caldo” ha temperatura maggiore di uno
“più freddo”. Questa semplice supposizione intuitiva è tuttavia banalmente
confutata dall’esperienza quotidiana. Immaginiamo di trovarci in una stanza
ad una temperatura ambiente di circa 20◦ C. Tutti gli oggetti all’interno
della stanza si trovano in ottima approssimazione all’equilibrio termico con
l’ambiente (se sono lì da parecchio tempo). Toccando però, ad esempio, con
le due mani un oggetto di metallo ed uno di legno, abbiamo due sensazioni
di calore completamente diverse: il corpo di metallo ci sembra decisamente
più freddo di quello di legno pur essendo le loro temperature molto vicine
(misurare per credere!). La nostra sensazione del calore non è quindi legata
alla temperatura. In realtà le nostre percezioni di caldo e freddo sono legate
alla quantità di calore scambiata e più in particolare alla rapidità con cui
avviene lo scambio: il ferro conduce il calore molto meglio del legno e quindi
lo scambio di calore determinato dalla differenza di temperatura tra la mano
e l’oggetto avviene molto più rapidamente per l’oggetto di ferro, piuttosto che
per quello di legno. Queste semplici considerazioni ci fanno comprendere che
il concetto di entropia definito con la (2) è molto più vicino all’idea intuitiva
di “caldo” di quanto non lo sia quello di temperatura.
3
Le macchine termiche
Una macchina termica è un dipositivo che trasforma calore in energia meccanica. Dovendo essere in grado di operare questa trasformazione, almeno
in principio, indefinitamente nel tempo, una tale macchina deve essere in
qualche maniera ciclica; deve cioé operare in maniera da attraversare una
serie di fasi del suo funzionamento, nelle quali si ha una produzione netta
di lavoro a spese del calore, per poi tornare allo stato iniziale ed iniziare un
nuovo ciclo di funzionamento.
Il prototipo di tutte le macchine termiche è la cosiddetta macchina di
Carnot: abbiamo un cilindro contenente un gas (un gas perfetto, nella descrizione del modello teorico della macchina) ed un pistone collegato ad una
biella, che può mettere in moto un albero motore; questo semplice dispositivo può sfruttare le dilatazioni e le compressioni del gas per trasformare il
calore che questo scambia con sorgenti esterne in energia meccanica, ossia,
per essere più precisi, per compiere un lavoro esterno. Le pareti del cilindro
possono essere messe a contatto con due riserve di calore aventi differenti temperature assolute Tc e Tf (che chiameremo sorgente calda e sorgente
fredda) o, in alternativa, con un isolante termico. La macchina di Carnot è
una macchina ideale. L’utilità della sua descrizione risiede nel fatto che il
4
ciclo di Carnot rappresenta un limite superiore alla capacità di una macchina
termica di produrre lavoro.
Il ciclo di Carnot è costituito da quattro fasi. Si suppone che tutte le
trasformazioni avvengano in maniera quasi-statica. Immaginiamo di partire
da uno stato in cui il pistone è ben inserito nel cilindro. Il gas all’interno
del cilindro occupa un volume piccolo e si trova ad una pressione piuttosto
elevata.
Nella prima fase del ciclo l’elevata pressione del gas fa si che esso si espanda compiendo lavoro sul pistone. Le pareti del cilindro sono a contatto con la
sorgente calda. Questa espansione avviene perciò a temperatura costante Tc
(isoterma), poiché il gas assorbe una certa quantità di calore dalla sorgente
calda in maniera che la sua temperatura non cambi nonostante l’espansione.
Se si lasciasse continuare questa espansione isoterma fino al punto in cui
il pistone si arresta e poi, spinto dall’inerzia impressa alla biella nella prima fase, ricomprime il gas, potremmo ottenere una trasformazione ciclica,
poiché questa compressione riporterebbe alla fine il gas nel suo stato iniziale
(rispettando la conservazione dell’energia totale). Si tratterebbe però di una
trasformazione ciclica inutile, poiché il lavoro compiuto dal gas sul pistone
nella prima fase, sarebbe esattamente identico a quello compiuto dal pistone
sul gas nella seconda e quindi non si avrebbe alcuna produzione netta di
energia meccanica.
La peculiarità fondamentale del ciclo di Carnot risiede perciò nella seconda fase del ciclo stesso. In questa fase l’espansione continua fino al punto massimo, ma questa seconda fase dell’espansione viene realizzata con le pareti del
cilindro a contatto col materiale isolante piuttosto che con la sorgente calda.
Questa espansione avviene quindi senza scambi di calore (adiabatica) e porta
quindi ad una diminuzione della temperatura del gas. La macchina ideale è
progettata in maniera che la temperatura del gas al termine dell’espansione
sia pari a Tf .
Il ciclo prosegue con una compressione isoterma a temperatura Tf : le
pareti del cilindro sono a contatto con la sorgente fredda ed il pistone compie
lavoro sul gas. La presenza della seconda fase del ciclo fa sì che il lavoro speso
dal pistone nella compressione del gas sia minore del lavoro compiuto dal gas
sul pistone nella fase di espansione. Questo perché l’espansione adiabatica
abbassa la pressione del gas più di quanto non avrebbe fatto un’espansione
isoterma.
Il ciclo si conclude con una compressione adiabatica, che riporta il gas nel
suo stato iniziale.
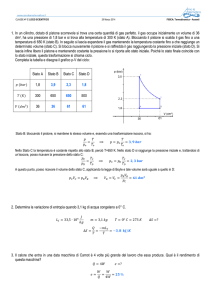
Riportando schematicamente l’evoluzione dello stato del gas in un piano
cartesiano Volume-Pressione (il cosiddetto piano di Clapeyron), otteniamo
la rappresentazione del ciclo di Carnot riportata in figura 1
5
Figura 1: Ciclo di Carnot
Il lavoro netto ottenuto durante il ciclo è dato dall’area racchiusa tra le
curve che lo descrivono.
Per caratterizzare l’efficienza della macchina di Carnot, ci interessa però
capire quale sia il rapporto tra l’energia prodotta sotto forma di lavoro e
l’energia assorbita sotto forma di calore. A questa quantità si da il nome di
rendimento della macchina
lavoro prodotto
L
Qc − Qf
Qf
rendimento =
=
=
= 1−
(4)
calore assorbito
Qc
Qc
Qc
dove con Qc e Qf abbiamo indicato il calore scambiato rispettivamente con
la sorgente calda e con quella fredda e dove abbiamo tenuto conto del fatto
che, in base al primo principio della termodinamica, deve risultare
L = Qc − Qf
(5)
Il secondo principio della termodinamica ci consente di esprimere il rendimento della macchina di Carnot in una forma che mette in luce il fatto che
il ciclo di Carnot ha la caratteristica di fissare un limite superiore al possbile rendimento di una qualunque macchina termica (a parità di temperatura
delle sorgenti utilizzzate).
Sulla base del principio dell’entropia sappiamo infatti che nel ciclo di
Carnot (che è costituito da trasformazioni reversibili) l’entropia ceduta alla
6
sorgente fredda deve essere uguale a quella prelevata dalla sorgente calda (in
modo che nell’intero ciclo la variazione di entropia sia nulla):
Qf
Qc
=
Tc
Tf
(6)
e quindi
rendimento = 1 −
Qf
Tf
=1−
Qc
Tc
(7)
Ovviamente qualunque altra macchina termica che operi con due sorgenti alle temperature Tc e Tf , potrà avere al più (nel caso funzioni con un
ciclo reversibile) un rendimento pari a quello della macchina di Carnot. Una
macchina reale, che operi attraverso trasformazioni non reversibili, dovrà necessiaramente avere un rendimento minore dovendo per essa risultare, sempre
sulla base del secondo principio
Qc
Qf
Qf
Tf
Qf
Tf
<
⇒
>
⇒ 1−
<1−
Tc
Tf
Qc
Tc
Qc
Tc
4
(8)
La macchina di Stirling
La macchina di Stirling è una macchina termica che, come la macchina di
Carnot, realizza la trasformazione ciclica di un gas contenuto in un cilindro
determinando la produzione di lavoro.
Nella sua versione più semplice, la macchina (vedi Figura 2) è costituita
da un unico cilindro diviso in due parti A e B, ognuna delle quali ospita un
pistone, e da un passaggio C che le mette in comunicazione. I due cilindri sono collegati tramite bielle ad un albero motore, in maniera tale che i
loro movimenti possano indurre la rotazione dell’albero. Nella realizzazione
pratica della macchina le parti A, B e C del cilindro possono anche essere
semplicemente zone distinte di un unico volume.
La parti A e B del cilindro sono costantemente a contatto con la sorgente
calda a temperatura Tc e con la sorgente fredda a temperatura Tf rispettivamente. Il passaggio C contiene uno speciale dispositivo, che è fondamentale
per il funzionamento della macchina, detto rigeneratore. Il rigeneratore ha
la funzione di mantenere costante la differenza di temperatura tra le parti
A e B del cilindro quando il gas passa dall’una all’altra (raffreddando il gas
quando è caldo e riscaldandolo quando è freddo). Tale dispositivo deve avere
bassa conducibilità termica e, contemporaneamente, deve avere alta capacità
termica, in maniera da poter funzionare da riserva temporanea di calore. Il
rigeneratore deve essere quindi costruito con un cattivo conduttore di calore
7
ed in modo da avere una grande superficie disponibile per lo scambio termico.
Un materiale particolarmente adatto a questi scopi è la cosiddetta lana di
rame.
Passiamo ora a descrivere le fasi del ciclo di Stirling, così come sono
schematicamente rappresentate in Figura 2
Figura 2: Ciclo di Stirling
Nello stato iniziale il pistone della parte A si trova ad un punto intermedio
della sua corsa, mentre il pistone B si trova a fine corsa verso l’alto. Questa
configurazione corrisponde al minimo volume occupato dal gas nell’intero
cilindro.
8
La prima fase del ciclo è caratterizzata da uno spostamento del pistone
A verso il basso fino a raggiungere la posizione di fine corsa, durante il quale
il pistone B resta praticamente immobile. Abbiamo quindi a che fare con
un’espansione isoterma a temperatura Tc che porta il gas al massimo volume
occupato nell’intero cilindro. In questa fase il gas compie lavoro sul pistone
A.
Nella seconda fase il pistone A si risposta verso l’alto fino a raggiungere
la posizione di fine corsa, mentre il pistone B si sposta verso il basso fino alla
posizione di fine corsa. In questa fase il volume del gas resta praticamente
costante (trasformazione isocora) mentre il gas fluisce dalla parte A alla parte
B del cilindro e viene raffredato dal rigeneratore. Il moto procede per inerzia
ed il lavoro compiuto dal sistema è nullo.
Nella terza fase il pistone A resta praticamente immobile, mentre il pistone B si sposta verso l’alto fino ad un punto intermedio della sua corsa. Si
tratta di una compressione isoterma a temperatura Tf che riporta il gas al
volume iniziale. In questa fase il pistone B compie lavoro sul gas.
Nell’ultima fase il pistone B conclude il suo spostamento verso l’alto raggiungendo la posizione di fine corsa, mentre il pistone A si sposta verso il
basso tornando alla sua posizione iniziale. Come nella seconda fase, il volume
resta praticamente costante mentre il gas fluisce dalla parte B alla parte A
riacquistando dal rigeneratore il calore che gli aveva ceduto nella seconda
fase e riportandosi a temperatura Tc .
Per capire come il susseguirsi di queste fasi possa essere compatibile con
la rotazione di un unico albero motore collegato ad entrambi i pistoni, si può
fare riferimento ad una animazione (che ci sembra particolarmente chiara)
disponibile alla pagina web
http://www.bekkoame.ne.jp/~khirata/english/anime_a.htm
nella quale si vede chiaramente che l’accorgimento da utilizzare è semplicemente quello di collegare le bielle dei due pistoni ad un albero a camme
con sfasamento di novanta gradi.
Al contrario di quanto accade per il ciclo di Carnot, le idee principali alla
base del ciclo di Stirling possono essere applicate alla costruzione di motori
reali il cui ciclo termodinamico è molto simile a quello ideale. Su internet è
facile reperire un’ampia documentazione (scritta e filmata) sui possibili modi
di costruire motori di Stirling reali. Questi motori sono basati su principi
costruttivi che ricordano da vicino quelli descritti in teoria in questo documento. Anche se esistono vari approcci tecnologici alla costruzione, che
differiscono per il numero di cilindri e di pistoni, tutti questi motori hanno
in comune due caratteristiche fondamentali: la sorgente calda può essere ot9
tenuta attraverso un qualsiasi processo di combustione esterna al motore; il
gas che compie il ciclo termodinamico è semplicemnte l’aria che tutti respiriamo. Ecco perché il motore di Stirling è noto anche col nome di motore ad
aria.
10