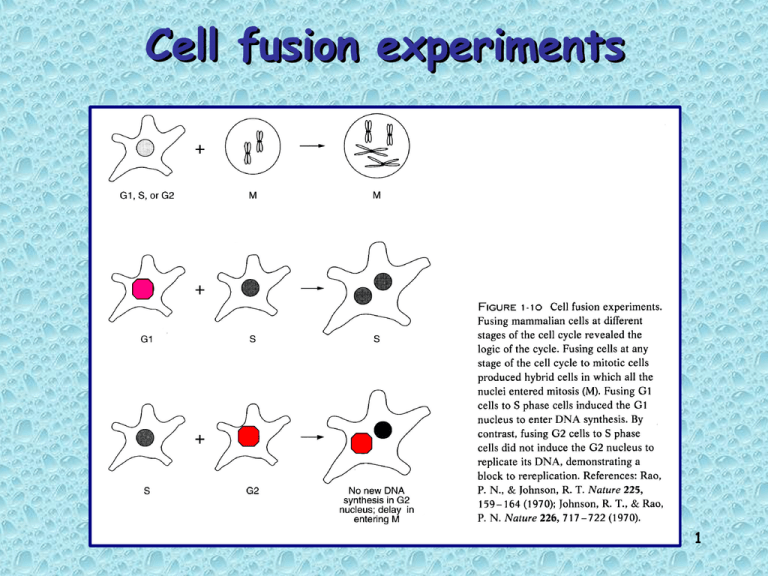
Cell fusion experiments
1
Fusion of mitotic cell to interphase cells
Interphase cells are induced to enter mitosis: chromosome
condensation + nuclear membrane breakdown
2
Fusione fra cellule in interfase e cellule in
mitosi:
La mitosi è dominante rispetto alle altre fasi;
Le cellule in mitosi contengono dei fattori
solubili che inducono cellule in interfase ad
entrare prematuramente in mitosi
M-phase Promoting Factor = MPF
3
Fusione fra cellule in G1 e cellule in S:
Le cellule in S contengono dei fattori
solubili che inducono la replicazione di nuclei
in G1;
L’eterocarion fuso non entra in M fino a
che il nucleo G1 non si è replicato
CONTROLLO FEEDBACK
4
Fusione fra cellule in G2 e cellule in S:
Le cellule in G2 non rientrano in S;
L’eterocarion fuso entra in M solo quando
tutto il nucleo in S è stato completamente
replicato
BLOCCO DI RIREPLICAZIONE
5
Different experimental systems have
contributed distinct kinds of information to our
understanding of the cell division cycle
Mammalian cells showed us the subdivision of
interphase into G1, S, and G2
Embryos (amphibian and echinoderm) have provided
large numbers of synchronized cells for useful
biochemistry, which has in turn led to the
identification of important control proteins
Yeast cells have provided insight into the pathways
that control the decision to move from one stage
to the next
6
Xenopus oocyte maturation
Good model for studying cell cycle regulation
Oocyte cytoplasm can be obtained in quantity
and manipulated, allowing both experimental
and biochemical studies
7
Maturation of frog eggs is induced by
progesterone, induction of
embryogenesis is induced by a sperm
Maturation
Activation
Use Oocyte maturation to study a simple, synchronized cell cycle
Hormone can drive G2 - M
Activation can drive M-G1
8
Once they are activated, oocytes produce a
cytoplasmic Maturation Promoting Factor (MPF),
which is Transferable and Autocatalytically produced
~100x dil.
~100x dil.
~100x dil.
(106 x dil.
In toto)
Yoshio Masui, Differentiation (2001) 69:1-17
9
MPF turns out to regulate the
embryonic Cell Cycle
MPF Regulates Mitosis as well as Meiosis
Yoshio Masui, Differentiation (2001) 69:1-17
10
How
MFP?
to pursue the purification of
Take advantage of synchrony
Collect many eggs that contain active MPF
Crush them and make cytoplasm or “egg
extract”
Fractionate by standard biochemistry, but
use a bioassay for MPF activity
Achieve several thousand-fold purification
11
Xenopus laevis egg extract system
centrifuge
+ Ca++
interphase
spindle assembly
in vitro
collect
Cytoplasm
= “egg extract”
Xenopus
sperm nucleus
+
rhodamine tubulin
12
Preparazione del citoplasma di Xenopus
13
To follow changes during the cell cycle:
Add
Xenopus sperm nuclei
can undergo rounds of S and M-phase
centrosome attached that nucleates microtubules
stain with blue DNA dye
Add rhodamine-labeled tubulin
incorporates into frog microtubules
microtubules appear red
14
MPF
- use of cell free assay to purify MPF
- test on various cytosolic fractions for MPF activity
15
Assay for Maturation Promoting Factor (MPF)
16
MPF Activity Peaks Before Each Cell Division
Moreover, MPF has kinase activity
17
M-phase promoting factor = MPF
=cdk1/cyclinB
MPF is a 2 subunit protein kinase complex:
cdk1 cyclin dependent kinase 1 (32 kDa)
Induces mitosis by phosphorylating
specific downstream targets on serine and
threonine
cyclin B (45 kDa)
regulatory subunit that activates cdk1
abundance oscillates during the cell cycle
18
Cyclin was Discovered in Sea Urchin Embryos
can stimulate to
lay lots of eggs
Protein
Level
cyclin A
cyclin B
M
M
M19
Time
2001 Nobel Prize in Medicine
“for their discovery of key regulators of the cell cycle”
Tim Hunt
QuickTime™ and a
Photo - JPEG decompressor
are needed to see this picture.
Paul Nurse
QuickTime™ and a
Photo - JPEG decompressor
are needed to see this picture.
Lee Hartwell
QuickTime™ and a
Photo - JPEG decompressor
are needed to see this picture.
QuickTime™ and a
Photo - JPEG decompressor
are needed to see this picture.
Sea urchin:
Identified cyclin
proteins in sea
urchin eggs
Yeast:
Identified genes that regulate
the cell cycle and showed that
humans also have them
20
La presenza di
inibitori della sintesi
proteica blocca l’uovo
fertilizzato in
interfase
L’aggiunta di MPF
spinge l’uovo in mitosi
anche in presenza di
inibitori della sintesi
proteica
21
✿ Il progesterone induce l’attivazione di MPF e la
rottura della membrana nucleare solo se l’oocita è in
grado di sintetizzare proteine;
✿ L’iniezione di citoplasma contenente MPF induce la
maturazione anche se la sintesi proteica dell’oocita
recipiente è inibita
✿ Gli oociti devono contenere complessi (definiti preMPF) che possono essere convertiti in MPF attivo
mediante modifiche post-traduzionali;
✿ L’attivazione di MPF è un evento citoplasmatico
poiché oociti privati del nucleo continuano a produrre
MPF attivo se trattati con progesterone
22
L’attività di MPF oscilla indipendentemente dalla
sintesi di DNA e dall’assemblaggio del fuso mitotico
Presenza di nocodazolo
(inibitore dell’assemblaggio
del fuso)
Presenza di afidicolina
(inibitore della
polimerizzazione di DNA)
23
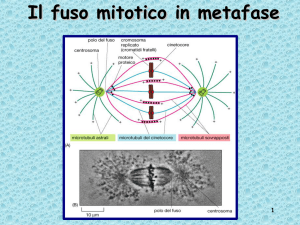
Schema di funzionamento del ciclo cellulare
Il “motore” del ciclo cellulare
è MPF: una elevata
concentrazione di MPF
induce la mitosi e una sua
bassa concentrazione induce
l’ingresso in interfase
24
Organizzazione del ciclo cellulare di una cellula
embrionale
somatica
25
Il ciclo cellulare embrionale ha solo due transizioni:
attivazione e inattivazione di MPF
Nel ciclo cellulare di una cellula somatica c’è anche
una terza transizione: START
26
Two sets of studies converged on same
regulators of the cell cycle:
3. Identification of proteins whose abundance varied
with the cell cycle from the eggs of marine
invertebrates;
4. Identification of mutants and the subsequent cloning
of the corresponding genes that are defective in
cell cycle progression.
These lines of investigations converged on the same
set of regulatory proteins.
The mechanisms regulating the progression through
the cell division cycle are largely conserved in all
eukaryotes!!
27
MPF regulation was elucidated
by Tim Hunt’s discovery of Cyclins
Cyclin B protein is synthesized continuously
Threshold cyclin B level induces MPF kinase activity
Cyclin B disappears suddenly during anaphase 28
29
Purification of MPF: The Birth
of Cyclin Dependent Kinases
This is cdc2+!!
(Cdc28 in
S. cerevisiae)
This is cyclin!!
(cdc13+
in S. pombe)
30
Cyclin synthesis
Interphase
Inactive MPF
Mitosis
Active MPF
Cyclin degradation
31
Dimostrazione che la sintesi e la degradazione della
ciclina sono necessarie per le oscillazioni cicliche
dell’attività dell’MPF
32
Cyclins are synthesized and degraded
during each cell cycle
Cyclins are a family of related proteins
Cyclin B:
• abundance peaks during G2/M
• degraded at anaphase onset
Anaphase-promoting complex (APC) causes
Polyubiquitination of cyclin B
Ubiquitination triggers degradation by the
proteasome
33
34
Cyclin Destruction Drives Mitotic Exit
G1
S
G2
M
G1
35
Mitotic Cyclins are Destroyed by
Ubiquitin-Dependent Proteolysis
M-cyclin
M-cyclin
Cdk
Cdk
36
Ubiquitin
NH2
Hydrophobic globular core
COOH
Point of attachment to
lysine side chains of
proteins
37
Ubiquitin is Transferred via Thioester Bonds
High Energy Thioester Bond,
can be transferred from E1 to E2, E3, or substrate
38
Substrate Ubiquitination is Processive
Processivity
Isopeptide
Bond
Il legame isopeptidico si forma fra la Gly C-terminale
della ubiquitina e il gruppo ε-amminico della Lys 48
….…-Lys-NH-CO-Gly-……….
39
Ubiquitination of Protein Substrates
E3 Enzymes:
responsible for specificity
and diversity of Ub system
40
Diversity in Ubiquitination Machinery is
largely provided by the many E3s, each of
which recognizes a specific group of
substrates
Single E1
Few E2’s
Many E3’s
41
Three examples of E3s in action
42
Two classes of E3 Ubiquitin Ligases
are important for cell cycle control
APC/C and SCF:
These Regulate Major Cell-Cycle Transitions
APC
Important
for mitotic
exit
SCF
Important
for a cell’s
entry into
S-phase
43
Inibizione di un complesso
Cdk/ciclina da parte di una CKI
Il controllo della
proteolisi da parte di
SCF e APC durante il
ciclo cellulare
44
APC/C Recognizes Different Substrates Through
Binding Different Accessory Proteins and is
Regulated by its own Phosphorylation
Cdc20
Cdh1
Present from G2/M through G1
- regulates Meta/Anaphase transition
- regulates M/G1 transition
45
APC Substrates
active
KEN-box proteins
(KENxxxxN)
i.e. Securin
inactive
active
D-box proteins
(RxxLxxxxN)
i.e. Cyclin B
46
Defining (APC) E3 Recognition Motif’s
“D-Box”
R X X L X X X X D/N
47
Non-Degradeable Cyclin B Causes an Arrest
During Mitosis, because Cells can’t Exit M-phase
Cyclin B
Destruction Box
Cyclin B ∆DB
Mitotic Arrest
48
APC controls entry into anaphase and
exit from mitosis
inactive
P
active
49
Ubiquitinated Proteins are Degraded by the
Proteasome
Binds to Ubiquitinated Proteins,
Cleaves and Recycles Ubiquitin
(Isopeptidase)
Destroys Target Proteins
(Peptidase)
50
Selective protein
degradation occurs in the
Proteasome,
Proteasome a large
protein complex in the
nucleus & cytosol of
eukaryotic cells.
α
20 S Proteasome
(yeast) closed state
β
β
α
two views
PDB 1JD2
The proteasome core complex, with a 20S sedimentation
coefficient, contains 2 each of 14 different polypeptides.
7 α-type proteins form each of the two a rings, at the ends
of the cylindrical structure.
7 β-type proteins form each of the 2 central b rings.
51
Regolazione dei livelli di cicline mitotiche
durante il ciclo cellulare
I livelli di APC
attivo (APCCdh1)
rimangono
elevati fino
alla G1
avanzata del
successivo
ciclo cellulare
52
❀ La regolazione della attività di APC
controlla la degradazione della ciclina B
❀ La degradazione della ciclina B provoca la
inattivazione di MPF
❀ Per iniziare l’anafase sono necessarie la
poliubiquitinazione
e
la
successiva
degradazione di altre proteine
❀ La separazione dei cromatidi fratelli
dipende dall’APC e induce la anafase
53
Dimostrazione sperimentale che l’inizio della anafase dipende
dalla poliubiquitinazione di altre proteine oltre la ciclina B
Estratti di uovo di Xenopus e nuclei isolati da spermatozoi di Xenopus.
Dopo 40 min il fuso è depolimerizzato e i cromosomi sono decondensati.
54
Dopo 80 min il fuso è ancora presente e i cromosomi non si decondensano!
La degradazione della ciclina B non è necessaria per la segregazione dei
cromosomi durante l’anafase, anche se è necessaria per la
depolimerizzazione del fuso mitotico e per la decondensazione di
cromosomi
55
Concentrazioni basse di peptide ritardano la segregazione dei cromosomi,
concentrazioni elevate inibiscono completamente la segregazione
Il peptide compete con proteine endogene la cui degradazione (mediata da
56
APC) è necessaria per l’inizo della anafase
Modello di induzione dell’anafase mediata dalla
regolazione dei complessi di coesine
Le coesine connettono i centromeri e sono presenti anche lungo i
bracci dei cromatidi fratelli. L’inibitore dell’anafase (regolato
mediante poliubiquitinazione da APC) modula la attività delle coesine.
57
Struttura e funzione delle coesine e delle condensine
La struttura flessibile è molto adatta alla
formazione di legami crociati nel DNA
58
La separazione dei cromatidi fratelli è
regolata da APC
59
EVENTI INDOTTI DA MPF
❀ Rottura dell’involucro nucleare
❀ Riorganizzazione del citoscheletro
❀ Condensazione dei cromosomi
Intervento diretto: fosforilazione di componenti
strutturali chiave della cellula
Intervento indiretto: fosforilazione di proteine chinasi
di controllo che agiscono in cascata
60
EVENTI INDOTTI DA MPF
❃ Rottura dell’involucro nucleare
Intervento diretto: fosforilazione di componenti
strutturali chiave della cellula
Intervento indiretto: fosforilazione di proteine chinasi
di controllo che agiscono in cascata
61
La lamina nucleare
62
I tetrameri di lamina sono
formati da due dimeri di lamina:
Lamina A e C
codificate
dalla stessa unità trascrizionale
mediante splicing alternativo
Lamina B
codificata da una
differente unità trascizionale
La fosforilazione delle Lamine A e C
provoca il loro rilascio in soluzione,
mentre quella della Lamina B non
consente il suo rilascio dalla
membrana
63
Dimostrazione sperimentale che la fosforilazione della
lamina A è necessaria per la depolimerizzazione delle
lamine nucleari
64
Assemblaggio dell’involucro nucleare durante la telofase
65
Panoramica sulla polimerizzazione e
depolimerizzazione della lamina nucleare
durante il ciclo cellulare
66
EVENTI INDOTTI DA MPF
✿ Rottura dell’involucro nucleare
✿ Riorganizzazione del citoscheletro
✿ Condensazione dei cromosomi
Intervento diretto: fosforilazione di componenti
strutturali chiave della cellula
Intervento indiretto: fosforilazione di proteine chinasi
di controllo che agiscono in cascata
67
EVENTI INDOTTI DA MPF
❃ Condensazione dei cromosomi
Intervento diretto: fosforilazione di componenti
strutturali chiave della cellula
Intervento indiretto: fosforilazione di proteine chinasi
di controllo che agiscono in cascata
68
Livelli di
condensazione
della cromatina
69
Assemblaggio di un ottamero di istoni
Il dimero degli istoni
H3-H4 da’ origine al
tetramero 2H3-2H4,
analogamente il dimero
H2A-H2B forma il
tetramero 2H2A-2H2B.
Successivamente i due
tetrameri formano
l’ottamero caratteristico
del nucleosoma
70
Struttura di un nucleosoma
H2A in giallo
H2B in fucsia
H3 in viola
H4 in verde
71
L’istone H1 è legato al DNA fra i nucleosomi
Appena inizia la mitosi l’istone H1 viene
progressivamente fosforilato su residui di Ser e Thr
C
N
…SPKK…
…SPKK…
72
73
EVENTI INDOTTI DA MPF
✿ Rottura dell’involucro nucleare
✿ Riorganizzazione del citoscheletro
✿ Condensazione dei cromosomi
Intervento diretto: fosforilazione di componenti
strutturali chiave della cellula
Intervento indiretto: fosforilazione di proteine chinasi
di controllo che agiscono in cascata
74
EVENTI INDOTTI DA MPF
❃ Riorganizzazione del citoscheletro
Intervento diretto: fosforilazione di componenti
strutturali chiave della cellula
Intervento indiretto: fosforilazione di proteine chinasi
di controllo che agiscono in cascata
75
Localizzazione della miosina I e della
miosina II durante la citocinesi
Miosina II in azzurro
Actina in fucsia
Citocinesi dell’ameba Dictyostelium
76
Struttura delle diverse molecole di miosina
Le miosine I e V sono
coinvolte nel
trasporto delle
vescicole
La miosina II è
coinvolta nella
contrazione
muscolare e nella
citocinesi
Il dominio di testa lega la actina ed ha attività ATPasica
❈Il
Le catene leggere hanno funzione regolatoria
❈Le
Il dominio di coda determina la specificità del ruolo fisiologico
❈Il
77
Regolazione della catena leggera della miosina II
da parte di MPF
78