Stima numerica dell età delle rocce!
Datazioni radiometriche!
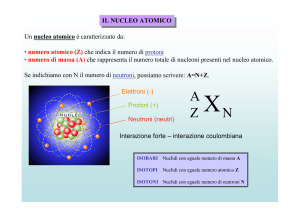
Gli ISOTOPI di uno stesso elemento hanno lo
stesso numero di protoni (e quindi di elettroni) ma
un diverso numero di neutroni N. Quindi hanno lo
stesso numero atomico Z (detto anche numero
protonico, o numero di protoni) ma un diverso
numero di massa A (protoni + neutroni).
Quando n neutroni/n protoni molto diverso da
1, isotopi INSTABILI (radioattivi). Decadono
spontaneamente fino ad assumere una
configurazione stabile
Usati per datare numericamente le rocce
Il decadimento di nuclei instabili!
Nuclei si possono trovare in stati quantizzati eccitati e
instabili. Il decadimento nucleare (radioattivo)
avviene ad una velocità che dipende solo dalla
caratteristica e dallo stato energetico del nucleo in
questione. !
Eʼ impossibile prevedere quando un nucleo decadrà,
ma si può prevedere la probabilità di decadimento =
λ, detta costante di decadimento (quantità di isotopi che
decadono per unità di tempo).!
!
Il tasso di decadimento di N nuclidi in un dt è dato da:!
dN/dt = - λ N !
dove il segno – indica che N diminuisce con t!
La soluzione di questa equazione ha la forma di:!
Elementi radioattivi (padri) decadono in elementi stabili non radioattivi (figli).
Conoscendo la costante di decadimento dell elemento padre, la sua
quantità nella roccia al tempo t della misura, e la quantità di elemento figlio
nella roccia al tempo t della misura, possiamo calcolare da quanto tempo
la reazione di decadimento è iniziata, ovvero il tempo t trascorso da
quando si è formata la roccia al momento della misura.
!
Radioisotopi utili in geologia
Tipi di decadimento!
Decadimento beta
Quanto in un nucleo ci sono troppi neutroni rispetto ai protoni si ha
conversione (decadimento) di un neutrone in protone con
emissione di una particella β- (elettrone) e un antineutrino.
OVVERO: neutrone->protone + β- + antineutrino
Quanto in un nucleo ci sono troppi protoni rispetto ai neutroni si ha
conversione (decadimento) di un protone in neutrone con
emissione di una particella β+ (positrone) e un neutrino.
OVVERO: protone->neutrone + β+ + neutrino
In entrambi I casi il numero atomico (protonico) cambia di 1. Il
numero di massa (protoni+neutroni) non cambia. Cambiando il
numero atomico, cambia l elemento. Ad esempio 87Rb-87Sr:
e.g., 87Rb 87Sr + β-
Decadimento beta
These particular reactions take place because
conservation laws are obeyed. Electric charge
conservation requires that if an electrically
neutral neutron becomes a positively charged
proton, an electrically negative particle (in this
case, an electron (β-)) must also be produced. Decadimento per cattura elettronica
Un elettrone, solitamente da livello energetico K o L, è
catturato da un protone, formando un neutrone e un
neutrino. Il numero di massa (protoni+neutroni) rimane
invariato, mentre il numero atomico (protonico)
diminuisce di 1. Cambiando il numero atomico
(protonico), cambio elemento. Alcuni nuclei possono
decadere contemporaneamente tramite cattura
elettronica, β- e β+. Ad esempio, 40K può decadere in
40Ar tramite cattura elettronica o β+ e in 40Ca tramite β-.
Decadimento alfa
Una particella α è un nucleo di He (due protoni e
due neutroni).!
Lʼemissione di una particella α produce una
diminuzione del numero atomico (protonico) di 2 e di
numero di massa (protoni+neutroni) di 4.
Cambiando numero atomico, cambia lʼelemento.
e.g., 147Sm 143Nd!
Decadimento gamma!
Decadimento per emissione di raggi gamma, cioè
fotoni ad alta energia (radiazione
elettromagnetica), da un nucleo eccitato.
La frequenza del fotone emesso è funzione della
differenza di energia fra stato superiore
(eccitato) e stato inferiore (stabile) del nucleo.
Il numero di atomico (protonico) e il numero di
numero di massa (protoni+neutroni) non
cambiano. Durante il decadimento, l elemento
non cambia.
Decadimento per fissione naturale!
Un nucleo di massa notevole si scinde in due nuclei
figli. In natura può avvenire ad esempio per
fissione di 238U che lascia scie di fissione in certi
minerali.!
La fissione produce nuclei con eccesso di neutroni e
quindi instabili e che subiscono decadimento β(emissione di particella β- e conversione di
neutrone in protone).!
Se la concentrazioni di U è elevata la fissione iniziale
di 238U può produrre decadimenti a catena dei vari
isotopi di U (p. es. bomba atomica). Può anche
avvenire in natura in giacimenti molto ricchi in U.!
Principi base !
Lʼequazione di decadimento è:!
!
Ft = F0 + Pt(eλt – 1) ove,!
Ft è il numero di atomi dellʼisotopo figlio al tempo t
della misura!
F0 è il numero di atomi dellʼisotopo figlio al tempo
iniziale (t = 0) quando è iniziato il decadimento
(ovvero quando si è formata la roccia)!
Pt è il numero di atomi dellʼisotopo padre al tempo t
della misura!
λ è la costante di decadimento dellʼisotopo padre, e!
t è il tempo trascorso tra lʼinizio del decadimento e la
misura!
!
Costanti di decadimento di alcuni isotopi a
demivita lunga (108 – 1010 anni)!
Problema !
Un problema sorge: si può agevolmente determinare (con uno spettrometro
di massa) il numero di figli al tempo t della misura (Ft ) ma NON è detto che
TUTTI guesti figli siano derivati dal decadimento di padri iniziato al tempo t0
di formazione del sistema isotopico (formazione della roccia). OVVERO,
alcuni elementi figli possono essere già presenti nel sistema (roccia) prima
del tempo t0 ovvero possono essere ereditati. Per ovviare a questo
problema si misurano rapporti isotopici con isotopi stabili non radiogenici,
la cui quantità cioè non muta nel tempo. !
Per esempio, per il sistema 87Rb -> 87Sr + β- si dividono isotopi figli (87Sr) e
padri (87Rb) per isotopi stabili non radiogenici 86Sr:!
Lʼequazione di decadimento diventa:!
RFt = RF0 + RPt(eλt - 1) ove,!
RFt = rapporto isotopico figlio/riferimento al tempo t della
misura!
RF0 = rapporto isotopico figlio/riferimento al tempo iniziale
(t=0) dallʼinizio del decadimento!
RPt rapporto isotopo padre/riferimento al tempo t della
misura.!
RFt!
RF0!
RPt!
Misurando RFt e RPt con spettrometro di massa, posso
determinare indirettamente la quantità RF0 che non posso
misurare direttamente (vedi slide successiva).!
!OVVERO: Lʼequazione RFt = RF0 + RPt (eλt - 1) è una retta con
pendenza (eλt - 1). Essa ha la forma tipica y = mx+b dove b, lʼintercetta
sullʼasse y, è RF0 e m è la pendenza della retta (eλt - 1). Questa retta è
detta Isocrona. Se si svolgono almeno 2 analisi di fasi RFt (figli/riferimento
al tempo t) e RPt (padri/riferimento al tempo t) in due fasi mineralogiche
diverse della roccia, si può ricavare la pendenza della retta (eλt - 1) e
determinare lʼincognita RF0 che non sarà altro che lʼintecetta della
isocrona con lʼasse RFt.!
RFt!
Intercetta=RF0!
RPt!
A questo punto, conoscendo RFt e RPt per misurazione diretta,
avendo stimato per intercetta RF0 e conoscendo λ, posso
risolvere l equazione per t:
Ovvero, RFt = RF0 + RPt(eλt - 1) diventa!
!
eλt = ((RFt - RF0) / RPt) + 1 (1)!
!
e ponendo A = ((RFt - RF0) / RPt) + 1!
e sapendo che ln ex = x, avremo che la (1) diventa!
!
λ t = ln A!
!
ovvero t = (ln A) / λ !
!
!
!
Dopo 1 half life, Nt = ½N0,
Dopo 2 half-lives Nt= ¼N0 ecc
Costanti di decadimento di alcuni isotopi a
demivita lunga (108 – 1010 anni)!
Sistema K-Ar Demivita 1.28 109 anni!
• K elemento abbastanza abbondante in rocce
crostali, feldspati, miche, anfiboli.!
• Ar elemento volatile, quindi in rocce
vulcaniche completamente degassato al
momento dellʼeruzione = no Ar iniziale.!
Sistema Rb-Sr Demivita 4.8 1010 anni!
• Sr e soprattutto Rb possono essere mobilizzati
da alterazioni e metamorfismo.!
Sistema U, Th-Pb!
•
•
•
238U
-> 206Pb + α; demivita = 4.47 109 anni!
235U -> 207Pb + α; demivita = 7.07 108 anni!
232Th -> 208Pb + α; demivita = 1.04 1010 anni!
Gli isotopi del Carbonio!
Stesso numero atomico (numero di protoni), diverso numero di
neutroni (quindi diverso numero di massa). Quando numero
neutroni/numero protoni circa 1, isotopi stabili (12C, 13C);
quando num neutroni/num protoni >> 1, isotopi instabili (14C). !
Sistema C-14; PREMESSE:
14C è
continuamente creato in alta atmosfera dal bombardamento di atomi di 14N
da parte dei raggi cosmici.
14C
continuamente decade in atmosfera in 14N + β- con demivita di 5740 anni.
Sistema C-14, continuazione…!
Queste continue reazioni di creazione/decadimento (slide precedente)
determinano un rapporto 14C/14N in atmosfera che possiamo misurare e
considerare in prima approssimazione stabile nel tempo.
Gli organismi viventi scambiano continuamente 14C e 14N con l atmosfera
circostante (per fotosintesi, respirazione, nutrizione) , per cui finchè
vivono, il loro rapporto 14C/14N sarà in equilibrio con quello atmosferico.
Alla morte dell organismo, viene interrotto l equilibrio di 14C e 14N con
l atmosfera circostante, e il 14C decade in 14N + β- con demivita di 5740
anni.
E quindi possibile misurare l alterazione del rapporto 14C/14N noto iniziale
(di quando cioè l organismo era vivo, e che coincide con quello noto
atmosferico), dovuta al decadimento post-mortem di 14C in 14N. Ovvero,
posso stimare l età trascorsa dalla morte dell organismo.
Il metodo del 14C si applica solo a resti organici (ossa, denti, legno, etc.).
Data la demivita corta, il metodo 14C è utilizzabile fino a 50.000 (massimo
75.000) anni BP.
Problema: la produzione di 14C atmosferico in realtà
varia (leggermente) nel tempo per effetto di variabilità
nell efficienza del bombardamento di 14N da parte dei raggi
cosmici.Variazioni di intensità del campo magnetico terrestre e/
o dell attività solare fanno variare le interazioni tra raggi
cosmici e 14N in alta atmosfera (+ altri fattori, e.g., circolazione
oceanica, cicli climatici, che cambiano la quantità di 14C
atmosferico trasferendolo agli oceani etc.).
Cià comporta che il rapporto 14C/14N atmosferico attuale,
usato come punto di partenza (ovvero assunto) per stimare
l inizio del decadimento post-mortem di un organismo (si veda
slide precedente), può essere in realtà stato diverso
dall attuale al tempo della morte dell organismo che si intende
datare. Ciò può introdurre errori nelle stime dell età di
morte dell organismo stesso.
Per ovviare a questo problema, si eseguono ad esempio stime
di età radiocarboniche su profili dendrocronologici. Ovvero, si
correlano le età assolute ottenute contando gli anelli di
crescita degli alberi (dendrocronologia) con le età
radiocarboniche ottenute dagli anelli stessi. In questo modo,
stimo l errore del metodo radiocarbonico introdotto da
variazioni di produzione di 14C atmosferico nel passato.
Albero tagliato 1999A.D.
Tran
s
etto
radi
oca
rbo
nico
1821A.D. per conteggio anelli
Tale metodo di correzione delle età radiocarboniche basato sulla dendrocronologia è stato
esteso indietro nel tempo utilizzando altri archivi naturali di dati. Ad esempio, sono state
correlate età radiometriche U-Th su coralli con età radiocarboniche sugli stessi coralli, oppure
sono stati utilizzat particolari sedimenti lacustri e marini dotati di varve, ovvero livelli le cui
caratteristiche sono determinate dalle stagioni e che quindi - come gli anelli degli alberi possono essere contati indietro nel tempo anno dopo anno. Il risultato è una curva di
calibrazione delle età radiocarboniche che si estende fino a 50.000 BP (cioè ai limiti del metodo
radiocarbonico).
Osservazione:
Le età
radiocarboniche
sono quasi sempre
più giovani delle
età reali (=età
calendario)
coralli (rosso)
varve lacustri (verde)
varve marine (blu)
speleotemi (arancio)
dendro (nero)
tempo
Hughen et al., 2004
Scala
temporale di riferimento!
Basata !
sull integrazione !
di dati!
Biostratigrafici!
Magnetostratigrafici!
Chemostratigrafici!
Astrostratigrafici!
Radiometrici. !
Con le misure relative possiamo stimare quanto una
roccia è più vecchia o più giovane di un altra in termini
di n unità litostratigrafiche (litostratigrafia), n unità
sequenziali (stratigrafia sequenziale), n zone
biostratigrafiche (biostratigrafia), n magnetozone
(magnetostratigrafia), n escursioni isotopiche
(stratigrafia isotopica), n periodi astronomici
(astrostratigrafia). Tutti questi metodi NON esprimono
quindi l età della roccia in anni, ma in maniera relativa.
Sono metodi però che forniscono informazioni
abbondanti e continue in senso stratigrafico, mentre le
misure assolute da datazioni radiometriche sono
molto più puntiformi nel tempo poichè fortemente
vincolate ai tipi di rocce-minerali utilizzabili in
laboratorio per le analisi. Il segreto sta
nell INTEGRARE le misure relative con misure
assolute da datazioni radiometriche, ottenendo
SCALE TEMPORALI di riferimento.
Scala temporale di riferimento!
Come si costruisce.!
!Situazione ideale: una sezione litostratigrafica
affiorante o in carota che contiene fossili
guida (riconoscibili e ~ubiquitari) per
biostratigrafia, livelli litologici databili
radiometricamente (livelli vulcanici), ricca in
ossidi di ferro primari per magnetostratigrafia,
e che presenta variazioni cicliche
milankoviane di parametri fisici e/o chimici e/o
biologici.!
Scala temporale di riferimento!
1. Con la Biostratigrafia si definiscono le unità
cronostratigrafiche, cioè le suddivisioni relative del tempo
geologico (e.g., base del Sistema Triassico).
2. Le basi delle unità cronostratigrafiche stabilite coi fossili
vengono datate numericamente con metodi radiometrici.
3. Le variazioni cicliche milankoviane di parametri fisici e/o
chimici e/o biologici interpolano il tempo tra i livelli datati
radiometricamente. L età numerica viene estesa a tutta la
sezione, permettendo di datare numericamente le basi
biostratigrafiche delle unità cronostratigrafiche, le inversioni del
campo magnetico e gli eventi chemostratigrafici. La scala delle
inversioni del campo magnetico diventa essa stessa un
metodo (indiretto) di datazione assoluta (numerica).
Scala temporale di riferimento!
Questa situazione ideale però non esiste perchè
la fonte principale di dati magnetostratigrafici
sono le anomalie magnetiche dei fondi oceanici,
quella di dati radiometrici le sequenze di lave
affioranti, e di dati biostratigrafici le sequenze
sedimentarie affioranti o in carota. !
!!
!
!!
Scala temporale di riferimento!
Ogni fonte di dati contiene un pezzo del puzzle.
Le inversioni del campo magnetico terrestre
(magnetostratigrafia), che sono isocrone e
ubiquitarie, permettono di unire più sezioni coeve
che contengono ognuna un pezzo del puzzle.!
!
!
!!
da imparare!!