Seconda Università degli Studi di Napoli
DiSTABiF
Anno Accademico 2016-17
Corso di Laurea Magistrale in
SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA
Insegnamento di
BIOCHIMICA e BIOTECNOLOGIE
degli ALIMENTI
Prof. Augusto Parente
Lezione 9-30. 03 . 2017
Metabolismo degli amminoacidi
- Eliminazione del gruppo carbossilico: produzione di ammine biogene
- Metabolismo del gruppo amminico
- Metabolismo della catena carboniosa
1- Eliminazione del gruppo carbossilico: produzione di ammine biogene
ALCUNE AMMINE BIOGENE
Amminoacido Ammina formatasi
Distribuzione e funzione
Lisina
Cadaverina
Ribosomi, batteri
Ornitina
Putrescina
Ribosomi, batteri
Metionina
(-> Spermidina, spermina) (Ribosomi, sperma)
Arginina
Agmatina
Batteri (flora intestinale)
Serina
Etanolammina
Fosfatidi
Treonina
Propanolammina
Vitamina B12
Cisteina
Cisteammina
Coenzima A
Acido aspartico -alanina
Coenzima A, acido pantotenico
Acido glutammico Acido -amminobutirrico Cervello (blocca i gangli)
Istidina
Istamina
Attiva sulla pressione del sangue
Tirosina
Tiramina
Fa contrarre l’utero
Dopamina
Ormone tessutale
3,4-diidrossifenilalanina (->Adrenalina)
(->Ormone)
Triptofano
Triptammina
Ormone?
5-idrossitriptofano Serotonina (->Melatonina) Ormone tessutale
______________________
Metionina (SAM) e cadaverina concorrono alla formazione di spermina e
spermidina
Lisina—> cadaverina
Ornitina—> putresceina
Istidina —> Istamina
Glutammato —> acido -amminobutirrico
GABA
Tirosina—> tirammina
Triptofano —> triptammina
Le ammine biogene sono presenti in: formaggio, vino, birra, vegetali, pesce e
carne.
La loro importanza nei prodotti alimentari è dovuta a due importanti ragioni:
1) se presenti in quantità elevate ed ingerite, possono avere effetti tossici.
La tiramina (da Tyr) e l’istamina (da His) sono state associate a sensazione di
bruciore alla gola, vampate di calore, mal di testa, nausea, ipertensione,
paralisi e formicolio delle labbra , accelerazione del polso e vomito.
2- sono indice di qualità dei prodotti alimentari e di un loro eventuale
deterioramento
L’industria alimentare ha perciò sviluppato metodi per la loro determinazione a
scopo di ricerca, salute e sicurezza, nonché per il controllo della qualità
alimentare
Esempio: L’istamina può provocare avvelenamento (sindrome sgombroide) da
pesce (sgombro – maccarello (pesce azzurro), tonno , sardine, ecc.
In questi casi sono importanti le pratiche di post-raccolta- raffreddamento.
METABOLISMO DEGLI AMMINOACIDI
2- Eliminazione del gruppo NH2
Organismi ureotelici (urea)
uomo e squali**
ammoniotelici (NH4+)
pesci ossei
uricotelici (acido urico)
rettili e uccelli
**Per migliorare il gusto della carne di squalo, si deve allontanare il sangue
immediatamente dopo la sua uccisione per evitare l’azione della ureasi sull’urea che
produce CO2 e NH3; Sumner);
AMMINOACIDI GLUCOGENICI:
Formano precursori della
gluconeogenesi
- Piruvato
- fumarato
- Ossalacetato
- -chetoglutarato
- Succinil-CoA
GLUCOSIO
AMMINOACIDI CHETOGENICI:
formano acetil-CoA, acetoacetil CoA,
precursori dei Corpi CHETONICI:
Acetone
Acido acetoacetico
Acido beta-idrossibutirrico
**
**
*
*
*
* Gluco e chetogenici
** Chetogenici
GLUCOGENICI
CHETOGENICI
GLUCOGENICI e CHETOGENICI
Alanina
Arginina
Asparagina
Acido aspartico
Cisteina
Acido glutammico
Fenilalanina
Glutammina
Glicina
Istidina
Prolina
Isoleucina
Metionina
Serina
Tirosina
Treonina
Triptofano
Valina
Leucina
Lisina
Fenilalanina
Triptofano
Tirosina
Isoleucina
- Metabolismo del gruppo amminico
1- Transamminasi
2- Glutammato deidrogenasi
Transamminasi
L- amminoacido (1) + -chetoacido (2)
-chetoacido (1) + amminoacido (2)
- La specificità delle transamminasi è duplice: per l’ -chetoacido (più elevata)
e per l’amminoacido
Es. Glutammico-piruvato transamminasi (GPT)
L-alanina + -chetoglutarato
Glutammico-ossalacetato transamminasi (GOT)
L-aspartato + -chetoglutarato
Piruvato + glutammato
Ossalacetato + glutammato
La glutammina trasporta
l’ammoniaca nel torrente
circolatorio.
-chetoglutarato
NEL MUSCOLO
L’alanina trasporta lo ione
ammonio dal muscolo
scheletrico al fegato in
forma non tossica
- Glutammato deidrogenasi
- Transamminazione con
ossalacetato
Glutammato deidrogenasi
Ciclo dell’Urea
o dell’ornitina
1
- Inizia nel mitocondrio
- prosegue nel citosol
2
I
3
Trasporto di Asp
nel citosol
Carbamil-P sintetasi
citosolica
(biosintesi delle pirimidine)
Il fumarato entra nei
mitocondri
Vie cataboliche di alanina,
glicina, serina, cisteina,
triptofano e treonina
G/C
*
Assenza o
carenza di
tirosinasi
(enzima che
porta alla sintesi
di melanine)
determina
l’albinismo
Catabolismo di:
Lys*
Leu*
Phe
Tyr
Trp
Ile
C
*
(Fenilchetonuria)
Malattia delle urine a sciroppo d’acero
Quando manca
l’enzima si ha la
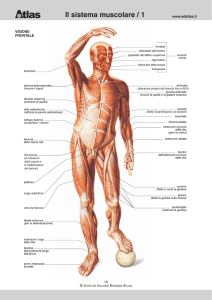
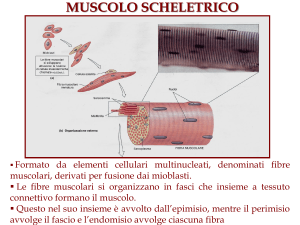
I tessuti animali presentano strutture simili, nonostante piccole differenze
tra animali terrestri e acquatici (pesci e molluschi).
Dopo la morte dell’animale la struttura della carne si rompe lentamente,
andando incontro ad un intenerimento ed in certi casi ad un
deterioramento.
Per capire questi processi, bisogna conoscere la struttura della carne, la
parte dell’animale usata come alimento .
La carne, oltre alla muscolatura, comprende fegato, rene, cervello ed altri
tessuti e parti commestibili.
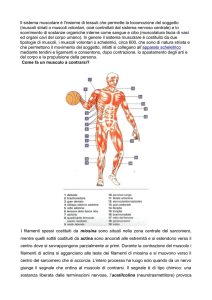
Terminologia specifica riferita ai muscoli
TERMINE GENERICO
Cellula muscolare
Membrana cellulare
Citoplasma
Mitocondri
Reticolo endoplasmatico
*Multinucleata; sincizio
**Il prefisso sarc deriva da sarkos = carne.
EQUIVALENTE MUSCOLARE
Fibra muscolare * o fibrocellula muscolare
Sarcolemma**
Sarcoplasma
Sarcosomi
Reticolo sarcoplasmatico
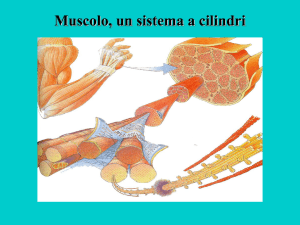
Fibre muscolari Miofibrille (nei pesci le fibre sono più corte)
Sarcomero
Disco Z
Linea M
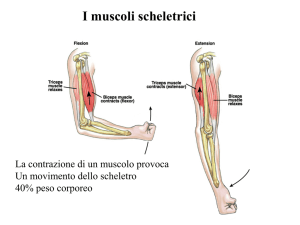
Muscolo rilassato
Muscolo contratto
Miosina
Linea M
Actina F
Disco Z
LOCALIZZAZIONE E FUNZIONI PRINCIPALI DI PROTEINE MIOFIBRILLARI ASSOCIATE CON
L’APPARATO CONTRATTILE E LA STRUTTURA DEL CITOSCHELETRO
Localizzazione
Proteina
Funzione principale
Banda A
Miosina
c-protein
proteine F-, H-, I
Contrazione muscolare
Lega i filamenti di miosina
Legano i filamenti di miosina
Linea M
Proteina M
Miomesina
Creatin chinasi
Lega i filamenti di miosina
Lega i filamenti di miosina
Sintesi di ATP
Actina
Tropomiosina
Troponine T, I, C
Contrazione muscolare
Regola la contrazione muscolare
Regolano la contrazione
muscolare
actinine -, y
Regolano i filamenti di actina
Apparato contrattile
(Banda A/Linea M)
(Banda I/disco Z)
Banda I
LOCALIZZAZIONE E FUNZIONI PRINCIPALI DI PROTEINE MIOFIBRILLARI ASSOCIATE
CON L’APPARATO CONTRATTILE E LA STRUTTURA DEL CITOSCHELETRO
Localizzazione
Proteina
Funzione principale
Filamenti GAP
Connectina (titina)
Lega I filamenti di miosina alla linea Z
Linea N2
Nebulina
Sconosciuta
Citoscheletro
Sul sarcolemma Vinculina
Linea Z
-actinina
Eu-actinina, filamina
desmina, vimentina
sinemina, proteina Z,
Z-nin
Lega le miofibrille al sarcolemma
Lega I filamenti di actina alla linea Z
Lega I filamenti di actina alla linea Z
Struttura periferica alla linea Z
Struttura a lattice della linea Z
Struttura delle proteine
- Primaria
- Secondaria
- Terziaria
- Quaternaria
STRUTTURA DELLE PROTEINE E PROCESSI TECNOLOGICI
Nella struttura delle proteine sono presenti siti sensibili dal punto di vista fisicochimico: i legami deboli (ionico, idrogeno, forze di van der Waals) si rompono a
temperature intorno ai 55-70 °C.
Inoltre, in alcuni processi tecnologici alcuni amminoacidi, inseriti nella catena
polipeptidica, possono subire degradazioni selettive.
Ne conseguono alterazioni sia della conformazione e dell’attività biologica sia del
valore nutritivo della proteina.
SITI SENSIBILI DI UNA PROTEINA
Amminoacido
Ossidazione
Calore
Reattività chimica con
Glucidi
Tannini e
polifenoli
Lys
++
++++
+++
Cys
++++
++++
++
Met
++++*
Asn e Gln
Trp
++
++
++++**
++++
++++***
Ala
++
+
Ser
++
+
Tyr
++
Asp e Glu
++
His
+++
Arg
+++
* Metionin sulfone e Met sulfossido
*** In mezzo acido
e ossidante
** Deammidazione
LA CARCASSA ANIMALE È COSTITUITA DA
- ACQUA
75%, a seconda della specie, razza, taglia, età, ecc.
- PROTEINE
16-22%
- LIPIDI
1,5-13%*
- CARBOIDRATI E SOSTANZE NON AZOTATE (min 0,5- max 1,5%): glicogeno (0,8%); glucosio
( 0,1%); prodotti intermedi e del metabolismo cellulare (0,1%)
- SOSTANZE AZOTATE NON PROTEICHE: creatina e creatinfosfato (0,5%); nucleotidi (ATP,
ADP, ecc. 0,3%); aminoacidi liberi (0,3%); peptidi (anserina**, carnosina***, ecc. 0,33%),
altre sostanze non proteiche (creatinina, urea, inosina monofosfato, ecc. 0,1%).
- COSTITUENTI INORGANICI/CENERI
0,9%
* Il contenuto meno costante nella composizione della carcassa è la quantità di grasso, che
può variare dal 2% in alcuni animali allo stato brado, fino al 8-18% negli animali domestici
da allevamenti intensivi.
** β-alanil-N-metilistidina
*** β-alanina ed L-istidina (muscolo e cervello; antiossidante)
Carnosina
COMPOSIZIONE DEL MUSCOLO
Principali proteine del muscolo.
%
Proteine ( 21%)
Miofibrillari
(9%)
Sarcoplasmatiche
(6%)
Stromali
(3%)
Miosina
Actina
Tropomiosina, Troponina, Proteina M, Proteina C,
-Actinina, -Actinina, ecc.
5
2
Enzimi mitocondriali, enzimi lisosomiali,
altri enzimi citosolici
5,5
Mioglobina
0,3
Emoglobina
0,1
Citocromi e flavoproteine
0,1
Collagene e reticolina
Elastina
2,5
1,5
0,1
INTENERIMENTO DELLA CARNE
Alla morte dell’animale il muscolo si viene a trovare nella condizione di “rigor
mortis” . L’ATP viene idrolizzato in ADP e Pi con modificazione della conformazione
delle proteine che costituiscono l’ACTOMIOSINA (elemento contrattile della cellula
muscolare formato, come già visto, da varie proteine tra cui predominano ACTINA
e MIOSINA).
-> Si genera un movimento a livello molecolare che determina la contrazione
fibrillare. Il complesso così formato è dotato di grande rigidità meccanica ed è
responsabile della rigidità cadaverica.
L’organismo si viene a trovare in anaerobiosi perché cessa l’apporto di OSSIGENO
e si determina una condizione di acidità determinata da:
- Degradazione del glicogeno, con formazione di acido lattico;
- Idrolisi di ATP in ADP e Pi
Per questo si avrà una doppia ACIDIFICAZIONE ed il pH diventa 5,6 (da 7,2-7,38).
A questo valore di pH ( 5,6) gli enzimi lisosomiali presentano il pH ottimale.
Gli enzimi che intervengono nelle prime fasi sono le calpaine, seguite dalle
catepsine.
L’effetto della loro azione è l’idrolisi parziale delle proteine muscolari (che
possono subire anche una denaturazione per il basso pH) con conseguente
scomparsa della rigidità muscolate. Questi fenomeni avvengono all’interno della
fibra muscolare e non riguardano né il collageno, né l’elastina, che sono proteine
extracellulari (stromali).
L’intenerimento della carne può essere ottenuta anche con l’aggiunta intenzionale
di peptidasi.
I processi che intervengono nella trasformazione del MUSCOLO in CARNE
sono di seguito schematizzati:
MUSCOLO
Macellazione: la circolazione del sangue si interrompe
Repentina diminuzione della concentrazione di O2 nel muscolo
Mancanza di O2
Il potenziale redox
scende a – 50 mV
La respirazione
si ferma
Cessazione delle attività
del sistema mitocondriale
Glicolisi
La generazione enzimatica di ATP si riduce
Produzione e accumulo di acido lattico
Consumo di ATP
Il pH scende a circa 5,6
Formazione di actomiosina
Contrazione
Le proteine si denaturano
Diminuzione della capacità di legare acqua
Riduzione del colore rosso
Rilascio di acqua e di nutrienti solubili
RIGOR MORTIS