Dossier N.14
Le connettiviti
autoimmuni
Aggiornamento tecnico scientifico a cura di:
Dr.ssa Simonetta Signorini
Dossier N. 14
Ottobre 2011
i. autoimmunologia Citochine
4
II. Diagnostica
15
8
Nuove prospettive
23
Algoritmo diagnostico
24
Conclusioni
27
Riferimenti bibliografici
27
Classificazione delle malattie autoimmuni
Inquadramento clinico delle malattie autoimmuni
10
non organo specifiche
12
3
I. AUTOIMMUNOLOGIA
Introduzione
Il sistema immunitario ha la funzione di proteggere il
nostro organismo dalle infezioni mediante il riconosci­
mento dei microrganismi, l’impedimento della loro
crescita e l’eliminazione delle cellule senescenti e delle
macromolecole. Questi sistemi di difesa sono in grado
di fornire uno stato di immunità contro le infezioni e i
loro meccanismi e costituiscono le basi del campo di
studio definito “Immunologia”. Per adempiere a questi
compiti, deve distinguere le molecole self e nonself.
La tolleranza immunologica consiste nell’incapacità da
parte dell’organismo di reagire verso determinati stimoli
antigenici per un’inibizione specifica del sistema immu­
nitario. I meccanismi di tolleranza immunologica agisc­o­
no sia a livello centrale che periferico.
La tolleranza centrale si verifica quando i linfociti incon­
trano il rispettivo antigene durante il loro processo matu­
rativo a livello degli organi linfatici centrali (midollo
osseo per i linfociti B, timo per i linfociti T) (fig. 1)
Le alterazioni dei meccanismi di controllo della tolleran­
za immunologica possono determinare le reazioni
autoimmuni verso le molecole self e quindi le malattie
autoimmuni.
CELLULA TIMICA
LINF. T
Il recettore del linfocito T combacia perfet­
tamente con il complesso HLA- auto antige­
ne presente nel timocita: l’interazione è ad
alta affinità
e il linfocito viene eliminato
Nucleosoma
Il recettore non riconosce per niente il
complesso HLA- autoantigene: il linfocito
viene eliminato perché inutile
Il recettore del linfocito T riconosce debol­
Istone H1
DNA
mente il complesso HLA-autoantigene:
il linfocita non viene eliminato perché
potenzialmente utile
Ottamero istonico
Fig. 1: Tolleranza centrale verso i linfociti T. I linfociti T immaturi con TCR ad elevata affinità per il complesso
peptide-MHC vanno incontro ad un processo di morte programmata o apoptotica (delezione clonale).
Legenda:
4
n = Autoantigene
n = Molecola HLA
n = Recettore del Linfocita T (TCR)
La tolleranza centrale per i linfociti B autoreattivi avvie­
ne a livello del midollo osseo mediante una delezione
dei linfociti B immaturi che hanno recettori ad elevata
affinità per gli autoantigeni presenti nel microambiente
midollare.
La tolleranza periferica è più importante di quella cen­
trale, poiché agisce sui linfociti T e B che sono sfuggi­
ti ai meccanismi di delezione clonale e morte apop­
totica, e che si trovano a contatto con gli autoantigeni.
La tolleranza periferica per i linfociti B si verifica quan­
do incontrano l’autoantigene specifico nei tessuti peri­
ferici in assenza del linfocito T helper specifico; i linfo­
citi B autoreattivi diventano incapaci di rispondere
all’antigene. Inoltre i linfociti B possono essere esclusi
dai follicoli linfatici mediante le perdita dei recettori
per le chemochine, che attraggono normalmente i lin­
fociti B maturi all’interno dei follicoli.
La tolleranza periferica nei confronti dei linfociti T viene
regolata mediante i seguenti meccanismi principali:
• Anergia clonale
Il linfocita T maturo riconosce il complesso peptideMHC della cellula presentante l’antigene, tuttavia
manca la sua attivazione completa per assenza delle
molecole cosiddette co-stimolatorie, oppure il peptide
presenta residui aminoacidici alterati nella zona di
contatto con TCR.
• Delezione clonale
La delezione clonale nei linfociti T maturi è determina­
ta dalla persistente stimolazione da parte dell’antigene,
con conseguente attivazione di un processo noto
come morte cellulare indotta dall’attivazione (“activati­
on-induced cell death” AICD). La AICD è una forma
di apoptosi indotta da segnali che originano da recet­
tori “di morte” presenti sulla membrana, il più impor­
tante di quali è il Fas. Il Fas, interagendo con il suo
ligando (FasL), attiva nelle cellule delle cistino-proteasi
dette caspasi che determinano la morte apoptotica.
• Soppressione da linfociti
Inibizione della risposta immunitaria ad opera di ci­
tochine prodotte dai linfociti T soppressori.
L’attivazione di questi linfociti sembra dipendere dalla
dose dell’antigene nonché dalla formazione del
complesso antigene-anticorpo.
Oltre ai principali meccanismi sopra-menzionati ci sono
altri sistemi per il controllo della tolleranza periferica:
• L‘ignoranza clonale, intesa come incapacità dei
linfociti autoreattivi di rispondere agli autoantigeni
senza tuttavia essere sottoposti ai meccanismi visti
precedentemente.
• L‘isolamento anatomico per impedire la possibilità
di contatto con i linfociti e quindi una reazione
immunitaria specifica.
• I confinamento in organi che normalmente non espri­
mono l‘MHC di classe II determina l’impedi­mento
alla reazione immunologica per un mancato ricono­
scimento.
La deficienza e/o l‘alterazione dei meccanismi re­
sponsabili del mantenimento della tolleranza possono
provocare l‘insorgenza di fenomeni di autoimmuniz­
zazione.
L‘autoimmunità può ovviamente risultare da anomalie
dei linfociti B, dei linfociti T o di entrambe le popola­
zioni linfocitarie. Le anomalie dei linfociti T sono più
importanti, perché i linfociti T rappresentano le cellule
centrali di tutte le risposte immuni nei confronti degli
antigeni proteici, sia con riferimento alle reazioni cel­
lulo-mediate che alla produzione di autoanticorpi. I
deficit dei meccanismi di tolleranza immunologica
possono manifestarsi a livello centrale o a livello peri­
ferico. I deficit dei meccanismi di tolleranza centrale
possono spiegare la presenza in circolo di cellule T
autoreattive, tuttavia questo difetto può essere control­
lato a livello periferico.
5
I difetti dei meccanismi di tolleranza periferica posso­
no essere determinati da:
•p
rocessi infiammatori che possono attivare le APC
in fase di riposo presenti a livello tessutale, inducen­
do su tali cellule l‘espressione aberrante delle mole­
cole co-stimolatorie necessarie alla presentazione
di autoantigeni;
•d
ifetto di espressione o di funzione delle molecole
coinvolte nella inattivazione dei processi di co-sti­
molazione;
•m
utazioni che interferiscono con la morte apoptoti­
ca dei linfociti maturi;
•d
ifetto nei meccanismi di soppressione mediati dai
linfociti T, in particolare di quelli capaci di produrre
citochine regolatorie.
Altre cause di alterazioni dei meccanismi di controllo
sono:
• Attivazione policlonale dei linfociti Th
• Attivazione policlonale dei linfociti B
• Liberazione di antigeni sequestrati:
l’alterazione della barriera anatomica tessutale, de­
termina l’esposizione di autoantigeni sconosciuti al
sistema immunitario
• Mimicrismo molecolare:
Cross-reattività immunologica di alcuni antigeni estra­
nei con le molecole self
• Superantigeni:
antigeni in grado di indurre una risposta immunolo­
gica dei linfociti T molto più elevata rispetto alla
reazione per gli antigeni proteici convenzionali
• Alterazioni del controllo idiotipo/anti-idiotipo:
la parte variabile degli anticorpi (idiotipo) con la
funzione di riconoscere antigeni è immunogenica e
genera anticorpi anti-idiotipo. Un’alterazione a cari­
co di questo network idiotipico può determinare la
perdita della tolleranza al self
6
• Heat shock proteins (HSP):
famiglia di proteine prodotte in gran quantità quando
si è sottoposti a stress fisico e metabolico con funzione
di coadiuvare la ristrutturazione e la funzionalità del­
le proteine denaturate. Infezioni e reinfezioni persi­
stenti determinano una continua esposizione al SIC
delle HSP batteriche inducendo una risposta immu­
nitaria anche contro le HSP espresse dalle cellule
umane con una conseguente risposta autoimmune
• Età
• Il sesso: nelle donne le malattie autoimmuni sono più
frequenti, circa 10 volte superiori a quella degli uo­
mini
• Deficit immunitari
Il sistema HLA (Human Leucocyte Antigen) è il princi­
pale responsabile per il riconoscimento delle cellule
self e non self, in quanto rappresenta il prodotto dei
loci genici del Complesso Maggiore di Istocompatibi­
lità (MHC), il cui compito principale è la presentazio­
ne dei peptidi ai linfociti T. La regione che codifica
per HLA è localizzata sul braccio corto del cromoso­
ma 6 (fig. 2).
Per alcune malattie autoimmuni esiste una correlazio­
ne tra la presenza di determinati alleli HLA e una pre­
disposizione ad una particolare patologia autoimmu­
ne; inoltre la diversa associazione tra gli alleli HLA,
esprime un‘ alta o bassa prevalenza di predisposizione
alla patologia.
• Infezioni e neoplasie
• Farmaci
• Fattori genetici: aplotipi HLA e non HLA
HLA Classe II
DP, DQ, DR
HLA Classe III
Complemento C4, C2, e FB, TNF
HLA Classe I
Antigeni B A C G
Fig. 2: Cromosoma 6
7
Citochine
Le citochine sono prodotte soprattutto dai linfociti T
helper (Th) e macrofagi, e la loro attività è relativa alla
differenziazione e proliferazione delle cellule immuni:
• s ono ridondanti nella loro attività poiché funzioni
similari possono essere stimolate da differenti ci­
tochine;
• regolano l’intensità e la durata della risposta immu­
nitaria, sia cellulare che umorale;
• u na citochina può indurre nelle cellule target la pro­
duzione di citochine addizionali;
• regolano la proliferazione e il differenziamento di
varie cellule;
•p
ossono anche agire sinergicamente (due o più ci­
tochine agiscono insieme) o in modo antagonista
(le citochine causano opposte attività).
• inducono la risposta infiammatoria;
• regolano l’ematopoiesi;
•a
giscono sulla fisiopatologia dell’endotelio vascola­
re e sulla riparazione dei tessuti.
Il dosaggio delle citochine è limitato dalle seguenti
caratteristiche:
• emivita breve
Le citochine sono prodotte dal sistema immunitario du­
rante la fase effettrice dell’immunità naturale e di quel­
la specifica, per mediare e controllare la risposta im­
munitaria, la reazione infiammatoria e la fagocitosi.
L’azione delle citochine è determinata dal legame al
recettore specifico alla cellula bersaglio. Tale legame,
attraverso un secondo messaggero intracellulare (soli­
tamente una tirosina chinasi), altera l’espressione geni­
ca cellulare che si traduce nell’aumento o diminuzione
dell’espressione delle proteine di membrana (incluso i
recettori per le citochine), nella proliferazione, nella
secrezione di molecole effettrici.
Citochine è una denominazione generica, si suddivi­
dono in:
• Linfochine (citochine prodotte dai linfociti)
• Monochine (citochine prodotte da monociti)
• Interleuchine (citochine prodotte da un leucocita e
che agiscono su altri leucociti).
Le caratteristiche principali delle citochine sono:
•p
ossono agire sulle cellule stesse che le producono
(azione autocrina), sulle cellule vicine (paracrina), o
in alcune circostanze su cellule distanti (endocrina);
•d
ifferenti tipi cellulari secernono le stesse citochine o
una citochina prodotta può agire su differenti tipi
cellulari;
8
• concentrazione plasmatica bassa
•p
leiotropia: le citochine svolgono differenti effetti su
diversi tipi di cellule bersaglio
• ridondanza: più citochine mediano le stesse attività
biologiche
• s inergismo: l’effetto combinato di più citochine può
risultare maggiore della somma degli effetti biologi­
ci delle singole citochine.
La determinazione necessita quindi di diversi sistemi
di indagine:
• l‘analisi dell‘espressione dei geni implicati nella sin­
tesi delle citochine;
• misura dell‘attività delle citochine
Un altro gruppo di citochine include interferoni e che­
mochine. Gli interferoni IFNα e IFNβ inibiscono la
replicazione virale nelle cellule infettate, mentre l’IFNγ
stimola anche l’espressione MHC delle cellule presen­
tanti l’antigene. Le chemochine attraggono i leucociti
nei siti di infezione, hanno residui di cisteina conser­
vati che le classificano in 4 gruppi:
•C
-C chemochine (CC Beta) ( ad es. RANTES, MCP-1,
MIP-1α e MIP-1β);
• C-X-C chemochine (CXC Alfa) (ed es. IL-8);
• C chemochine (C Gamma) (linfoattine);
• CXXXC chemochine (fractaalkine).
La produzione delle citochine è regolata da segnali
specifici sulla membrana delle cellule. Le citochine
agiscono sulle cellule target legando recettori specifici
di membrana. I recettori e le corrispondenti citochine
sono suddivisi in diverse famiglie:
• Famiglia dei recettori dell’ematopoietina
• F amiglia per i recettori del Tumor Necrosis factor,
che hanno 4 domain extracellulari, che includono i
recettori per TNFα e TNFβ, il CD40 legato alla
membrana (importante per l’attivazione delle cellule
B e dei macrofagi), e il Fas (che segnala le cellule
di procedere all’apoptosi)
• F amiglia di recettori per le chemochine, che hanno
7 eliche transmembrana ed interagiscono con le G
protein. Questa famiglia include i recettori per IL8,
MIP-1 e RANTES.
La principale attività delle citochine è indurre la proli­
ferazione e la differenziazione delle cellule immuni: in
CELLULE T
Th1
Le cellule T helper hanno due importanti funzioni:
• Stimolare le cellule immunitarie e infiammatorie
• Stimolare le cellule B a produrre anticorpi
• Famiglia dei recettori per interferoni
Tab. 1:
Elenco citochine ed
attivita’
particolare, per quanto riguarda le cellule T helper,
l’azione delle citochine determina la differenziazione
in Th1 o Th2.
L’equilibrio tra l’attività Th1 e Th2 può guidare la rispo­
sta nella direzione dell’immunità umorale o cellulomediata.
Nelle malattie autoimmuni l’immunità cellulo-mediata
e in particolare la risposta linfocitaria T svolge un ruo­
lo patogenetico importante.
In particolare, nelle malattie autoimmuni organo-speci­
fiche sono coinvolti i meccanismi patogenetici sostenu­
ti da risposte di tipo Th1, mentre nelle malattie autoim­
muni sistemiche sono prevalentemente coinvolti i
meccanismi di tipo Th2.
CITOCHINE
IL-2, IFNγ , TNFb
IL-3 e GM-CSF
Th2
IL-4, IL-5, IL-6, IL-10
ATTIVITA’
Cellule T e macrofagi, stimolazione delle
cellule immunitarie e dell’infiammazione.
Immunità cellulo-mediata
Stimola la produzione dei leucociti a
livello del midollo osseo
Produzione di anticorpi dalle cellule B.
Immunità umorale e ipersensibilità tipo I
(IgE)
9
Classificazione delle
malattie autoimmuni
Le malattie autoimmuni sono classificate in organo e
non organo specifiche in base al tipo di autoanticor­
po coinvolto nella malattia. In realtà esiste anche un
terzo tipo di malattia autoimmune che è definita inter­
media, poichè gli autoanticorpi coinvolti sono non-or­
gano specifici (contro antigeni nucleari, mitocondri,
gammaglobuline), tuttavia sono presenti infiltrati linfo­
citari limitati ad un solo organo o apparato (parotide,
fegato, colon).
La alterazioni a livello dei tessuti sono mediate dalle
immunoreazioni definite da Coombs e Gell in quattro
tipi principali di ipersensibilità, con aggiunta di un
quinto di tipo “stimolatorio”.
In particolare, nelle malattie autoimmuni organo speci­
fiche le lesioni indotte a livello dell’organo bersaglio
vengono indotte da immunoreazioni di tipo II, IV, V;
nelle malattie autoimmuni non organo specifiche o si­
stemiche le alterazioni prodotte sono indotte da mec­
canismi immunopatogeni di tipo III; nelle malattie auto­
immuni intermedie le immunoreazioni sono mediate
da meccanismi di tipo II, III, o IV.
Di seguito le tabelle riassuntive relative ai bersagli anti­
genici specifici e malattie autoimmuni associate.
Tab. 2: Malattie autoimmuni organo specifiche
ORGANO
PATOLOGIA AUTOIMMUNE
Stomaco
Anti fattore intrinse
Anti-cellule parietali gastriche
Anemia perniciosa
Gastrite atrofica tipo A
Pancreas
Anti insula pancreatica = ICA
Anti decarbossilasi dell’acido
glutammico 65 = Gad 65
Anti tirosina fosfatasi = IA2
Anti insulina = IAA
Diabete Mellito tipo I
Surrene, Ovaio
Anti-cortico-surrenale
Anti-21 idrossilasi
Malattia di Addison
Anti ovaio
Menopausa precoce
Anti-recettori del TSH= TRAK
Malattia di Basedow
Anti-tireoperossidasi = TPO
Anti-tireoglobulina = Tg
Tiroidite Hashimoto- Mixedema primitivo
Rene, Polmone
Anti membrana basale del glomerulo = GBM
Sindrome di Goodpasture
Giunzione
neuromuscolare
Anti-recettori dell’acetilcolina = Ach
Anti Proteina Chinasica
Specifica = MuSK
Anti muscolo striato
Miastenia Gravis
Anti canali del calcio
Sindrome miastenica di Lambert-Eaton
Tiroide
10
ANTICORPO
Tab. 3: Malattie autoimmuni intermedie
ORGANO
ANTICORPO
Fegato
PATOLOGIA AUTOIMMUNE
Anti-mitocondri di tipo 2 (anti-piruvato
deidrogenasi) = PDH
Anti-muscolo liscio
Anti- F Actina
Anti-antigene solubile epatico = SLA/LP
Cute
Intestino
Cirrosi biliare primitiva
Epatite autoimmune tipo I
Anti-microsomi epatici e renali
di tipo anti-citocromo P450 II D6 = LKM1
Anti-citosol epatico = LC1
Epatite autoimmune tipo II
Anti-sostanza inter-cellulare (Desmogliena 1 e 3)
Pemfigo
Anti-membrana basale epidermica (BP180 e 230)
Anti-transglutaminasi e Anti-endomisio
Pemfigoide
Herpes gestationis
Dermatite erpetiforme
Anti-SSA
Lupus cutaneo subacuto
Anti-transglutaminasi
Anti-endomisio
Anti-gliadina
Malattia celiaca
Anti-saccharomyces cerevisiae = ASCA
Morbo di Crohn
Tab. 4: Malattie autoimmune non organo specifiche
ANTICORPO
PATOLOGIA AUTOIMMUNE
Anti-nucleo; Anti-Dna nativo
Anti-nucleosoma
Anti-Sm, anti-SSA/Ro
Anti-Ribosoma
Lupus Eritematoso Sistemico (LES)
Anti-nucleo
Anti SSA/Ro, anti SSb/La
Sindrome di Sjögren
Anti-nucleo
Anti-RNP
Malattia mista del tessuto connettivo
(MCTD)
Anti-nucleo; Anti-Jo1; Anti-Pm-Scl
Anti-aminoacil tRNA sintetasi
(PL-12, PL-7, EJ, OJ, KS)
Anti-Mi-2; Anti-SRP
Polimiosite
Dermatomiosite
Anti-nucleo
Anti-Scl70
Sclerosi Sistemica
Anti-centromero
Sindrome di CREST
Anti-cardiolipina
LAC
Anti-Beta2 glicoproteina I
Anti-fosfolipidi
Anti-citrullina
Fattore reumatoide
Artrite reumatoide
11
Inquadramento clinico
delle malattie autoimmuni
non organo specifiche
Lupus eritematoso sistemico (LES)
Prevalenza: 14.6 a 50.8 per 100.000 abitanti. In Italia 20 ogni 100.000 abitanti.
Incidenza: 2.6 a 4.6 ogni 100.000 abitanti
CRITERI CLINICI
Alterazioni ematologiche:
• anemia emolitica
• leucopenia
• linfocitopenia
• Trombocitopenia
Disordini immunologici:
• autoanticorpi anti dsDNA
• autoanticorpi anti Sm
• positività degli anticorpi antifosfolipidi (LAC)
• aumentati livelli di anticardiolipina IgG o IgM
• autoanticorpi anti nucleo (ANA)
CRITERI DIAGNOSTICI
• Eritema a farfalla
• Eritema discoide
• Fotosensibilità
• Ulcere orali
• Artrite
• Sierosite (pericardite e/o polmonite)
• (proteinuria > 0.50 g/die e/o cilindri)
• Manifestazioni neurologiche
• (psicosi/convulsioni)
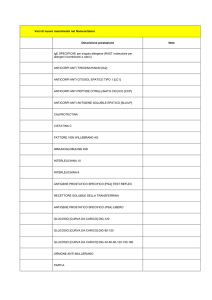
Artrite reumatoide (AR)
Prevalenza 500 casi /anno. Incidenza 1 milione /anno. La diagnosi è principalmente clinica.
CRITERI CLINICI
CRITERI DIAGNOSTICI
• Rigidità mattutina della durata di almeno un’ora
•A
rtrite a livello di almeno 3 articolazioni, inter­
essate simultaneamente, con tumefazione e
versamento rilevati da un medico.
•A
rtrite delle mani a livello delle articolazioni
interfalangee, prossimali, metacarpofalangee o
radio-carpiche.
•A
rtrite simmetrica ad interessamento simultaneo
delle stesse articolazioni.
•N
oduli reumatoidi sottocutanei sulle superfici
ossee estensorie o iuxtaarticolari, osservate da
un medico.
12
• FR presente nel 70% dei casi
• Anti CCP presente nell’80% dei casi
• Esami sul liquido sinoviale, caratteristiche
chimico-fisiche:
– Volume: > 4 ml
– Colore: giallo carico
– Trasparenza: opaco
– Viscosità: ridotta
– Coagulo: friabile
• FR presente a livello del siero.
– Cellule/mm3 : 2000-50000
•S
egni radiologici (osteoporosi iuxtaarticolare o
erosioni a livello delle mani o polsi).
– Polinucleati (%): > 70
E’ inoltre possibile eseguire i seguenti esami nel liqui­
do sinoviale ma con una sensibilità e specificità non
adeguate e sufficienti ai fini diagnostici :
Proteine che sono aumentate fino a 4-7 g/dl
Glucosio diminuito
Frazioni del complemento diminuite
FR che si comporta come nel siero e talvolta può esse­
re presente nel liquido sinoviale ma assente nel siero
e quindi utile per le AR sieronegative.
Conteggio dei globuli bianchi tra 2000 e 50000 ed
il 90% sono granulociti neutrofili
Livelli elevati di tutte le citochine proinfiammatorie IL1,
IL6, IL8, TNFα , IL1β. TNFα e IL1β sono i maggiori
responsabili del danno articolare.
L’esame sul liquido sinoviale nei pazienti in corso di
Artrite Reumatoide può risultare utile per identificare
l’origine flogistica del campione, potendo fornire in­
formazioni al clinico sia di tipo prognostico che di
un’efficace terapia, anche se non è possibile raggiun­
gere una diagnosi precisa.
Sindrome Sjögren (SS) e crioglobulinemia mista
I dati di prevalenza ed incidenza della SS non sono noti.
CRITERI CLINICI
•S
intomi oculari: risposta affermativa ad almeno
1 delle 3 domande validate
• Sintomi orali: risposta affermativa ad almeno 1
delle 3 domande validate
• Segni oculari: risultato positivo al test di Schir­
mer I e/o test con Rosa bengala
• Analisi istopatologica delle ghiandole salivari
minori
• Coinvolgimento delle ghiandole salivari
Autoanticorpi: presenza di anticorpi anti-SSA o
anti-SSB o entrambi
Per la definizione di SS primaria
La presenza di almeno 4 su 6 dei precedenti
criteri, di cui uno almeno istopatologico e uno
almeno sierologico.
Criteri di esclusione
Irradiazione testa-collo, infezione da HCV e HIV,
linfoma pre-esistente, sarcoidosi, GVHD, uso di
farmaci anticolinergici.
CRITERI DIAGNOSTICI
• Leucopenia (<4000/ul)
• Linfopenia (<1500/ul)
• ANA (≥1/80) speckled
• Anti SSA
• Anti SSB
• Fattore Reumatoide (>20UI/ml)
• Crioglobuline
• Ipergammaglobulinemia (> 1800 mg/ml)
• Componente monoclonale sierica
• C3 ridotto
• C4 ridotto
• LDH elevato
• Beta2-microglobulina sierica elevata
13
Poli/Dermatomiositi
Gli autoanticorpi anti nucleo ANA si rilevano nel 6080% dei pazienti con miopatia autoimmune.
Tuttavia il test ANA non è specifico e risulta negativo
nel 20% dei pazienti con miosite autoimmune.
Il test ANA deve essere affiancato da test più specifici
per la ricerca delle specificità antigeniche.
Di seguito i tests specifici e le ricerche autoanticorpali
associate alla Miosite.
CRITERI DIAGNOSTICI
CRITERI DIAGNOSTICI
• Topoisomerasi I (Scl70) nel 70% in SSc cutanea
Miosite specifici
Gli anticorpi miosite-specifici (MSA) sono caratte­
ristici di miosite e considerati markers di malattia:
• Anti-Jo1 (istidil-tRNA sintetasi)
•A
nti-aminoacil tRNA sintetasi (PL-12, PL-7, EJ,
OJ, KS)
• Anti-Mi-2
diffusa
• Centromero nel 70-80% in SSc cutanea limitata
– RNA pol I 4% dei casi (marker diagnostico)
– Fibrillarina 8% dei casi (marker diagnostico)
– PM-Scl 3% dei casi
– To/Th rara
– Ku rara
• Anti-SRP
– NOR-90 rara
Sclerosi sistemica progressiva
Prevalenza 240-280 casi per milione, incidenza 18-20 casi per milione di abitanti/anno.
CRITERI CLINICI
CRITERI DIAGNOSTICI
• Topoisomerasi I (Scl70) nel 70% in SSc cutanea
Malessere generalizzato (astenia, calo ponderale,
febbricola)
• Interessamento cutaneo (diffuso, limitato)
• Fenomeno Raynaud
• Interessamento gastrointestinale
• Interessamento polmonare
• Interessamento cardiaco
• Interessamento renale
14
diffusa
• Centromero nel 70-80% in SSc cutanea limitata
– RNA pol I 4% dei casi (marker diagnostico)
– Fibrillarina 8% dei casi (marker diagnostico)
– PM-Scl 3% dei casi
– To/Th rara
– Ku rara
– NOR-90 rara
II. DIAGNOSTICA
1. Linee Guida
Il metodo di riferimento per la ricerca degli autoanti­
corpi anti nucleo è l’immunofluorescenza indiretta su
cellule Hep-22. Con questa metodica è possibile rile­
vare la presenza di autoanticorpi che riconoscano
antigeni nucleari e citoplasmatici senza identificarli in
modo specifico: quindi, in caso di positività per gli
autoanticorpi anti nucleo è consigliata la ricerca spe­
cifica degli antigeni nucleari estraibili (ENA screen)
ed ENA profilo come conferma.
Con la metodica in Immunofluorescenza indiretta, in
caso di esito positivo vengono descritti i seguenti qua­
dri fluoroscopici o patterns2:
Quadri fluoroscopici più comuni:
PATTERN
ANTIGENI
ASSOCIAZIONE CLINICA
Omogeneo
Istoni,dsDna ,
Complessi Dna-istoni
LES, LES indotto da farmaci
Granulare
(punteggiato)
Sm, RNP, SSA(Ro), SSB(La)
Malattie autoimmuni reumatiche,
LES, MCTD, SS
Nucleolare
fibrillarina, RNA polimerasi, NOR90, Scl70,
PM/Scl
Malattie autoimmuni reumatiche, LES,
Sclerodermia, Miositi
Centromerico
(CENP-A; B, C)
Proteine centromeriche A,B,C
Sclerodermia, Sindrome CREST
Nuclear Dots
Sp 100, PBC 95
NSpl (proteina 95/100 kD)
Malattie autoimmuni epatiche e reumatiche
Quadri fluoroscopici mitotici:
PATTERN
ANTIGENI
ASSOCIAZIONE CLINICA
Fuso mitotico
NUMA
Proteina 235-kDa
LES e altre patologie reumatiche
Fibre del fuso
mitotico
Antigeni dei poli del fuso
comprendenti la tubulina
Non definite
Midbody
Antigeni presenti nel solco di clivaggio delle
cellule in divisione
SSc
Cetrioli
Antigeni del centrosoma
Non definite raramente SSc
15
Quadri fluoroscopici Citoplasmatici:
PATTERN
ANTIGENI
ASSOCIAZIONE CLINICA
Mitocondri
Antigeni associati al complesso Piruvato
Deidrogenasi
Tipo M2-M4 Cirrosi Biliare Primitiva
Ribosoma
Fosfoproteine dei ribosomi
P0, P1, P2
LES con coinvolgimento del sistema
nervoso centrale
Lisosoma
Antigeni lisosomiali
Non definite
Golgi
Proteine del Golgi
Non definite
Granulare (Jo1)
Istidil-tRNA sintetasi
PM
Citoscheletro
Actina, Vimentina, Citocheratina
Epatopatie, AR, MCTD
Quadri fluoroscopici rari:
PATTERN
ANTIGENI
ASSOCIAZIONE CLINICA
PCNA
Proliferating Nuclear Antigen
LES
CENP-F
Proteina Centromerica F
Tumori, malattie croniche epatiche,
malattie sistemiche reumatiche
Nuclear Matrix
hnRNP
LES, SSc, MCTD
NOR90
Nucleolar Organizing Regions
SSc
Membrana
nucleare
Lamine nucleari A,B,C, e pori nucleari
Epatopatie autoimmuni
Legenda: LES = Lupus Eritematoso sistemico; SS = Sindrome di Sjögren; SSc = Sclerosi Sistemica cutanea;
MCTD = Malattie del Tessuto Connettivo Miste; PM = Polimiosite; AR = Artrite Reumatoide; CREST = Calcinosi,
fenomeno di Raynaud, Esofagodattilia, Sclerodattilia, Telangectasia.
16
2. Descrizione degli antigeni e associazioni
cliniche
SSA
L‘antigene intracellulare SS-A/Ro è un bersaglio per la
risposta autoimmune in molti pazienti con Lupus Erite­
matoso Sistemico (LES), Sindrome di Sjögren (SS) ed
altre malattie del connettivo2. Gli studi hanno dimostra­
to che gli anticorpi anti-SS-A/Ro si trovano nel 95%
dei pazienti con la Sindrome di Sjögren primaria e nel
30-50% dei pazienti con LES, essendo associati parti­
colarmente con dermatite fotosensibile. Gli autoanti­
corpi si trovano spesso anche nella maggioranza di
pazienti con Lupus Eritematoso cutaneo subacuto o
LES anticorpo antinucleare negativo.
ANTICORPI ANTI SSA (Ro) 52 kD
ANTICORPI ANTI SSA (Ro) 60 kD
L’antigene SSA (Ro) è costituito da due proteine 52 kD
e 60 kD.
La positività solo per autoanticorpi anti SSA 52 kD,
secondo alcuni studi, è rilevabile quasi esclusivamente
in soggetti con SS (Sindrome di Sjögren), mentre la
presenza di solo autoanticorpi anti SSA 60 kD è rile­
vabile nei soggetti affetti da LES2. Inoltre la positività
soprattutto per anticorpi anti SSA 52 kD , ma anche
per SSA 60 kD nel siero materno, possono causare lo
sviluppo del LES neonatale, con conseguente manife­
stazione clinica del blocco atrio-ventricolare congenito.
SSB
L‘antigene intracellulare SS-B/La è un bersaglio per la
risposta autoimmune in molti pazienti con Sindrome
di Sjögren (SS), Lupus Eritematoso Sistemico (LES), e
altre malattie del connettivo. Gli studi hanno dimostra­
to che gli anticorpi anti-SS-B/La si trovano nell’87%
dei pazienti con la Sindrome di Sjögren primaria e nel
15% circa dei pazienti con LES. Gli autoanticorpi si
trovano spesso anche in presenza di anti-SS-A/Ro.
SM
L‘antigene intracellulare Sm è un bersaglio per la rispo­
sta autoimmune in molti pazienti con Lupus Eritemato­
so Sistemico (LES) ed è considerato altamente specifi­
co per questa malattia2. Gli anticorpi anti-Sm
reagiscono con le piccole ribonucleoproteine nucleari
(snRNP) che contengono almeno 9 polipeptidi. Gli
studi di immunoblotting hanno comunque dimostrato
che gli anticorpi anti-Sm si legano principalmente alle
proteine SmB, SmBI e SmD. Gli studi hanno anche
dimostrato che gli anticorpi anti-Sm si manifestano nel
30-40% dei pazienti con LES, ma sono state osservate
percentuali più elevate in pazienti non caucasici.
SM/RNP
L‘antigene intracellulare Sm/RNP è un complesso di
componenti Sm e RNP. Il complesso antigene Sm/
RNP è un bersaglio per la risposta immune in molti
pazienti con la malattia mista del connettivo (MCTD),
Lupus Eritematoso Sistemico (LES), Sindrome di Sjo­
gren primaria (SS) e Sclerodermia (PSS)2. Gli studi
hanno dimostrato che gli anticorpi anti-Sm/RNP si ma­
nifestano in oltre il 95-100% dei casi di MCTD, nel
35-45% dei pazienti con LES e nel 30% circa dei
pazienti con SS.
ANTICORPI ANTI RNP
ANTI RNP 68 ANTI RNP A
Gli autoanticorpi anti RNP (ribonucleoproteina) rico­
noscono nella maggior parte dei casi gli antigeni U1
68-70 kD e U1-A. La positività per questi antigeni si
rileva nei pazienti affetti da Artrite reumatoide, miocar­
dite e nei pazienti affetti da LES. Gli autoanticorpi anti
RNP sono presenti in pazienti affetti da LES con una
sensibilità diagnostica del 30% e 40%, ma hanno una
bassa specificità, poiché presenti in elevata percentu­
ale nei soggetti con MTCD (malattie del tessuto con­
nettivo miste).
Sono significativi quando presenti a titolo elevato
poiché sono criterio diagnostico importante nei pa­
zienti affetti da MTCD, anche se il dato quantitativo
non correla con l’andamento della patologia.
Non sono indicativi di patologia specifica quando
presenti in basse concentrazioni perché sono rilevabi­
li in altre malattie reumatiche come la sclerosi sistemi­
ca e l’artrite reumatoide.
17
Tuttavia è stato recentemente dimostrato un ruolo pre­
dittivo nel lupus, dato che possono essere evidenziati
nel siero fino a 7 anni prima della comparsa della
patologia.
SCL70
L‘antigene intracellulare Scl-70 è un bersaglio per la
risposta autoimmune in molti pazienti con Scleroder­
mia o Sclerosi Sistemica Progressiva (SSP) ed è consi­
derato specifico per questa malattia. Gli anticorpi
anti-Scl-70 si trovano nel 20-30% circa dei pazienti
affetti da Sclerodermia2. Circa il 20-30% dei pazienti
affetti da Sclerodermia presentano caratteristiche sinto­
matologiche tipiche della sindrome di CREST (Calci­
nosi-Raynaud-Esofagodattilia-Sclerodattilia-Telangecta­
sie).
JO1
L‘antigene ENA Jo-1 è un bersaglio per la risposta
autoimmune in molti pazienti con Polimiosite e Derma­
tomiosite e gli anticorpi anti Jo-1 sono considerati indi­
catori per queste malattie. Nella Polimiosite il muscolo
striato si infiamma e la fibra muscolare si degrada2.
Quando sussiste questa condizione, assieme ai cam­
biamenti tipici cutanei, è conosciuta come Dermatomi­
osite. Circa il 25% dei pazienti affetti da queste malattie
autoimmuni dimostrano livelli superiori di anticorpi
anti-Jo-1. Gli anticorpi Jo-1 sono inoltre associati alla
fibrosi polmonare ed al fenomeno di Raynaud (estremo
spasmo dei vasi sanguigni in risposta al freddo o allo
stress).
ANTI CENTROMERO CENP-B
Gli anticorpi anti centromero riconoscono una fami­
glia di proteine localizzata nella regione centromerica
delle cellule eucariotiche. Le proteine associate al cen­
tromero sono CENP-A, CENP-B, CENP-C, CENP-D,
CENP-E, CENP-F e CENP-G. Le tre principali proteine
sono CENP-A, CENP-B, CENP-C.
La positività per gli anticorpi anti centromero è asso­
ciata alla Sclerosi Sistemica Cutanea limitata (lcSSc),
soprattutto la sua variante limitata o CREST. Gli anti­
corpi anti centromero possono essere identificati
18
anche in altre condizioni patologiche come AR, LES,
SS e PBC (Cirrosi Biliare Primitiva)2.
La SSc limitata cutanea è una patologia limitata alla
pelle, alle estremità delle braccia, basse gambe e tal­
volta faccia e collo. E’ denominata anche CREST (Cal­
cinosi, fenomeno Raynaud, Esofagodattilia, Sclerodat­
tilia, Telangectasia).
L’utilizzo diagnostico di questo test è stimato con una
sensibilità del 33% e una specificità del 99.9%.
L’utilizzo come marcatore prognostico e di definizione
del subset cutaneo limitato è caratterizzato da una
sensibilità del 61% e specificità del 84%, mentre non
si riscontra una rilevanza clinica come marcatore per
il monitoraggio della patologia.
ANTI DNA NATIVO o dsDNA (double-strand DNA
= DNA a doppia elica)
Il DNA è un antigene presente sia sotto forma di dop­
pia elica (ds = double strand) o nativo che in singola
elica (ss = single strand). La ricerca degli autoanticor­
pi è rivolta soprattutto verso la forma nativa del DNA
o a doppia elica perché è più specifico per la patolo­
gia LES.
Ci sono due importanti ma differenti utilizzi diagnosti­
ci della ricerca degli autoanticorpi anti Dna nativo:
• s creening e ausilio diagnostico in caso di sospetta
malattia autoimmune
•m
onitoraggio clinico di pazienti affetti da LES
In pazienti con LES in fase attiva si rilevano livelli ele­
vati di autoanticorpi anti dsDNA, mentre in pazienti in
fase di remissione questi autoanticorpi sono presenti in
basse concentrazioni, o assenti.
Gli autoanticorpi presenti in circolo, tuttavia, compren­
dono una popolazione anticorpale che differisce per:
• Avidità (bassa o alta avidità)
• Classe immunoglobulinica
• Specificità antigenica
Per la diagnosi del LES il test utilizzato per la ricerca
degli autoanticorpi anti ds-DNA deve avere un’elevata
specificità, tuttavia per quanto riguarda l’avidità anti­
corpale, questa caratteristica è inversamente proporzio­
nale alla sensibilità del test; infatti per rilevare gli auto­
anticorpi a bassa avidità è necessario utilizzare
metodi con una maggiore sensibilità a scapito della
specificità.
Esiste una correlazione tra l’avidità anticorpale e
ANTICORPI ANTI CROMATINA (NUCLEOSOMA)
Il DNA nella cellula è presente complessato in nucleo­
somi che rappresentano la struttura base della croma­
tina.
I nucleosomi sono costituiti da un dimero di quattro
proteine istoniche H2A, H2B, H3, H4 complessate
con il DNA. I nucleosomi sono uniti tra loro mediante
un filamento di DNA a cui è attaccato la proteina isto­
nica H1.
l’implicazione dell’organo:
LINF. T
•g
li anticorpi ad alta avidità sono correlati
all’implicazione renale, mentre gli anticorpi a bassa
avidità sono presenti anche in patologie reumati­
che diverse dal LES oppure in pazienti con forme di
LES meno aggressive o con bassa frequenza di epi­
sodi di nefrite.
CELLULA TIMICA
Nucleosoma
Per i motivi sopra descritti in funzione della diversa
avidità anticorpale, per lo screening è consigliabile
eseguire un metodo con un’elevata sensibilità e suc­
cessivamente, in caso di positività, eseguire un secon­
do test con elevata specificità.
ANTI ssDNA (single-strand DNA = DNA a singola
elica)
Gli autoanticorpi anti ssDNA sono rivolti contro la
componente basica che nel DNA a doppia elica
(dsDNA) è mascherata all’interno della struttura a eli­
ca. Sono presenti nell’87% dei pazienti affetti da LES
nelle fasi acute e nel 43% dei pazienti nelle fasi inatti­
ve. Rappresentano un utile strumento diagnostico nel­
la diagnosi differenziale tra LES e LES indotto da far­
maci, tuttavia sono rilevabili in concentrazioni elevate
anche in pazienti affetti da Mononucleosi, Epatite e
varie forme di Leucemia.
Ottamero istonico
Istone H1
DNA
Fig. 3: Nucleosoma
Gli autoanticorpi anti nucleosomi sono presenti in di­
verse patologie autoimmuni, anche se prevalenti nel
LES (3) :
Tab. 5: Patologie autoimmuni e anticorpi anti nucleosoma
PATOLOGIA
% ANTICORPI ANTI
NUCLEOSOMA
LES (Lupus Eritematoso Sistemico)
85.1%
AR (Artrite Reumatoide)
45.4%
MTCD (Malattie del tessuto con­
nettivo miste)
41.1%
SSc (Sclerosi Sistemica cutanea)
36.3%
SS (Sindrome di Sjögren
10%
19
Data la maggiore prevalenza di positività nel LES, la
presenza di questi anticorpi potrebbe precedere la
formazione di anticorpi specifici anti nucleari come
anti ds-Dna e anti istoni (8).
Esistono dati contrastanti relativamente all’utilità diagno­
stica della ricerca degli autoanticorpi anti nucleosomi,
al significato clinico e specificità di questi autoanticor­
pi per il LES, ed il loro utilizzo come indicatori per il
monitoraggio della patologia e di coinvolgimento
d’organo.
Da alcuni studi è emerso che proprio per la maggiore
prevalenza di positività nella patologia LES possono
essere inseriti come test aggiuntivo nella diagnostica
della patologia per le seguenti caratteristiche (7) :
• per alcuni pazienti affetti da LES sono presenti in
maggiore prevalenza rispetto agli autoanticorpi anti
dsDNA
• presentano una migliore correlazione con il lupus
nefritico o l’attività della patologia nel LES rispetto
agli anticorpi anti dsDNA
• la reattività per gli autoanticorpi anti nucleosomi
può essere rilevata nel 40% dei pazienti con lupus
che sono negativi per gli autoanticorpi anti dsDNA
Il valore prognostico degli autoanticorpi anti nucleoso­
mi per la progressione della patologia ed il monito­
raggio nelle fasi culminanti della malattia autoimmune
non è ancora chiaro.
Secondo altri studi, nonostante l’elevata prevalenza di
presenza di questi autoanticorpi in pazienti affetti da
LES, non sono ancora ben chiari alcuni punti:
• se rappresentano markers specifici della patologia;
• se sono effettivamente indicatori utili per il monito­
raggio;
• se esiste un’effettiva correlazione tra la positività per
questi autoanticorpi, l’attività della malattia e il dan­
no renale(3).
20
ANTICORPI ANTI ISTONI
Gli autoanticorpi anti istoni sono rivolti contro le prote­
ine H1, H2A, H2B, H3, H4, e sono presenti in diver­
se patologie autoimmuni, sistemiche e organo speci­
fiche come LES (Lupus Eritematoso Sistemico), AR
(Artrite Reumatoide), Artrite cronica giovanile, Cirrosi
biliare primitiva, Epatite Autoimmune, Polimiosite/Der­
matomiosite. Inoltre sono presenti in pazienti con pa­
tologie autoimmuni indotte da farmaci, patologie neu­
rologiche e infettive.
A differenza degli autoanticorpi anti nucleosoma la
positività per gli anticorpi anti istoni non è indicativa
di patologia, data anche la loro presenza in diverse
patologie: quindi non hanno nessuna utilità dal punto
di vista diagnostico e prognostico.
Il metodo di riferimento per la ricerca degli autoanti­
corpi per le patologie sistemiche non organo-speci­
fiche è l’immunofluorescenza indiretta. Questa metodi­
ca prevede l’utilizzo di un substrato costituito da
cellule Hep-2 (cellule epiteliali da carcinoma di larin­
ge). Il siero viene dispensato su questo substrato ed
incubato per la ricerca degli eventuali autoanticorpi
presenti. Per l’identificazione anticorpale e la visione
mediante microscopia a fluorescenza si utilizza un co­
niugato associato ad un fluoroforo FITC specifico.
Questa metodica è caratterizzata da un’elevata sensi­
bilità perché permette di rilevare autoanticorpi contro
tutti gli antigeni nucleari e citoplasmatici, ma ha una
scarsa specificità poiché non riesce ad individuare in
modo specifico l’antigene. Per l’identificazione degli
antigeni nucleari e citoplasmatici specifici (ENA) è ne­
cessario procedere all’approfondimento diagnostico
con Ena profilo cioè il dosaggio degli antigeni: Ssa,
SSb, Sm, Sm/RNP, Jo1, Scl70, CENP-B.
La metodica in immunofluorescenza presenta delle li­
mitazioni determinate da:
•p
erdita di alcuni antigeni critici (Ssa, SSb, Jo1, Ri­
bosoma P, RNP) legato alla metodica stessa o per
difficoltà interpretative
•d
ifficoltà di riproducibilità dei dati legato alla lettura
soggettiva a microscopio e alla metodica
• tempistica di refertazione
•b
assa specificità
Fig. 4: Immagini di autoanticorpi anti nucleo con
metodica immunofluorescenza indiretta. Substrato
cellule Hep-2
21
Per i motivi sopra descritti, sono state valutate metodi­
che di screening alternative.
Le metodiche valutate sono ELISA e nuove tecnologie
(chemiluminescenza, luminescenza), che utilizzano
substrati costituiti da un mix di antigeni nucleari e cito­
plasmatici specifici per le connettiviti autoimmuni.
Le caratteristiche di sensibilità e specificità dei diffe­
renti metodi sono di seguito riportate:
Tab. 6: Specificità dei differenti metodi
METODI
% SENSIBILITÀ E SPECIFICITÀ
IFA (Immunofluorescenza indiretta)
sensibilità 92%
specificità 65%
ELISA
sensibilità compresa tra 32% e 69%
specificità compresa tra 68% e 98%
MULTIPLEX LUMINEX
sensibilità compresa tra 77% e 100%
specificità compresa tra 92% e 100%
CHEMILUMINESCENZA
sensibilità 96.30%
specificità 97.60%
Le linee guida per la ricerca degli autoanticorpi anti
nucleo (2), identificano come test di riferimento la me­
todica in immunofluorescenza indiretta su cellule Hep2, tuttavia è possibile utilizzare un metodo di scree­
ning alternativo solo se soddisfa i seguenti requisiti:
•C
oncordanza con il metodo IFA non inferiore al
90% (livello decisionale > o = 1/160)
•O
gni laboratorio deve valutare l’applicabilità di
questi livelli decisionali in base alle caratteristiche
della propria casistica/popolazione
• R iconoscere autoanticorpi importanti dal punto di
vista prognostico, come quelli diretti verso i nucleoli
o la membrana nucleare
• I risultati positivi devono essere successivamente
confermati con il metodo IFA, con specificazione
del pattern e del titolo
22
• I dati discordanti (positivi con metodo di screening
e negativi in IFA) vanno valutati per la presenza
di anti-Ssa e Jo1; se questi antigeni sono negativi la
positività con il metodo di screening è da consider­
arsi come falso positivo, tranne in caso di sospetto
clinico di MAIS (Malattie autoimmuni immunitarie
sistemiche), dove i pazienti vanno monitorati nel
tempo.
Nuove prospettive
La disponibilità di nuove tecnologie ci ha permesso di
valutare metodiche alternative all’immunofluorescenza
indiretta: in particolare abbiamo analizzato 1205 sie­
ri richiesti in routine per la ricerca degli autoanticorpi
antinucelo con la metodica in immunofluorescenza in­
diretta e con la tecnologia Multiplex Luminex, median­te
la strumentazione automatica Bioplex 2200.
A seguito di questo studio descritto in un poster pre­
sentato al Congresso Internazionale di Autoimmunità
tenutosi a Porto nel Settembre 2008, “BioPlexTM2200
MULTIPLEX ANASCREEN ASSAY: A NOVEL AP­
PROACH FOR THE DETECTION OF ANTINUCLEAR
AUTOANTIBODIES”, abbiamo inserito questo sistema
per lo screening degli autoanticorpi anti nucleo.
Il nuovo test ANA screen prevede la ricerca degli auto­
anticorpi contro gli antigeni dsDNA, Cromatina (nu­
cleosoma), P-ribosoma, SSA, SSB, Sm, snRNP, Sm/
RNP, Scl-70, Jo1, centromero CENP-B per le malattie
autoimmuni non organo specifiche, connettiviti autoim­
muni: Lupus Eritematoso Sistemico (LES), Malattie del
Tessuto Connettivo Miste (MCTD), Polimiositi/Derma­
tomiositi (PM/DM), Artrite Reumatoide (AR), Sclerosi
Sistemica cutanea (SSc), Sindrome di Sjögren (SS),
Sclerodermia, CREST (Calcinosi, fenomeno di Rayn­
aud, disfunzione esofagea, sclerodattilia e telangecta­
sia) (tab. 7).
Questa tecnologia consente l’identificazione di diversi
analiti contemporaneamente sullo stesso campione,
utilizzando beads (microsfere) magnetiche con adesi
gli antigeni nucleari e citoplasmatici.
Il siero viene incubato con la miscela delle beads e
dopo l’aggiunta di un anticorpo anti IgG umano lega­
to ad un secondo fluoroforo specifico, le beads pas­
sano attraverso un citometro a flusso che identifica e
quantifica il segnale.
Il sistema prevede inoltre l’utilizzo di 3 beads speci­
fiche per la verifica del funzionamento del sistema di
lettura, delle interferenze causate da legami aspecifi­
ci, della presenza del volume di campione necessario
per l’esecuzione del test.
Le caratteristiche principali del test ANA screen, in
confronto alla metodica in Immunofluorescenza Indi­
retta, sono rappresentate dalla possibilità di rilevare
gli autoanticorpi contro antigeni critici non rilevabili
con la metodica in Immunofluorescenza Indiretta, dal­
la standardizzazione e riproducibilità dei dati, in par­
ticolare per i campioni con esiti di dubbia o bassa
positività, e dalla riduzione delle tempistiche di refer­
tazione.
• identificazione di autoanticorpi contro gli antige­
ni critici per la metodica immunofluorescenza in­
diretta (IFI), quali: Ssa/Ro con la possibilità di
distinguere e dosare SSA 52 kD e 60 kD, Jo1, P
Ribosoma, U1 snRNP distinto nelle frazioni A e
68 kD associati alle Malattie del Tessuto Connet­
tivo Miste (MCTD)
• standardizzazione e riproducibilità dei dati
• riduzione delle tempistiche di refertazione
Il test in immunofluorescenza indiretta viene utilizzato
solo a seguito della positività del test ANA screen con
metodica Multiplex Luminex.
Il test in Immunofluorescenza Indiretta viene comunque
eseguito su richiesta per i pazienti con patologie au­
toimmuni in monitoraggio (Artrite Reumatoide, Epato­
patie Autoimmuni etc.), o pazienti con forte sospetto e
sintomatologia decisamente suggestiva di patologia
autoimmune, con esito ANA screen negativo.
Queste richieste particolari e le informazioni cliniche
del paziente vengono raccolte mediante una Scheda
Anamnestica che abbiamo consegnato a tutti i nostri
punti prelievo e ai nostri laboratori clienti service.
E‘ molto utile quindi per la diagnostica delle patologie
autoimmuni avere le informazioni cliniche del pazien­
te e una collaborazione diretta con il Medico/Spe­
cialista.
23
Algoritmo diagnostico
Per le richieste di screening per le Connettiviti Autoimmuni abbiamo introdotto il seguente algoritmo diagnostico:
ANA screen
Multiplex Luminex
dsDNA
Multiplex Luminex
ENA screen
Multiplex Luminex
POS/DUBNEG
POS/DUBNEG
POSNEG
IFT
REF*
IFT
REF
ENA
Prof.
REF
Fig. 5: Screening per le Connettiviti Autoimmuni
*In caso di esiti negativi per ANA screen e forte sospetto di malattia autoimmune e/o su richiesta
specifica del Medico/ Specialista eseguiamo il test in Immunofluorescenza Indiretta.
Legenda: IFA= Immunofluorescenza Indiretta; REF=Refertazione
24
In tabella 6 riportiamo l’elenco degli antigeni, utilizzati per lo screening degli autoanticorpi antinucleo mediante
tecnologia Multiplex Luminex, con la descrizione dell’origine dell’antigene e le associazioni cliniche.
Tab. 7: Elenco antigeni e associazioni cliniche
ANTIGENI
DsDNA(1)
ORIGINE
ANTIGENI
ASSOCIAZIONI
CLINICHE
PERCENTUALE
PREVALENZA
ANTICORPALE
Sintetizzato da PCR
LES
40-80%
Nucleoistone purificato
LES
AR
MTCD
SSc
SS
85.1%
45.4%
41.1%
36.3%
10%
SSA(4,5)
SSA 52 kD
SSA 60 kD
Antigene purificato per
affinità
SS, LES, LES neonatale incluso il blocco
cardiaco congenito
25-30% LES 40%
SS
SSB(4,5)
Antigene purificato per
affinità
LES
SS
15%
50-60% di solito
associati a SSA
SM(4,5)
Antigene purificato per
affinità
LES
25-40%
SM/RNP(1,4,5,)
Antigene nativo purifica­
to
MTCD
LES
95%
30-70%
RNP(4,5)
RNP 68 kD
RNPA
Antigene ricombinante
MTCD
46%
CENTROMERO
CENP B(6)
Antigene ricombinante
CREST
Sclerosi cutanea limitata (lcSSc)
70-80%
P RIBOSOMA(1,7) Antigene purificato per
affinità
LES associato con nefrite e coinvolgi­
mento del SNC, incluso epilessia e
disordini psichiatrici
10-40%
SCL 70(4,5,6)
Antigene ricombinante
Sclerodermia
SSc diffusa
20-28%
70%
Jo1(4,5)
Antigene ricombinante
Polimiosite
18-36%
CROMATINA
(3)
Legenda: LES= Lupus Eritematoso Sistemico. SS= Sindrome di Sjögren. SSc= Sclerosi Sistemica cutanea
CREST= Calcinosi, fenomeno di Raynaud, disfunzione esofagea, sclerodattilia e telangectasia. MCTD= Malattia
del Tessuto Connettivo Mista
25
Per ottimizzare ed utilizzare al meglio le potenzialità
di questa nuova tecnologia, consigliamo di seguire il
seguente algoritmo diagnostico:
ANA SCREEN MULTIPLEX LUMINEX
(ANA-ENA SCREEN-dsDNA)
NEG
POS/DUBBIO
PANNELLI SPECIFICI MULTIPLEX
LUMINEX:
Connettiviti
LES
MCTD
SS
Sclerodermia/SSP
In caso di forte sospetto di malattia autoim­
mune e/o richiesta specifica del Medico/
Specialista, si procede con l’esecuzione del
test Immunofluorescenza Indiretta su cellule
Hep-2. Per sospetto di Polimiosite/Dermato­
miosite e patologie autoimmuni del fegato si
procede con l’esecuzione dei test specifici in
Immunoblot
Fig. 6: Seguente algoritmo diagnostico
Legenda:
26
Pannello connettiviti
Pannello LES
Pannello MCTD
DsDNA, Cromatina,
Ssa (52&60 kD),
SSb, Sm, Sm/RNP,
RNP(A&68 kD),
Scl70, Jo1, Riboso­
ma P, CENP-B
dsDNA, Cromatina, RNP68&A kD
Ssa (52&60 kD),
Sm/RNP
SSb, Sm, Sm/RNP,
Ribosoma P
Pannello SS
Pannello sclerodermia (SSP)/CREST
Ssa52&60 kD
SSb
Scl70, CENP-B
CONCLUSIONI
RIFERIMENTI BIBLIOGRAFICI
Con questa brochure abbiamo tracciato un percorso
sintetico relativo alle nozioni base di immunologia, le
problematiche immunologiche che possono determi­
nare le patologie autoimmuni, la descrizione delle
patologie stesse e i metodi diagnostici.
La diagnostica di queste patologie è tuttavia comples­
sa e la Medicina di Laboratorio può solo fornire un
supporto al clinico che in funzione della sintomatolo­
gia valuterà attentamente tutto il quadro degli esami
eseguiti.
Per questo il nostro Laboratorio è sempre attento alle
nuove tecnologie che possano facilitare ed aiutare lo
specialista nell’inquadramento delle patologie autoim­
muni in tempistiche ristrette mantenendo la qualità del
dato analitico o in alcuni casi migliorandola.
I nuovi algoritmi diagnostici proposti hanno proprio
l’obiettivo di snellire la richiesta di questi esami e di
fornire utili informazioni per gli eventuali approfondi­
menti diagnostici specifici.
Per la caratteristica di questa diagnostica sempre in
evoluzione, a questa prima edizione della Brochure
relativa all’autoimmunità faranno seguito degli aggior­
namenti.
1) R.Tozzoli, N. Bizzarro, D. Villalta, E. Tonutti. Il labo­
ratorio nelle malattie reumatiche autoimmuni.
2) . R. Tozzoli; N. Bizzarro. La diagnostica di labora­
torio delle malattie autoimmuni sistemiche. La Medici­
na di Laboratorio Vol. IX N.1, 1998.
3) P. Quattrocchi e coll. Ruolo degli anticorpi anti-nu­
cleosoma nel lupus eritematoso sistemico. Risultati di
uno studio condotto in pazienti con lupus eritematoso
sistemico ed altre connettiviti sistemiche. Reumatismo,
2005; 57(2):109-113.
4) White, R. H.; Robbins, D. L: Clinical Significance
and Interpretation of Antinuclear Antibodies. West. J.
Med. 1987, 147, 210-213.
5) Maddison, P. J.; Skinner, R. P.; Vlachoyannopoulos,
P. ; Brennand, D. M. ; Hough, D. Antibodies to nRNP,
Sm, Ro(SSA) and La(SSB) detected by ELISA: their spe­
cificity and inter-relations in connective tissue disease
sera. Clin.Exp. Immunol. 1985, 62 337-345.
6) D. Bassetti. Gli esami di autoimmunologia nella
diagnosi e nel monitoraggio della Sclerosi Sistemica.
La risposta del laboratorio. RIMeL/IJLaM 2007; 3
(suppl).
7) Y.Sherer, Y. Shoenfeld. Autoantibodies guide in
Systemic Lupus Erythematosus. First Edition.
E. Jenny Heathcote Management of Primary Biliary
Cirrhosis. Hepatology Vol 31, No. 4, Aprile 2000.
27
I-10-00-8_08_Autoimmunologia
synlab Italia S.r.l.
Via Orzinuovi 111 - 25125 Brescia
Tel. 030 3514085
www.synlab.it