RASSEGNA
Anomalia di Ebstein: diagnosi e trattamento chirurgico
Pietro Giorgio Malvindi1, Nicola Viola1,2
1
Dipartimento di Chirurgia Toracica e Cardiovascolare, Ospedale Universitario di Southampton, UK
2
Dipartimento di Chirurgia Cardiovascolare, Ospedale Pediatrico di Southampton, UK
Ebstein’s anomaly is a rare congenital heart disorder secondary to a malformation of the tricuspid valve and
right ventricle. The heterogeneous spectrum of presentation of its structural anomalies and associated cardiomyopathy accounts for a widely varied clinical and hemodynamic manifestation of the pathology and its
impact on timing of diagnosis and prognosis. Neonatal Ebstein’s anomaly is characterized by reduced survival,
while an average risk of mortality per year of 1% to 1.4% has been reported in infancy and adulthood. Medical management and a careful clinical and echocardiographic follow-up are advisable for all asymptomatic
patients and those with minimal abnormalities. Surgical correction is recommended in presence of progressive dilation of the right atrium and right ventricle, development of right ventricular dysfunction, occurrence
of supraventricular or ventricular arrhythmias or episodes of paradoxical embolization, reduced exercise capacity, or significant desaturation. Prosthetic valve replacement or repair of the tricuspid valve are both common strategies in the correction of tricuspid regurgitation. During the last three decades, important contributions in the development of repair techniques were driven from the experience of Danielson, Carpentier
and da Silva, with satisfactory results in terms of safety and durability at long-term follow-up.
Key words. Ebstein’s anomaly; Heart defects, congenital; Tricuspid valve; Valve repair.
G Ital Cardiol 2015;16(3):175-185
INTRODUZIONE
L’anomalia deriva il nome dal medico tedesco Wilhelm Ebstein
che per primo, nel 1866, descrisse le peculiari alterazioni della
valvola tricuspide e del ventricolo destro in uno studio autoptico su un uomo di 19 anni che per tutta la vita aveva presentato cianosi, dispnea e palpitazioni (Figura 1)1,2.
L’anomalia di Ebstein è una malformazione cardiaca rara, riscontrata in circa 1/200 000 nati vivi, rappresenta <1% di tutti i
casi di anomalie cardiache congenite e si presenta in egual misura
in soggetti di sesso maschile e femminile3-5. La base patogenetica è un difetto di delaminazione dei lembi della valvola tricuspide. Raramente è riscontrabile una distribuzione su base familiare, nella maggior parte dei casi la presentazione è sporadica. Diversi fattori genetici ed ambientali sono stati chiamati in causa
quali fattori di rischio per lo sviluppo delle alterazioni a carico della valvola tricuspide e del ventricolo destro. La patologia è più comune nei gemelli e nelle famiglie con storia di cardiopatie congenite, è stata descritta un’associazione con esposizione materna alle benzodiazepine e più raramente a terapia con litio6,7.
Figura 1. Disegno dall’originale caso clinico di Ebstein. A, atrio destro; B, ventricolo
destro; b, valvola tricuspide; l, rudimentale lembo settale della valvola tricuspide inserito direttamente a livello dell’endocardio del setto interventricolare.
Riprodotta con permesso da Mann e Lie1.
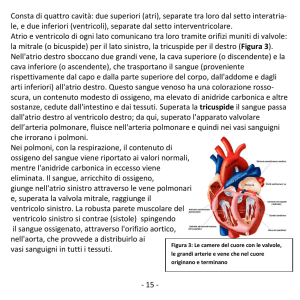
ANATOMIA PATOLOGICA
L’anomalia di Ebstein è la manifestazione di un generale e marcato difetto di sviluppo della valvola tricuspide e del ventrico-
lo destro. Morfologicamente l’anomalia di Ebstein è caratterizzata da:
© 2015 Il Pensiero Scientifico Editore
Ricevuto 07.10.2014; nuova stesura 17.12.2014; accettato 23.12.2014.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Nicola Viola Department of Thoracic and Cardiovascular Surgery,
University Hospital of Southampton, Tremona Road, Southampton
SO16 6YD, UK
e-mail: [email protected]
•
•
lembi tricuspidali settale e posteriore fermamente aderenti
al miocardio ventricolare; caratteristica secondaria al difetto di delaminazione degli strati di tessuto precursori dei
lembi valvolari e della parete ventricolare;
dislocazione a spirale verso l’apice e anteriormente verso il
tratto di efflusso del ventricolo destro dell’inserzione (“anuG ITAL CARDIOL | VOL 16 | MARZO 2015
175
PG MALVINDI, N VIOLA
CHIAVE DI LETTURA
Ragionevoli certezze. La storia naturale dei
pazienti con anomalia di Ebstein è estremamente
variabile e dipende dal grado delle alterazioni a
carico dell’apparato valvolare tricuspidale e del
ventricolo destro. In presenza di severe anomalie
anatomiche si riscontra scompenso cardiaco
congestizio in epoca neonatale o la morte
intrauterina del feto; tuttavia pazienti con
disfunzione e alterazioni di minor grado possono
restare asintomatici sino all’età adulta o rimanere
asintomatici per tutta la vita. Un work-up
preoperatorio accurato e un puntuale follow-up
possono indirizzare ad un’opportuna terapia
medica o ad un intervento chirurgico correttivo
che nei soggetti giovani e adulti è caratterizzato
da basso rischio di mortalità ospedaliera,
soddisfacente sopravvivenza a lungo termine e
libertà da reintervento.
Aspetti controversi. L’anomalia di Ebstein è
caratterizzata da un’ampia variabilità di alterazioni
strutturali e coinvolgimento delle strutture
cardiache. Queste evidenze associate ad una bassa
incidenza nella popolazione generale non hanno
permesso lo sviluppo di uniformi tecniche
riparative supportate da risultati su ampie
popolazioni. Le esperienze riportate dai gruppi di
Danielson, Carpentier e più recentemente da Silva
sottolineano come una chirurgia riparativa possa
essere eseguita anche in presenza di severe
alterazioni anatomiche e con ottima durabilità. La
diagnosi di Ebstein neonatale è gravata da una
prognosi spesso infausta. Il supporto della terapia
medica può risultare decisivo nelle prime
settimane ma nei casi con marcate alterazioni e
cianosi la mortalità è altissima e limitate sono le
esperienze sia con chirurgia palliativa
univentricolare che di correzione biventricolare.
Prospettive. L’accumulo di esperienza riparativa
con tecniche che permettano la preservazione
della valvola tricuspide e la scelta del trattamento
perioperatorio adeguato al singolo paziente
rappresentano le prospettive più promettenti nella
terapia dell’anomalia di Ebstein. La cura della
patologia neonatale presenta ancora notevoli
ostacoli, ma lo sviluppo di tecniche di diagnosi
intrauterina sta cominciando a fornire dati
importanti per la stratificazione del rischio, e può
aiutare il cardiologo nel corso della consulenza
prenatale.
•
176
lus funzionale”) dei lembi valvolari con interessamento
maggiore dei lembi settale e posteriore e in misura minore
del lembo anteriore8 (Figura 2);
ridotta cavità ventricolare destra, dilatazione e assottigliamento della parete del ventricolo destro situata al di sopra
G ITAL CARDIOL | VOL 16 | MARZO 2015
Figura 2. Disposizione su un unico piano dei lembi anteriore, posteriore e settale in una valvola tricuspide normale (in alto). Disposizione anomala dei lembi posteriore e settale con dislocazione massima a livello della “crux” posteriore tipica dell’anomalia di Ebstein
(al centro). Dislocazione dei lembi in presenza di anomalia di Ebstein
a carico della valvola atrioventricolare sinistra, in casi di correzione
congenita di trasposizione dei grandi vasi (in basso).
Riprodotta con permesso da Anderson et al.12.
•
•
•
dell’anulus funzionale (“atrializzazione”); il tratto di afflusso del ventricolo destro è direttamente coinvolto nella malformazione ed è funzionalmente integrato nell’atrio destro,
la funzione ventricolare è preservata solo nelle componenti zona trabecolata e tratto di efflusso;
lembo anteriore più esteso con tessuto ridondante e superficie fenestrata; le corde tendinee afferenti, generalmente
accorciate, possono causare retrazione del lembo e dislocazione del tessuto mobile a livello di tratto di efflusso con
conseguente ostruzione all’efflusso del ventricolo destro;
dilatazione della giunzione atrioventricolare (anulus tricuspidale anatomico);
alterazioni della muscolatura, con processi di fibrosi che
possono interessare il tessuto di conduzione, alla base del
frequente riscontro di blocco di branca destra, e il lembo
anteriore, creando una continuità muscolare sopra e sotto
l’anulus e la presenza di multiple vie accessorie di conduzione.
Alle peculiari alterazioni della valvola tricuspide e del ventricolo destro sono spesso associate altre malformazioni cardiache. Un difetto interatriale è presente nell’80-94% dei casi9,10; ulteriori concomitanti anomalie includono bicuspidia o
atresia della valvola aortica, atresia o stenosi della valvola polmonare, ipoplasia delle arterie polmonari, stenosi subaortica,
coartazione aortica, prolasso della valvola mitrale, difetto interventricolare, presenza di accessorio tessuto mitralico o di
banda muscolare a livello del ventricolo sinistro. La stenosi o
atresia polmonare è riscontrata in circa un terzo dei casi di Ebstein nell’infanzia, l’associata ostruzione del tratto di efflusso
ventricolare destro è diagnosticata già in epoca fetale. In presenza di severa insufficienza tricuspidale non è sempre facile
distinguere alterazioni strutturali da un’atresia polmonare funzionale. In entrambi i casi le anomalie a carico della valvola polmonare sono secondarie alla malformazione della valvola tricuspide e all’ipoplasia del tratto di efflusso4,11. Anomalie a ca-
ANOMALIA DI EBSTEIN: DIAGNOSI E TRATTAMENTO CHIRURGICO
rico del cuore sinistro sono riscontrabili in circa il 40% dei pazienti, di cui circa la metà presenta segni di non compattazione del ventricolo sinistro. Nel 15-50% dei casi, in pazienti con
trasposizione corretta delle grosse arterie, la valvola tricuspide
sistemica presenta caratteristiche anatomiche che soddisfano i
criteri diagnostici per anomalia di Ebstein, anche se non è chiaro se l’eziopatogenesi sia comune in presenza di connessione
atrioventricolare concordante o discordante12-15.
CLASSIFICAZIONE
Celermajer et al.5 hanno descritto uno score ecocardiografico
prognostico basato sul rapporto tra l’area combinata di atrio
destro e porzione atrializzata e l’area totale del ventricolo destro funzionale e atrio e ventricolo di sinistra. Questo rapporto
è stato utilizzato per definire quattro gradi di severità: grado 1,
rapporto 0.5; grado 2, rapporto 0.5-0.99, grado 3, rapporto
1.0-1.49; grado 4, rapporto ≥1.5. All’analisi univariata il grado
di severità 4 era associato a significativo rischio di mortalità (rischio 13.3 vs grado 1); ad ogni incremento del grado di severità corrispondeva un aumento di rischio relativo di mortalità di
un fattore 2.7.
Nel 1988 Carpentier et al.16 hanno proposto una classificazione anatomica basata sul volume del ventricolo destro funzionale e la funzione del lembo anteriore della valvola tricuspide:
•
•
•
•
Tipo A, adeguato volume del ventricolo destro funzionale,
ridotto volume della porzione atrializzata, minima dislocazione dei lembi settale e posteriore;
Tipo B, presenza di un’estesa porzione di ventricolo destro
atrializzata, moderata dislocazione dei lembi settale e posteriore e normale mobilità del lembo anteriore;
Tipo C, severa dislocazione dei lembi settale e posteriore e
importante restrizione del lembo anteriore con possibile stenosi tricuspidale da ostruzione al tratto di efflusso del ventricolo destro;
Tipo D, atrializzazione quasi completa della cavità ventricolare destra, minima cavità ventricolare funzionale (Figura 3).
Nel 2000 Dearani e Danielson17 hanno distinto 4 sottotipi di
anomalia di Ebstein basandosi sulle alterazioni coinvolgenti le
strutture cardiache ed enfatizzando caratteristiche determinanti
della strategia chirurgica:
•
•
•
•
porzione atrializzata del ventricolo destro. Sottotipo ideale
per la riparazione valvolare;
Tipo II: lembi anteriore e posteriore sono piccoli e dislocati. La cavità atrializzata è moderatamente dilatata. Anche
per questo sottotipo la riparazione valvolare è particolarmente efficace;
Tipo III: il lembo anteriore si presenta con corde accorciate
e fuse. I lembi posteriore e settale sono displastici e non delaminati. La porzione del ventricolo destro atrializzata è ampia. Sottotipo borderline per una chirurgia riparativa;
Tipo IV: lembo anteriore è severamente deformato e non delaminato. I lembi posteriore e settale sono ipoplastici o assenti. La cavità del ventricolo destro è quasi completamente
atrializzata, con possibile ostruzione del tratto di efflusso.
FISIOPATOLOGIA
L’ampio spettro di presentazione delle alterazioni anatomiche
dell’anomalia di Ebstein e dell’associata cardiomiopatia produce differenti manifestazioni cliniche ed emodinamiche. Fattori
determinanti sono il grado di malformazione della valvola tricuspide e correlata severità di rigurgito e più raramente di stenosi valvolare, il grado di disfunzione ventricolare destra e sinistra, la presenza/assenza di una comunicazione interatriale, ulteriori anomalie cardiovascolari, le aritmie.
L’insufficienza tricuspidale associata al movimento paradosso della porzione atrializzata comporta una riduzione della
portata. In sistole, la porzione atrializzata causa un incremento pressorio venoso che riduce la capacità di riempimento dell’atrio e incrementa sia le resistenze al flusso, sia il grado di possibile shunt destro-sinistro. Durante la diastole ventricolare, la
porzione atrializzata si comporta da “reservoir” passivo per il ritorno venoso e riduce l’effettivo flusso attraverso la valvola tricuspide. Anche in presenza di grado non severo di insufficienza tricuspidale, l’incremento pressorio e volumetrico a livello
dell’atrio destro è uno stimolo continuo alla sua dilatazione e
all’innesco di aritmie atriali. La dilatazione dell’anulus tricuspidale infine peggiora il grado di insufficienza valvolare (Figura 4).
La funzione del ventricolo sinistro può essere compromessa dalla dilatazione del ventricolo destro cha causa lo spostamento a sinistra del setto interventricolare. Tale disfunzione sisto-diastolica può essere esacerbata da alterazioni primarie del
Tipo I: lembo anteriore è largo e perlopiù delaminato. I lembi posteriore e settale possono essere o meno presenti e dislocati, comune è la presenza di fenestrazioni. Variabile la
Figura 3. Classificazione dell’anomalia di Ebstein secondo Carpentier.
Riprodotta con permesso da Chauvaud et al.47.
Figura 4. Fisiopatologia delle alterazioni anatomiche ed emodinamiche delle camere cardiache di destra in presenza di anomalia di
Ebstein.
IT, insufficienza tricuspidale; VD, ventricolo destro; VT, valvola tricuspide.
G ITAL CARDIOL | VOL 16 | MARZO 2015
177
PG MALVINDI, N VIOLA
miocardio ventricolare e presenza di aree di miocardio non
compattato.
In epoca neonatale la normale presenza di elevate resistenze vascolari polmonari può essere peggiorata dall’estrema dilatazione cardiale con conseguente compressione del parenchima polmonare e alte pressioni intrabronchiali. Durante la
progressiva chiusura del dotto arterioso il flusso polmonare diminuisce drammaticamente quando associata a stenosi o atresia polmonare.
tato e globoso, reperto simile alla presenza di importante versamento pericardico o in corso di severa cardiomiopatia dilatativa (Figura 6). La vascolarizzazione polmonare può essere normale o ridotta nei casi di pazienti cianotici e in presenza di
shunt interatriale destro-sinistro. Pletora polmonare può essere peraltro riscontrata in caso di scompenso cardiaco sinistro
con elevata pressione telediastolica. Nella presentazione fetale
un reperto comune è l’ipoplasia parenchimale polmonare secondaria a prominente dilatazione cardiaca.
Il rapporto cardiotoracico è associato ad una prognosi peggiore quando >0.60-0.653,5.
SEGNI E SINTOMI
Il corteo sintomatologico e la presentazione clinica variano in
base alla severità delle alterazioni anatomiche, all’età di presentazione, alla compromissione emodinamica e il grado di
shunt destro-sinistro a livello interatriale, aumentato è inoltre il
rischio di morte improvvisa cardiaca.
Comune è il riscontro di cardiomegalia, edema periferico,
ascite e disfunzione epatica. La presentazione neonatale è caratterizzata da elevate resistenze vascolari polmonari e il loro
effetto sulla circolazione anterograda (Figura 5). Casi estremi
possono causare il decesso intrauterino da idrope fetale.
Nei pazienti con età >10 anni si riscontra affaticamento, dispnea e ridotta tolleranza allo sforzo. Alterazioni anatomiche e
funzionali meno pronunciate possono condurre in età adulta a
sviluppo di scompenso cardiaco destro, dispnea e ridotta tolleranza allo sforzo. Comuni sono gli episodi di cardiopalmo e
l’occorrenza di tachiaritmie sopraventricolari, fibrillazione atriale parossistica e sindrome di Wolff-Parkinson-White. La presenza di policitemia è direttamente legata al grado di cianosi.
In presenza di shunt interatriale destro-sinistro è aumentato il
rischio di embolia paradossa e lo sviluppo di ascessi cerebrali.
L’obiettività cardiaca si caratterizza per la presenza di un
ampio e persistente sdoppiamento del secondo tono e tipicamente si riscontrano toni accessori. Un soffio olosistolico da rigurgito tricuspidale è spesso udibile e aumentato in inspirazione. Raramente il polso venoso giugulare mostra una prominente onda V, nonostante la presenza di severa insufficienza
valvolare a causa della severa dilatazione atriale.
DIAGNOSI STRUMENTALE
Radiografia del torace
L’ombra cardiaca può variare da normale alla tipica configurazione dell’anomalia di Ebstein con un’immagine di cuore dila-
Figura 6. Radiografia del torace in Ebstein neonatale (A) e in un soggetto adulto (B).
Elettrocardiogramma
L’elettrocardiogramma è anormale nella maggior parte dei pazienti con anomalia di Ebstein. L’onda P è ampia e raggiunge
una maggiore altezza a causa della dilatazione dell’atrio destro.
Comune è il riscontro di un blocco di branca destro completo
o incompleto. Un blocco atrioventricolare completo è raro ma
quasi la metà dei pazienti presenta un prolungamento del PR
come da blocco di primo grado causato dalla presenza di un
atrio dilatato, possibile compressione del nodo atrioventricolare o alterazioni strutturali del sistema di conduzione atrioventricolare. Comuni le aritmie da preeccitazione e tachiaritmie parossistiche da conduzione retrograda e anterograda. La fibrillazione atriale e il flutter atriale possono essere secondari a conduzione da vie accessorie o più spesso causate da alterazioni
anatomiche del miocardio dell’atrio destro.
L’onda R si presenta piccola in V1 e V2, molto comuni sono alternate e bizzarre morfologie del QRS dovute a disturbi di
Figura 5. Ebstein neonatale; severo rigurgito tricuspidale, elevate pressioni arteriose polmonari e ostruzione all’efflusso del ventricolo destro.
178
G ITAL CARDIOL | VOL 16 | MARZO 2015
ANOMALIA DI EBSTEIN: DIAGNOSI E TRATTAMENTO CHIRURGICO
conduzione a livello intra-hissiano e ad anomala attivazione nella porzione di ventricolo destro atrializzata (Figura 7).
Ecocardiografia
L’ecocardiografia è il test diagnostico di scelta per l’anomalia
di Ebstein. Il rilievo più sensibile e specifico per diagnosi di anomalia di Ebstein è la dislocazione apicale del margine di inserzione del lembo settale che può essere facilmente apprezzato
comparando l’altezza di inserzione anulare dei lembi mitralici
nella proiezione 4 camere apicale. La distanza tra i punti di inserzione dei lembi valvolari, indicizzata per la superficie corporea, caratterizza l’indice di dislocazione che, in presenza di segni di alterata delaminazione cardiaca, quando >8 mm/m2, rappresenta un fondamentale reperto diagnostico per anomalia di
Ebstein. Lo studio ecocardiografico può determinare lo stato
funzionale e i volumi del ventricolo destro e sinistro, la presen-
za di ostruzione all’efflusso ventricolare destro, il grado di rigurgito tricuspidale e fornire dettagli sulle dimensioni e il grado di shunt del difetto interatriale ed evidenziare ulteriori malformazioni a carico delle sezioni sinistre del cuore e dei grossi
vasi (Figure 8 e 9). L’aggiunta di immagini in 3D e 4D contribuisce a meglio definire l’anatomia dell’apparato sottovalvolare e dei lembi, compresa la rotazione antero-apicale della valvola, i difetti di coaptazione, la vena contratta e il volume ventricolare (Figura 10).
Risonanza magnetica cardiaca
La risonanza magnetica cardiaca ha la stessa capacità della metodica ecocardiografica nel predire la riparabilità della valvola tricuspide e nella dimostrazione del lembo anteriore e settale e del
grado di rigurgito valvolare. I volumi e la funzione del ventricolo
destro sono difficilmente valutabili con la metodica ecocardio-
Figura 7. Elettrocardiogramma di una paziente di 47 anni con anomalia di Ebstein, con alterazioni
tipiche dell’anomalia. In particolare, si notano deviazione dell’asse a destra, blocco atrioventricolare di primo grado e ritardo di conduzione intraventricolare non specifico. Onde Q sono evidenti nelle derivazioni II, III, aVF e V1-V4. Il tratto S-T è anormale nelle derivazioni anteriori toraciche,
probabilmente dovuto a difetti intrinseci della conduzione.
Figura 8. Ecocardiogramma e anomalia di Ebstein. A-B: proiezione 4 camere apicale evidenzia il dislocamento del lembo anteriore (freccia bianca), un rigurgito
tricuspidale severo e prominente dilatazione dell’atrio destro e della porzione
atrializzata del ventricolo destro. C: proiezione asse corto per la valutazione del
ventricolo destro. D: proiezione asse lungo. Talvolta può risultare difficile valutare l’inserzione dei lembi valvolari ma altri reperti ecocardiografici risultano utili alla diagnosi, quali la presenza di un lembo anteriore allungato, di corde tendinee
accorciate, la retrazione dei lembi a ridosso dell’endocardio del ventricolo destro,
l’inserzione del lembo anteriore direttamente sul miocardio, l’assenza dei lembi
settale o posteriore, la presenza di fenestrazioni e la dilatazione dell’anulus tricuspidale.
G ITAL CARDIOL | VOL 16 | MARZO 2015
179
PG MALVINDI, N VIOLA
Figura 9. Ecocardiogramma transesofageo: lembo anteriore (A) e lembo settale (B) della valvola tricuspide.
Figura 10. Ecocardiogramma 3D. A: apertura della valvola tricuspide in diastole. B: ampio difetto di coaptazione in sistole (freccia bianca).
grafica a causa dell’asimmetria e la struttura trabecolata della camera ventricolare destra. La risonanza magnetica cardiaca consente un’analisi segmentaria e lo studio della funzione e dei volumi del ventricolo destro18 (Figura 11). Garantisce inoltre migliori
dettagli nella visualizzazione del lembo tricuspidale posteriore,
caratterizza meglio la presenza di fenestrazioni dei lembi e la dislocazione verso l’apice degli stessi19,20. Recenti evidenze hanno rilevato una significativa correlazione tra rilievi volumetrici otte-
nuti in risonanza magnetica, peptide natriuretico cerebrale e test
cardiopolmonare, suggerendo una possibile valenza su prognosi e timing chirurgico nei pazienti trattati con terapia medica21,22.
Cateterismo cardiaco
Il cateterismo cardiaco è raramente necessario per la diagnosi di
anomalia di Ebstein eccetto che per lo studio coronarico. Le
pressioni polmonari e le resistenze polmonari non sono elevate
sebbene la pressione telediastolica del ventricolo destro possa
essere aumentata. Solitamente la pressione atriale destra è normale nonostante un severo rigurgito tricuspidale a causa della
dilatazione dell’atrio e dell’effetto “reservoir” dovuto alla discinesia della porzione ventricolare atrializzata. Dimostrabile inoltre desaturazione sistemica e shunt interatriale destro-sinistro.
STORIA NATURALE
Figura 11. Risonanza magnetica cardiaca. Valutazione delle volumetrie delle camere cardiache (A-C) e dell’apparato valvolare tricuspidale (A). Riduzione del volume del ventricolo destro dopo chirurgia riparativa (D).
180
G ITAL CARDIOL | VOL 16 | MARZO 2015
Alterazioni severe sono diagnosticate nel feto e nel neonato
con aspettativa di sopravvivenza molto ridotta. In presenza di
meno pronunciate anomalie strutturali e funzionali riscontrate
alla nascita o durante l’infanzia i pazienti mostrano un’aspettativa migliore.
Una prima revisione della storia naturale dei pazienti con
anomalia di Ebstein è stata pubblicata da Watson23 nel 1974.
Successivi e più recenti dati sulla popolazione neonatale hanno
riportato una mortalità del 20-40% al primo mese e una sopravvivenza a 5 anni <50%11,24-26. A partire dalla metà degli anni ’80, con la progressiva affermazione e diffusione della diagnostica ecocardiografica, si è apprezzata una decisa tendenza verso una diagnosi più precoce. Tendenza confermata dalla
descrizione di Celermajer et al.5 nel 1994 della storia naturale
di 220 pazienti. In questo studio pubblicato con un range di
ANOMALIA DI EBSTEIN: DIAGNOSI E TRATTAMENTO CHIRURGICO
follow-up di 1-34 anni, gli autori riportarono una sopravvivenza del 67% a 1 anno e del 59% a 10 anni. Una progressione
dello scompenso cardiaco, complicanze postoperatorie e morte improvvisa rappresentano le cause principali di morte. Il rischio annuale di mortalità calcolato è del 36% per il primo anno di vita, 4% per il secondo, 1% dal secondo al decimo anno
di vita e 1.4% tra i 10 e i 40 anni. Il rischio operatorio per i 32
pazienti sottoposti a correzione chirurgica in corso di followup è risultato correlato più all’età di diagnosi o manifestazione
della patologia che al timing chirurgico (Figura 12).
TRATTAMENTO
Terapia medica
Nel neonato è fondamentale preservare il flusso polmonare attraverso la somministrazione di prostaglandine E1 per garantire la
pervietà del dotto di Botallo e l’uso di vasodilatatori polmonari
per contrastare l’ipertensione polmonare neonatale. La maggior
parte dei neonati solitamente migliora spontaneamente alla caduta delle resistenze polmonari ma il supporto del ventilatore può
essere necessario nei primi giorni o nelle prime settimane. Per i pazienti con diagnosi di lievi anomalie anatomiche, relativamente
normale pattern emodinamico ed asintomatici, è opportuna l’osservazione clinica ed un follow-up ecocardiografico. Il trattamento medico è indicato per i pazienti in classe NYHA I e II mentre risulta inefficace nei pazienti in classe NYHA III e IV. Sebbene non
vi siano evidenze definitive su una maggiore predisposizione all’endocardite batterica, sembra utile consigliare in corso di procedure odontoiatriche la profilassi antibiotica nei pazienti cianotici o sottoposti a sostituzione della valvola tricuspide27,28.
Non esistono indicazioni precise per il follow-up: gli autori
si attengono alle linee guida in uso al Southampton General
Figura 12. Curve di sopravvivenza per la diagnosi di anomalia di Ebstein in età fetale, tra 0 e 2 anni di vita, tra 2 e 18 anni di vita e oltre il 18° anno. L’asse X per i casi fetali si riferisce all’età stimata dal
concepimento, per gli altre tre grafici all’età postnatale.
Riprodotta con permesso da Celermajer et al.5.
Hospital che prevedono una simile condotta per pazienti operati e non. Si consigliano visite in centri specializzati in cardiologia congenita dell’adulto, ad intervalli di 1 o 2 anni. Tali intervalli dipendono dall’età del paziente e dal grado di severità
della lesione, che include il grado di insufficienza della valvola
tricuspide, il volume telediastolico (indicizzato), la funzione sistolica del ventricolo destro e la geometria del ventricolo sinistro. Le visite dovrebbero includere una anamnesi completa con
particolare attenzione all’insorgenza di nuovi sintomi, specie
cianosi e aritmie atriali. Questi ultimi, insieme all’aggravamento della classe funzionale e all’aumento del volume telediastolico, possono indicare l’aumento della frequenza delle visite fino all’intervento o reintervento chirurgico. La prospettiva di un
intervento di riparazione piuttosto che di sostituzione valvolare, basata su ecocardiografia e risonanza magnetica cardiaca,
può influenzare la tempistica dell’intervento.
Trattamento chirurgico
La diagnosi di Ebstein nel periodo neonatale è associata ad una
mortalità del 20-40% nel primo mese con una sopravvivenza
<50% nei primi 5 anni di vita; nei neonati cianotici questa condizione è generalmente fatale. Nel 1991 Starnes et al.29 hanno
riportato una sopravvivenza del 70% utilizzando una strategia
chirurgica palliativa a ventricolo singolo. L’esperienza nella riparazione biventricolare nei neonati è limitata. Le indicazioni al
trattamento chirurgico precoce sono state mutuate dallo score
prognostico (GOSE score) proposto da Celermajer et al.5. Nei
neonati con alterazioni classificate come grado 4 la mortalità è
del 100%, così come in soggetti con grado 3 e cianosi. Nei neonati non cianotici in grado 3 si registra una mortalità a breve
termine del 10%, tuttavia circa il 45% non sopravvive durante
l’infanzia30. Ulteriori fattori associati a mortalità nel periodo neonatale sono la presenza di atresia polmonare strutturale o funzionale, di un ampio difetto interatriale e di un severo rigurgito
tricuspidale; un rapporto cardiotoracico.0.85 è correlato con
una mortalità precoce del 100%31. Sulla base di queste evidenze, Knott-Craig e Goldberg30 hanno proposto delle indicazioni per il trattamento entro le prime 2 settimane di vita dei
neonati con anomalia di Ebstein: nei soggetti asintomatici un
GOSE score di 4, il rilievo di un rapporto cardiotoracico >0.80 e
la presenza di insufficienza valvolare tricuspidale severa; nei soggetti sintomatici in presenza di severa cianosi, cianosi moderata e GOSE score 3-4, rapporto cardiotoracico >0.80, presenza
di severa insufficienza valvolare tricuspidale e associati difetti
cardiovascolari. La tecnica utilizzata per la correzione biventricolare comprende una plastica riduttiva dell’atrio destro e la ricostruzione di una competente valvola tricuspide, il difetto interatriale è chiuso con un patch con una fenestrazione di 3-4
mm. L’esperienza riportata comprende 8 neonati sottoposti a
correzione chirurgica biventricolare con un decesso postoperatorio e riportata durabilità di riparazione valvolare in 6 pazienti
con miglioramento sintomatico e funzionale31.
La progressiva dilatazione di atrio e ventricolo destro, l’evidenza di una ridotta funzione ventricolare destra, l’insorgenza
di aritmie atriali e/o ventricolari, episodi di embolia paradossa,
una ridotta tolleranza allo sforzo e la presenza di significativa
desaturazione a riposo o sotto sforzo, rappresentano le indicazioni chirurgiche principali nell’infanzia e tra gli adulti.
La strategia per la correzione dell’insufficienza valvolare tricuspidale prevede la riparazione o sostituzione della valvola tricuspide. Non è stata provata l’associazione con un migliore outcome per la sostituzione o la riparazione valvolare né chiarito se
G ITAL CARDIOL | VOL 16 | MARZO 2015
181
PG MALVINDI, N VIOLA
preferibile la scelta di una protesi meccanica o biologica. Le bioprotesi hanno dimostrato una durabilità maggiore in sede tricuspidale per anomalia di Ebstein con una libertà da reintervento dell’80.6 ± 7.6% ad un follow-up esteso a 17.8 anni32.
L’impianto di una protesi meccanica è riservato nei casi in cui sia
già presente un’altra protesi valvolare meccanica e in assenza
di importante disfunzione del ventricolo destro che può essere
causa di un’alterata mobilità dei lembi protesici e conseguente
più elevato rischio di fenomeni tromboembolici. La mortalità
dopo sostituzione della valvola tricuspide è riportata tra il 6%
e il 9% con una sopravvivenza a 1, 5, 10, 15 e 20 anni rispettivamente del 91%, 86%, 82%, 73% e 66%33-35 (Figura 13).
Numerose sono le tecniche riparative descritte in letteratura.
L’ampia eterogeneità di presentazione della patologia giustifica la ricerca di nuove soluzioni ma al contempo la bassa incidenza si traduce in esperienze con popolazioni limitate e raramente con adeguato follow-up. Contributi importanti nello sviluppo e nella promozione della chirurgia riparativa valvolare per
anomalia di Ebstein sono stati proposti tra la fine degli anni ’70
e l’inizio degli anni ’80 da Danielson e Carpentier. Più recentemente da Silva et al.36 hanno riportato eccellenti risultati nell’applicazione di una tecnica riparativa quale ulteriore sviluppo
della strategia riparativa proposta da Carpentier.
Tecniche chirurgiche riparative
L’esperienza chirurgica maggiore proviene dalla Mayo Clinic la
cui tecnica di riparazione originale proposta nel 1979 da Danielson consisteva nella plicatura della parete libera della porzione atrializzata del ventricolo destro associata ad anuloplastica tricuspidale a livello dell’anulus posteriore e plastica riduttiva
dell’atrio destro. Numerose modifiche sono state apportate nel
Figura 13. Libertà da reintervento dopo sostituzione e riparazione
della valvola tricuspide in soggetti con età <12 (A) o i12 anni (B).
Riprodotta con permesso da Brown et al.34.
182
G ITAL CARDIOL | VOL 16 | MARZO 2015
corso degli anni e in relazione all’ampia variabilità di presentazione anatomica. La base dei muscoli papillari è spostata verso
il setto interventricolare e fissata con suture a materassaio orizzontale con pledget in feltro. La commissura lembo anterioreposteriore è suturata con spostamento del lembo anteriore verso il setto e plicatura del lembo posteriore, un’anuloplastica posteriore è quindi associata per ridurre il diametro dell’anulus tricuspidale, ridotto poi ulteriormente da un’anuloplastica secondo De Vega anche a livello di anulus anteriore. Alla riparazione
valvolare a livello dell’anulus funzionale si associa selettivamente la plicatura o resezione della porzione atrializzata del ventricolo destro. I risultati riportati da Brown et al.34 della Mayo Clinic sono molto incoraggianti: su 539 pazienti trattati chirurgicamente per anomalia di Ebstein, la riparazione valvolare è stata eseguita in 182 casi (il 60% dei pazienti presentava alterazioni anatomiche di grado moderato-severo) con una mortalità
ospedaliera del 5% e libertà da reintervento a 1, 5, 10, 15 e 20
anni rispettivamente del 100%, 95%, 89%, 77% e 64%. Purtroppo in questa rivisitazione dell’esperienza chirurgica globale
sul trattamento dell’anomalia di Ebstein non è stato valutato
l’outcome funzionale dei pazienti sottoposti a riparazione valvolare. Lo stesso gruppo aveva in precedenza riportato in una
sottopopolazione in studio con età media di 7 anni un netto miglioramento sintomatologico dopo riparazione della valvola tricuspide, con l’89% dei pazienti in classe funzionale NYHA I
(62%) o II (17%) ad un follow-up medio di 12.2 ± 7.4 anni37.
Carpentier propose la sua tecnica di riparazione nel 1980,
con la correzione attraverso la mobilizzazione del lembo anteriore. Il lembo anteriore è separato dall’anulus valvolare a partire dalla commissura antero-settale e includendo, laddove presente, anche il lembo posteriore. L’unità lembo anteriore-posteriore viene quindi traslocata a livello dell’anulus anatomico
creando così una valvola monocuspide (Figura 14), dopo aver
eseguito una plicatura longitudinale della porzione atrializzata
del ventricolo destro. Un’anuloplastica con anello protesico
completa la tecnica di riparazione. Dal 1980 al 2002, 187 pazienti (età media 24.7 ± 15 anni, range 1-65 anni) sono stati
sottoposti a chirurgia riparativa. La mortalità ospedaliera riportata è stata del 9% dovuta nella maggior parte dei casi a “failure” del ventricolo destro. La durabilità della riparazione è risultata ottimale con libertà da reintervento a 10 e 20 anni
dell’88.6 ± 4% considerando anche un’ampia prevalenza di alterazioni classificabili come tipo C e tipo D secondo la classificazione di Carpentier. Dal punto di vista funzionale, tra i 156
pazienti con follow-up >1 anno, 146 si presentavano in classe
NYHA I e 9 in classe NYHA II38.
Nel corso delle ultime tre decadi molte soluzioni sono state proposte per correggere problemi specifici nel corso della riparazione. Il gruppo di Quaegebeur39,40 ha proposto una variante della tecnica di Carpentier evitando l’anuloplastica con
ring protesico. Ullmann et al.41 hanno riportato buoni risultati
con la tecnica di ventricolizzazione, caratterizzata dalla mancata plicatura della porzione atrializzata, strategia comune alle
esperienze di Hancock Friesen et al.42 e Hetzer et al.43. Altri autori hanno proposto l’utilizzo di patch per aumentare o rimodellare i lembi44,45 e differenti tecniche per proteggere il sistema di conduzione46. La maggior parte di queste esperienze è
però basata su un numero limitato di pazienti.
Lo sviluppo più recente proviene dal gruppo di San Paolo.
Da Silva propose già nel 1993 la cosiddetta “Cone procedure”,
in cui si aggiunge alla delaminazione dei lembi anteriore e posteriore la divisione e mobilizzazione del lembo settale dal tes-
ANOMALIA DI EBSTEIN: DIAGNOSI E TRATTAMENTO CHIRURGICO
Figura 14. Valutazione del risultato della riparazione secondo Carpentier con la creazione di una valvola monocuspide. A: ecocardiogramma transtoracico preoperatorio, lembo anteriore della valvola tricuspide (freccia bianca). B: ecocardiogramma transtoracico postoperatorio,
lembo anteriore della valvola tricuspide (freccia bianca).
suto ventricolare, quando presente (Figura 15). I risultati pubblicati nel 2007 su 40 pazienti mostrano una mortalità ospedaliera del 2.5% e sottolineano l’efficacia nella riparazione con
un tasso di reintervento del 5% a 4 anni e miglioramento della classe funzionale NYHA da 2.6 ± 0.7 a 1.2 ± 0.4 (p<0.001)36.
PROCEDURE ASSOCIATE
Lo shunt cavo-polmonare
La creazione e aggiunta dello shunt bidirezionale nel trattamento dell’anomalia di Ebstein è stata proposta solo in casi selezionati47,48 in presenza di severa disfunzione e/o dilatazione
del ventricolo destro. Usualmente le resistenze e le pressioni
polmonari in pazienti con anomalia di Ebstein sono basse sia
prima che dopo la riparazione biventricolare; tuttavia in presenza di ridotta funzione ventricolare sinistra è necessario valutare preoperatoriamente e intraoperatoriamente che siano
soddisfatte determinate condizioni emodinamiche per un’adeguata funzione dello shunt: una pressione telediastolica del
ventricolo sinistro <15 mmHg, un gradiente transpolmonare
<10 mmHg e una pressione polmonare media di 18-20 mmHg.
I pazienti trattati con la strategia “one and one-half ventricle” beneficiano di una maggiore sopravvivenza a medio termine e, a parità di grado di ricorrenza di importante insufficienza
tricuspidale, di un più significativo miglioramento clinico47.
Chirurgia delle aritmie
La correzione chirurgica sembra ridurre l’occorrenza e la frequenza degli episodi aritmici anche quando non associata a
Figura 15. Riparazione della valvola tricuspide secondo da Silva
(“Cone procedure”). Solo la porzione di lembo anteriore inserita a
livello dell’anulus anatomico e le corrispondenti afferenze sottovalvolari sono lasciate in sede (B). L’unità lembo anteriore-posteriore
è ruotata in senso orario e traslocata sull’anulus anatomico con sutura del lembo posteriore sul margine posteriore del lembo settale
(C). Si viene a costituire la nuova valvola tricuspide a forma conica.
La riparazione è completata dalla plicatura dell’anulus anatomico e
della porzione ventricolare atrializzata, senza però utilizzare un anello di rinforzo (D).
ASD, difetto del setto atriale; CS, seno coronarico; TTA, anulus tricuspidale vero.
Riprodotta con permesso da da Silva et al.36.
complesse procedure chirurgiche antiaritmiche. Chauvaud et
al.49 hanno riportato in 45 pazienti con aritmia preoperatoria e
sottoposti a riparazione chirurgica di anomalia di Ebstein, il ripristino di ritmo sinusale nel 40% dei pazienti nell’immediato
postoperatorio (5 pazienti sottoposti a impianto di pacemaker
permanente) e nel 39% dei casi ad un follow-up di 58 ± 50
mesi.
Tuttavia l’evidenza di un più elevato rischio di morte improvvisa in pazienti con aritmia nell’immediato periodo postoperatorio suggerisce l’introduzione di un più esteso approccio
al trattamento delle aritmie. Greason et al.50 hanno riportato
in pazienti con cardiopatia congenita (70% con anomalia di
Ebstein) e aritmia atriale sottoposti a Maze destra il ripristino
del ritmo sinusale in più dell’80% dei casi ad un follow-up medio di 17 mesi. Risultati simili ed estesi ad un follow-up medio
più lungo di 2.7 anni sono stati riportati dal gruppo di Dearani51 in 99 pazienti con fibrillazione atriale parossistica (n=62) o
cronica (n=15) e flutter atriale parossistico (n=19) o cronico
(n=3), sottoposti a correzione di anomalia di Ebstein e Maze
destra. Il sospetto di associata preeccitazione ventricolare era
stato studiato in 13 paziente nel preoperatorio e confermato
in 11. In 4 casi il trattamento di ablazione è stato eseguito per
via percutanea prima dell’intervento chirurgico mentre nei restanti 7 pazienti è stata eseguita una mappatura intraoperatoria con associata divisione del tessuto di conduzione accessorio.
G ITAL CARDIOL | VOL 16 | MARZO 2015
183
PG MALVINDI, N VIOLA
RIASSUNTO
L’anomalia di Ebstein è una malformazione cardiaca rara, manifestazione di un generale e marcato difetto di sviluppo della valvola tricuspide e del ventricolo destro. L’eterogeneo spettro di presentazione delle tipiche alterazioni anatomiche e dell’associata
cardiomiopatia è alla base dell’ampia variabilità nelle manifestazioni cliniche ed emodinamiche e del loro impatto sulla diagnosi
e la prognosi della patologia. La sopravvivenza è ridotta nei casi
di Ebstein neonatale mentre una mortalità media annua dell’11.4% caratterizza la storia naturale nell’infanzia e negli adulti. Per
i pazienti con diagnosi di lievi anomalie anatomiche ed asintomatici, è opportuna l’osservazione clinica ed un follow-up ecocardiografico. L’intervento chirurgico è indicato in presenza di pro-
gressiva dilatazione delle camere cardiache destre, riduzione della funzione ventricolare destra, l’insorgenza di aritmie atriali e/o
ventricolari, episodi di embolia paradossa, una ridotta tolleranza
allo sforzo e la presenza di significativa desaturazione a riposo o
sotto sforzo. La strategia per la correzione dell’insufficienza valvolare tricuspidale nell’infante e nell’età adulta prevede la riparazione o sostituzione della valvola tricuspide. Importanti contributi nello sviluppo delle tecniche di riparazione valvolare sono giunti nel corso degli anni dalle esperienze di Danielson, Carpentier e
da Silva, con soddisfacenti risultati in termini di sicurezza e durabilità.
Parole chiave. Anomalia di Ebstein; Cardiopatia congenita; Riparazione valvolare; Valvola tricuspide.
BIBLIOGRAFIA
1. Mann RJ, Lie TJ. The life story of Wilhelm Ebstein (1836-1912) and his almost
overlooked description of a congenital heart
disease. Mayo Clin Proc 1979;54:197-204.
2. van Son JA, Kostantinov IE, Zimmermann V. Wilhelm Ebstein and Ebstein’s malformation. Eur J Cardiothorac Surg 2001;
20:1082-5.
3. Attenohofer CH, Connolly HM, Dearani
JA, Edwards WD, Danielson GK. Ebstein’s
anomaly. Circulation 2007;115:277-85.
4. Sharland G, Cita S, Allan L. Tricuspid
valve dysplasia or displacement in intrauterine life. J Am Coll Cardiol 1991;17:944-9.
5. Celermajer DS, Bull C, Till JA, et al.
Ebstein’s anomaly: presentation and
outcome from fetus to adult. J Am Coll
Cardiol 1994;23:170-6.
Una moderna chiave di lettura della
storia naturale dell’anomalia di Ebstein.
6. Correa-Villasenor A, Ferencz C, Neill
CA, Wilson PD, Boughman JA. Ebstein’s
malformation of the tricuspid valve: genetic and environmental factors. The Baltimore-Washington Infant Study Group.
Tetralogy 1994;50:137-47.
7. Edwards WD. Embriology and pathologic features of Ebstein’s anomaly. Prog Pediatr Cardiol 1993;2:5-15.
8. Martinez RM, O’Leary PW, Anderson
RH. Anatomy and echocardiography of the
normal and abnormal tricuspid valve. Cardiol Young 2006;16(Suppl 3):4-11.
9. Danielson GK, Driscoll DJ, Mair DD,
Warnes CA, Oliver WC Jr. Operative treatment of Ebstein’s anomaly. J Thorac Cardiovasc Surg 1992;104:1195-202.
10. Brickner ME, Hillis LD, Lange RA. Congenital heart disease in adults: second of
two parts. N Engl J Med 2000;342:334-42.
11. Celermajer DS, Cullen S, Sullivan ID,
Spiegelhalter DJ, Wyse RK, Deanfield JE.
Outcome in neonates with Ebstein’s anomaly. J Am Coll Cardiol 1992;19:1041-6.
12. Anderson KR, Zuberbuhler JR, Anderson RH, Becker AE, Lie JT. Morphologic
spectrum of Ebstein’s anomaly of the
heart: a review. Mayo Clin Proc 1979;54:
174-80.
13. van Son JA, Danielson GK, Huhta JC,
184
G ITAL CARDIOL | VOL 16 | MARZO 2015
et al. Late results of systemic atrioventricular valve replacement in corrected transposition. J Thorac Cardiovasc Surg 1995;109:
642-52.
14. Celermajer DS, Cullen S, Deanfield JE,
Sullivan ID. Congenitally corrected transposition and Ebstein’s anomaly of the systemic
atrioventricular valve: association with aortic arch obstruction. J Am Coll Cardiol 1991;
18:1056-8.
15. Dekker A, Mehrizi A, Vengsarkar AS.
Corrected transposition of the great vessels
with Ebstein malformation of the left atrioventricular valve: an embryologic analysis
and two case reports. Circulation 1965;
31:119-26.
16. Carpentier A, Chauvaud S, Mace L,
et al. A new reconstructive operation
for Ebstein’s anomaly of the tricuspid
valve. J Thorac Cardiovasc Surg 1988;
96:92-101.
Descrizione e risultati della tecnica di riparazione alla base dei più recenti sviluppi chirurgici.
17. Dearani JA, Danielson GK. Congenital
Heart Surgery Nomenclature and Database
Project: Ebstein’s anomaly and tricuspid
valve disease. Ann Thorac Surg 2000;69
(Suppl):S106-17.
18. Yalonetsky S, Tobler D, Greutmann M,
et al. Cardiac magnetic resonance imaging
and the assessment of ebstein anomaly in
adults. Am J Cardiol 2011;107:767-73.
19. Kilner PJ. The role of cardiovascular
magnetic resonance in adults with congenital heart disease. Prog Cardiovasc Dis
2011;54:295-304.
20. Bonello B, Kilner PJ. Review of the role
of cardiovascular magnetic resonance in
congenital heart disease, with a focus on
right ventricle assessment. Arch Cardiovasc
Dis 2012;105:605-13.
21. Hösch O, Sohns JM, Nguyen TT, et al.
The total right/left-volume index: a new and
simplified cardiac magnetic resonance
measure to evaluate the severity of ebstein
anomaly of the tricuspid valve: a comparison with heart failure markers from various
modalities. Circ Cardiovasc Imaging 2014;
7:601-9.
22. Tobler D, Yalonetsky S, Crean AM, et
al. Right heart characteristics and exercise
parameters in adults with Ebstein anomaly:
new perspectives from cardiac magnetic
resonance imaging studies. Int J Cardiol
2013;165:146-50.
23. Watson H. Natural history of Ebstein’s
anomaly of tricuspid valve in childhood and
adolescence: an international co-operative
study of 505 cases. Br Heart J 1974;36:41727.
24. McElhinney DB, Salvin JW, Colan SD,
et al. Improving outcomes in fetuses and
neonates with congenital displacement
(Ebstein’s malformation) or dysplasia of the
tricuspid valve. Am J Cardiol 2005;96:5826.
25. Celermajer DS, Dodd SM, Greenwald
SE, Wyse RK, Deanfield JE. Morbid anatomy in neonates with Ebstein’s anomaly of
the tricuspid valve: pathophysiologic and
clinical implications. J Am Coll Cardiol
1992;19:1049-53.
26. Yetman AT, Freedom RM, McCrindle
BW. Outcome in cyanotic neonates with Ebstein’s anomaly. Am J Cardiol 1998;81:74954.
27. Warnes CA, Williams RG, Bashore TM,
et al. ACC/AHA 2008 Guidelines for the
management of adults with congenital
heart disease: executive summary: a report
of the American College of Cardiology/
American Heart Association Task Force on
Practice Guidelines (writing committee to
develop guidelines for the management of
adults with congenital heart disease). Circulation 2008;118:2395-451.
28. Baumgartner H, Bonhoeffer P, De
Groot NM, et al.; Task Force on the Management of Grown-up Congenital Heart
Disease of the European Society of Cardiology (ESC); Association for European Paediatric Cardiology (AEPC); ESC Committee for
Practice Guidelines (CPG). ESC Guidelines
for the management of grown-up congenital heart disease (new version 2010). Eur
Heart J 2010;31:2915-57.
29. Starnes VA, Pitlick PT, Bernstein D,
Griffin ML, Choy M, Shumway NE. Ebstein’s
anomaly appearing in the neonate. A new
ANOMALIA DI EBSTEIN: DIAGNOSI E TRATTAMENTO CHIRURGICO
surgical approach. J Thorac Cardiovasc Surg
1991;101:1082-7.
30. Knott-Craig CJ, Goldberg SP. Management of neonatal Ebstein’s anomaly. Semin
Thorac Cardiovasc Surg Pediatr Card Surg
Annu 2007;10:112-6.
31. Knott-Craig CJ, Overholt ED, Ward
KE, Ringewald JM, Baker SS, Razook JD.
Repair of Ebstein’s anomaly in the
symptomatic neonate: an evolution of
technique with 7-year follow-up. Ann
Thorac Surg 2002;73:1786-92.
Indicazioni e trattamento della patologia in epoca neonatale.
32. Kiziltan HT, Theodoro DA, Warnes CA,
O’Leary PW, Anderson BJ, Danielson GK.
Late results of bioprosthetic tricuspid valve
replacement in Ebstein’s anomaly. Ann Thorac Surg 1998;66:1539-44.
33. Brown ML, Dearani JA, Danielson GK,
et al. Comparison of the outcome of
porcine bioprosthetic versus mechanical
prosthetic replacement of the tricuspid valve
in the Ebstein anomaly. Am J Cardiol 2009;
103:555-61.
34. Brown ML, Dearani JA, Danielson
GK, et al. The outcomes of operations
for 539 patients with Ebstein anomaly.
J Thorac Cardiovasc Surg 2008;135:
1120-36.
Revisione della più grande esperienza
nel trattamento chirurgico dell’anomalia di Ebstein.
35. Sarris GE, Giannopoulos NM, Tsoutsinos AJ, et al. Results of surgery for Ebstein
anomaly: a multicenter study from the European Congenital Heart Surgeons Association. J Thorac Cardiovasc Surg 2006;132:
50-7.
36. da Silva JP, Baumgratz JF, da Fonseca L, et al. The cone reconstruction of
the tricuspid valve in Ebstein’s anomaly.
The operation: early and midterm results. J Thorac Cardiovasc Surg 2007;
133:215-23.
Prima pubblicazione dell’esperienza dei
primi 40 pazienti operati con la modificazione della tecnica di Carpentier, la
“Cone procedure”.
37. Boston US, Dearani JA, O’Leary PW,
Driscoll DJ, Danielson GK. Tricuspid valve repair for Ebstein’s anomaly in young children:
a 30-year experience. Ann Thorac Surg
2006;81:690-6.
38. Chauvaud S, Berrebi A, d’Attellis N,
Mousseaux E, Hernigou A, Carpentier A.
Ebstein’s anomaly: repair based on functional analysis. Eur J Cardiothorac Surg
2003;23:525-31.
39. Quaegebeur JM, Sreeram N, Fraser
AG, et al. Surgery for Ebstein’s anomaly: the
clinical and echocardiographic evaluation of
a new technique. J Am Coll Cardiol 1991;
17:722-8.
40. Chen JM, Mosca RS, Altmann K, et al.
Early and medium-term results for repair of
Ebstein anomaly. J Thorac Cardiovasc Surg
2004;127:990-8.
41. Ullmann MV, Born S, Sebening C,
Gorenflo M, Ulmer HE, Hagl S. Ventricularization of the atrialized chamber: a concept
of Ebstein’s anomaly repair. Ann Thorac
Surg 2004;78:918-24.
42. Hancock Friesen CL, Chen R, Howlett
JG, Ross DB. Posterior annular plication: tricuspid valve repair in Ebstein’s anomaly.
Ann Thorac Surg 2004;77:2167-71.
43. Hetzer R, Nagdyman N, Ewert P, et al.
A modified repair technique for tricuspid incompetence in Ebstein’s anomaly. J Thorac
Cardiovasc Surg 1998;115:857-68.
44. Ogus NT, Indelen C, Yildirim T, Se-
limoglu O, Basaran M. Pericardial patch
augmentation of both anterior and septal
leaflets in Ebstein’s anomaly. Ann Thorac
Surg 2007;83:676-8.
45. van Son JA, Kinzel P, Mohr FW. Pericardial patch augmentation of anterior tricuspid leaflet in Ebstein’s anomaly. Ann
Thorac Surg 1998;66:1831-2.
46. Bichell DP, Mora BN, Mathewson JW,
Kirkpatrick SK, Tyner JJ, McLees-Palinkas T.
Modified technique for the surgical treatment of severe tricuspid valve deformity in
Ebstein’s anomaly. Ann Thorac Surg 2007;
83:678-80.
47. Chauvaud S, Fuzellier JF, Berrebi A, et
al. Bi-directional cavopulmonary shunt associated with ventriculo and valvuloplasty in
Ebstein’s anomaly: benefits in high risk patients. Eur J Cardiothorac Surg 1998;13:
514-9.
48. Quinonez LG, Dearani JA, Puga FJ, et
al. Results of the 1.5-ventricle repair for Ebstein anomaly and the failing right ventricle.
J Thorac Cardiovasc Surg 2007;133:130310.
49. Chauvaud SM, Brancaccio G, Carpentier AF. Cardiac arrhythmia in patients undergoing surgical repair of Ebstein’s anomaly. Ann Thorac Surg 2001;71:1547-52.
50. Greason KL, Dearani JA, Theodoro DA,
Porter CB, Warnes CA, Danielson GK. Surgical management of atrial tachyarrhythmias associated with congenital cardiac
anomalies: Mayo Clinic experience. Semin
Thorac Cardiovasc Surg Pediatr Card Surg
Annu 2003;6:59-71.
51. Stulak JM, Dearani JA, Puga FJ, Zehr
KJ, Schaff HV, Danielson GK. Right-sided
Maze procedure for atrial tachyarrhythmias
in congenital heart disease. Ann Thorac
Surg 2006;81:1780-5.
G ITAL CARDIOL | VOL 16 | MARZO 2015
185