UNIVERSITA' DEGLI STUDI DI CATANIA
Struttura didattica Scienze del Farmaco
A.A. 2012-2013 - Prova di ammissione con selezione locale
Dip. di Scienze del Farmaco
[O86]
CHIMICA
1. L’elettrone è:
A) un bosone
B) un fotone
C) un fermione
D) privo di massa
2. A quale periodo della tabella periodica appartiene un atomo con configurazione elettronica [Ar]3d104s24p65s1?
A) Primo
B) Secondo
C) Terzo
D) Quinto
3. Un elemento con la configurazione elettronica esterna del tipo s2 p5 a quale gruppo della tavola periodica appartiene?
A) Alogeni
B) Gas rari
C) Metalli alcalini
D) Metalli alcalino terrosi
4. Quale tra i seguenti idrocarburi ha il peso molecolare maggiore?
A) Propano
B) Butano
C) Pentano
D) Etano
5. Quale delle seguenti sostanze in soluzione acquosa presenta proprietà ossidanti?
A) Cloruro di sodio
B) Acido tri-cloroacetico
C) Ipoclorito di sodio
D) Acido tri-fluoroacetico
6. L’ottone è:
A) un elemento della tavola periodica
B) un composto chimico
C) un chetone
D) una lega
7. Portando a contatto il succo di un limone con una piccola quantità di polvere bianca costituita da bicarbonato di
sodio e sale da cucina si nota immediatamente lo sviluppo di gas. Il gas in questione è:
A) vapore acqueo
B) cloro
C) sodio
D) anidride carbonica
8. Gli idrossidi da quale/i dei seguenti composti sono formati?
A) Un atomo di Ossigeno e uno di Idrogeno
B) Solo da atomi di Ossigeno
C) Ossigeno e un non metallo
D) Ossigeno, Idrogeno ed un metallo
Pagina 1
9. Qual è l'elemento più elettronegativo del sistema periodico?
A) Alluminio
B) Silicio
C) Fluoro
D) Sodio
10. Date le sostanze He, H2, HCl, NH3, e grafite, quali sono composti chimici?
A) Tutte le sostanze sono composti chimici
B) HCl e NH 3
C) H 2, HCl, e NH 3
D) Grafite
11.
A)
B)
C)
D)
Un sistema costituito da acqua pura e ghiaccio è:
una soluzione
un sistema fisicamente e chimicamente omogeneo
un sistema fisicamente eterogeneo e chimicamente omogeneo
un sistema fisicamente e chimicamente eterogeneo
12. Nella reazione di formazione dell’acido carbonico (H2CO3) da anidride carbonica (CO2) e acqua, quanti grammi di CO2
sono necessari per formare 62 grammi di H2CO3? (Peso atomico di H:1; peso atomico di C:12; peso atomico di O:16)
A)
B)
C)
D)
12 g
16 g
24 g
44 g
13.
A)
B)
C)
D)
Per quale delle seguenti classi di composti chimici si può prevedere una buona solubilità in acqua:
idrocarburi aromatici
idrocarburi alifatici
alcoli a basso peso molecolare
alcoli ad alto peso molecolare
14.
A)
B)
C)
D)
In una soluzione non satura di cloruro di sodio in acqua, le molecole di acqua si orientano in modo che:
lo ione sodio è circondato dagli atomi di ossigeno dell’acqua e lo ione cloro dagli atomi di idrogeno dell’acqua
lo ione cloro è circondato dagli atomi di ossigeno dell’acqua e lo ione sodio dagli atomi di idrogeno dell’acqua
formano legami idrogeno tra loro mentre lo ione sodio è circondato dagli ioni cloro
formano legami idrogeno tra loro mentre lo ione cloro è circondato dagli ioni sodio
15. Nella formazione di acqua da ossigeno e idrogeno molecolari (O2, H2) quanti grammi di idrogeno sono necessari per
formare 36 g di H2O? (considerare 32 come peso molecolare di O 2, e 2 come peso molecolare di H2)
A)
B)
C)
D)
1g
2g
4g
8g
16. Una soluzione non satura di NaCl in H2O è:
A)
B)
C)
D)
17.
A)
B)
C)
D)
un sistema fisicamente e chimicamente omogeneo
un sistema fisicamente omogeneo e chimicamente eterogeneo
un sistema fisicamente eterogeneo e chimicamente omogeneo
un sistema fisicamente e chimicamente eterogeneo
Quale tra le seguenti affermazioni riguardanti due isomeri è vera?
Hanno lo stesso numero di Carboni e di Idrogeni
Hanno lo stesso gruppo funzionale
Hanno le stesse proprietà fisiche ma diverso peso molecolare
Hanno lo stesso peso molecolare
Pagina 2
18. Considerato l'insieme formato da ogni primo elemento di ciascun periodo della tavola periodica, cosa hanno in
comune tutti gli elementi dell'insieme?
A) Hanno lo stesso raggio atomico
B) Sono tutti metalli alcalino terrosi
C) Hanno un solo elettrone di tipo s nella configurazione elettronica esterna
D) Hanno la stessa elettronegatività
19. Gli orbitali ibridi di tipo sp2 del Carbonio formano tra loro un angolo di quanti gradi?
A) 180
B)
C)
D) 120
20.
A)
B)
C)
D)
Il valore di elettronegatività di sodio e cloro:
è uguale tra i due elementi perché appartengono allo stesso periodo della tavola periodica
è più alto per il sodio
è più alto per il cloro
è nullo per entrambi
21.
A)
B)
C)
D)
L'apice a sinistra del simbolo chimico di un elemento indica:
il numero di protoni
il numero di elettroni
il numero di massa
la differenza tra il numero di protoni e quello di neutroni
22. Una piccola quantità di un composto chimico sconosciuto viene sciolta in 100 cc di acqua pura. Il pH della soluzione
così ottenuta viene misurato e il valore ottenuto risulta essere pari a 7. Quale delle seguenti ipotesi sul composto ignoto è
plausibile?
A) Il composto è un acido forte
B) Il composto è una base debole
C) Il composto è un sale ottenuto da acido forte più base forte
D) Il composto è un sale ottenuto da acido forte più base debole
23.
A)
B)
C)
D)
Nella reazione con ossigeno, i metalli alcalino terrosi:
formano esclusivamente ossidi basici
formano esclusivamente ossidi acidi
possono formare ossidi basici od ossidi acidi a seconda del numero di ossidazione
formano ossidi anfoteri
24. Quali dei seguenti composti sono ossidi basici e quali sono ossidi acidi: SO3, BaO, K2O, P2O 3
A) Sono tutti ossidi acidi
B) Ossidi basici: BaO, K2O, P2O 3; ossidi acidi: SO3
C) Ossidi basici: BaO, K2O; ossidi acidi: SO3, P2O 3
D) Sono tutti ossidi basici
25. 48 g di metano vengono fatti reagire con ossigeno secondo la reazione: CH4 + 2 O2
CO2 + 2 H 2O. La quantità
stechiometrica di ossigeno espressa in grammi necessaria a bruciare il CH 4 è pari a: (si consideri il peso atomico del
carbonio, ossigeno e idrogeno pari a 12.0, 16.0 e 1.0, rispettivamente)
A) 192
B) 128
C) 96
D) 64
26. Il legame tra due atomi di cloro nella molecole Cl 2 è:
A)
B)
C)
D)
covalente semplice
covalente doppio
covalente triplo
covalente quadruplo
Pagina 3
27. Nella seguente reazione Fe + CuSO4
A)
B)
C)
D)
FeSO4 + Cu
il rame si comporta da riducente
il rame disproporziona
il ferro viene ossidato
il ferro disproporziona
28. L' ammoniaca può reagire con l'ossigeno secondo la reazione 4 NH3 + 3 O2
p N2 + q H2O. Perché sia bilanciata p,
q dovranno essere, rispettivamente:
A) 4 e 3
B) 2 e 6
C) 3 e 4
D) 1 e 1
29.
A)
B)
C)
D)
In condizioni ottimali durante la combustione di idrocarburi viene prodotto:
acqua e ossido di carbonio
ossigeno e anidride carbonica
acqua e grafite
acqua e anidride carbonica
30.
A)
B)
C)
D)
Con quale criterio sono ordinati gli elementi all'interno della tavola periodica?
Numero di massa crescente
Numero atomico crescente
In ordine alfabetico
Raggio atomico crescente
31.
A)
B)
C)
D)
Quale tra questi elementi è un metallo?
Cloro
Argon
Cadmio
Ossigeno
32. Quale dei seguenti composti o elementi può esistere in natura come solido cristallino in cui tutti i legami sono
covalenti:
A) Fe
B) NaCl
C) C
D) NaCO3
33.
A)
B)
C)
D)
Quante moli ci sono in 32g di Metano (PM 16)?
4 moli
0.5 moli
16 moli
2 moli
34. Il metano (CH4) è caratterizzato da:
A)
B)
C)
D)
35.
A)
B)
C)
D)
quattro legami CH covalenti polari
due legami CH covalenti polari e due legami CH covalenti non polari
quattro legami CH covalenti non polari
un legame CH covalente non polare e tre legami covalenti polari
Due elementi chimici possono formare un legame ionico se:
entrambi gli elementi hanno un alto potenziale di ionizzazione
i due elementi hanno uguale elettronegatività
i due elementi sono uguali
i due elementi presentano un’elevata differenza di elettronegatività
Pagina 4
36.
A)
B)
C)
D)
Il peso molecolare (massa molecolare) è dato da:
la somma dei protoni e degli elettroni degli atomi della molecola
la somma dei protoni degli atomi della molecola
la somma dei pesi atomici degli atomi escludendo l'Idrogeno
la somma dei pesi atomici degli atomi della molecola
37.
A)
B)
C)
D)
Una soluzione tampone ha come principale caratteristica quella di:
avere il pH sempre prossimo a 7
mantenere il pH costante e prossimo al valore di 14
essere sempre acida
limitare le variazioni di pH
38. Quale tra le seguenti molecole è la più polare?
A) H2
B) F2
C) N 2
D) HCl
39.
A)
B)
C)
D)
Il pH dell’acqua pura a 25° è pari a:
5.5
-7
7
0
BIOLOGIA
40.
A)
B)
C)
D)
Quale tra le seguenti risposte definisce meglio la cellula?
È un virus
È un organismo superiore
È composta in minima parte di acqua
È l’unità fondamentale della vita
41.
A)
B)
C)
D)
Il nucleo cellulare:
si trova negli organismi procarioti
si trova solo nei protozoi
è caratteristico solo delle cellule eucariote
si trova nei virus
42. Se osservo al microscopio ottico elementi come i mitocondri, vacuoli, reticolo endoplasmatico e membrana cellulare
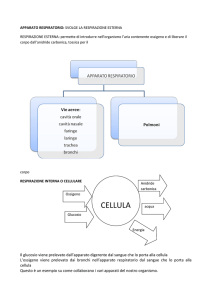
sto osservando:
A) una particella virale
B) una cellula vegetale
C) una cellula animale
D) un proteosoma
43.
A)
B)
C)
D)
Urea e ammoniaca sono i principali prodotti di rifiuto presenti:
nel liquido rachidiano
nel sangue
negli alveoli polmonari
nell’intestino retto
44.
A)
B)
C)
D)
Dove si trova, negli eucarioti, il DNA?
Nei ribosomi
Negli istoni
Nell’apparato di Golgi
Nel nucleo cellulare
Pagina 5
45.
A)
B)
C)
D)
L’emoglobina che trasporta l’ossigeno nei tessuti di un organismo superiore si trova all’interno:
dei linfonodi
dei globuli rossi
delle cellule epatiche
della cistifellea
46. I principali prodotti di sintesi della glicolisi sono:
A) fruttosio e CO2
B) acido piruvico
C) ribosio e ammoniaca
D) saccarosio e acetato
47.
A)
B)
C)
D)
L’effetto globale del flusso genetico è:
creare un collo di bottiglia nella popolazione
aumentare l’efficienza della selezione naturale
favorire l’accoppiamento non casuale
diminuire le differenze tra popolazioni
48.
A)
B)
C)
D)
Quante paia di cromosomi ha la specie Homo sapiens?
22
24
25
23
49.
A)
B)
C)
D)
Che cosa è un aminoacido?
È un componente del DNA
È un componente del RNA
Costituisce l’unità fondamentale della cellula
È un composto chimico che costituisce le proteine
50.
A)
B)
C)
D)
Se un composto è formato da glicerolo, fosfato, catene alifatiche e azoto mi trovo in presenza di:
un aminoacido
una base azotata
un fosfolipide
una proteina
51.
A)
B)
C)
D)
Le membrane cellulari sono costituite principalmente da:
lipidi e proteine
zuccheri e collagene
acidi grassi e vitamine
aminoacidi
52.
A)
B)
C)
D)
Quanti sono gli aminoacidi naturali?
20
21
22
23
53.
A)
B)
C)
D)
L’acido de-ossiribonucleico è composto da:
saccarosio e fruttosio
aminoacidi e lipidi
basi azotate e ribosio
acidi grassi e acidi poli-instaturi
54.
A)
B)
C)
D)
La respirazione aerobica negli organismi eucarioti ha luogo:
nei lisosomi
nel reticolo endoplasmatico
nei mitocondri
nel reticolo endoplasmatico rugoso
Pagina 6
55.
A)
B)
C)
D)
Nelle femmine appartenenti alla specie Homo sapiens sapiens, il 23-esimo cromosoma è del tipo:
XY
XX
YY
ZX
56.
A)
B)
C)
D)
I ribosomi sono composti da:
RNA e proteine
RNA e DNA
DNA e proteine
proteine di membrana
57.
A)
B)
C)
D)
Gli enzimi sono composti chimici che:
bloccano una reazione chimica
limitano la resa di una reazione chimica
aumentano la velocità di reazione
aumentano l’energia dello stato di transizione
58. Quale tra queste tecniche d’indagine sperimentale è usata per determinare la struttura tri-dimensionale delle
proteine?
A) Spettroscopia di massa
B) Calorimetria
C) Fluorimetria
D) Spettroscopia a diffrazione ai raggi X
59.
A)
B)
C)
D)
Quale di questi non è un tipo di tessuto animale?
Linfatico
Muscolare
Nervoso
Connettivo
60.
A)
B)
C)
D)
Se un organismo possiede alleli diversi per uno stesso gene, si dice:
che è aploide
che è procariote
che è recessivo
che è eterozigote
61.
A)
B)
C)
D)
Nel regno animale, l’ontogenesi è quel processo biologico tramite il quale:
da una singola cellula fecondata si sviluppa un organismo vivente
da una singola cellula si forma un organo funzionante
da una cellula staminale si ottengono cellule differenziate mature
da una singola specie si forma una popolazione eterogenea di più specie diverse
62.
A)
B)
C)
D)
Se in un vetrino al microscopio ottico osserviamo un’abbondante presenza di mitocondri, stiamo in presenza di:
una cellula muscolare
una cellula epatica
una cellula epiteliale
un fibroblasto
63.
A)
B)
C)
D)
Quale tra le seguenti affermazioni descrive meglio la differenza tra la mitosi e la meiosi?
La prima è conservativa del numero di cromosomi
La seconda è conservativa del numero di cromosomi
Entrambe sono conservative
Entrambe producono due cellule figlie
MATEMATICA
64. In un triangolo isoscele gli angoli alla base misurano 20° e i lati congruenti misurano L. Il perimetro del triangolo
vale allora
A) 2L(1 + cos 20°)
B) 2L(1 + sin 20°)
C) 2L(1 + tan 20°)
D) 2L(1 + 1/ tan 20°)
Pagina 7
65.
A)
B)
C)
D)
Quanto vale 1000 x 10-3 ?
1
1000000
0
-1
66. Mettere in ordine crescente i valori dei seguenti angoli: = 37, 25°,
= 0,5 rad e
A)
B)
C)
D)
67. L’equazione 8x2-2 = 0 è:
A) pura, determinata ed ha soluzioni
B) pura, determinata ed ha soluzioni
e
e
C) l’equazione è pura, impossibile in R
D) l’equazione è spuria ed ha soluzioni
e
68. In un piano cartesiano ortogonale, la distanza tra i punti A(3, -2) e B(4, 1) è:
A)
B)
C)
D)
69. La soluzione della disequazione log2(x+3)>1 è:
A)
B)
C)
D)
x>-1
x>1
x>2
x> e
70. Il risultato di
è:
A)
B)
C)
D)
Pagina 8
= 37°15'30".
71. Gli studenti di una classe sono classificati secondo la loro età nell’istogramma in figura avente in ascissa l’età dello
studente e in ordinata il numero di studenti con quell’età. Scegliendo a caso uno studente della classe la probabilità di
prendere uno studente con un’età minore o uguale a 18 anni vale:
A)
B)
C)
D)
5/6
3/4
35/74
3/8
72. Sapendo che log10 36 = a, quanto vale log 10 6?
A)
B)
C)
D)
a/2
2a
a−2
a2
73. La retta rappresentata in figura ha coefficiente angolare:
A)
B)
C)
D)
m<0
m=1
m = -1
m>0
74. Su un retta sono disposti 3 punti F, G, H in ordine alfabetico. Il segmento FG misura 6 cm e il segmento GH misura
la metà della misura di FG. Sia poi M il punto medio di FG e N il punto medio di FH. Allora la misura di MN vale?
A) 1,5 cm
B) 3 cm
C) 4,5 cm
D) 2,25 cm
75. Quante diverse sequenze di 4 note può effettuare un musicista se vuole utilizzare esclusivamente re, mi, fa e sol di
una stessa ottava, senza ripetere una nota già suonata?
A) 24
B) 3
C) 6
D) 12
76. In un sistema di assi coordinati nel piano cartesiano ortogonale, se un punto P(x,y) diverso dall’origine appartiene
all’asse y, allora:
A) x=0 e y≠0
B) x=y
C) x=-y
D) x≠0 e y=0
Pagina 9
77. La soluzione dell’equazione log2x = - 2 è?
A)
B)
C)
D)
x=1/4
x=1/2
x=2
x=-1/4
78. Quale intervallo è rappresentato dal seguente grafico?
A)
B)
C)
D)
79.
A)
B)
C)
D)
-3 ≤ x < 5
-3 ≤ x ≤ 5
-3 ≤ x > 5
-3 < x < 5
Un numero aumentato dei suoi 2/7 dà come risultato 495. Qual è il numero?
385
636
110
55
80. Se
A)
B)
C)
D)
il valore dell'espressione
è
-6
0
-3
3
81. Quale delle seguenti relazioni è falsa?
A)
B)
C)
D)
FISICA
82. Una differenza di potenziale V applicata ai capi di una resistenza determina il passaggio di una corrente di intensità
I. Il valore della potenza dissipata nella resistenza è:
A) W = VI
B) W = V/I
C) W = I/V
D) W = V2/I
83. Quale quantità di calore si deve somministrare a una massa d'acqua m = 1Kg per riscaldarla da T1 = 20° a T2 = 80°
(si ricordi che 1 cal = 4,186J)?
A) 2,5 x 105J
B) 2,5 x 102J
C) 0,6 x 105J
D) 0,6 x 102J
Pagina 10
84.
A)
B)
C)
D)
Il moto della terra attorno al sole è approssimativamente:
ellittico con il sole al posto di uno dei fuochi dell'ellisse
ellittico con il sole al posto del centro dell'ellisse
circolare con il sole al centro della circonferenza
circolare con il sole leggeremente spostato verso il centro
85.
A)
B)
C)
D)
Un newton è equivalente a:
1 coulomb per volt diviso metro
1 coulomb per volt per metro
1 coulomb per volt
1 coulomb diviso volt diviso metro
86. Un cubetto di spigolo 1cm è fatto con legno di noce e viene messo in un recipiente pieno d'acqua. Sapendo che il
peso specifico del legno di noce e dell'acqua sono rispettivamente P NOCE = 800Kg/m3 e P ACQUA = 1000Kg/m3 quale è il
volume del cubetto che emerge fuori dall'acqua?
A) 0,2cm3
B) 0,25cm3
C) 1,2cm 3
D) 0,75cm3
87.
A)
B)
C)
D)
Cosa è la sublimazione di un solido?
il passaggio diretto allo stato gassoso
il passaggio dallo stato solido allo stato liquido
il passaggio allo stato liquido e la successiva evaporazione
il passaggio dallo stato gassoso allo stato solido
88. Un corpo di massa m viene portato su un pianeta la cui massa è pari a 1/4 della massa della Terra, e il cui raggio è
pari a 1/8 di quello della Terra. Il peso del corpo sul nuovo pianeta:
A) vale 16 volte quello sulla Terra
B) vale 4 volte quello sulla Terra
C) vale 1/4 di quello sulla Terra
D) vale 1/16 di quello sulla Terra
89. Due pendoli ideali hanno fili (inestensibili di massa nulla ) di lunghezze L1 e L2 e masse (puntiformi) pari a m1 e m2
rispettivamente. Sapendo che i periodi delle loro oscillazioni libere per piccole variazioni angolari sono uguali, è corretto
affermare che:
A) L1 = L 2
B) L1/L2 = m 1/m2
C) L1/L2 = m 2/m1
D) (L1/L2) 2 = m2/m1
90.
A)
B)
C)
D)
Nel Sistema Internazionale, la carica elettrica si misura in:
coulomb
ampère
volt
ohm
91. Supponendo che la velocità del suono nell’aria sia di 300 m/s, quanto vale la stessa velocità espressa in chilometri
orari?
A) 1, 080 × 103
B) 1, 080 × 104
C) 1, 080 × 10−4
D) 1, 080 × 10−3
Pagina 11
92. Qual è l’unità di misura del coefficiente di dilatazione lineare dei solidi?
A)
B)
C)
D)
K-1
K
K/m
m/K
93. Attraverso un circuito composto da due resistenze R1 ed R2 connesse in serie scorre una corrente di intensità I. La
differenza di potenziale ai capi del circuito è pari a:
A) V = (R 1 + R2)I
B) V = (R 1 - R2)I
C) V = (R1 + R2)I/2
D) V = IR 1R2/(R 1 + R2)
94.
A)
B)
C)
D)
Da quale proprietà dell’onda sonora dipende l’altezza di un suono?
dalla frequenza dell’onda
dalla forma dell’onda
dalla velocità dell’onda
dalla lunghezza dell’onda
95. Attraverso un circuito composto da due resistenze rispettivamente di 10 Ω e 15 Ω connesse in serie scorre una
corrente di intensità 2 mA. La differenza di potenziale ai capi del circuito è:
A) V = 50 mV
B) V = 0,05 mV
C) V = 0,08 mV
D) V = 12 mV
96.
A)
B)
C)
D)
La forza elettromotrice si misura in:
volt
newton
dine
watt
97. Il seguente grafico mostra la velocità in funzione del tempo per un moto rettilineo. Dire quali delle seguenti
descrizioni del moto è corretta:
A)
B)
C)
D)
Moto uniforme e poi moto uniformemente accelerato con accelerazione positiva
Moto uniformemente accelerato con accelerazione positiva e poi moto uniforme
Moto uniformemente accelerato con accelerazione negativa e poi moto uniforme
Moto uniforme e poi moto uniformemente accelerato con accelerazione negativa
98. Nel piano T-S (entropia in ascissa e temperatura in ordinata) una trasformazione adiabatica reversibile si
rappresenta con:
A) un segmento verticale
B) un segmento orizzontale
C) un ramo di iperbole
D) una segmento inclinato di 45° rispetto all'ascissa
Pagina 12
99. Se un corpo di massa m viene portato su un pianeta sul quale l’accelerazione di gravità vale la metà rispetto a quella
misurata sulla Terra, la massa del corpo:
A) rimane invariata
B) dimezza
C) raddoppia
D) quadruplica
Pagina 13