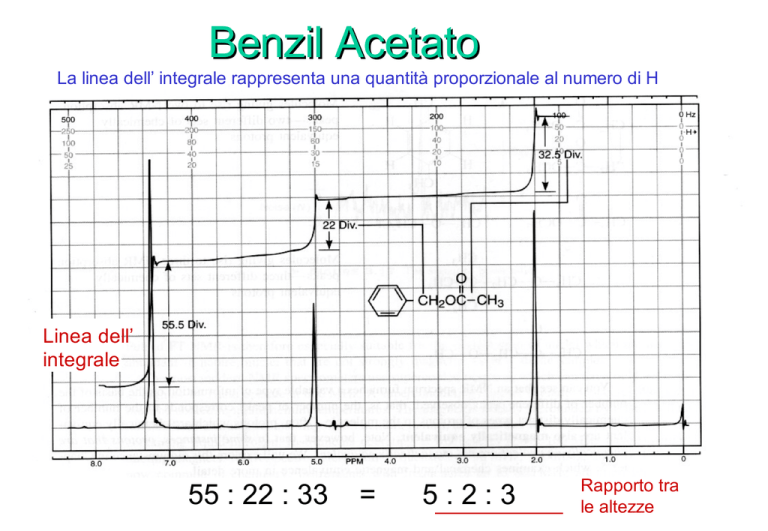
Benzil Acetato
La linea dell’ integrale rappresenta una quantità proporzionale al numero di H
Linea dell’
integrale
55 : 22 : 33
=
5:2:3
Rapporto tra
le altezze
Accoppiamento Spin-Spin
Accoppiamento SPIN-SPIN
Molto spesso un gruppo di idrogeni equivalenti risuona
come un multipletto piuttosto che come un singolo picco.
I multipletti sono classificati in:
Singoletto
Doppietto
Tripletto
Quartetto
Quintetto
Eptupletto
Ottupletto
Nonupletto
Questo fenomeno dipende dall’ interazione con gli
idrogeni vicini ed è detto SPIN-SPIN SPLITTING.
1,1,2-Tricloroetano
integrale = 2
Cl H
H
integrale = 1
tripletto
C
C
Cl H
doppietto
Cl
REGOLA n + 1
Il segnale di questo idrogeno
è diviso dai due idrogeni vicini
Questo idrogeno è
diviso dall’ idrogeno vicino
H
H
H
H
C
C
C
C
H
Due idrogeni vicini
n+1 = 3
tripletto
H
Un vicino
n+1 = 2
doppietto
MULTIPLETTI
singoletto
doppietto
tripletto
quartetto
quintetto
sestetto
eptupletto
Alcuni modelli comuni
Alcuni modelli di splitting
X CH CH Y
(x=y)
CH-CH2
X CH 2 CH 2 Y
(x=y)
CH-CH3
-CH2-CH3
CH3
CH
CH3
Gruppo tert-butile
CH3
H3C
C
CH3
Cl
9 equivalent protons = singlet
ECCEZIONI ALLA REGOLA N+1
IMPORTANTE!
1)
Protoni che sono equivalenti per simmetria
Normalmente non accoppiano
X CH 2 CH 2 Y
X CH CH Y
non accoppiano se x=y
Non c’è accoppiamento se x=y
2)
Protoni nello stesso gruppo
Di solito non accoppiano
H
C H
H
H
or
C
H
LA BASE DELLO
SPLITTING
COSA SUCCEDE
IL CHEMICAL SHIFT DI UN PROTONE HA E’
INFLUENZATO DALLO SPIN DEI SUOI VICINI
allineato con Bo
+1/2
50 % di
molecule
opposto a Bo
-1/2
H
HA
H
HA
C
C
C
C
Bo
Campi bassi
Vicini allineati
Campi alti
Vicini opposti
In ogni momento metà delle molecole in soluzione avrà
uno spin +1/2 e l’altra metà avrà spin -1/2.
50 % di
molecule
SISTEMA di SPIN
un vicino
n+1 = 2
doppietto
un vicino
n+1 = 2
doppietto
H
H
H
H
C
C
C
C
yellow spins
blue spins
La posizione di risonanza (splitting) per un certo idrogeno è
Influenzato dal possibile spin dei suoi vicini.
SISTEMA di SPIN
Due H vicini
n+1 = 3
tripletto
Un H vicino
n+1 = 2
doppietto
H
H
H
H
C
C
C
C
H
H
methine spins
methylene spins
SISTEMA di SPIN
3 H vicini
n+1 = 4
quartetto
H
H
C
C
H
H
2 H vicini
n+1 = 3
tripletto
H
metilene spins
metile spins
H
H
C
C
H
H
H
ALCUNI ESEMPI DI SPETTRI
ACCOPPIATI
Spettro NMR del Bromoetano
Br CH 2CH 3
SPETTRO NMR del 2-Nitropropano
H
CH 3
C
CH 3
+
N
O
O-
1:6:15:20:16:6:1
Nei multipletti superiori I picchi esterni
Sono bassi e spesso si perdono nella linea di base
Spettro NMR dell’ Acetaldeide
O
CH 3 C
offset = 2.0 ppm
H
Il gruppo propilico
CH3-CH2-CH2-X
Can you predict the splitting patterns for this compound?
Spettri NMR di Composti Carbonilici
• Anisotropia nei carbonlici composti
• L’ anisotropia descherma il legame C-H delle
aldeidi: 9-10 ppm
• L’ anisotropia descherma anche i gruppi
metilenici e metilici intorno al C=O: 2.0 - 2.5 ppm
• I gruppi metilenici direttamente legati all’
ossigeno risuonano intorno a 4.0 ppm
1
2-Butanone (Metil Etil Chetone)
60 MHz
O
CH 3 C
CH 2CH 3
2-butanone, 300 MHz
WWU Chemistry
2
Etil Acetato
Compare the methylene shift to that of Methyl Ethyl Ketone (previous slide).
O
CH3 C O
CH 2CH3
3
t-Butil Metil Chetone
(3,3-dimetil-2-butanone)
CH 3
O
CH 3
C
C
CH 3
CH 3
4
Feniletil Acetato
O
CH 2CH 2 O C CH 3
5
Etil Succinato
O
O
CH 3 CH 2 O C CH 2 CH 2 C O CH 2 CH 3
6
Acido α-Cloropropionico
O
CH 3
CH
Cl
C OH
Alcheni, Alchini e
Composti Aromatici
CHEMICAL SHIFTS
Alcheni e alchini
• Protoni vinilici risuonano tra
5 e 6.5 ppm (anisotropia)
• gruppi metilenici e metilici vicini ad un
doppio legame risuona a circa 1.5 - 2.0 ppm
• per alchini terminali, il protone risuona a
circa 2 ppm
IDROGENI BENZENECI
La corrente d’anello fa si che i protoni aromatici
cadano tra 7-8 ppm.
Protoni di un gruppo metilenico o metilico legato
all’ anello risuonano da
2 a 2.5 ppm.
NMR del Toluene
5
CH3
3
GLI EFFETTI DI UN SOSTITUENTEN CARBONILICO
Quando un gruppo carbonilico è legato all’anello i protoni
o- and p- sono deschermati dall’ anisotropia del C=O
O
H
C
R
R
H
H
C
O
H
Solo I due protoni in orto risentono di questo effetto.
Acetofenone (90 MHz)
O
C
CH3
H
H
2
3
deschermati
3
NMR dell’
1-iodo-4-metossibenzene
3
I
OCH 3
CHCl3 impurità
2
2
NMR dell’
1-bromo-4-etossibenzene
Br
OCH 2CH 3
4
2
3
NMR dell’
1-amino-4-etossibenzene
4
H 2N
OCH 2CH 3
2
2
3
NMR del p-Xilene
(1,4-dimetilbenzene)
6
CH 3
4
CH 3
Protoni Ossidrilici e Aminici
Protoni ossidrilici e aminici
Protoni ossidrilici e aminici possono risuonare
quasi ovunque nello spettro (legame H).
Questi segnali di solito sono più larghi degli altri
E possono essere facilmente riconosciuti.
I protoni degli acidi carbossilici risuonano a campi
bassi a 10-12 ppm.
Disaccopiamento spin-spin
Negli alcoli l’accoppiamento tra l’idrogeno O-H e quelli
Su atomi di carbonio adiacenti di solito non è visibile.
C
O
Questo è dovuto al rapido scambio tra
i protoni OH delle varie molecole di alcol
presenti in soluzione.
H
H
Solitamente il segnale OH è largo
In alcol molto puri comunque,
l’accoppiamento può avvenire.
NMR dell’ Etanolo
CH 3 CH 2 OH
3
2
1
RIASSUNTO
Calcolo Grado di Insaturazione
Definizione: n° totale di anelli e legami π presenti
nella molecola.
Si ottiene confrontando il n° di H del composto
di riferimento (saturo con stesso numero di atomi di C):
CnH2n + 2
Grado di insaturazione: (Hrif – Hx)/2
9) Per ogni elemento VII gruppo (F, Cl, Br, I) - 1 H
10)Per ogni elemento VI gruppo (O, S, Se) 0
11)Per ogni elemento V gruppo (N, P, As) + 1 H
DALLO SPETTRO NMR
ALLA STRUTTURA
1. Il grado di insaturazione ci dice quanti anelli o
legami π ci sono nella molecola
2. Il numero di segnali indica il numero minimo di H
non equivalenti
3. L’integrale indica quanti sono gli idrogeni nella
molecola che partecipano a quel segnale.
4. Il chemical shift (d, in ppm) da l’indicazione del
tipo di idrogeni che generano il picco
(alcani, alcheni, benzene, aldeide, etc.)
5. Spin-spin splitting indica il numero di idrogeni sul C
adiacente