Elettrofisiologia del cuore
Meteor
Cellule differenti: Potenziali d’azione
differenti
Quattro importanti caratteristiche elettriche dei
potenziali d’azione cardiaci
Depolarizzazione spontanea (potenz. pacemaker)
Innervazione neuronale non richiesta
Propagazione tra le cellule
Sincizio elettricamente accoppiato
Assicura un’attività ritmica continua
Fase di plateau lunga nei miociti (~200ms)
Assicura una forte contrazione
Periodo di refrattarietà lungo nei miociti
Previene la sommazione di scosse muscolari semplici
Obiettivi
comprendere:
La specializzazione delle cellule cardiache
Il flusso di informazione elettrica nel cuore
Le basi ioniche del potenziale d’azione in
queste cellule specializzate
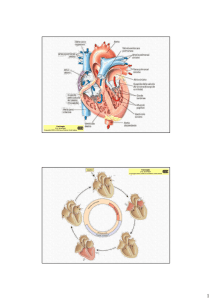
Organizzazione multi-cellulare
= Giunzioni gap
Flusso dell’attività elettrica
cardiaca (potenziali d’azione)
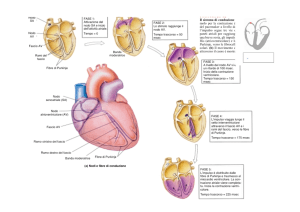
Nodo SA
Andatura (stabilisce il ritmo cardiaco)
Muscolo atriale
Contrazione
Nodo SA
Nodo AV
Nodo AV
Ritardo
Fascio AV
Fibre del Purkinje
Rapide, distribuite uniformemente
Muscolo ventricol. Contrazione
Fibre di
Purkinje
Potenziale d’azione del nodo SA
È un potenziale d’azione
al Ca2+!!!!!
Potenziale di membr.
del nodo SA (mV)
Nodo SA
Depolarizzazione lenta e
Ca+2-dipendente
0
Ripolarizzazione
K+-dipendente
-50
200 msec
Non c’è potenziale di riposo
(prepotenziale)
Potenziale d’azione del nodo AV
È un potenziale d’azione
al Ca2+!!!!!
Nodo AV
Potenziale di membr.
del nodo AV (mV)
0
nodo SA
-50
nodo AV
200 msec
Simile al nodo SA
Segnaritmo latente
Depolarizzazione lenta,
Ca+2-dipendente
Conduzione lenta (ritardo)
Ripolarizzazione K+dipendente
Potenziale d’azione del muscolo atriale
Potenziale di membr.
del muscolo atriale (mV)
Muscol. atriale
0
-50
200 msec
Potenziale di riposo (-80 / -90 mV)
Attivazione rapida, Na+-dipendente
Spalla Ca2+-dipendente
Ripolarizzazione K+-dipendente
Contrazione e conduzione
Potenziale di membr.
delle fibre del Purkinje (mV)
Potenziale d’azione delle fibre del
Purkinje
Fibre di
Purkinje
0
-50
200 msec
Un altro pacemaker latente
Attivazione rapida, Na+-dipendente
Plateau Ca2+-dipendente
Ripolarizzazione K+-dipendente
Conduzione rapida
PdA del muscolo ventricolare
Potenziale di membr.
del muscolo ventricolare (mV)
Muscolatura
ventricloare
0
-50
200 msec
Potenziale di riposo (-80 / -90 mV)
Attivazione rapida, Na+-dipendente
Plateau Ca2+-dipendente
Ripolarizzazione K+-dipendente
Contrazione
Il lunghissimo “plateau” del pda dei miociti ventricolari è funzionalmente importante per
due buone ragioni:
a) il Ca2+ che entra attraverso i canali (L) della membrana plasmatica attiverà il “Caactivated Ca-release” del reticolo sarcoplasmatico, quindi la contrazione del cuore;
b) mantenendo depolarizzata la membrana, la
rende ineccitabile per tutta la sua durata (perché
mantiene inattivati i canali del Na+).
In altre parole: durante il plateau, il cuore si
trova in uno stato di refrattarietà assoluta,
quindi per tutta la durata della contrazione (della
sistole) non può essere nuovamente eccitato.
Abbiamo visto che la situazione è molto
diversa da quella che si ha nel muscolo
scheletrico, nel quale la refrattarietà assoluta
termina ancor prima che inizi la contrazione.
Potenziale di membrana
del muscolo ventricolare (mV)
Canali ionici nei muscoli ventricolare e atriale
Canali del K (KA)
Canali del K “anomalus rectifier”
0
Canali del Na
voltaggio-dip.
Canali del K “delayed rectifier”
Canali del Ca
voltaggio-dip.
L-type
-50
IK1
200 msec
Nota: Nel muscolo atriale il plateau è meno pronunciato dovuto ad un
diverso equilibrio tra I canali del Ca e del K voltaggio-dipendenti
Canali del Na cardiaci
Quasi identici ai canali del Na dei neuroni
(strutturalmente e funzionalmente)
Apertura molto rapida (come nei neuroni)
Inattivano (come nei neuroni)
NON sono sensibili alla Tetrodotoxin
Espressi solo in tessuto non nodale
Responsabili dell’innesco e della
propagazione del potenziale d’azione in
cellule non nodali
Canali del Ca Cardiaci
Cellule nodali (SA-AV): principalmente T-type
– innesco e propagazione dei potenziali d’azione -LENTO
Cellule non nodali: L-type
– controllano la durata del potenziale d’azione
– contrazione
Canali pacemaker “f”
Appartengono alla classe dei canali HCN: “canali cationici attivati
dall’iperpolarizzazione”.
I canali del Ca2+ delle cellule nodali
sostengono il pda, ma per essere
attivati
necessitano
di
una
depolarizzazione della membrana.
Questa, nelle cellule autoritmiche,
avviene “spontaneamente” e si chiama
prepotenziale.
Nel tessuto pacemaker, il prepotenziale
(e con esso l’automatismo cardiaco) è
generato dall’apertura dei canali-f .
I canali “f” vengono attivati alla fine di ogni pda, quando la membrana si
iperpolarizza. La loro apertura genera una corrente cationica entrante che,
depolarizzando la membrana, produce il prepotenziale, e quindi innesca il pda
successivo.
Modulazione dei Canali “f”
Di grande importanza è la “modulazione” (variazione della sensibilità al voltaggio) dei
canali f operata dall’orto- e dal para-simpatico tramite i rispettivi neurotrasmettitori
<noradrenalina(+adrenalina) ed acetilcolina>.
Modulando i canali f, l’orto- ed il para-simpatico regolano la frequenza cardiaca (!!),
come se fossero l’uno l’acceleratore e l’altro il freno di un’automobile.
Questi neurotrasmettitori agiscono su recettori accoppiati a proteine-G e fanno
rispettivamente aumentare e diminuire il livello intracellulatre di AMPc.
L’elettrocardiogramma
Jimmie
Dimostrazione di Waller
alla Royal Society 1909
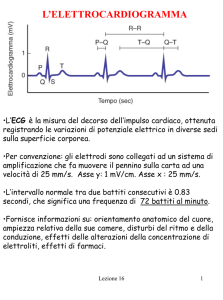
L’Elettrocardiogramma (ECG)
L’onda P è dovuta alla depolarizzazione del nodo SA.
Il complesso QRS è dovuto alla depolarizzazione ventricolare.
L’onda T corrisponde alla ripolarizzazione ventricolare.
Relazione tra sequenza dei potenziali
d’azione nel cuore ed elettrocardiogramma
P ≡ depolarizzazione del nodo SA.
approx. 0.44 s
0.12-0.2 s
R
ECG
T
P
Q S
QRS ≡ depolarizzazione ventricolare.
T ≡ ripolarizzazione ventricolare.
SA
Atrii
AV
Nodo SA
Nodo AV
Purkinje
Ventricoli
Fascio AV
Fibre di
Purkinje
Eccitamento cardiaco correlato
all’elettrocardiogramma
Il nodo SA genera
un impulso:
incomincia
l’eccitamento atriale
Nodo SA
Impulso ritardato al
nodo AV onda P
finisce
Nodo AV
L’eccitamento
ventricolare è
completo
complesso
QRS
L’impulso passa
all’apice del cuore:
incomincia
l’eccitamento
ventricolare
Fibre del
Purkinje
Rami del
fascio di His
R
P
Q
Q S
L’onda T, che fa seguito all’onda S, corrisponde alla ripolarizzazione ventricolare
Intervalli dell’ECG normale
L’intervallo P-R è normalmente
0.12-0.20 sec, gran parte di
questo tempo è il ritardo con cui
l’eccitamento arriva al nodo AV.
Il complesso QRS dura
normalmente meno di 0.10 sec.
Un aumento nella durata del
complesso è una caratteristica
di difetti a livello delle
ramificazioni del fascio o delle
fibre del Purkinje.
L’intervallo Q-T varia in maniera
inversamente proporzionale alla
velocità cardiaca.
Aritmie cardiache
La sindrome denominata “Long QT” è una malattia definita da
un prolungamento dell’intervallo QT dell’elettrocardiogramma.
Elettrocardiogramma: l’intervallo QT
approx. 0.44 s
R
T
P
ECG
Q S
Ventricoli
intervallo QT
L’intervallo QT inizia con il complesso QRS e termina alla fine dell’onda T. Rappresenta
il periodo temporale tra la depolarizzazione (contrazione) ventricolare e la
ripolarizzazione (rilassamento).
Tutte le forme della sindrome del “long QT” coinvolgono una ripolarizzazione anormale
del cuore.
Caratteristiche generali
(1)Malattia genetica, frequentemente autosomiale dominante.
(2)Predisposizione ad aritmie pericolose per la vita.
(3)Appare tra i 5 e i 15 anni di età.
(4)Manifestazioni iniziali sono sincope (perdita temporanea di
coscienza dovuta ad ischemia cerebrale), attacco
apoplettico, arresto cardiaco o morte improvvisa.
(5)Trattabile con antagonisti β-adrenergici, pacemaker
cardiaci e denervazione delle terminazioni ortosimpatiche
sinistre del cuore.
Genetica della sindrome Long QT
Mutazioni nei geni che codificano i canali al K+ cardiaci sono le più comuni cause
della sindrome Long QT. Difetti nei canali al Na+ cardiaci possono pure essere
causa di questa malattia.
Denominazione
gene
Proteina codificata, funzione
LQT1
KCNQ1
Canale del K+ (Ks - slow)
LQT2
KCNH2
Canale del K+ (Kr - rapid)
LQT3
SCNSA
Canale del Na+ Volt. Dip.
Biologia molecolare della sindrome Long QT
Mutazioni nei canali del K+ sono state identificate un po’ in tutta la molecola. Tuttavia il
numero più elevato di mutazioni è stato riscontrato nelle eliche S3 e S6 e nell’ansa
S5/S6 che forma il poro. Qui sotto sono riportate le mutazioni più frequenti:
gene
proteina
mutazione
KCNQ
KvLQT1 Gly168Arg
Gly314Ser
Ala341Glu
Ala341Val
S2
Poro
S6
S6
KCNH
HERG
S6
S5
poro
Ala561Thr
Ala561Val
Ala614Val
Localizz.
FINE
Potenziale di membrana
del muscolo ventricolare (mV)
Canali ionici nel muscolo ventricolare
Canali del K inattivanti (ITO)
Canali del K “ultra-rapidi” (IKur)
“Canali del K “rapidi” (IKr)
0
Canali del Na
voltaggio-dip.
Canali del K “lenti” (IKs)
Canali del Ca
voltaggio-dip.
-50
IK1
200 msec
Canali ionici nel muscolo ventricolare
Corrente
Geni
Corrente di Na
SCNA5
Corrente di Ca
CACNL1A1
IK1
Kir2.1 (KCNJ2)
ITO
Kv4.3 (KCND3)
IKur
Kv1.5 (KCNA5)
IKr
HERG (KCNH2) + miRP1 (KCNE2)
IKs
KvLQT1 (KCNQ1) + minK (KCNE1)
Canali del K inattivanti (ITO)
Canali del K “ultra-rapidi” (IKur)
Canali del K “rapidi” (IKr)
Canali del K “lenti” (I Ks)
Canali del K
cardiaci
voltaggiodipendenti
Tutti strutturalmente simili ai canale del K dei neuroni
ITO è un canale del K inattivante - rapida ripolarizzazione
al plateau
IKur funziona come il canale del K neuronale – compete
con il Ca per mantenere il plateau
IKr, IKs strutturalmente e funzionalmente complessi; IKr
aumenta all’aumentare della concentrazione esterna di K
Struttura dell’Inward Rectifier (IRK1)
Nota: non ha un
“sensore del voltaggio”
Regione P
Fluido
extracellulare
M1
M2
membrane
Interno
H2N
HO2C
Corrente
Canali Inward Rectifier
0
-120
-100
-80
-60
-40
-20
Vm (mV)
0
20
40
60
Ruolo dell’Inward Rectifier
Espresso primariamente nel tessuto non nodale
Stabilisce il potenziale di riposo nei muscoli
atriali e ventricolari
Contribuisce all’ultima fase della ripolarizzatione
del potenziale d’azione in cellule non nodali
Canali ionici nelle cellule nodali
Corrente
Corrente di Ca
Correnti di K
If
(corrente pacemaker)
Gene
CACNL1A1
Various
HCN4
Canali del Ca della muscolatura cardiaca
L-type (sensibili alle di-idropiridine)
Strutturalmente abbastanza simili ai canali del Na
Somiglianza funzionale con i canali del Na:
la depolarizzazione apre i canali del Ca
Differenze funzionali con i canali del Na:
Apertura più lenta
Inattivazione molto lenta e incompleta
Generano un flusso di corrente molto minore
Canali ionici nel cuore
Ruolo fisiologico
Obiettivi da comprendere
Le più importanti proprietà dei canali ionici
nelle diverse regioni del cuore
Il ruolo di questi canali nel modellare la forma
dei potenziali d’azione in regioni diverse del
cuore
Potenziale di membr. del nodo SA (mV)
Canali ionici nelle cellule nodali
Canali del Ca+2 volt.-dip. (T)
Canali del K+ volt.dip.
0
-50
Canali If (pacemaker)
200 msec
Canali ionici nelle fibre del Purkinje
Gli stessi delle cellule ventricolari
Più una quantità molto piccola di canali If
(pacemaker)
Farmaci antiarritmici
Classe I: Azione di anestetici locali, riducendo la
corrente di Na
Classe III: prolungamento del potenziale d’azione
– di solito inibendo canali del K cardiaci
Quinidina
Lidocaina
Amiodarone
Classe IV – Antagonisti del canale del Ca
Verapamil
Domande a cui occorre rispondere quando si analizza un ECG:
Qual è la frequenza? È compresa nell’ambito normale di 60-10 battiti al
minuto?
Il ritmo è regolare?
Tutte le normali onde dell’ECG sono chiaramente identificabili?
C’è un complesso QRS per ogni onda P? in caso affermativo il segmednto PR è di lunghezza costante?
Se non c’è un complesso QRS per ogni onda P, contate la frequenza cardiaca
utilizzando le onde P, poi utilizzando le onde R. la frequenza è la stessa?
Quale onda corrisponde alla pulsazione avvertita al polso?