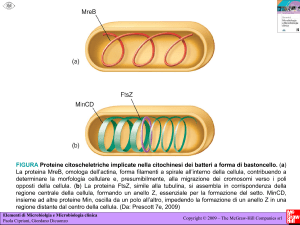
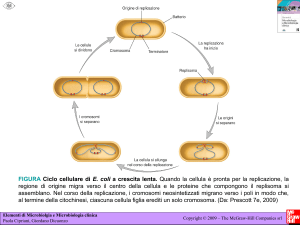
Malattie del sangue
Prof.Leone
13-03-2007
ore11,00-13,00
LA CELLULA STAMINALE EMOPOIETICA
Un tempo quando si parlava di cellula staminale (CS) ci si riferiva essenzialmente alla CS emopoietica,oggi
invece si parla di CS per tutti gli organi, gli apparati e addirittura per il tessuto nervoso, in particolare delle CS a
livello pontino.
C’è una grossa diatriba, che coinvolge il mondo cattolico, che distingue CS embrionarie e CS dell’adulto (
anche le CS del cordone ombelicale sono CS dell’adulto).
Una CS è una cellula in grado di riprodursi uguale a se stessa per un lungo periodo di tempo e nel caso
della CS dell’adulto per tutta la vita (è il caso delle CS emopoietiche, che continuano sempre a riprodursi e a
differenziarsi ).Ci sono poi le CS embrionarie che devono avere la capacità di riprodursi, autorinnovarsi e di
differenziarsi: possono essere totipotenti (se sono in grado di dare vita a tutte le cellule dell’organismo) o
multipotenti o unipotenti.
Le CS dell’adulto riescono a proliferare per 4-6 sett in una coltura liquida,le CS che è la migliore per le CS,
dopodichè perdono la loro spinta e cessano di proliferare.
La storia delle CS è relativamente recente: nel 1998 un ricercatore dell’università americana del Wisconsin
isolò le cellule dalla parte interna della blastocisti ( embrione a 4-5 gg) e sviluppò la prima CS embrionale. Si
tratta di cellule capaci di ricostituire tessuti mesodermici, ectodermici ed endotermici. Queste cellule si
prelevano, si mettono in piastre di Petri,che contengono il cosiddetto field layer (spesso sono fibroblasti che
fanno da supporto nutritivo) proliferano e a seconda del condizionamento cui sono sottoposte sono in grado di
differenziarsi in tutti i tessuti .
Le CS embrionarie non sono di per sé degli embrioni, ma hanno il potenziale di rigenerare tanti tipi di cellule.
Si tratta pur sempre di un potenziale ed infatti attualmente non esistono malattie che abbiano avuto giovamento
da CS embrionarie ( non c’è un cuore, un pancreas ricostituiti da CS embrionarie).
Le CS embrionarie e dell’adulto hanno proprietà immunogenetiche, da qui l’utilità dei trapianti autologhi, del
“mettersi da parte delle CS”.
L’interesse per le CS è in assoluto più forte in campo ematologico che in altri ambiti.
La CS dell’adulto è una cellula indifferenziata che si trova in tessuti differenziati; nella passata decade si
credeva che alcuni tessuti fossero perenni, oggi invece si sa che esistono CS anche per il tessuto nervoso
(perenne per antonomasia) come nella maggior parte degli altri tessuti.
Una caratteristica delle CS di cui si è parlato di recente (per la quale è da verificarsi l’attendibilita’ delle
ricerche) è la “plasticità” , cioè la capacità di una CS di un tessuto di diventare CS di un altro tessuto di
qualsiasi derivazione embriogenetica ( qualsiasi dei tre foglietti embrionari) e questo è soprattutto valido per le
CS emopoietiche che si ritrovano nel midollo, ma anche nel sangue periferico. CS emopoietiche possono
differenziarsi in vitro, in particolari condizioni, in neuroni,astrociti, cellule cardiache, epatociti, etc.; ma nel
midollo abbiamo anche cellule di supporto e si è visto che anche tali cellule stremali sono capaci di
differenziarsi in tessuti diversi dallo stroma; negli animali poi si è visto che cellule del cervello possono a loro
volta dare vita a cellule ematiche.
Tale caratteristica indurrebbe a disinteressarsi delle CS embrionarie, essendo comunque quelle dell’adulto in
grado di riprodurre ogni tessuto; il problema però è la relativa scarsità delle CS dell’adulto. Potrei espanderle in
coltura liquida, ma la proliferazione cellulare ha una durata limitata perché, quando prolifera, la CS tende a
differenziarsi e a perdere la sua staminalità, pertanto la vera CS non riusciamo ad espanderla.
Blood vessels
Liver
BLOOD
Muscle
Astrocytes, neurons, oligodendrocytes
Neural stem cells
All germ layers in chimeric embryos
Il sangue si troverebbe al centro di un sistema di riproduzione di tessuti diversi.
Definiamo le diverse caratteristiche dei due tipi ti CS, per comprenderne anche le diverse potenzialità
terapeutiche:
CS embrionarie
CS dell’adulto
Capacità proliferativa
+++
+
Capacità differenziativa
Totipotenti
Pluripotenti
Teratogenità
++
-
Immunogenicità
Presente
Presente
Un dato importante da tenere in considerazione è la teratogenità, propria di ogni manipolazione genetica.
Le CS emopoietiche sono state le più studiate sia sul piano emopoietico sia su quello immunologico (basti
pensare ai problemi di un pz trapiantato di midollo, in cui tutti gli organi potrebbero essere attaccati dal SI del
donatore trapiantato nel ricevente;è indispensabile pertanto la compatibilità HLA, mentre può esservi
incompatibilità ABO essendo il gruppo sanguigno ridefinito dalle cellule del sangue donato (??? NdR)).
Abbiamo quindi una CS emopoietica multipotente dalla quale deriveranno tutte le cellule del sangue: essa si
dividerà attraverso successivi steps in una linea mieloide ( da cui origineranno eritrociti, piastrine, granulociti e
monociti) ed una linea linfoide (per le cellule T e B).In realtà alcuni recenti studi hanno dimostrato che tale
distinzione non può essere assoluta, come spiegheremo dopo.
Inoltre dalla cellula emopoietica derivano anche cellule del reticolo, cellule di Langherans della cute, cellule del
sistema dei fagociti-mononucleati, che hanno tutte derivazione midollare.
Esistono dogmi che sanciscono che una volta differenziatasi una CS adulta non può più tornare indietro ed
andare in diverse direzioni differenziative; inoltre distinguono la CS in totipotente, pluripotente, multipotente e
differenziata.
Due problemi riguardano le CS: l’eterogeneità ( cioè la presenza in ogni tessuto di determinate CS, che siano le
più adatte a riprodurre il tessuto stesso di provenienza) e la plasticità (ad es. cellule endoteliali che proliferano
in periferia in un vaso derivano evidentemente da elementi midollari e questo può essere accettato data la
somiglianza delle cellule, infatti si parla di EMOANGIOBLASTO, che può dar vita sia all’andotelio sia a
cellule del sangue ; in altri casi si confuta tale teoria della plasticità, ritenendo ad es. che le cellule del
miocardio possano rigenerarsi da cellule staminali presenti in loco piuttosto che da cellule provenienti dal
midollo).
In realtà plurime riviste scientifiche sostengono la capacità della CS del midollo osseo di dare origine a:
Endotelio (1997)
Mioblasti (1998)
Cellule neuroectodermiche (1999)
Cardiomiociti (1999)
Epatociti (2000)
Epitelio polmonare, intestinale, cutaneo
Oociti
Consideriamo ora la comparsa di CS emopoietiche durante la vita fetale, basandoci su studi eseguiti
confrontando lo sviluppo del topo e quello umano (11 gg di gestazione del topo corrispondono a 5 sett
dell’uomo). A questa età le sedi interessate dall’emopoiesi sono il sacco vitellino, l’aorta dorsale, i vasi
ombelicali e i vasi a livello fetale; importanza della placenta, importanza del sacco vitellino, importanza del
fegato fetale e della regione AGM ( Aorta, Gonadi, Mesonefro).
Si è studiato in modelli animali il progressivo spostamento delle sedi di sviluppo delle cellule emopoietiche:
Specificazione
Mesoderma
Emergenza
Pre-HSC
A livello della
cresta
AGM
Maturazione
HSC
Espansione
HSC
proliferanti
fegato
Quiescenza
HSC
non
proliferanti
midollo
Tolte dagli specifici ambienti in cui si trovano in ogni fase dello sviluppo fetale, tali CS perdono le loro capacità
e ad es. introdotte in un topo irradiato non riescono a ricostituire, se non in particolari condizioni, l’emopoiesi.
Una osservazione importante è che le CS emopoietiche presenti nel midollo sono quiescenti, mentre quelle del
fegato fetale hanno elevata proliferazione.
Rivediamo le sedi dell’emopoiesi:
placenta
CRESTA
AGM
- - - - ?- - - - →
fegato fetale
MIDOLLO
Sacco vitellino
Le CS non hanno caratteristiche morfologiche specifiche; per distinguere CS emopoietiche si possono fare
prove in vitro o in vivo (sugli animali). Per le prove in vivo si prendono CS di un topo ad 11 gg e le si mettono
in un topo adulto irradiato in cui avremo, nel caso in cui si tratti di HSC (cellule staminali emopoietiche),
un’emopoiesi persistente e normale. Se le CS sono prelevate prima, esse non attecchiranno nel ricevente se non
condizionato in un determinato modo; ciò perché sono necessarie proteine di adesione specifiche che vadano ad
aderire nei tessuti giusti.
La controprova della staminalità di una CS, della sua capacità di autoriprodursi è il trapianto.
Altri metodi per identificare le HSC:
Caratteristiche immunologiche, identificazione di Ag di superficie:
1. CD45 (ma esso è presente nell’adulto e non nella placenta o nel sacco vitellino)
2. caderina
3. CD34 (il più importante, almeno nell’uomo, perché consentiva l’attecchimento delle CS trapiantate
nella scimmia); tuttavia nemmeno questo Ag identifica la CS che può non avere CD34.
-LTC (colture a lungo termine): colture liquide
-saggio di colonie: dopo 7-14 gg dall’allestimento vedo colonie di cellule diverse a seconda delle
cellule che avevo usato: posso avere solo cellule eritroidi, CFU-GEMM ( Unità Formante Colonie di
Granulociti-Eritrociti-Monociti-Megacariociti, cellula comune per macrofagi e granulociti), CFU-GM
(per Granulociti e Monociti), BFU-E (Burst Forming Unit- Eritroidi, primo stadio di differenziazione,
dopo 7 gg; CFU-E è uno stadio successivo, dopo 14gg).
In un numero di Nature del 2005 un gruppo di ricercatori ha dimostrato che esiste una cellula detta LMPP
(Lymphoid primed multipotential progenitors) che ha perso la capacità di produrre cellule eritroidi e
megacariociti, ma pur producendo essa linfociti è ancora in grado di originare granulociti e macrofagi: si può
arrivare quindi a macrofagi e granulociti attraverso 2 strade diverse ( la strada classica, a partenza dalla cellula
mieloide e questa nuova via possibile) .
La differenziazione è ovviamente un processo stocastico in cui però posso indirizzare lo sviluppo delle cellule
attraverso l’azione di determinati fattori di crescita, che vengono usati anche in terapia (CGSF, EPO,
trombopoietina, GM.CSF, G-CSF): essi indirizzano una cellula, che ha già una certa predisposizione casuale,
più in una direzione che in un’altra. Il monocita è la cellula che secerne più fattori di crescita. I fattori di crescita
sono molteplici, ridondanti e molti possono essere sostituiti l’uno dall’altro, mentre altri ,come il CGSF ,se
assenti non permettono sopravvivenza.L’importanza dei fattori fattori di crescita è dimostrata dai topi knocked
out. I grow factors agiscono attraverso fattori di trascrizione ( le cui alterazioni possono provocare malattie
linfoproliferative).Ad esempio mutazioni di AML1 possono dare la leucemia mieloide acuta, GATA1 è
coinvolto nelle leucemie familiari.
A Boston hanno dimostrato l’importanza di :
-PU.1: agisce nella linfopoiesi ed emopoiesi
-C/EBPα
la cui up o down-regolation dirige una cellula verso una parte o un’altra.
Ovviamente questi fattori agiscono a livello dei recettori di superficie:
PU.1 e c-Jun agiscono sul precursore mieloide modulando l’espressione dei recettori per il GM-CSF;
GATA1 agisce sui precursori eritroidi modulando l’espressione del recettore dell’EPO.
Recettori per EPO sono presenti sulle BFU-E e non sulle CS. Nelle policitemie si può avere
ipersensibilità del recettore dell’EPO; nelle forme acquisite il recettore si è sganciato dall’EPO, per
mutazione di Jek2, quindi non si ha più bisogno o servono quantità minime di EPO.
Schemi riassuntivi:
HSC (ha bisogno di un certo milieu per svilupparsi e
differenziare)
Emoangioblasto
Cellula endoteliale
Midollo osseo dell’adulto→
Mesenchimali → Osso, cartilagine, adipociti
Cellula progenitrice multipotente dell’adulto (non accreditata da tutti la sua
esistenza)
HSC nel midollo sono molto poche: le CD34 + sono l’1%, in periferia saranno l’1 per 1000;
le CS vere sono almeno 1 o 2 log in meno.
Fondamentale che le cellule immature siano solo nel midollo (assioma):non devono essere presenti in circolo (
se non in piccolissime percentuali).
La CS viene commissionata e man mano che evolve acquisisce particolari Ag di superficie:
-GR→ Hb, CD61, glicoforina
-piastrine→ fvW,CD41
-granulociti→ CD33
-B cell→ CD19
-T cell→ CD3, Cd4, CD8.
Le cellule mieloidi non ricircolano (salvo probabilmente i monociti), le cellule linfoidi circolano tra sangue e
organi linfoidi.
Esistono CS, cellule progenitrici, cellule precursori e cellule mature:
CS: morfologicamente non si distingue, ha CD34;
Cellule progenitrici: una certa differenziazione in senso linfoide o mieloide è presente, hanno ancora
CD34;
CONCETTO DI STAMINALITA’
-Capacità di autorinnovarsi
-lunga sopravvivenza
-ampio repertorio differenzietivo
-capacità differenziativi
CONCETTO DI PROGENITORI (CFU-GEMM, BFU-E :non hanno ancora individualità biologica, hanno
ancora CD34)
-sopravvivenza limitata
-modesto autorinnovamento
-amplificazione ed intensa capacità proliferativa in risposta allo stress
-differenziamento verso un repertorio limitato di linee maturative.
POTENZIALI IMPIEGHI CLINICI DELLE CS
Generazione ex vivo di tessuti emopoietici
Veicoli per il trasferimento genico
Trapianto allogenico ( leucemia acuta, cronica, aplasia midollare, immunodeficienza,tesaurismosi,
talassemia)
Trapianto autologo (mielomi, linfomi, K ovario, mammario): crioconservazione, trattamento
antiblastico sovramassimale ( non si guarisce direttamente il carcinoma, ma ho la possibilità di usare
dosi più alte); vi sono stati però trials non positivi o addirittura negativi pertanto si procede ora con
immunoterapia.
IRMA…
Unico rapido saluto al Boss e “grazie”…(credo tu possa immaginare il perché)…