Principali sistemi sperimentali e tecniche di
microscopia integrata alla biologia
molecolare e alla biochimica per lo studio
del differenziamento cellulare delle piante
Microscopia ottica
Ad oggi, il MO composto è lo strumento di indagine
microscopica più utilizzato nei laboratori di ricerca
biologica
Ingrandimento e risoluzione adatti allo studio di cellule eucariotiche
Microscopia ottica
La cellula vegetale ha, generalmente, dimensioni molto
superiori rispetto ad una cellula animale
Microscopia ottica
Le dimesioni della cellula vegetale vanno da alcune
decine ad alcune centinaia di μm
Microscopia ottica
Il microscopio ottico composto a luce trasmessa in campo chiaro
Microscopia ottica
Nelle cellule vegetali, il differenziamento cellulare si manifesta come
acquisizione di una forma definitiva, imposta dalla forma della parete
cellulare
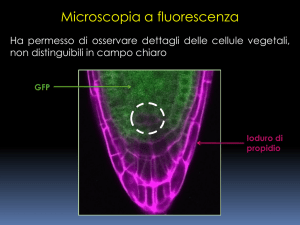
Microscopia a fluorescenza
ha permesso di osservare dettagli delle cellule vegetali,
non distinguibili in campo chiaro
GFP
Ioduro di
propidio
Il microscopio a fluorescenza (MF)
Il MF è un microscopio ottico in grado di generare una radiazione
luminosa monocromatica
Il microscopio a fluorescenza (MF)
Nel MF la luce proviene dall’obiettivo, poi colpisce il campione eccitando le
molecole fluorescenti. La fluorescenza emessa dal campione viene poi
raccolta, sempre dall’obiettivo: EPIFLUORESCENZA
Microscopio
ottico in
campo chiaro
Microscopio
ottico a
fluorescenza
Il termine fluorescenza
Deriva dal nome della fluorite (o fluoruro di calcio)
Luce bianca
UV
Molti altri composti organici e inorganici
emettere fluorescenza (fluorofori o fluorocromi)
possono
I fluorofori
I fluorofori, se esposti ad una radiazione di una
determinata lunghezza d’onda (radiazione incidente)
emettono luce di un’altra lunghezza d’onda (fluorescono)
UV
Red
radiazione
incidente
radiazione
emessa
Clorofilla
Struttura dei fluorofori
La capacità di fluorescere è legata alla struttura chimica
dei fluorofori, in particolare alla presenza di sistemi di
doppi legami coniugati
Meccanismo della fluorescenza
1) Assorbimento radiazione incidente → passaggio di un
elettrone π dallo stato fondamentale allo stato eccitato
2) Emissione fluorescenza →
stato fondamentale
Ritorno dell’elettrone allo
La radiazione emessa ha una lunghezza d’onda maggiore (energia
minore) rispetto alla radiazione incidente (parte dell’energia viene
dissipata come calore)
λemissione ≠ λeccitazione
Il fatto che la luce emessa abbia un colore diverso dalla
luce incidente permette di visualizzare i fluorofori con
molta chiarezza all’interno dei campioni vegetali
Nuclei rosa
UV
Pareti verdi
Spettri di assorbimento e di emissione
Se si espone un fluoroforo a una gamma di lunghezze
d’onda crescenti, si può costruire uno spettro di
assorbimento e uno spettro di emissione
DAPI
Picco di assorbimento
Picco di emissione
Picchi di assorbimento e di emissione
spettri di emissione
spettri di assorbimento
Ciascun fluoroforo è caratterizzato da un picco di
assorbimento (max eccitazione) e da un picco di
emissione (max emissione)
Autofluorescenza
Molte molecole presenti nella cellula vegetale sono
naturalmente fluorescenti, quindi per essere visualizzate
con il MF non richiedono trattamenti
Fluorescenza secondaria
Molte molecole presenti nella cellula vegetale non sono
naturalmente fluorescenti e per essere osservate in
fluorescenza devono essere rese fluorescenti:
1) Reagenti cito- e isto-chimici fluorescenti (es. DAPI e PI
per gli acidi nucleici)
2) Anticorpi coniugati con fluorofori (immunofluorescenza)
3) Proteine fluorescenti (es. GFP)
4) Sonde di altro tipo (es. sonde ad RNA o DNA usate
nell’ibridazione in situ)
1) Reagenti cito-isto-chimici fluorescenti
Il DAPI (4',6-diamidin-2-fenilindolo) è un agente
intercalante del DNA, si fissa alla doppia elica in
corrispondenza delle basi A e T
DAPI
1) Reagenti cito-isto-chimici fluorescenti
Lo ioduro di propidio si lega sia al DNA che al RNA
Ioduro di propidio
Per distinguere tra DNA o RNA occorre utilizzare delle
nucleasi (che digeriscano l’uno o l’altro)
1) Reagenti cito-isto-chimici non
fluorescenti
Esistono molti reagenti chimici non fluorescenti, che
impartscono colorazioni specifiche a diverse classi di
metaboliti
Dopo il trattamento istochimico, i campioni vegetali
vengono analizzati con microscopio ottico in campo
chiaro
2. immunofluorescenza
Anticorpi coniugati con fluorofori
Legame antigene-anticorpo
L’anticorpo riconosce e si lega a specifici elementi
strutturali dell’antigene dette epitopi
Antigene = proteina
d’interesse
Epitopo = sito di
legame dell’anticorpo
Anticorpo = immunoglobulina
Immunoglobuline
Nella tecnica dell’immunofluorescenza vengono utilizzate
principalmente le IgG
Marcatura dell’anticorpo
Il primo passo consiste nella marcatura dell'anticorpo con un
fluoroforo
fluoroforo
Catene pesanti
Il fluoroforo deve essere legato alla zona FC (effettrice) poiché,
se fosse legato alla zona FAB (di riconoscimento),
l'immunoglobulina perderebbe la sua funzionalità, cioè la
capacità di riconoscere lo specifico antigene
Anticorpi monoclonali e policlonali
MONOCLONALI
•Prodotti da un unico clone di linfociti B
•Si crea un ibrido tra linfociti B e cellule tumorali immortalizzate
•Gli anticorpi riconoscono un unico epitopo
•Rischio di falsi negativi per denaturazione del sito antigenico
Anticorpi monoclonali e policlonali
POLICLONALI
•Ottenuti dal sangue di un animale (capra, pecora, coniglio, topo)
•Diversi linfociti sono coinvolti, generando diverse Ig specifiche per i
diversi epitopi dell’antigene
•Rischio di falsi positivi per cross-reattività (stessi epitopi su diversi
antigeni)
Immunofluorescenza diretta e indiretta
DIRETTA:
La marcatura viene effettuata sullo stesso anticorpo che
riconosce l’antigene della molecola target
Molecola
target
Epitopo
Fluoroforo
Anticorpo primario
Immunofluorescenza diretta e indiretta
INDIRETTA:
• L’anticorpo primario non riconosce l'antigene.
• L’anticorpo secondario marcato, riconosce l’anticorpo
primario.
Anticorpo primario
Molecola
target
Anticorpo secondario
1°
Epitopo
Fluoroforo
Tale sistema è definito anticorpo anti-anticorpo
Immunofluorescenza diretta e indiretta
INDIRETTA:
Uno dei principali vantaggi è dato dall’amplificazione del
segnale: ad un singolo epitopo possono legarsi numerosi
anticorpi secondari
Anticorpo primario
Molecola
target
1°
Epitopo
Segnale
3) Proteine fluorescenti
GFP (Green Fluorescent Protein)
Aequorea victoria
GFP
Il gene codificante la GFP è stato sequenziato negli anni ‘60
Nel 2008 i suoi scopritori sono stati insigniti del Nobel per la chimica
Principali caratteristiche di GFP
Max abs
395 nm (UV)
27 Kda
238 aa
Max flu
505 nm (verde)
Max abs
475 nm (azzurro)
La porzione fluorescente della molecola è parte della
amminoacidica ed è posta al centro di una struttura cilindrica
sequenza
Applicazioni di GFP
Inizialmente il gene per GFP era utilizzata come reporter in esperimenti di
trasformazione genica
Attualmente è utilizzata principalmente per sviluppare costrutti genici in cui la
sequenza codificante per GFP è affiancata ad altre sequenze
Osservazioni su organismi vivi
Le proteine chimeriche fluorescenti sono fluorofori endogeni estremamente
selettivi, poichè legati alla proteina di interesse
Non essendo necessario alcun trattamento dei campioni, è possibile
osservare in fluorescenza anche organismi vivi
Altre proteine fluorescenti
GFP è il capostipite di un’ampia gamma di proteine fluorescenti
naturali:
• DsRed (da meduse del genere Discosoma)…………………….
semisintetiche:
• EGFP (Enhanced GFP)………………………………………………..
• CFP (Cyan Fluorescent Protein)……………………………….
• YFP (Yellow Fluorescent Protein)……………………………………
Attualmente si annoverano circa 60 proteine fluorescenti, ma
questo numero aumenterà notevolmente nei prossimi anni.
Colorazioni combinate
L’uso combinato di più colorazioni complementari, vale a dire che emettano
fluorescenza in zone diverse dello spettro, permette di realizzare una
marcatura policroma e di evidenziare quindi strutture biologiche diverse in un
medesimo campione
4) Sonde di altro tipo: ibridazione in situ
Le tecniche di ibridazione in situ permettono di rivelare
sequenze specifiche di acidi nucleici (DNA e/o RNA) in
cellule e tessuti morfologicamente conservati mediante
l’impiego di sonde geniche marcate con traccianti di
diversa natura
Sonda
Cellula 1
Ibridazione
Cellula 2
Target (DNA o RNA)
Ibridazione in situ
Metodi diretti
La molecola reporter (tracciante fluorescente) è legata alla
sonda prima di effettuare l’ibridazione
Marcatura
sonda
Cellula 1
Ibridazione
Cellula 2
Target (DNA o RNA)
Ibridazione in situ
Metodi indiretti
Il bersaglio (RNA o DNA) viene ibridato con una sonda non
marcata
Dopo l’ibridazione, il complesso target/sonda viene rivelato
trattando il campione con reagenti specifici per la sonda
Sonda
non marcata
Cellula 1
Ibridazione
Cellula 2
Target (DNA o RNA)
Applicazioni dell’ibridazione in situ
Le finalità della tecnica sono principalmente 2:
1. Se il target è un RNA, si può studiare l’espressione di un
gene a livello tissutale e cellulare
2. Se il target è il DNA, si può studiare la localizzazione di
specifiche sequenze nucleotidiche sui cromosomi
Sonda
trascritto
Sonda
cromosoma
cromosoma
Ibridazione in situ ed espressione genica
In genere si usano delle ribosonde (sonde a RNA) marcate,
complementari sugli RNA target (il legame RNA-RNA è molto
stabile).
Le sonde possono essere marcate con molecole fluorescenti
(fluorofori) o con molecole colorate (cromofori)
Ibridazione in situ e mappatura
cromosomica (FISH)
FISH: classificazione delle sonde
FISH: chromosome painting
Sonde: collezione di frammenti specifici di un singolo cromosoma
Cromosomi fluorescenti con colori diversi
Microscopia confocale
Microscopio a fluorescenza
Microscopio confocale
Schema di un microscopio confocale
Fotomoltiplicatore
Pinhole
di
eccitaz.
Pinole di
emissione
Specchio
dicroico
Obiettivo
Campione
Fibre
ottiche
Laser
Microscopia confocale
Microscopio a fluorescenza
Microscopio confocale
Sezione ottica
Per ciascun pixel vengono acquisite 3 informazioni:
1) Posizione sull’asse X
2) Posizione sull’asse Y
3) Intensità luminosa
Sezioni ottiche
Ricostruzione tridimensionale
Per ciascun voxel vengono acquisite 4 informazioni:
1) 2) 3)Posizione sugli assi X, Y e Z
4) Intensità luminosa
Ottenimento di sezioni del campione
Rappresentazione della tridimensionalità
Microscopia ottica
Il microscopio stereoscopico permette di osservare la superficie esterna di
oggetti di maggiori dimensioni (interi organi) non ridotti a sezioni
Luce riflessa
Minore
ingrandimento
Maggiore
profondità di
fuoco
Microscopia ottica
Il microscopio stereoscopico permette di osservare la superficie esterna di
oggetti di maggiori dimensioni (interi organi)
Fig. 7. Effect of alkamides on auxin-regulated gene expression. (A and B) Twelve hours of GUS staining of
DR5:uidA type I explants grown for 14 d in medium without auxin, (C and D) under 1 mM IAA, (E and F) 0.5
mM NAA, (G and H) 80 mM affinin or (I and J) 24 mM N-isobutyl decanamide. Photographs are
representative individual of at least 10 plants stained. Scale bar = 100 mm.
Microscopia elettronica a scansione
Microscopia elettronica a scansione
Microscopia elettronica a scansione