Laurea triennale in BIOLOGIA
A. A. 2013-14
CHIMICA
Lezioni di Chimica Fisica
Prof. Antonio Toffoletti
1
Conversione di una grandezza tra unità
di misura differenti
Uno scienziato ha misurato la pressione atmosferica ottenendo il valore
p = 1,115 bar. Quanto vale la pressione in atmosfere ?
1 unità vecchia = x unità nuove
1,01325 bar = 1 Atm
da dati tabulati
(1,01325 / 1,01325) bar = (1/1,01325) Atm
1 bar = (1/1,01325) Atm
p = 1,115 bar = x Atm
= 1,115 (1/1,01325) Atm
= 1,100 Atm
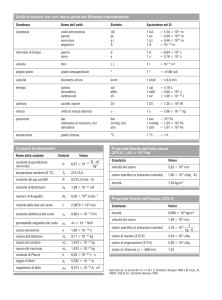
Tabella di trasformazione u. di misura
Pressione
1 Atm
101,325 kPa
1,01325 bar
Pressione
1 bar
105 Pa
0,9869 Atm
0,082 L Atm K-1 mol-1
8,314 J K mol-1
Energia
1 L Atm
101,325 J
Energia
1J
0,00987 L Atm
R costante dei gas
LE LEGGI DEI GAS
L’equazione del gas ideale
1
V∝
P
legge di Boyle
V∝T
legge di Charles
V∝n
legge di Avogadro
nT
V∝
P
nT
V =R
P
PV = nRT
LE LEGGI DEI GAS
L’equazione del gas ideale
V∝
R=
nT
P
V =R
nT
P
PV = nRT
(1 atm)(22,41 4 L)
= 0,08206 L atm K -1 mol -1
(1 mol)(273,1 5 K)
1 atm = 1,01325 × 10 -5 Pa
1 L = 1 × 10 -3 m3
(1,01325 × 10 -5 N m-2 ) (22,414 × 10 -3 m3 )
R=
(1 mol)(273,1 5 K)
= 8,314 N m K -1 mol -1
= 8,314 J K -1 mol -1
(1 J =1 N m )
LE LEGGI DEI GAS
L’equazione del gas ideale
Esercizio
L’aria che entra nei polmoni finisce in sacche sottili chiamate alveoli, da cui l’ossigeno
diffonde nel sangue. Il raggio medio di un alveolo è 0,0050 cm, e l’aria nel loro interno
contiene il 14 % di ossigeno (percentuale molare). Assumendo che la pressione negli
alveoli sia 1 atm e che la temperatura sia 37°C, calcolare il numero di molecole di
ossigeno in uno degli alveoli.
Il volume di un alveolo è
V = 4/3 π r3 = 4/3 π (0,0050 cm)3
= 5,2 × 10-7 cm3 = 5,2 × 10-10 L
moli di gas(aria) in un alveolo
(1 atm)(5,2 × 10 -10 L)
=
=
-1
-1
(0,08206 L atm K mol )(310,15 K)
naria = pV/RT
= 2 × 10-11 mol
moli di O2 in un alveolo nO2 = naria × 0,14
molecole di O2 in un alveolo
NO2 = naria × 0,14 × 6,022 × 1023 = 1,7 × 1012 molecole di O2
LE LEGGI DEI GAS
La legge di Dalton delle pressioni parziali
Finora abbiamo considerato solo gas puri, non miscele.
Consideriamo ora le miscele di gas.
Sistema che contiene 2 (o più) gas differenti
considerati ideali
nTOTALE = n1 + n2
(n1 e n2 sono le moli dei 2 gas)
calcoliamo la pressione totale P
P = nTOTALE RT / V = (n1 + n2)RT / V = n1RT / V + n2RT / V
LE LEGGI DEI GAS
La legge di Dalton delle pressioni parziali
nTOTALE = n1 + n2
calcoliamo la pressione totale P
P = nTOTALE RT / V = (n1 + n2)RT / V = n1RT / V + n2RT / V
Definiamo le pressioni parziali Pi = niRT / V
ad esempio
P1 =
n1 RT
V
Le P1, P2 ecc. sono le pressioni che ognuno dei gas
eserciterebbe se occupasse da solo il volume V
P = n1RT / V + n2RT / V
= P1 + P2
In generale, per un numero qualsiasi di gas :
P = P1 + P2 + P3 + L = ∑ Pi
i
P1 , P2 , P3 , L
sono le pressioni parziali
dei componenti 1, 2, 3, ...
LE LEGGI DEI GAS
La legge di Dalton delle pressioni parziali
PT = P1 + P2 + P3 + L = ∑ Pi
legge di Dalton delle pressioni parziali
i
Consideriamo un sistema formato da due gas differenti (1 e 2) a
temperatura T e aventi volume totale V.
n1 e n2 sono le moli dei 2 gas
PT = P1 + P2 =
P1 PT =
n1 RT n2 RT
RT
+
= (n1 + n2 )
V
V
V
n1RT V
n1
=
(n1 + n2 )RT V (n1 + n2 )
Definizione di
frazioni molari
n2RT V
n2
P2 PT =
=
(n1 + n2 )RT V (n1 + n2 )
si ottiene infine:
P1 =
n1
PT = x1 PT
n1 + n2
P2 =
n2
PT = x2 PT
n1 + n2
n1
x1 =
n1 + n2
n2
x2 =
n1 + n2
LE LEGGI DEI GAS
2.7 La legge di Dalton delle pressioni parziali
frazioni molari
x1 =
n1
n1 + n2
x2 =
n2
n1 + n2
∑ x =1
i
i
1 atm = 760 torr
Equazioni algebriche e grafici
equazioni di primo grado
y = ax + b
y − b = ax
y−b
=x
a
equazioni di secondo grado
y = ax 2 + bx + c
80
ax 2 + bx + c = 0
− b ± b 2 − 4ac
x1, 2 =
2a
x1=+2
x2=-4
60
40
x2
20
x1
0
-22
-17
-12
-7
-2
-20
3
8
13
18
Equazioni algebriche e grafici
3000
funzioni di una variabile
f ( x ) = ax + b
2500
f ( x ) = pendenza × x
1500
2000
1000
+ intersezione
500
0
-200
-500 0
200
400
600
800
1000
0,5
0,7
200000
esempio di funzione
di una variabile
150000
100000
1000
f ( x) =
x
50000
0
-0,7
-0,5
-0,3
-0,1
-50000
-100000
-150000
0,1
0,3
Equazioni algebriche e grafici
8
esempio di funzione
di una variabile
f ( x ) = ln( x )
6
4
2
0
-2
0
100
200
300
400
500
600
700
800
-4
-6
esempio di funzione
di una variabile
160
140
120
f ( x) = ex
100
80
60
40
20
0
-2
-1
0
1
2
3
4
5
900
1^ Legge della Termodinamica
La 1^ Legge della termodinamica o 1° Principio della termodinamica
La 1^ legge della termodinamica afferma che
L’ENERGIA PUO’ ESSERE CONVERTITA o TRASFORMATA DA UNA FORMA AD
UN’ALTRA, MA NON PUO’ ESSERE CREATA E NEPPURE DISTRUTTA
In altri termini:
L’energia totale di un sistema isolato è costante
L’energia totale dell’Universo è costante
Le variazioni sono: Euniverso = Esistema + Eambiente
E universo - 2 - E universo - 1 = (E sistema - 2 - E sistema - 1 ) + (E am biente - 2 - E ambiente - 1 ) = 0
∆Euniverso = ∆Esistema + ∆Eambiente = 0
∆Esistema = - ∆Eambiente
Come applicare il principio di conservazione dell’energia alla descrizione macroscopica del sistema, cioè utilizzando le grandezze di stato descrittive del suo
stato termodinamico di equilibrio?
Trasformazioni irreversibili (o spontanee):
trasformazioni ordinarie dove il sistema
passa attraverso stati di non-equilibrio
(non rappresentabili nel diagramma di stato)
Trasformazioni reversibili (o quasi statiche):
quando anche gli stati intermedi sono
stati di equilibrio (sono rappresentabili nel
diagramma di stato)
T
Stato iniziale
trasformazione
reversibile
trasformazione
Irreversibile
Stato finale
P
15
Tipi di trasformazioni termodinamiche (1)
Delle infinite trasformazioni che può subire un sistema alcune sono denominate in
base alle particolari condizioni in cui si realizzano.
Trasformazione isocora ( variazione di volume ∆V = 0 ). Si realizza in un
contenitore chiuso a pareti rigide che assicura l’invarianza del volume. Per
esempio un autoclave, che è un reattore in impianti chimici.
Trasformazione isobara (variazione di pressione ∆P = 0 ). Si realizza ad esempio
in un contenitore aperto a contatto con l’atmosfera. Le reazioni chimiche in
laboratorio e le reazioni biochimiche negli esseri viventi sono due esempi di
questte trasformazioni.
16
Tipi di trasformazioni termodinamiche (2)
Trasformazione isoterma (variazione di temperatura ∆T = 0). Si realizza
mettendo il sistema in contatto termico con un bagno termostatico. Un
comune termostato a 273 K è il bagno di acqua e ghiaccio fondente.
Trasformazione adiabatica ( calore scambiato q = 0 ). Si realizza in un
recipiente termicamente isolato dall’esterno, in modo che il sistema non può
scambiare con i dintorni energia sotto forma di calore (ma può scambiare
energia sotto forma di lavoro). Il thermos, o vaso di Dewar, è un esempio di
contenitore adiabatico.
17
Le trasformazioni reversibili sono un caso limite delle trasformazioni reali:
incrementi infinitesimi dei parametri esterni che controllano la deviazione
rispetto alla condizione di equilibrio (la direzione della trasformazione è invertibile
cambiando il segno degli incrementi, cioè i ∆T oppure i ∆p).
18
19
2) Si ipotizza che il sistema sia immobile, altrimenti bisognerebbe tener
conto dell’energia cinetica del sistema stesso.
3) Il 1° principio è applicabile solo a trasformazioni tra stati di equilibrio
per i quali sono definite le grandezze di stato (quale l’energia interna)
20
Il calore ed il lavoro non sono grandezze di stato, ma energia scambiata!
21
Diverse forme di lavoro a seconda del tipo di interazione con il sistema,
in particolare:
1) lavoro meccanico: forza meccanica che produce il moto di una
superficie di separazione tra il sistema e l’ambiente;
2) lavoro elettrico: differenza di potenziale imposta dall'esterno che genera
una corrente nel sistema.
Modalità di esecuzione del lavoro meccanico:
1) lavoro puramente dissipativo (sfregamento, agitazione di una soluzione)
che non provocano variazioni di volume (se non a seguito del conseguente
aumento di temperatura);
2) lavoro di volume: la forza esterna è utilizzata per modificare il volume del
sistema.
Trasformazione irreversibile!
22
1^ Legge della Termodinamica
Il Lavoro
Il Lavoro può essere di diversi tipi, ma comunque
In meccanica il lavoro è il prodotto di una forza per uno spostamento
L=F⋅s
r r
L = F× s
prodotto scalare
Più in generale, in altri campi della scienza, si incontrano anche altre forme di lavoro:
• lavoro elettrico
• lavoro di espansione superficiale
• lavoro gravitazionale
• lavoro di volume
Q ∆E
γ ∆A
mg ∆h
P ∆V
Avremo a che fare nella maggior parte dei casi solo con il lavoro di volume.
E’ una modalità di trasferimento dell’energia che deriva da un moto ordinato
nell’ambiente oppure che produce un moto ordinato nell’ambiente.
Strumenti matematici
Quantità infinitesima
d (qualcosa)
d (G, Grandezza che è una funzione di stato)
d (g, grandezza che NON è una funzione di stato)
è un differenziale e anche un
piccolo incremento della
grandezza G
è una piccola quantità di g
DEFINIZIONE
Il differenziale di una funzione di una variabile f(x) si indica con df oppure con d f(x)
ed è l’incremento infinitesimo della funzione f(x) per effetto della variazione dx;
Si calcola nel modo seguente:
d f(x) = f’(x) dx
incremento infinitesimo
della variabile indipendente x
derivata prima
della funzione f(x)
(dx è un ∆x molto piccolo, infinitesimo)
Strumenti matematici
Faccio la somma di molti piccoli contributi dG oppre dg
cioè scrivo l’integrale di questi infinitesimi
2
= ∆ G = G 2 - G1
∫ dG
1
ottengo come risultato un incremento
finito ( cioè grande ) della grandezza G
[
d G, Grandezza che è una funzione di stato)
è un differenziale e anche un
piccolo incremento della
grandezza G
]
2
∫ dg
1
[
=g
ottengo come risultato una quantità
finita ( cioè grande ) della grandezza g
d (g, grandezza che NON è una funzione di stato)
è una piccola quantità di g
]
pext = p (T ,V )
dwvol = − pext dV = − p (T , V )dV
V2
wvol = − ∫ p (T , V ) dV
V1
Caso del gas perfetto:
p (T , V ) = nRT / V
Termostato: sistema in grado di scambiare efficientemente calore senza
cambiare la sua temperatura (esempio: miscela di acqua e ghiaccio).
26
Esempio di calcolo del lavoro di volume
1 litro di gas a 25°C (T=298.15K) ed alla pressione di 1 bar viene compresso
in condizioni isoterme con una pressione costante di 2 bar
Stato iniziale: p1 = 1 bar V1 = 1 litro
Stato finale:
p1V1 = nRT = p 2V2
p 2 = 2 bar V 2 = 0 .5 litri
Compressione isoterma reversibile tra gli stessi stati iniziale e finale
27
w el = q ∆ V
q
Lavoro elettrico determinato dal passaggio di una corrente i per un tempo t
in seguito all’applicazione di una differenza di potenziale ∆ V ad una
resistenza R (legge di Ohm: ∆ V = Ri ):
q = it
w el = it ∆ V = t ∆ V 2 / R
28