Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
Università degli studi di Padova
Dipartimento di Scienze Chimiche
Corso di Laurea Triennale in Chimica Industriale
Laboratorio di Chimica Fisica
(Anno Accademico 2016-2017)
Pagina 1 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
1. Sistemi Elettrochimici
I sistemi elettrochimici sono costituiti da conduttori di prima e seconda specie collegati “in serie” e, in
particolare, da due conduttori di prima specie (generalmente metallici) e almeno un conduttore di seconda
specie (generalmente soluzioni elettrolitiche). I sistemi elettrochimici si distinguono in base alla capacità di
fornire energia o di assorbire energia. Definiamo quindi come:
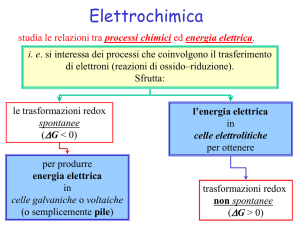
Pila: un sistema in cui una reazione chimica spontanea genera energia elettrica;
Cella elettrolitica: un sistema in cui un generatore di energia elettrica induce una reazione chimica non
spontanea
U=Utilizzatore
G=Generatore
Per convenzione si scrive sempre la pila con l’elettrodo positivo a destra e quello negativo a sinistra. In una
pila, all’elettrodo positivo ha luogo la riduzione (catodo) e a quello negativo l’ossidazione (anodo). Nelle
celle elettrolitiche il segno degli elettrodi è invertito rispetto a quello delle pile: l’anodo (a cui avviene
l’ossidazione) è l’elettrodo positivo e il catodo (a cui avviene la riduzione) è quello negativo
Se abbiamo a disposizione per esempio i tre semielementi
(1) Cu2+/Cu E° = +0.341
(2) Zn2+/Zn
E° = -0.763
(3) Ag+/Ag
E° = +0.799
possiamo ottenere 3 accoppiamenti diversi in cui un semielemento può assumere la funzione di anodo o di
catodo in base al potenziale dell'altro semielemento. Si nota che, mentre il semielemento Zn2+/Zn, che
possiede E° più basso, funziona, in questi esempi, sempre da anodo, il semielemento Cu2+/Cu funge da
catodo nel primo caso e da anodo nel terzo. Se la differenza fosse negativa, occorrerebbe invertire le
posizioni, in modo che sia sempre l'anodo a sinistra e il catodo a destra.
Pagina 2 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
Sia nella cella elettrolitica sia nella galvanica, i cationi si muovono sempre dall'anodo verso il catodo, gli
anioni viceversa, o per reagire sull'elettrodo o, quantomeno, per equilibrare la densità di cariche positive e
negative nella soluzione.
1.1. Conduttori elettrici
I conduttori elettrici si differenziano a seconda di come le cariche elettriche si muovono all’interno di essi:
conduttori elettronici o di I specie, per i quali le uniche cariche elettriche in grado di muoversi
sono gli elettroni (appartengono a questa specie i metalli, i semiconduttori e composti del carbonio
come la grafite, il glassy carbon, il diamante opportunamente drogato, ma anche alcuni materiali
polimerici);
conduttori ionici o di II specie, nei quali le cariche elettriche mobili sono gli ioni, generalmente sia
positivi che negativi (appartengono a questa specie le soluzioni elettrolitiche, i cristalli ionici, gli
elettroliti fusi, in particolare i cosiddetti liquidi ionici, gli elettroliti polimerici).
1.1.1. Conduttori elettronici
Le proprietà dei conduttori elettronici sono descritte dalla teoria delle bande. I livelli energetici di atomi
isolati hanno valori ben definiti e gli elettroni riempiono i livelli più bassi in accordo con le leggi della
quantomeccanica. Quando gli atomi non sono più isolati, ma aggregati tra loro, vi è un’interazione tra gli
orbitali atomici dei singoli atomi, con formazione di orbitali molecolari e di nuovi livelli energetici, differenti
da quelli degli atomi isolati. Quando l’insieme di atomi aggregati giunge a formare un reticolo cristallino, i
livelli energetici originati dagli orbitali molecolari si combinano in bande energetiche di ampiezza finita,
all’interno delle quali sono collocati un numero molto grande di orbitali, i cui livelli energetici sono
naturalmente discreti, ma il salto energetico tra un orbitale e l’altro è estremamente piccolo, dato il
grandissimo numero di orbitali confinati in un intervallo di energia limitato.
Pagina 3 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
Le bande sono tra loro separate da un salto energetico (gap) che non contiene livelli energetici. Ogni singolo
livello energetico in una certa banda può contenere al massimo due elettroni. I conduttori elettronici, come
ad esempio i metalli, mettono in comune gli elettroni di valenza per la costituzione del reticolo cristallino.
Gli orbitali atomici che ospitano gli elettroni di valenza danno origine a due bande: la banda di valenza,
costituita dagli orbitali ad energia minore, la banda di conduzione, costituita dagli orbitali molecolari ad
energia maggiore. Il numero di elettroni di valenza può essere inferiore a quello che può essere ospitato
nell’insieme degli orbitali della banda di valenza, per cui la banda è occupata solo parzialmente. Anche
quando la banda di valenza fosse completamente piena, essa risulta comunque parzialmente sovrapposta alla
banda di conduzione vuota. In questa situazione gli elettroni della banda di valenza sono estremamente
“mobili”, perché hanno a disposizione un numero elevatissimo di orbitali nella stessa banda, ai quali possono
accedere liberamente, dato che il salto energetico tra un orbitale ed un altro è largamente inferiore all’energia
cinetica kBT (kB = costante di Boltzman).
Nei materiali non metallici i livelli energetici della banda a più bassa energia sono completamente occupati e
quelli della banda a energia superiore sono completamente vuoti, ma tra le due bande vi è un ampio
intervallo energetico. Per trasferire un elettrone dal livello energetico più alto della banda inferiore
completamente piena (banda di valenza) a quello più basso della banda superiore completamente vuota
(banda di conduzione) occorre un’elevata quantità di energia (band gap) rispetto all’energia cinetica kBT. Per
tale motivo gli elettroni non sono in grado di passare da una banda all’altra; d’altra parte, essendo tutti
occupati gli orbitali della banda di valenza, gli elettroni non sono in grado di muoversi attraverso il materiale
perché sono confinati nel proprio orbitale: la sostanza viene definita isolante. Taluni materiali presentano una
differenza energetica relativamente piccola tra la banda di valenza piena e quella di conduzione vuota, per
cui è possibile eccitare facilmente alcuni elettroni e trasferirli quindi dalla banda piena a quella vuota. In
questa situazione si liberano degli orbitali nella banda di valenza, che consentono una certa mobilità agli altri
elettroni e, d’altra parte, gli elettroni finiti nella banda di conduzione sono diventati mobili, data la grande
disponibilità di orbitali vuoti in quella banda: la sostanza in questo caso viene definita semiconduttore
Pagina 4 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
L’energia cinetica è quantizzata per cui gli elettroni sono distribuiti su un numero adeguato di livelli di
energia , secondo la legge di distribuzione di Fermi-Dirac (che vale per i fermioni, cioè particelle soggette
al principio di esclusione),
( )=
1
1 + exp[( −
)/
]
dove F è l’energia del cosiddetto livello Fermi, che rappresenta sostanzialmente il livello con probabilità di
occupazione pari a 0.5, mentre a 0 K rappresenta il massimo livello che può essere occupato dagli elettroni
(HOMO). Il livello Fermi viene considerato il livello energetico al quale si trovano gli elettroni che sono
coinvolti nei processi di trasferimento da e verso un metallo e costituisce quindi lo stato standard degli
elettroni.
1.1.2. Soluzioni elettrolitiche
Nelle soluzioni liquide il componente maggioritario è detto solvente. Non tutti i solventi sono uguali, ma
possono essere classificati in due grandi famiglie: quelli ionici e quelli molecolari. I primi sono
essenzialmente costituiti da specie completamente dissociate in ioni (es. sali fusi), sia in forma monoatomica
sia in forma poliatomica, e presentano elevata conducibilità elettrica. Ovviamente in questo caso le forze
coesive che realizzano lo stato liquido sono dovute alle forti interazioni coulombiane tra gli ioni di carica
opposta. I solventi molecolari sono costituiti da molecole; le forze coesive sono hanno diverse origini:
legami a ponte (di idrogeno, di alogeno, ecc.), interazioni dipolo-dipolo o di tipo van der Waals. Questi
solventi si comportano quasi come isolanti, hanno cioè una conducibilità elettrica molto ridotta, che è dovuta
a una possibile dissociazione ionica (legata generalmente a processi di scambio protonico). Anche i liquidi
molecolari, come quelli ionici, non sono completamente amorfi, ma mantengono in parte la struttura
originaria della forma cristallina dello stato solido da cui derivano. In particolare l’acqua a temperatura
ambiente è costituita per il 70% di aggregati di circa 50 molecole con struttura simile a quella del ghiaccio,
mentre il restante 30% è costituito da molecole sostanzialmente singole. Una soluzione elettrolitica è
formata da un solvente molecolare e dagli ioni in esso disciolti. In questo caso la conducibilità elettrica
raggiunge valori anche elevati (pur sempre largamente inferiori a quelli dei conduttori elettronici di tipo
metallico), grazie alla buona mobilità degli ioni. La formazione di una soluzione elettrolitica avviene quindi
per dissoluzione di un elettrolita in un solvente molecolare. Esistono peraltro due tipi di elettroliti: gli
elettroliti ionofori e gli elettroliti ionogeni. Gli elettroliti ionofori sono i cristalli ionici, cioè quelle sostanze
che sono costituite da ioni già nel loro stato naturale (generalmente lo stato solido, anche se esistono diversi
tipi di cristalli ionici liquidi a temperatura ambiente). Si tratta ad esempio di sali, ossidi, idrossidi, per i quali
la struttura cristallina è costituita da ioni di carica opposta tenuti assieme dalle forti interazioni coulombiane.
Gli elettroliti ionogeni sono invece sostanze costituite da molecole neutre che producono ioni (ovviamente
almeno due, di carica opposta per il bilancio di carica) attraverso una reazione chimica con il solvente nel
quale vengono disciolti (in generale si tratta di una reazione acido-base, cioè di scambio protonico). Ad
Pagina 5 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
esempio, NaCl è un elettrolita ionoforo, poiché allo stato naturale (solido) è costituito da ioni Na + e Cl–, che
si separano quando viene sciolto in un adeguato solvente; viceversa HCl è un elettrolita ionogeno, poiché
allo stato naturale (gassoso) è costituito da molecole, ma una volta sciolto in acqua produce ioni H3O+ e Cl–
per reazione acido-base.
1.2. Interfasi e differenza di potenziale
Quando abbiamo due fasi a contatto, la regione interfasale risulta elettrificata. Se consideriamo un punto
dello spazio all’interno di una fase, immediatamente vicino all’interfaccia, ed un punto all’interno dell’altra
fase, anch’esso vicino all’interfaccia, avremo una differenza di potenziale elettrico, dovuta alla
elettrificazione interfasale, che viene quantificata dal
(differenza di potenziale interno o di Galvani),
esprimibile come somma dei due contributi: (differenza di potenziale esterno o di Volta), dovuta agli
eccessi di cariche elettriche che si accumulano nella regione interfasale, e (differenza di potenziale
superficiale), dovuta alla presenza dei due strati dipolari superficiali (effetti a corto raggio degli ioni
adsorbiti sulla superficie e delle molecole di solvente orientate).
L’elettrificazione interfasale riveste un’importanza enorme per tutti i fenomeni elettrochimici, che
coinvolgono una varietà di situazioni estremamente vasta: dai processi biologici, in particolare quelli di
membrana alle elettrosintesi, dal funzionamento del sistema nervoso alla produzione di energia.
Naturalmente la struttura delle interfasi elettrificate ha attratto l’attenzione degli elettrochimici, a partire dal
caso più eclatante dell’interfaccia tra un metallo (nel quale ci sono elettroni liberi) ed una soluzione
elettrolitica (nella quale ci sono ioni liberi).
Il primo modello di interfase elettrificata si deve a Helmholtz, che immaginò di avere i due eccessi di carica
disposti su due piani paralleli: uno è la superficie del metallo (sulla quale sono concentrate le cariche in
eccesso del metallo) e l’altro è un piano parallelo, luogo dei centri degli ioni in eccesso presenti dalla parte
della soluzione elettrolitica. Il modello è molto semplice, ma abbastanza aderente alla realtà e in grado di
rappresentare la situazione, almeno in prima approssimazione, in molte condizioni sperimentali. Da questo
Pagina 6 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
modello la regione interfasale prese il nome di doppio strato elettrico che, anche se la situazione è alquanto
più complessa, rimane la denominazione tuttora utilizzata per esprimere una interfase elettrificata.
Quando metto a contatto due fasi differenti come nel caso in cui immergo una lamina di rame in una
soluzione di solfato di rame, tra le due fasi a contatto si può avere trasferimento di elettroni, i quali però non
esistono liberi in soluzione ma vengono scambiati tra le specie che danno luogo ad una semireazione:
Cu 2 + (aq) + 2 e Cu (s)
Zn 2 + (aq) + 2 e
Zn (s)
All’interfaccia solido/liquido la differente velocità del trasferimento di carica comporta l’instaurarsi di una
differenza di potenziale elettrico
(differenza di potenziale interno o di Galvani). All’interno di ciascuna
fase il potenziale rimane costante, è solo ed esclusivamente all’interfase che ho una variazione del
potenziale. La d.d.p. interfasale metallo - soluzione modifica le due velocità di trasferimento elettronico fino
ad equilibrarle portando il sistema ad uno stato di equilibrio dinamico.
Il potenziale
della singola interfaccia non è però misurabile in quanto la misura dello stesso implica la
creazione di nuove interfacce (puntale strumento-metallo e puntale strumento soluzione e quindi in generale
avrei una pila). Pertanto ciò che è realmente misurabile è una differenza di potenziale e non un singolo
potenziale interfasale.
ΔΦ = Φ − Φ
d. d. p = (Φ )
− (Φ )
. .
= (Φ )
= (ΔΦ)
− Φ
− (Φ )
− Φ
− (ΔΦ)
Altro discorso invece all’interfase tra due soluzioni poste a diretto contatto, aventi differente composizione e
/o concentrazione. In questo caso si crea una d.d.p. denominata potenziale di giunzione liquido – liquido o
anche potenziale interliquido. Tale d.d.p. nasce dalla diversa velocità di diffusione dei cationi e degli anioni
attraverso l’interfaccia. La diffusione è il fenomeno di trasporto di materia associato all’esistenza di gradienti
di concentrazione (attività). Se ad esempio consideriamo due soluzioni contenenti l’elettrolita
diversa attività a1 e a2 separate da un setto poroso. Se a2 > a1;
Pagina 7 di 27
e
con
diffondono dalla soluzione 2 alla
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
soluzione 1. Se
ha maggiore mobilità di
il maggiore flusso dei cationi attraverso l’interfaccia di
separazione crea un eccesso di cariche positive dalla parte della soluzione 1 ed un eccesso di cariche negative
dalla parte della soluzione 2. Tali eccessi di carica rallentano i cationi ed accelerano gli anioni, fino ad
equilibrare i due flussi. Tra i due limiti estremi della zona diffusiva si instaura una d.d.p. dovuta agli eccessi
di cariche e che è legata alla differente attività dell’elettrolita nelle due soluzioni ed alla diversa mobilità
degli ioni che lo compongono
In presenza di soluzioni diverse (S1, S2) a contatto tra loro attraverso ad esempio un setto poroso la f.e.m,
cioè la d.d.p. in condizioni di equilibrio cioè quando non ho passaggio di corrente, dovrà tener conto anche
dei così detti potenziali di giunzione inter-liquido Δint.
. .
. = (ΔΦ)
− (ΔΦ)
f .e.m. (Φ) catodo . (Φ) anodo . (Φ) int .
(Φ) int . (Φ s1 ) catodo . (Φ s2 ) anodo
Se posso considerare che Δint = 0 ad esempio quando ho che la soluzione è unica o è trascurabile (ΔΦint 0)
ad esempio per l’utilizzo di un ponte salino, è opportuno considerare un elettrodo come riferimento
attribuendogli arbitrariamente un potenziale interfasale nullo e utilizzarlo come riferimento per la
determinazione del potenziale di altri elettrodi attraverso la misura della f.e.m. della pila costituita
dall’elettrodo a potenziale incognito e quello di riferimento. Ciò comporta l’impiego dei potenziali
elettrodici E al posto della quantità Δ
Φ Φ cat Φ anod Φ cat 0 E
ΔΦ anod Φ rif 0
L’elettrodo scelto come riferimento è quello ad idrogeno che per convenzione ha appunto potenziale zero a
tutte le temperature, il che significa rGo = 0 e rSo = 0. L’elettrodo ad idrogeno è costituito da una lamina o
una retina di platino immerso in una soluzione ad attività unitaria di H+ e alla pressione di un bar di H2. La
Pagina 8 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
superficie spugnosa del platino adsorbe l'idrogeno gassoso; quindi tra l’idrogeno adsorbito all’elettrodo e gli
ioni H+ della soluzione si stabilisce così l'equilibrio:
2H+(aq) + 2e ⇄ H2(g)
Pt | H 2 ( g , p 1bar ) | HCl( aq, a
EH / H
2
H
1)
aH
RT
ln
F
( f H 2 )1/ 2
Dove f coincide con la fugacità di H2 che per pressioni non troppo elevate coincide con la pressione del gas
stesso. In questo modo è stato possibile stilare una serie di potenziali elettrodici standard (25°C) detta serie
elettrochimica nella quale le coppie redox più ossidanti rispetto all’idrogeno assumono valori di E0 positivi,
mentre coppie redox più riducenti assumono valori di E0 negativi.
1.3. Leggi di Faraday
All’interfaccia solido liquido avvengono i processi elettrochimici di riduzione al catodo e di ossidazione
all’anodo; entrambi questi processi sono descritti dalle leggi di Faraday:
1 - la quantità di sostanza chimica prodotta o consumata dalla corrente è proporzionale alla quantità di
elettricità (carica, Q) che attraversa il sistema.
=
2 - le quantità di differenti sostanze, trasformate dalla stessa quantità di carica, sono proporzionali al
peso equivalente (PE) delle rispettive sostanze.
=
Dove
rappresenta il numero di moli,
il numero di cariche mentre
che è appunto la costante di Faraday è
una costante rappresenta la carica necessaria per trasformare 1 grammo equivalente di sostanza.
F = N Ae = 6.022521023 1.6021031019 = 96485 C/mol
Pagina 9 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
1.4. Equazione di Nernst.
In pratica i semielementi definiti da coppie redox i cui potenziali standard sono elencati dalla serie
elettrochimica non vengono sfruttate in condizioni standard, cioè a 298 K e ad attività unitarie
(concentrazioni 1M), ma in condizioni quanto mai varie per concentrazione e temperatura. In condizioni
differenti da quelle standard, il potenziale effettivo di un elettrodo è funzione, oltre che della natura chimica
del materiale che costituisce l'elettrodo, anche della temperatura e della concentrazione degli ioni nella
soluzione. In questo caso i potenziali dei semielementi possono essere ricavati dalla legge di Nernst:
=
+
Dove:
è il potenziale di elettrodico assunto nelle particolari condizioni di temperatura e
concentrazione,
è potenziale standard della coppia ossidato – ridotto,
: 8,3145 J/(mol⋅K) (costante dei gas),
: temperatura assoluta espressa in K,
è il numero di elettroni scambiati nella semireazione Ox + ne → Red,
: 96485 coulomb/mol (costante di Faraday)
: indica il prodotto delle 'attivita' di tutte le specie che compaiono nella semireazione dalla parte
della forma ossidata, elevate al loro coefficiente stechiometrico;
: indica il prodotto delle 'attivita' di tutte le specie che compaiono nella semireazione dalla parte
della forma ridotta, elevate al loro coefficiente stechiometrico
Nella forma semplificata l’equazione di Nernst diventa:
=
+
.
[
]
[
]
Questa si ottiene passando da logaritmo naturale a logaritmo decimale (lnA = 2.303logA), considerando
T=298 K (25°C) e tenendo conto che le attività possono essere approssimate con le concentrazioni in mol/L
Ad esempio se consideriamo la semireazione
Cu 2 + (aq) + 2 e Cu (s)
= 0.341 + .
[
= 0.341
]
Dove si considera, unitaria l'attività di Cu metallico, non essendo disciolto nella soluzione. Se adesso
consideriamo entrambe le semireazioni componenti una pila e la reazione globale nella,
Pagina 10 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
→
+2
+2
→
_____________________
+
→
+
L’equazione di Nernst che esprime la reazione globale sarà:
=
Nel caso in cui [
]=[
] = 1
=
−
/
+
/
.
[
]
il tutto si riduce:
−
/
= 0.3419 + −0.7618 = 1.1037V
Il valore così ricavato corrisponde proprio alla forza elettromotrice abbreviata f.e.m della pila, in questo
caso una pila Daniell. Se le concentrazioni differiscono tra loro o non sono unitarie dobbiamo applicare
l'equazione di Nernst per calcolare i potenziali non standard e procedere nello stesso modo.
=
=
−
/
−
/
+
/
[ . ]
]
.
[ .
= 1.1037 +
⁄
.
= 1.1332
L’equazione di Nernst descrive l’equilibrio di una reazione redox, se consideriamo due semireazioni e la
reazione globale di un caso del tutto generale:
→
+
+
→
_____________________
+
⇋
+
All'equilibrio si avrà:
=
/
=
/
/
+
.
/
[ ]
[ ]
=
la reazione globale è descritta dalla costante di equilibrio
Pagina 11 di 27
+
[ ]
.
+
/
=
/
/
[ ]
[ ]
.
[ ]
/
+
.
[ ]
[ ]
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
=
[ ] ∙[ ]
] ∙[ ]
∙
≈[
∙
Da cui si ricava che
0=
−
/
+
/
/
=
.
/
.
Questa espressione ci consente il calcolo teorico della costante di equilibrio della reazioni redox (a 298K),
noti i potenziali standard e il numero totale di elettroni scambiati nella reazione. Dalla reazione si capisce che
quanto più differiscono i potenziali standard tanto più il valore della costante di equilibrio e molto grande o
molto piccolo.
1.5. Tipi di elettrodo e loro potenziale
Gli elettrodi sono classificati in base al tipo di processo redox che “governa” il potenziale elettrodico.
Naturalmente il potenziale elettrodico è dato dall’equazione di Nernst relativa al processo redox che avviene,
a condizioni che il processo avvenga in modo reversibile e che l’elettrodo sia in condizioni di equilibrio. Ciò
significa che il trasferimento elettronico (TE) può avvenire in entrambi i versi (dal conduttore elettronico a
quello ionico e viceversa) con una velocità abbastanza elevata (reversibilità elettrochimica significa appunto
questo: TE in entrambi i versi con elevata velocità) e, in condizioni di equilibrio, non si ha alcun
trasferimento elettronico netto attraverso l’interfaccia. In molti casi il conduttore elettronico è un metallo che
partecipa al predetto processo redox che governa il potenziale elettrodico.
1.5.1. Elettrodi Di I Specie
Il processo redox in questo tipo di elettrodi è del tipo
+
⇄
( )
si tratta di un elettrodo costituito da un metallo M immerso in una soluzione che contiene i suoi ioni Mn+,
cioè un sale costituito dal catione Mn+ e da un qualche anione, che è ininfluente dal punto di vista
elettrochimico. In questo caso il metallo M svolge il ruolo di conduttore elettronico, cioè di serbatoio di
elettroni (che possono andare e venire dal relativo livello Fermi), ma è anche la forma ridotta della coppia
redox, cioè partecipa al TE. Un elettrodo di I specie viene indicato con il seguente schema:
M | Mn+(aq, c = )
Pagina 12 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
L’equazione di Nernst per un tale elettrodo è immediata:
=
+
/
Normalmente il metallo M utilizzato è puro, per cui si trova nel proprio stato termodinamico standard (che è
definito proprio in questo modo: l’elemento puro nel proprio stato naturale alla T in esame). Ciò significa che
aM = 1, per cui l’equazione di Nernst viene espressa normalmente in forma semplificata
=
(
+
/
)
Naturalmente, se il metallo M non fosse puro (ad esempio una sua lega) aM < 1, per cui il suo valore
andrebbe inserito nell’equazione di Nernst. Esistono molti esempi di elettrodi di I specie. Ad esempio un filo
di Cu in una soluzione di solfato di rame CuSO4, un filo di Ag in una soluzione di nitrato di argento AgNO 3,
una lamina di Cd in una soluzione di cloruro di cadmio CdCl2, ecc.. In tutti questi casi, se si usa il metallo
puro, l’espressione dell’equazione di Nernst è quella semplificata, dato che l’attività della forma ridotta, cioè
del metallo, è sempre unitaria. Viceversa, se si usasse una lega, bisognerà utilizzare l’equazione completa.
Ad esempio, se si utilizzasse una lamina di ottone (lega Cu-Zn) immersa in una soluzione di cloruro di rame
CuCl2 (o solfato di rame, dato che l’anione è ininfluente), il processo redox sarebbe.
+2
⇄
(
)
e l’equazione di Nernst corrispondente
=
/
+
2
(
)
1.5.2. Elettrodi di II Specie
Un elettrodo di II specie è costituito da un metallo (che ha sempre il doppio ruolo, di conduttore elettronico e
di specie ridotta del processo redox), in presenza di un suo sale poco solubile, che, essendo poco solubile, è
presente come solido indisciolto, a contatto con una soluzione che contiene un sale solubile (quindi sciolto,
con una definita concentrazione) formato dallo stesso anione del sale insolubile e da un altro catione, che è
ininfluente.
Uno degli esempi più noti è l’elettrodo ad argento-argento cloruro Ag/AgCl
Ag | AgCl(s) | Cl–(aq, c = )
dove AgCl(s) vuol dire del cloruro di argento solido e Cl– significa una soluzione di un qualche cloruro, ad
esempio cloruro di potassio o di sodio, KCl o NaCl.
Pagina 13 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
Il processo redox in questo tipo di elettrodi è ancora del tipo
+
⇄
( )
cioè, il trasferimento elettronico coinvolge anche in questo caso il metallo elettrodico e gli ioni metallici in
soluzione. Pertanto, per l’elettrodo in esame avremo
+
=
/
⇄
( )
+
ovviamente, se si usa un filo o una lamina di Ag puro (altrimenti si dovrà tenere conto della minore attività
dell’Ag, se si usasse una lega). In questo caso però, l’attività dell’Ag+ non è indipendente, cioè non può
essere fissata arbitrariamente, ma dipende dall’attività degli ioni Cl– attraverso il prodotto di solubilità di
AgCl.
+
⇄
( )
K PS aAg aCl
per cui, nell’equazione di Nernst si può sostituire aAg+ con KPS/aCl-, per cui si ha:
o
E EAg /Ag
RT K PS
RT
RT
1
o
ln
EAg /Ag
ln K PS
ln
F
aCl
F
F
aCl
o
E EAgCl/Ag,
Cl
RT
1
ln
F
aCl
o
o
EAgCl/Ag,
EAg
Cl
/Ag
RT
ln K PS
F
Come si vede dall’espressione finale dell’equazione di Nernst, il potenziale elettrodico dipende dalla attività
(concentrazione) del cloruro, per cui si usa dire che questo elettrodo è “reversibile” ai cloruri. L’equazione
finale riconduce al processo redox complessivo di questo elettrodo, come tutti gli elettrodi di II specie:
Ag+ + e
AgCl(s)
AgCl(s) + e
Ag(s)
Ag+ + Cl–
Ag(s) + Cl–
da cui si capisce che l’espressione su scritta per l’equazione di Nernst è valida assumendo che aAgCl e aAg
siano entrambe unitarie, cioè i due solidi siano puri. Altrimenti
Pagina 14 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
o
E EAgCl/Ag,Cl
aAgCl
RT
ln
F
aAg aCl
Un modo, largamente utilizzato, per realizzare un tale elettrodo consiste nel prendere un filo di Ag (puro),
ricoprirlo di AgCl solido, che si può fare facilmente per via elettrochimica (elettrolizzando il filo in una
soluzione di HCl). Una volta ricoperto l’argento di uno strato di AgCl, si introduce in una soluzione di
cloruri e l’elettrodo è costituito. Si può anche prendere la soluzione di cloruri, versarvi una punta di spatola
di AgCl (polvere bianca), che sostanzialmente non si scioglie, per cui si deposita sul fondo, e introducendo il
filo di Ag. Naturalmente, il primo metodo realizza un contatto più intimo tra le specie chimiche coinvolte,
per cui è largamente preferito. Gli elettrodi di seconda specie sono molto stabili e altamente reversibili, per
cui costituiscono delle ottime interfacce impolarizzabili. Per tale motivo vengono usati come elettrodi di
riferimento nelle misure sperimentali. Oltre all’elettrodo ad argento/argento cloruro, l’altro elettrodo di
riferimento largamente utilizzato è l’elettrodo a calomelano. Il calomelano è il cloruro mercuroso Hg2Cl2 (il
catione è dimero Hg22+)
Hg22+ + 2e
2Hg(liq)
Hg22+ + 2Cl–
Hg2Cl2(s)
2Hg(liq) + 2Cl–
Hg2Cl2(s) + 2e
o
E EHg
2 Cl 2 /Hg, Cl
RT
1
ln
F
aCl
la cui equazione di Nernst può essere ricavata con il solito procedimento
o
E EHg
2
/Hg
2
o
EHg
2
/Hg
2
RT
RT
K PS
o
ln aHg 2 EHg
ln
2
2F
2F a 2
2
2 /Hg
Cl
RT
RT
1
RT
1
o
ln K PS
ln
EHg
ln
2F
F
aCl
F
aCl
2 Cl 2 /Hg, Cl
o
EHg
2 Cl 2 /Hg, Cl
o
EHg
2
/Hg
2
RT
ln K PS
2F
Sia per l’elettrodo a calomelano che per quello Ag/AgCl, si utilizza per la soluzione di cloruri il KCl. Quasi
sempre si utilizza una soluzione satura di KCl, cioè in presenza di un eccesso di KCl, il che garantisce che la
concentrazione e, quindi, l’attività degli ioni Cl– rimangano costanti nel tempo, per cui anche il potenziale
elettrodico è costante, come si richiede per un buon riferimento.
1.5.3. Elettrodi redox
Pagina 15 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
Naturalmente esistono anche molti casi di elettrodi per i quali il conduttore elettronico svolge solo il compito
di serbatoio di elettroni, mentre le specie chimiche che partecipano al processo redox sono presenti nel
conduttore ionico (soluzione elettrolitica o altro). In questo caso, il conduttore elettronico deve essere
assolutamente inerte dal punto di vista chimico, rispetto a tutte le specie coinvolte nel processo redox. Per
tale motivo, si usa molto spesso il Pt, che è tra i metalli più inerti, oppure conduttori a base di carbonio
(glassy carbon o grafite). Ad esempio, una soluzione che contenga ioni ferrici Fe3+ e ioni ferrosi Fe2+
(potrebbe essere una soluzione di solfato ferrico Fe2(SO4)3 e solfato ferroso FeSO4) nella quale si introduca
un filo di platino costituisce un elettrodo che viene schematizzato nel modo seguente
Pt | Fe3+(aq, c = ), Fe2+(aq, c = )
per il quale il processo redox è
+
⇄
da cui si vede che il Pt non partecipa al processo redox. Il potenziale elettrodico è dato, come sempre,
dall’equazione di Nernst
o
E EFe
3
/Fe 2
RT aFe 3
ln
F aFe 2
Ci sono due aspetti che richiedono di essere chiariti. Il primo riguarda l’espressione dell’equazione di Nernst.
Per il generico processo redox
+
⇄
l’equazione di Nernst è:
o
E EOx/R
RT aOx
ln
nF aR
dove però, aOx e aR rappresentano rispettivamente le attività di tutte le specie che costituiscono la forma
ossidata e la forma ridotta della coppia redox, ciascuna elevata al proprio coefficiente stechiometrico. Ad
esempio, considerando il processo redox di riduzione del permanganato MnO4– a manganese Mn2+
MnO4– + 8H+ 5e
Mn2+ + 4H2O
la relativa equazione di Nernst risulta
o
E EMnO
/Mn 2
4
Pagina 16 di 27
aMnO
RT
ln
5F a
4
Mn 2
8
aH
a
4
H 2 O
o
EMnO
/Mn 2
4
RT
ln
5F
aMnO
4
8
aH
aMn 2
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
dove, in particolare, aH2O si può considerare praticamente unitaria, dato che il solvente è quasi puro
(soluzioni diluite).
Il secondo aspetto riguarda la cosiddetta convenzione dei segni per il potenziale elettrodico. L’impostazione
che abbiamo seguito nel descrivere gli elettrodi corrisponde alla “convenzione IUPAC” (IUPAC =
International Union of Pure and Applied Chemistry), storicamente nota come “convenzione europea, indicata
brevemente come “zinco-meno/rame-più”. Anche se la comunità scientifica internazionale ha adottato la
convenzione europea, sopravvive, soprattutto in qualche testo americano, l’atra convenzione, che è, appunto,
la “convenzione americana”, indicata brevemente come “zinco-più/rame-meno”.
Come si capisce, le due convenzioni danno il segno esattamente opposto ai valori del potenziale elettrodico,
mentre il valore è lo stesso. Questa differenza di segno dipende dal modo in cui si scrive il processo redox ed
il relativo rG. Per la convenzione IUPAC, come abbiamo sempre scritto, abbiamo:
+
⇄
l’equazione di Nernst è:
o
E EOx/R
RT aOx
G
ln
r
nF aR
nF
dove rG è la variazione di energia libera del processo di riduzione (per tale motivo, si parla anche di serie
dei potenziali di riduzione). Conseguentemente, la differenza di potenziale interfacciale è definita =
M – S.
TIPO
COSTITUZIONE
Esempio
1° specie
un metallo immerso in una
soluzione di un suo sale
solubile
lamina Cu immerso
in soluzione CuSO4
2° specie
un metallo immerso in una
soluzione di un suo sale
poco solubile
lamina Ag immerso
in soluzione
AgCl/KCl e ricoperto
di AgCl
un metallo inerte immerso
in una soluzione contenente
una coppia redox
lamina Pt immerso in
una soluzione
interessata dalla
semireazione
3° redox
Fe3+ +1e-→ Fe2+
Pagina 17 di 27
Esempio di calcolo del potenziale a 298
K
=
+
0.059
2
=
+
0.059
1
=
+
0.059
1
[
]
[
[
[
]
]
]
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
1.6. Convenzioni per descrivere una pila
Per una pila si scrive, in una stessa riga, tutte le specie presenti, specificandone lo stato fisico (solido,
liquido, gas, soluzione) e le condizioni (pressione, concentrazione)
Pt(s) H2 (g, 1 bar) HCl(aq, 0.1 M) , KCl(aq, 0.2 M) AgCl(s) Ag(s)
Si pongono i conduttori di prima specie agli estremi, con il catodo a dx e l’anodo a sx, riportando in
sequenza le specie coinvolte nei rispettivi processi elettrodici, separando specie presenti nella stessa fase
mediante virgole. La presenza di una separazione tra due fasi (interfaccia) si indica con una barra verticale.
se sono presenti due soluzioni elettrolitiche, la loro separazione mediante setto poroso viene indicata
anch’essa con una barra o, in alternativa, con tre punti in verticale.
Zn ZnSO
(s)
4 (aq, 0.1 M)
CuSO
4 (aq, 0.05 M)
Cu
(s)
Ag(s) AgBr(s) KBr(aq, 0.1 M) ⋮ KCl(aq, 0.1 M) Hg2Cl2 (s) Hg(l)
Ag(s) AgBr(s) KBr(aq, 0.1 M) KCl(aq, 0.1 M) Hg2Cl2 (s) Hg(l)
l’eventuale presenza di un ponte salino viene indicata con una doppia barra
Zn(s) ZnSO4 (aq, 0.1 M) CuSO4 (aq, 0.05 M) Cu(s)
AgBr(s) e Hg2Cl2(s) indicano la presenza di tali sali in fase solida, e ciò significa che le soluzioni con cui sono
a contatto sono sature. Il processo chimico globale della pila va scritto nel senso in cui procede
spontaneamente, considerando quindi che all’elettrodo di dx deve avvenire la riduzione e a quello di sx
l’ossidazione. Per le tre pile sopra riportate si scriverà quindi
AgCl(s) ½H2 (g)Ag(s) HCl(aq)
2Ag(s) 2KBr(aq) Hg2Cl2 (s)2AgBr(s) 2Hg(l) 2KCl(aq)
CuSO4 (aq) Zn(s) Cu(s) ZnSO4 (aq)
Considerando che alcune specie sono presenti in forma dissociata, si può anche scrivere:
AgCl(s) ½H2 (g)Ag(s) H(aq) Cl(aq)
2Ag(s) 2Br(aq) Hg2Cl2 (s)2AgBr(s) 2Hg(l) 2Cl(aq)
Cu(aq) Zn(s) Cu(s) Zn(aq)
Pagina 18 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
2. Determinazione dei G, H e S di pile e del potenziale standard della coppia
Fe(CN)63-\ Fe(CN)64- da misure di f.e.m.
2.1. Termodinamica delle Pile
Una pila è un sistema termodinamico chiuso, in grado di scambiare energia sotto forma di calore (q), lavoro
di volume (wvol) e lavoro elettrico (wel). Per un’analisi termodinamica della pila la trasformazione di energia
chimica in elettrica deve avvenire in modo reversibile. In pratica la pila è reversibile se si verificano queste
tre condizioni:
bilanciando la pila con una sorgente di potenziale opposta ad E non deve aver luogo la reazione
chimica e la corrente elettrica si riduce a zero;
se la differenza di potenziale esterna viene abbassata di un infinitesimo la pila produce una
piccola corrente;
se la differenza di potenziale esterna viene alzata di un infinitesimo la pila produce la stessa
intensità di corrente, ma di segno contrario.
Se consideriamo una pila sottoposta a una pressione esterna costante pest, e a contatto con una riserva termica
(termostato) alla temperatura T, applicando il primo principio della termodinamica a un processo
infinitesimo di scarica spontanea della pila possiamo scrivere, per quanto riguarda la sua variazione di
energia interna:
=
+
=
+
+
dove dq rappresenta il calore scambiato con il termostato (negativo nel caso sia ceduto dalla pila).
Se supponiamo ora che tale processo di scarica venga condotto in modo completamente reversibile, allora si
avrà che:
il lavoro elettrico fatto dalla pila (e quindi negativo) nel passaggio della carica positiva dQ
dall’elettrodo a potenziale più alto (catodo) a quello a potenziale più basso (anodo) è esprimibile come
EdQ, con il termine
che indica la differenza di potenziale tra catodo e anodo. Questo è possibile
perché la scarica è fatta avvenire opponendo alla pila una differenza di potenziale più piccola della forza
elettromotrice E di una quantità infinitesima.
il lavoro di volume che accompagna il processo di scarica (negativo in caso di espansione) risulta pari a
pdV, in quanto, per avere la reversibilità del processo meccanico di espansione o compressione che
accompagna la scarica, la pressione del sistema deve differire da quella esterna di una quantità
infinitesima;
Pagina 19 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
il calore scambiato è pari a TdS, per definizione stessa di entropia, dove dS è la variazione di entropia
associata al processo infinitesimo di scarica e T è la temperatura del sistema, la quale deve differire da
quella del termostato solamente di una quantità infinitesima affinché anche lo scambio di calore sia
reversibile.
=
−
−
Tenendo conto delle definizioni di entalpia (H U pV), e di energia libera di Gibbs (G H TS),
l’espressione del bilancio energetico per la pila si trasforma nella relazione:
=−
la quale indica che, a temperatura e pressione costanti, il lavoro elettrico ottenibile dal sistema in condizioni
di reversibilità (lavoro massimo non di volume) è pari alla variazione di energia libera del processo. La
carica infinitesima dQ che attraversa il sistema è a sua volta legata ai processi faradici che hanno luogo ai
due elettrodi, e quindi alla reazione globale di pila. Se esprimiamo tale reazione come:
0 ni Si
i
dove Si rappresentano i simboli delle varie specie chimiche coinvolte nella reazione di pila (sia reagenti che
prodotti), e ni i relativi coefficienti stechiometrici, considerati quindi con segno positivo per i prodotti e
negativo per i reagenti, allora il legame tra le variazioni dei numeri di moli (ni ) delle specie chimiche
interessate al processo risulta espresso dall’insieme di relazioni:
=
dove con
= ⋯….=
=
si è indicato il termine comune dei rapporti dni /ni . Tale termine serve quindi a rappresentare il
decorso infinitesimo della reazione, al pari di ciascun dni , in modo però non legato a una particolare specie
che prende parte al processo, per cui la grandezza
viene indicata come grado di avanzamento della
reazione.
La carica dQ può quindi essere messa in relazione, sulla base delle leggi di Faraday, oltre che con i
singoli dni , con la quantità
, considerando che:
=
dove z rappresenta il valore comune del numero di elettroni scambiati nelle due semireazioni che
compongono la reazione globale di pila, in corrispondenza di una variazione unitaria del grado di
avanzamento, cioè in corrispondenza della variazione di n1 moli della specie S1, di n2 moli della specie S2, e
così via.
Si ottiene così l’espressione:
=−
Pagina 20 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
definendo il rapporto
=Δ
che rappresenta quindi la variazione di energia libera associata a una variazione unitaria del grado di
avanzamento della reazione di pila, si ottiene infine la relazione:
Δ
=−
Tenendo conto della relazione fondamentale della termodinamica relativa all’energia libera di Gibbs:
=−
a T e p costanti e considerando che
=
=
+∑
+
si ottiene:
∑
=∑
Δ
ovvero
che lega quindi la variazione di energia libera ai potenziali chimici delle specie coinvolte nel processo.
Sulla base dell’espressione Δ
=−
e tenuto conto che in generale vale la relazione:
=−
,
e quindi
∆
∆ =−
,
si ottiene inoltre:
Δ
per cui, essendo ∆
=
,
= ∆ + ∆ si avrà:
Δ
=−
+
,
2.2. Procedura sperimentale
L’esperienza si divide in due parti; nella prima parte gli studenti dovranno seguire la variazione della f.e.m.
di tre pile presenti in laboratorio al variare della temperatura, mentre nel secondo caso gli studenti dovranno
costruire una pila e determinarne la variazione della f.e.m a seguito della variazione delle concentrazioni dei
reagenti in un ramo della pila stessa.
2.2.1. Parte 1: f.e.m al variare della temperatura.
In laboratorio sono presenti 3 differenti pile, che sono state precedentemente assemblate in quanto
comportano l’utilizzo di amalgama di metalli, la cui preparazione necessita tempo e una certa esperienza
nell’utilizzo del mercurio. Le pile sono:
Pagina 21 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
1. Pt|Cd(Hg)(l)|CdCl2 (aq. 0.1M) ||CdCl2 (aq. 0.1M) |AgCl (s)|Ag(s)
2. Pt|Zn(Hg)(l)|ZnSO4 (aq. 0.1M)||ZnSO4 (aq. 0.1M)|Hg2SO4 (s)|Hg(s)|Pt
3. Pt|Zn(Hg)(l)|ZnSO4 (aq. 0.1M) ||ZnSO4 (aq. 0.1M)|PbSO4 (s)|Pb(Hg)(l)|Pt
Le pile sono reattori a forma di H con due rami per il comparto anodico e catodico separati da un setto
poroso che evita il rimescolamento delle soluzioni. Ogni ramo è costituito da una soluzione elettrolitica, da
un elettrodo metallico (metallo o amalgama) e da un connettore elettrico. Si può notare che laddove si
utilizza un’amalgama di un metallo viene utilizzato un elettrodo di Pt come contatto elettrico, in quanto il
platino stesso non dà amalgama con il mercurio. L’utilizzo delle amalgame è reso necessario dal fatto che i
processi di trasferimento elettronico risultano più veloci che non con i rispettivi metalli, questo comporta una
maggiore velocità nel raggiungimento dell’equilibrio. Quindi avrò che i potenziali standard anche se di poco
saranno diversi tra metalli puri e metalli in amalgama ad esempio
+2
+2
⇄
⇄
+
(
)+
= 0.3588
= 0.3505
Figura 1: pila disponibile in laboratorio e annesso bagno termostatico
Mentre per determinare il valore di Δ
ad una particolare temperatura ( ) è sufficiente effettuare la misura
della f.e.m. della pila, E , a tale temperatura, per determinare le quantità Δ
e Δ
è invece necessario
effettuare misure di E in un intervallo di temperatura contenente quella considerata. Gli studenti troveranno
le pile immerse in un bagno termostatico alla temperatura di circa 16°C; ogni gruppo dovrà scegliere una
postazione a cui corrisponde una sola pila. Per ogni postazione è presente anche un multimetro digitale e due
cavetti. Come prima cosa lo studente dovrà riconoscere in base alla serie elettrochimica quale dei due rami
della pila funge da catodo e quale da anodo e collegare quindi i due poli al multimetro in maniera che la f.e.m
risultante abbia il segno atteso. Il multimetro dovrà essere settato in maniera che solo l’ultima cifra
significativa abbia una certa variabilità. La prima lettura può essere effettuata immediatamente in quanto il
Pagina 22 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
sistema è già all’equilibrio; lo studente dovrà annotare con cura la temperatura effettiva del bagno Tp con
relativa incertezza e 10 misure ripetute per la f.e.m. Effettuata la prima misura, lo studente dovrà settare il
bagno termostatico alla temperatura successiva e quindi dopo aver concesso al sistema di raggiungere la
condizione di equilibrio (10-15 min) si effettuerà una seconda lettura. Le rilevazioni di Tp e f.e.m. dovranno
essere effettuate in un range di temperature 15-50°C. Lo studente è libero di scegliere i T, tuttavia si
consiglia di variare la temperatura di 4-5° per volta in maniera da avere almeno 8 punti per l’elaborazione
finale.
In fase di elaborazione si dovranno determinare i valori medi delle f.e.m a ciascuna temperatura con la
relativa incertezza e riportare i dati in un grafico in cui i valori di f.e.m. sono la variabile dipendente mentre i
valori di temperatura assoluta Tp saranno la variabile indipendente (Figura 2).
b
a
Figura 2: plot f.e.m. vs T per due diverse tipologie di pile.
Per quanto riguarda la forma analitica della funzione ( ) questa può avere andamento lineare (Figura 2a)
o quadratico (Figura b). Un andamento lineare si ottiene quando le capacità termiche
di reagenti e
prodotti non sono molto diverse tra loro. In generale le capacità termiche vengono espresse come:
,
=
,
Poiché Δ = ∑
=
,
Se si può supporre che ∆
∑
=
∆
sia abbastanza piccolo da poter ritenere Δ
praticamente costante allora in
questo caso la funzione assume una forma del tipo
( )=
+
e la pendenza
=
,
rappresenta il coefficiente termico della f.e.m. stessa ed è indipendente dalla temperatura. La pendenza della
Pagina 23 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
retta E (T ) può assumere un valore positivo o negativo a seconda della tipologia di pila.
Se l’andamento di E contro T non risultasse lineare (Figura 2b), ma presentasse una significativa curvatura
anche in un ristretto intervallo di temperature, Δ
non può essere ritenuto costante; in tal caso, il
coefficiente di temperatura della pila deve essere determinato come pendenza della retta tangente alla curva
rappresentativa della funzione ( ) in corrispondenza del particolare valore di temperatura considerato. In
questo caso sarà necessario applicare la regressione supponendo che l’equazione che soddisfa i dati sia di
tipo parabolico:
( )=
+
+
=
+2
ed il coefficiente termico della pila sarà dato da
,
Quindi i valori di
=
, Δ
e Δ
dovranno essere riportati con le rispettive incertezze. Inoltre poiché
, è di conseguenza possibile ottenere anche il valore della costante di equilibrio del processo
globale; anche questa dovrà essere riportata con l’opportuna incertezza. Si raccomanda che tutti i dati e le
elaborazioni vengano riportati con il corretto numero di cifre significative e le rispettive incertezze, il
procedimento utilizzato per la propagazione degli errori dovrà essere riportato in appendice alla relazione in
modo che sia chiaro al docente come lo studente sia arrivato a tale risultato.
2.2.2. Parte 2: f.e.m al variare della concentrazione.
La prima parte dell’esperienza non comporta un impegno attivo dello studente nella preparazione della pila,
questo comporta tempi di attesa nei quali lo studente potrà preparare le soluzioni per costruire una pila del
tipo
Pt|Hg(l)|Hg2Cl2(s)|Cl(sat) ||KNO3 (l, 0.5M) || Fe(CN)64-( KNO3, 0.5M), Fe(CN)63- ( KNO3, 0.5M) |Pt
Il ramo anodico della pila corrisponde ad un elettrodo di riferimento SCE commerciale che lo studente
troverà in laboratorio già assemblato, mentre il ramo catodico della pila è costituito da un elettrodo redox
immerso in una soluzione a rapporto variabile della coppia redox
(
)
/
(
)
Figura .
Gli studenti in laboratorio avranno a disposizione per ogni work station la seguente strumentazione:
Multimetro digitale utilizzato in concomitanza con la prima parte della misura
Staffa e pinza porta cella
Cella elettrochimica ad H dota di rubinetto per lo scarico
Elettrodo di riferimento
Matraccio da 100 mL, 2 matracci da 50 mL, 7 matracci da 25 mL, pippetta tarata da 10, 5 ed 1 mL,.
Pagina 24 di 27
( )
( )
( )
, elettrodo redox di Pt,
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
Becker per raccolta reflui e lavaggi, salviettine morbide per pulizia elettrodi
reagenti KNO3, K3Fe(III)(CN)6, K4Fe(II)(CN)63H2O, acqua bidistillata
propipetta, imbutino, pesafiltri
Figura 3: cella ad H con sistema di scarico e cella ad H con elettrodo SCE.
Si preparano tre matracci “madre”
100 mL 0.25 M KNO3 – 2.53 g
50 mL 0.05 M K3Fe(CN)6 – 0.8231 g
50 mL 0.05 M K4Fe(CN)63H2O – 1.055 g
Dalle soluzioni madre si prepareranno le successive soluzioni di misura in 7 matracci così composti (sono
sufficienti una pipetta da 10, una da 5 e una da 0.5 mL)
N
KNO3
mL
K3Fe(III)(CN)6
mL
K4FeII(CN)63H2O
mL
1
2
3
4
5
6
7
10
10
10
10
10
10
10
0.2
0.5
1.5
2.5
3.5
4.5
4.8
4.8
4.5
3.5
2.5
1.5
0.5
0.2
Preparare tutte le soluzioni, riempire il comparto anodico con circa 20 mL di soluzione di KNO3 e inserire
l’elettrodo di riferimento SCE (il setto deve essere almeno in parte bagnato dalla soluzione!). Il comparto
catodico provvisto di rubinetto di scarico va riempito con la soluzione 1 contenete la soluzione redox e
quindi si inserisce l’elettrodo di platino. Preparata la pila ci connetterà il multimitro con la corretta polarità in
maniera da ottenere una f.e.m. con il corretto segno. Si dovrà attendere un breve tempo che la cella vada
Pagina 25 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
all’equilibrio e quindi si procede alla lettura della misura. Si dovranno effettuare 5 rilevazioni.
Successivamente si dovrà svuotare la semicella catodica e lavare accuratamente l’elettrodo di Pt e la
semicella stessa con acqua bidistillata il tutto senza rimuovere la pila dal suo sotegno. Si avvina con qualche
mL della soluzione 2 (non più di 2-3 mL), e poi si procede alla nuova misura. È importante controllare la
temperatura dell’ambiente alla quale vengono effettuate le misure in quanto il sistema non è termostatato. Se
non si lavora in velocità, dopo un po’ della soluzione catodica può diffondere nel comparto anodico. Non è
un grave problema in quando l’elettrodo di riferimento è in un setto diviso, tuttavia ci possono essere delle
derive nel dato (a causa della diversa mobilità dei due ioni), quindi è bene registrare la misura in non più di
un minuto.
Il valore medio dei dati di f.e.m. così registrati per ogni rapporto [Fe(CN)63-]/[Fe(CN)64-] devono essere
portati in grafico come in Figura contro il logQ dove
=
[Fe(CN) ]
[Fe(CN) ]
Si dovrà osservare un andamento lineare che può essere interpolato con una funzione del tipo
( )=
+ ∙
Questa equazione ha la stessa forma dell’equazione di Nernst:
=
+ 2.303
log
[Fe(CN) ]
[Fe(CN) ]
Si dovrà quindi determinare il valore di
, che corrisponde al potenziale standard della coppia
Fe(CN)62+/Fe(CN)63+ quando = 1 e calcolare il suo valore rispetto all’elettrodo standard ad idrogeno
(NHE). Sapendo che
=−
determinare anche l’energia libera standard di reazione.
Pagina 26 di 27
Dispense di Laboratorio di Chimica Fisica, A.A. 2016-2017
E vs SCE (V)
0.25
0.20
0.15
0.10
-1.5
-1.0
-0.5
0.0
0.5
1.0
1.5
logQ
Figura 4: andamento della E vs logQ.
Quindi i valori di
e
dovranno essere riportati con il corretto numero di cifre significative ed
incertezze. Il procedimento utilizzato per la propagazione degli errori dovrà essere riportato in appendice alla
relazione in modo che sia chiaro al docente come lo studente sia arrivato a tale risultato.
Pagina 27 di 27