Spettroscopia NMR
(Risonanza Magnetica Nucleare)
•studia l’assorbimento della radiazione a radiofrequenze da parte di
molecole quando i loro atomi sono orientati da un campo magnetico
applicato.
•rispetto alle altre tecniche (es. IR, UV), fornisce un maggior numero
di informazioni di tipo strutturale utili all’identificazione di un composto
organico.
•Dallo spettro NMR di un composto si possono ottenere informazioni
qualitative e quantitative.
•inoltre, conducendo esperimenti sofisticati, è possibile risalire alla
conformazione di molecole molto complesse.
Rabi
Fisica 1944
Ernst
Chimica 1991
Lauterbur
Medicina 2003
Purcell
Fisica 1952
Bloch
Fisica 1952
Wutrich
Chimica 2002
Mansfield
Medicina 2003
Spettroscopia NMR
(Risonanza Magnetica Nucleare)
Momento angolare di spin
Le particelle elementari che compongono gli atomi, come
elettroni, protoni e neutroni, hanno alcune proprietà di
base:
•Massa
•Carica elettrica (protoni ed elettroni)
•Momento angolare di spin
Il momento angolare di spin può essere
rappresentato intuitivamente come
un movimento di rotazione intorno al
proprio asse della massa
UN PO’ DI RIPASSO:
?????????
Il numero quantico principale n definisce il livello di energia dell'elettrone e la
dimensione degli orbitali. Può assumere valori interi positivi: n = 1, 2, 3, 4, 5, 6 ……
Il numero quantico secondario l stablisce il numero dei sottolivelli in cui si differenzia
ciascun livello. Ogni sottolivello raggruppa orbitali della stessa forma definita dal valore di
l compreso tra 0 e (n – 1). Ogni sottolivello corrispondente a ciascun valore di l viene
indicato con una lettera minuscola secondo il seguente schema: valore di l=0 1 2 3 4
simbolo s p d f g Si parla quindi di orbitali di tipo s, orbitali di tipo p, orbitali di tipo d
ecc.
Il numero quantico magnetico m. Determina il numero di orbitali appartenenti a ciascun
sottolivello e il loro orientamento nello spazio. Gli orbitali di uno stesso sottolivello sono
isoenergetici (degeneri); m può assumere tutti i valori interi da -l a +l, compreso lo zero.
Per esempio, per l = 1, m = -1, 0, +1, ossia al sottolivello p appartengono tre orbitali
degeneri orientati secondo gli assi cartesiani: px, py, pz.
Il numero quantico di spin, ms è legato al senso della rotazione, orario o antiorario,
dell'elettrone attorno al proprio asse. Esso può assumere valore +1/2 e -1/2. Ogni orbitale
può contenere al massimo due elettroni (doppietto elettronico) con spin opposto.
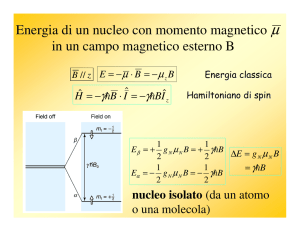
Proprietà magnetiche dei nuclei
I nuclei che posseggono una massa dispari o una carica dispari o
entrambe si comportano come se fossero in rotazione (spin)
attorno all’asse nucleare.
Essi posseggono un momento
angolare di spin quantizzato P
Proprietà magnetiche dei nuclei
Il momento magnetico m è proporzionale al
momento di spin
m=gP
La costante di proporzionalità tra il momento
magnetico m ed il momento angolare nucleare
P è detta rapporto giromagnetico (g)
Nella visione classica, un nucleo ruotando
intorno al proprio asse (moto di spin)
genera un campo magentico microscopico
ed è equivalente ad una barretta
magnetica il cui asse cocnide con l’asse
di rotazione.
Si parla cioè di dipolo magnetico nucleare
Momento magnetico
Il momento magnetico (chiamato anche momento di
dipolo magnetico e indicato dalla lettera greca μ) è un
vettore che caratterizza le proprietà magnetiche di un
corpo: in una barra magnetica, per esempio, il verso
del momento magnetico è diretto dal polo sud al polo
nord della barra.
http://vam.anest.ufl.edu/forensic/nmr.html
m
Momento magnetico
Il modulo del momento magnetico è fisso per ogni nucleo, e non può
cambiare in nessun modo.
Può cambiare l’orientazione che il vettore momento magnetico può assumere
nei confronti di una direzione esterna z.
Campo magnetico spento
Campo magnetico acceso
Momento magnetico
Il modulo del momento magnetico è fisso per ogni nucleo, e non può
cambiare in nessun modo.
Può cambiare l’orientazione che il vettore momento magnetico può assumere
nei confronti di una direzione esterna z.
Numero quantico di spin
Questa orientazione è quantizzata, ed il vettore momento magnetico può
assumere solo
2I+1 orientazioni,
dove il numero quantico di spin I è una costante fisica per ogni nucleo
Elemento
1H
2H
12C
13C
14N
16O
17O
N° massa
1
2
12
13
14
16
17
N°carica
1
1
6
6
7
8
8
0
1/2
0
5/2
Numero
quantico
di spin
(I)
1/2
1
1
Numero di massa pari e numero di carica pari I=0
Numero quantico di spin
Questa orientazione è quantizzata, ed il vettore momento magnetico può
assumere solo
2I+1 orientazioni,
dove il numero quantico di spin I è una costante fisica per ogni nucleo
Elemento
1H
2H
12C
13C
14N
16O
17O
N° massa
1
2
12
13
14
16
17
N°carica
1
1
6
6
7
8
8
0
1/2
0
5/2
Numero
quantico
di spin
(I)
1/2
1
1
Numero di massa pari e numero di carica dispari I intero
Numero quantico di spin
Questa orientazione è quantizzata, ed il vettore momento magnetico può
assumere solo
2I+1 orientazioni,
dove il numero quantico di spin I è una costante fisica per ogni nucleo
Elemento
1H
2H
12C
13C
14N
16O
17O
N° massa
1
2
12
13
14
16
17
N°carica
1
1
6
6
7
8
8
0
1/2
0
5/2
Numero
quantico
di spin
(I)
1/2
1
1
Numero di massa dispari I semiintero
A ogni numero quantico di spin sono associati degli
stati di spin -I<m<+I (Δm=±1)
A ogni numero quantico di spin sono associati degli
stati di spin -I<m<+I (Δm=±1)
m=-1
m=0
m=1
La Spettroscopia NMR si basa sul fatto che i nuclei atomici possono
essere orientati in un campo magnetico* (B0) e assorbire una
radiazione a radiofrequenze ad una determinata frequenza.
Fenomeno di
Risonanza Magnetica
B0
DE
hn=DE
Radiazione spenta
La transizione avverra’ quando
hn= DE, e comportera’ un
assorbimento di energia
Processi di
Rilassamento
Magnetico
* Lo spazio entro il quale un magnete esercita la sua azione prende il nome di Campo magnetico
I=1/2
I=1/2
In presenza di campo magnetico
In assenza di campo magnetico
2I+1=2*1/2+1=2
Precessione del Momento
Magnetico Nucleare
B0
I=1/2
In presenza di campo magnetico
La frequenza di precessione è
chiamata frequenza di Larmor
n=(g/2p)B0
Quantizzazione dell’Energia
Popolazione dei livelli energetici
b
DE1
DE2
B0
a
Popolazione dei livelli energetici
b
DE1
DE2
B0
a
Popolazione dei livelli energetici
b
DE1
DE2
B0
a
Poiché i due stati di spin hanno energia diversa, è quindi
possibile indurre il passaggio da uno stato all’altro
mediante un quanto di radiazione elettromagnetica di
frequenza
DE gB0 gB0
n
h
h
2p
LA SENSIBILITA’
Principale problema della spettroscopia NMR
Distribuzione di Boltzmann
Nb
Na
e
DE
kT
DE
1
kT
Nb
Na
1
gB0
kT
LA SENSIBILITA’
Principale problema della spettroscopia NMR
b
Distribuzione di Boltzmann
Nb
Na
e
DE
kT
DE
1
kT
Nb
Na
1
gB0
kT
hn
hn
hn
hn
hn
a
b b
a b
b
a
a ba
a b
b
a
b a
a
b a
a b
b a
b
a
a
hn
hn
hn
hn
LA SENSIBILITA’
Principale problema della spettroscopia NMR
Distribuzione di Boltzmann
Nb
Na
e
DE
kT
DE
1
kT
Nb
Na
1
gB0
kT
LA SENSIBILITA’
Principale problema della spettroscopia NMR
Distribuzione di Boltzmann
Nb
Na
e
DE
kT
DE
1
kT
La sensibilità di un
esperimento NMR
aumenta:
• all’aumentare del campo
applicato;
•all’aumentare del
rapporto giromagnetico
Nb
Na
1
gB0
kT
DE gB0
PRINCIPI BASILARI DI UN ESPERIMENTO NMR
Come si induce una transizione tra differenti livelli energetici?
•Nell’NMR cio’ viene realizzato attraverso l’irradiazione del nucleo con una
radiazione a radiofrequenze (r.f) la cui componente magnetica possa interagire
con i dipoli nucleari.
•La transizione avrà luogo quando hn= DE; ciò comporterà un assorbimento di
energia. In pratica la frequenza n della radiazione a r.f. dovra’ essere uguale alla
frequenza di Larmor (ogni transizione comporta un cambiamento di spin)
•Secondo le regole di selezione, saranno permesse solo le transizioni in cui il numero
quantico m vari di 1: Dm = 1
Spettrometro NMR
900 MHz (21.2 T)
Spettroscopia NMR in trasformata di Fourier (FT)
Il campione viene eccitato mediante pulsi di RF
di durata molto breve (ms).
Il segnale rivelato dallo spettrometro è quello rilasciato dai nuclei
durante la fase di rilassamento
(ritorno all’equilibrio).
FID
F (n )
f (t ) exp( i 2pnt )dt
Freq. Larmor
Spettroscopia NMR in trasformata di Fourier (FT)
Vi sono persone in grado di riconoscere le singole note nel caso di piu' note suonate
contemporaneamente, anche se questo processo diventa piu' difficile all'aumentare delle
note
Provate a suonare più note simultaneamente. Riuscireste a dire quali frequenze
sono state suonate? La trasformata di Fourier puo' farlo!
Cambiate ora le ampiezze relative delle note. Riuscireste a determinare le
intensita' relative delle note con il vostro orecchio? La trasformata di Fourier puo'
farlo!
L'operazione effettuata dalla trasformata di
Fourier puo' essere assimilata ad un musicista che
ascolta un insieme di toni (segnale nel dominio del
tempo) e ne determina le note (contenuto in
frequenza).
La trasformata inversa di Fourier puo' essere
assimilata ad un musicista che vede le note
(frequenze) sullo spartito musicale e le converte in
toni (segnali nel domino del tempo).
Spettroscopia NMR in trasformata di Fourier (FT)
Vi sono persone in grado di riconoscere le singole note nel caso di piu' note suonate
contemporaneamente, anche se questo processo diventa piu' difficile all'aumentare delle
note
Provate a suonare più note simultaneamente. Riuscireste a dire quali frequenze
sono state suonate? La trasformata di Fourier puo' farlo!
Cambiate ora le ampiezze relative delle note. Riuscireste a determinare le
intensita' relative delle note con il vostro orecchio? La trasformata di Fourier puo'
farlo!
L'operazione effettuata dalla trasformata di
Fourier puo' essere assimilata ad un musicista che
ascolta un insieme di toni (segnale nel dominio del
tempo) e ne determina le note (contenuto in
frequenza).
La trasformata inversa di Fourier puo' essere
assimilata ad un musicista che vede le note
(frequenze) sullo spartito musicale e le converte in
toni (segnali nel domino del tempo).
Spettroscopia NMR in trasformata di Fourier (FT)
Spettroscopia NMR in trasformata di Fourier (FT)
Se tutti i nuclei dello stesso tipo di una
molecola precedono alla stessa
frequenza di risonanza
quanti segnali ci aspettiamo di
trovare nel corrispondente
spettro NMR?
Es. Quanti segnali ci aspettiamo
dallo spettro
1H-NMR dell’ etanolo
(CH3-CH2-OH)?
LO SPOSTAMENTO CHIMICO (CHEMICAL SHIFT)
Nonostante tutti i nuclei di una certo tipo
(per esempio 1H) siano esattamente identici,
essi risuonano a frequenze leggermente
diverse purché si trovino in intorni chimici
differenti.
Sotto l’influenza del campo magnetico
esterno gli elettroni tendono ad
assumere un movimento rotatorio, e
ruotando generano essi stessi un campo
magnetico.
Il campo magnetico generato si oppone al campo magnetico esterno
Pertanto, il nucleo sarà sottoposto ad un campo magnetico effettivo
minore di quello applicato, è cioè schermato dagli elettroni.
http://faculty.ccc.edu/cabrams/projects/nmrtutor/INTRO.dcr
SCHERMAGGIO
CAMPO MAGNETICO
EFFETTIVO
Beff=B0(1-s)
s= costante di schermo
che dipende dalla
struttura elettronica in prossimità
del nucleo in esame
FREQUENZA DI LARMOR
EFFETTIVA
neff=n0(1-s)
LO SPOSTAMENTO CHIMICO
LO SPOSTAMENTO CHIMICO
La posizione del centro del segnale NMR è chiamata
spostamento chimico (chemical shift, d) e viene espressa in
ppm:
d
(n campione n riferimento )
n spettrometro
*10
riferimento=tetrametilsilano (TMS) Si(CH3)4
6
n=g/2pB0
CHEMICAL SHIFT PROTONICO
d-
d
Il principale fattore che determina il
chemical shift di un protone è la densità
elettronica del relativo idrogeno.
Cl Cd- Hd
Elemento
elettronegativo
Composto CH3X
CH3F
Elemento X
F
Elettronegatività of X
4.0
3.5
3.1
4.26
3.40
3.05
Chemical shift
d
Più
deschermati
CH3OH
O
CH3Cl
Cl
CH3Br
Br
CH3I
CH4
(CH3)4Si
I
H
Si
2.8
2.5
2.1
1.8
2.68
2.16
0.23
0
TMS
CHEMICAL SHIFT PROTONICO
idrogeni alifatici primari, secondari e terziari
risuonano a valori di ppp via via più alti.
L’elettronegatività del carbonio è bassa per cui
tutti e tre i tipi d idrogeno si trovano al di sotto dei
2 ppm
CHEMICAL SHIFT PROTONICO
Come nel caso delle spettroscopie di assorbimento anche per l’NMR è possibile formulare
alcune regole di additività che permettono di prevedere, con ragionevole approssimazione , il
chemical shift dei vari nuclei.
Per quanto riguarda la spettroscopia protonica il calcolo è ristretto a 1) derivati metilenici
derivati metilenici 2) derivati etilenici.
REGOLE DI SHOOLERY PER I DERIVATI METILENICI
Serve per calcolare il chemical shift di derivati del tipo X-CH2-Y. Si parte dal c.s. del metano (
0.233 ppm) e si addizionano i contributi tabulati per i vari sostituenti:
d=0.233+Somma(contributi)
-C
0.248
-C-C
0.244
c
c-C
c
c
c-C
0.147
0.006
ANISOTROPIA DI CHEMICAL SHIFT
I protoni olefinici (legati a carboni sp2) hanno chemical shifts molto più
alti dei protoni legati a carboni sp3, con valori tipici di d 5-6 ppm. Ciò è
dovuto alla nuvola elettronica p che può generare campi magnetici
relativamente intensi.
I protoni sono
deschermati
H
H
C=C
H
BO
H
Linee di forza del
campo magnetico
indotto
CORRENTE DI ANELLO NEL BENZENE
elettroni p
DeschermatI
H
B0
H
Linee di forza del campo
magnetico indotto dagli
elettroni p
http://faculty.ccc.edu/cabrams/projects/nmrtutor/BENZENE.dcr
Riassumendo…………………….
Riassumendo…………………….
aumenta d
aumenta lo schermaggio
INTEGRAZIONE
L’intensità di un segnale nello spettro NMR protonico è
proporzionale al numero di protoni che lo genera.
CH3OH
metanolo
CH3OH
metanolo
3
1
CH3CH2OH
etanolo
1H-NMR
CH3CH2OH
etanolo
1H-NMR
Es. HO-CH2-
Es HO-CH3
CH3CH2OH
OH
CH2
il protone dell’OH è ancora
meno schermato. Qui
scambia “rapidamente” con
le altre molecole ed è quindi
disaccoppiato dagli altri
nuclei
I protoni del metilene sono
meno schermati di quelli
del metile (d più grande).
Quartetto 1:3:3:1 per
accoppiamento con il CH3
CH3
Tripletto 1:2:1 per
accoppiamento con
il CH2
Integrali dei multipletti. Sono proporzionali al
numero di nuclei che contribuiscono al
multipletto.
CH3CH2OH
STRUTTURA FINE & ACCOPPIAMENTO SCALARE
(SPIN-SPIN)
deriva dall’interazione magnetica tra i nuclei presenti nella molecola
e viene trasmesso attraverso la polarizzazione degli elettroni di legame
un gruppo di N nuclei magneticamente equivalenti scompone il
segnale NMR di un nucleo o un gruppo di nuclei non
magneticamente ai primi in 2NI+1 componenti.
nuclei magneticamente equivalenti
stesso chemical shift e stesso accoppiamento con altri gruppi di nuclei
nella stessa molecola.
n A ,n B
3 nuclei A
equivalenti
2 nuclei B
equivalenti
frequenze di risonanza
NMR
Se tra i due gruppi di nuclei non ci
fosse accoppiamento...
nA
nB
Ma se c’è accoppiamento, i nuclei A risentono della situazione dei nuclei
B, e viceversa. In tal caso ogni riga dovuta ad un gruppo di nuclei
equivalenti si separa (splitting) in un numero di righe corrispondente ai
diversi stati di spin del gruppo vicino.
3 nuclei A
equivalenti
2 nuclei B
equivalenti
nA
Gli integrali dei
due multipletti
stanno nello
stesso rapporto
del numero di
protoni
equivalenti
corrispondenti
J=0
nB
3 : 2
J0
J
1
J
2
J
1
Tripletto di righe
1
J
3
J
3
Quartetto di righe
1
Accoppiamenti uguali con nuclei vicini
J(Hz)
costante di accoppiamento scalare
Poiché l’ accoppiamento spin-spin è
dovuto alle interazioni tra i momenti
magnetici nucleari, che sono
indipendenti dal campo magnetico
applicato B0, le costanti di
accoppiamento J sono indipendenti dal
campo magnetico applicato e risultano
uguali in qualunque spettrometro.
Il valore di J decresce con l’aumentare
del numero di legami tra i nuclei
accoppiati
Functional Group
JHH (Hz)
6–8
11 – 18
6 – 15
4 – 10
6 – 10
8 – 11
a,a: 8 - 14
a,e: 0 - 7
e,e: 0 – 5
cis: 6 - 12
trans: 4 - 8
TRIANGOLO DI PASCAL
Le intensità relative dei segnali di un multipletto generato
dalla vicinanza di N nuclei a spin ½ possono essere previste
sulla base dei valori numerici del TRIANGOLO DI PASCAL
Numero e intensità delle righe
numero di H
1
0
1
1
1
2
3
1
4
5
1
1
2
3
4
5
1
1
3
6
10
1
4
10
1
5
1
ecc.
I=1/2
Triangolo di
Pascal
Se due nuclei (o gruppi di nuclei) non chimicamente
equivalenti accoppiano con il medesimo nucleo (o gruppo di
nuclei), l’effetto dei nuclei va considerato separatamente.
esempio
CH3CH2CH2CH2…….
Accoppiamenti diversi con nuclei vicini
spettro del primo ordine
le differenze in chemical shift sono maggiori della costante di
accoppiamento (d»J), e l’identificazione dei nuclei magneticamente
equivalenti e´ di facile risoluzione.
•Molteplicità 2nI+1
•Triangolo di Pascal se I=1/2
•Segnali equidistanti
spettro di ordine superiore
le differenze in chemical shift sono comparabili con le costanti di
accoppiamento (d≤J) e l’attribuzione dei segnali risulta più
complicata. In tal caso bisogna ricorrere all'analisi quanto
meccanica dello spettro.
CH3
CH3
13C-NMR
2,2-DIMETILBUTANO
STRUTTURA FINE DEGLI SPETTRI 13C-NMR
Accoppiamento 1JCH
Dominante negli spettri NMR del 13C
Spettro 13C
Accoppiato
Spettro 13C
Accoppiato
Spettro 13C
Disaccoppiato
I TEMPI DI RILASSAMENTO T1 E T2
L’energia assorbita dai nuclei sottoposti alla risonanza magnetica viene
dissipata mediante processi di rilassamento magnetico nucleare, che
regolano il ritorno all’equilibrio della magnetizzazione. Questi processi
sono chiamati
•Rilassamento spin-reticolo (che comporta uno scambio di energia tra il
nucleo e l’ambiente circostante)
•Rilassamento spin-spin (che comporta uno scambio diretto di energia
elettromagnetica tra gli spin nucleari)
I due processi sono rispettivamente regolati da due constanti di tempo T1
e T2 il cui valori dipendono dalla struttura molecolare del campione e dal
suo stato di aggregazione (solido, liquido)
NMR in biologia
Nei campioni biologici ha permesso l’identificazione di composti di rilevanza
farmacologica-tossicologica (es. ricerca di un farmaco, pesticidi, droghe d’abuso,
veleni).
Attraverso l’identificazione di biomarcatori in patologie oncologiche è possibile
diagnosticare alcune forme di cancro.
Informazioni sulla possibilità di molecole di piccole dimensioni di legarsi
ad un recettore proteico alterandone la funzionalità.
La risonanza magnetica nucleare viene utilizzata per
determinare la struttura di macromolecole
NMR di biomolecole
Etanolo
Problema: Come si fa ad
assegnare tutti i segnali di uno
spettro NMR di una proteina?
SPETTROSCOPIA NMR BI-DIMENSIONALE
2D-NMR
3
Etil crotonato
2
5
4
6
glicina
isoleucina
valina
glicina
isoleucina
leu
valina
val
Spettro NMR di una Miscela di aminoacidi???
Esempio: Estratto acquoso di Bottarga (amino acidi, nucleotidi, ac.organici,…)
HETeronuclear CORrelation(COSY 1H-13C)
HETCOR
HETCOR non è altro che la versione eteronucleare dell’esperimento di
correlazione COSY.
La tecnica Hetcor correla gli shifts del 13C con quelli dell’1H attraverso
l’accoppiamento tramite un legame. Gli shifts dei carboni e degli idrogeni che
sono legati l’uno all’altro sono letti come segnali fuori diagonale.
Tale tecnica permette di misurare gli shifts dei due nuclei in un solo
esperimento, e allo stesso tempo permette di stabilirne la connettivita’.
HETeronuclear CORrelation(COSY 1H-13C)
J-resolved Spectra