AreaPediatrica | Vol. 14 | n. 1-2
| gennaio-giugno 2013 30
Caso clinico Titolo articolo anche lungo
[ come
s i fa
]
Nuove metodiche diagnostiche
nella tubercolosi pediatrica
L
a tubercolosi (TBC) è una patoSilvia Martini
o condizioni di immunodeficienza
Dipartimento
di
Scienze
Ginecologiche,
logia infettiva sostenuta da micobatteri
congenita) i micobatteri possono soOstetriche e Pediatriche,
tubercolari e trasmessa per via aerogepravvivere in maniera silente all’inUniversità degli Studi, Bologna
email: [email protected]
na che colpisce primitivamente i polmoni, da
terno dei macrofagi, determinando
cui può tuttavia diffondere ed interessare altri
la condizione di infezione latente
distretti quali l’apparato osteoarticolare, le meningi o le
(LTBI), oppure possono proliferare dando origine alla
stazioni linfonodali, prendendo il nome di TBC extramalattia tubercolare vera e propria.
polmonare. Benché diversi tipi di micobatteri possano
Il sistema immunitario dei bambini, specialmente se
causare la malattia tubercolare, l’agente eziologico di più
di età <2 anni, è ancora alquanto immaturo, pertanto il
frequente riscontro nelle infezioni umane è il Mycobacterischio di progressione da infezione a TBC attiva è molrium tuberculosis (MT). Del complesso MT fanno parte, to elevato; nella maggior parte (>90%) dei casi osservaoltre a tale bacillo, anche le specie M. bovis, M. africanum
ti in età pediatrica la malattia si sviluppa entro 1 anno
ed i più rari M. microti, M. caprae e M. canettii1,2, mentre
dall’infezione primaria3 e si manifesta con la comparsa di
manifestazioni cliniche caratteristicamente persistenti4.
in altri casi l’infezione può essere sostenuta dai cosiddetti
Le manifestazioni cliniche polmonari della TBC
micobatteri non tubercolari (MNT), come M. marinum,
comprendono generalmente una riduzione del murmure
M. kansasei o M. flavescens.
vescicolare variamente associata a rantoli, ottusità alla
percussione e aree di iperinsufflazione/atelettasia secondarie alla compressione del parenchima da parte delQuadro clinico
le linfoadenopatie ilari; nei bambini, tuttavia, la TBC
ella pratica clinica si definisce “infetto” un
polmonare si manifesta frequentemente con sintomi più
soggetto che ha avuto un contatto certo con il miaspecifici, quali tosse persistente, produttiva e non, scarso
cobatterio tubercolare, senza tuttavia sviluppare manifeaccrescimento ponderale, febbre e sudorazioni notturne,
stazioni cliniche o specifici segni radiografici. Il risultato
astenia5,6, contribuendo a ritardarne la diagnosi clinica. Nel sospetto di TBC polmonare l’esecuzione di un
più comune dell’infezione iniziale è la TBC polmonare
esame radiologico del torace in duplice proiezione è di
primaria, caratterizzata da un processo infiammatorio
fondamentale importanza; il reperto più caratteristico è
essudativo generato dalla risposta immunitaria specificostituito da cospicue linfoadenopatie ilari che, laddove
ca che consegue alla fagocitosi macrofagica dei bacilli
determinino la compressione delle vie aeree adiacenti,
tubercolari, con formazione del cosiddetto granuloma
possono associarsi a quadri di iperinsufflazione o atetubercolare; i micobatteri contenuti all’interno dei macrolettasia localizzata3. Possono inoltre coesistere aree di
fagi possono inoltre migrare verso le stazioni linfonodali
addensamento parenchimale o versamenti pleurici che,
locoregionali, determinando linfoadenopatie ilari e pase evacuati con la toracentesi, mostrano una natura tipiratracheali. In presenza di un’adeguata immunità di tipo
camente essudativa7.
cellulo-mediato la completa eradicazione dei micobatteri
La disseminazione linfoematogena dell’infezione detubercolari è possibile; se tuttavia la risposta immunitaria
termina il quadro della TBC extrapolmonare, che in età
risulta variamente inficiata (per es. in caso di infezione da
pediatrica costituisce il quadro clinico più frequente e si
HIV, immunodepressione iatrogena, patologie croniche
AreaPediatrica | Vol. 14 | n. 1-2
| gennaio-giugno 2013 31
N
Come si fa
Nuove metodiche diagnostiche nella tubercolosi pediatrica
manifesta soprattutto con interessamento dei linfonodi
laterocervicali (scrofola), dei tessuti ossei o delle meningi.
La meningite tubercolare, in particolare, costituisce la
complicanza più severa dell’infezione tubercolare prima
dei 2 anni di vita; il riscontro alla rachicentesi di liquor
limpido con pleiocitosi linfocitaria, ipoglicorrachia ed
iperprotidorrachia è generalmente diagnostico.
Nei lattanti, a causa della fisiologica immaturità della
risposta immunitaria, un elevato numero di bacilli si riversa in circolo determinando una diffusione ematogena
dell’infezione, con sviluppo della cosiddetta TBC miliare.
Le sedi più coinvolte sono milza, fegato e midollo osseo;
si può inoltre osservare anche una disseminazione miliare
a livello degli stessi polmoni, rilevabile con la radiografia
del torace.
Un’altra possibile evoluzione dell’infezione tubercolare è la riattivazione di un’infezione latente, che
può conseguire o ad una nuova reinfezione o ad una
riduzione delle difese immunitarie del soggetto infetto.
Questa condizione consegue spesso ad LTBI contratta
durante l’infanzia, manifestandosi più frequentemente
durante l’adolescenza e in età adulta ed associandosi
sovente all’erosione di un bronco, con formazione di
caratteristiche caverne tubercolari che possono essere
visualizzate all’esame radiografico del torace; in tal caso
avviene l’eliminazione di micobatteri con l’escreato, ed
il soggetto affetto diviene contagioso.
Epidemiologia
AreaPediatrica | Vol. 14 | n. 1-2
| gennaio-giugno 2013 32
N
onostante gli importanti progressi diagno‑
stico-terapeutici abbiano condotto ad una riduzione della prevalenza e dell’incidenza della TBC, questa
rimane ancora la malattia infettiva a più elevata mortalità nel mondo da singolo agente patogeno. Secondo gli
ultimi dati forniti dall’Organizzazione Mondiale della
Sanità (OMS)8, circa un terzo della popolazione mondiale presenta un’infezione tubercolare latente; di questi,
nel 2010, quasi 9 milioni di persone hanno sviluppato
una TBC attiva, con tassi di incidenza più elevati specialmente nei paesi asiatici ed africani. Circa 2 milioni
muoiono a causa della malattia e più di un milione degli
affetti è inoltre HIV-positiva, condizione che costituisce
un importante fattore predisponente sia all’acquisizione
che allo sviluppo della TBC attiva. Complici i flussi
migratori sempre crescenti, il parallelo incremento della
diffusione di ceppi multifarmaco-resistenti e, non di minore importanza, la progressiva diffusione dell’infezione
da virus HIV, negli ultimi decenni la TBC è tornata
a costituire un problema sanitario rilevante anche nei
paesi più sviluppati, presentando una recrudescenza nelle
classi socio-economiche più disagiate e nella popolazione immigrata (specialmente se proveniente da paesi
ad alta incidenza di TBC attiva), immunodepressa o
HIV-positiva.
Per la relativa immaturità del sistema immunitario, i
bambini rappresentano una categoria ad alto rischio di
contrarre l’infezione tubercolare e sviluppare la malattia attiva. Quando acquisita in età infantile, la malattia
tubercolare presenta tassi di morbilità e mortalità più
elevati; inoltre, le forme di infezione latente contratte in
questa fascia di età vanno più frequentemente incontro a
riattivazione in età adulta. I bambini che vivono nelle aree
ad elevata endemia ed in quelle a maggior prevalenza di
HIV, come l’Africa sub-sahariana, sono i più a rischio di
contrarre un’infezione tubercolare3; parimenti, uno stretto
contatto con adulti affetti da TBC, la provenienza da
paesi endemici o condizioni di povertà, sovraffollamento
o l’immunodepressione costituiscono fattori favorenti
anche nei paesi più sviluppati, nei quali la maggior parte
dei casi di TBC si verifica nella popolazione immigrata9.
L’età pediatrica costituisce il 10-20% della popolazione
globalmente affetta da TBC ed i dati diffusi dall’OMS
stimano circa 1 milione di casi all’anno in questa fascia di
età; si ritiene tuttavia che tali cifre siano sottostimate3,10,
in prima istanza a causa dell’elevata frequenza delle forme
paucibacillari e, nondimeno, per le oggettive difficoltà
all’isolamento del patogeno dall’espettorato, considerato
il gold standard diagnostico dell’infezione tubercolare,
Il gold standard diagnostico della TBC è dato
dal riscontro del bacillo di Kock all’analisi microscopica e/o
colturale dell’espettorato o dell’aspirato gastrico mattutino.
Come si fa Nuove metodiche diagnostiche nella tubercolosi pediatrica
Micobatteri
non tubercolari
Bacillo
di Calmette
Guérin
Mycobacterium
tuberculosis
A
Citochine
(TNF-a, IL-2)
Antigeni
tubercolari
B
C
Antigen Presenting Cell (APC)
I
l gold standard diagnostico della TBC è costituito dal riscontro diretto del bacillo di Koch
all’analisi microscopica e/o colturale dell’espettorato o,
in alternativa, dell’aspirato gastrico mattutino, prelevato
con sondino; tuttavia, per l’elevata frequenza delle forme
Linfocita T CD4+
Linfocita T della memoria
paucibacillari ed extrapolmonari e per l’oggettiva difficoltà
a ricavare campioni biologici adeguati in età pediatrica, le indagini microscopiche risultano positive in meno
del 15% dei bambini con diagnosi clinico-radiologica di
TBC, mentre l’esame colturale, che necessita di tempistiche molto più lunghe (fino a 8 settimane), risulta diagnostico in meno del 30-40% degli affetti, con conseguente
rischio di sottostima diagnostica11,12.
Si rende pertanto evidente l’importanza dei test diagnostici indiretti dell’infezione tubercolare, costituiti dal
test cutaneo alla tubercolina di Mantoux (tuberculin skin
test o TST) e dai più recenti test di rilascio di interferone-γ
(interferon-γ-release assays o IGRA), entrambi fondati
sull’evidenza dell’immunità cellulo-mediata che si sviluppa da 2 a 12 settimane dopo l’infezione13.
L’interferone-γ prodotto dai linfociti T CD4+, e, in
minore misura, dai linfociti T CD8+ e dalle cellule natural
killer svolge un ruolo fondamentale nell’eliminazione del
micobatterio tubercolare, attivando nei macrofagi infetti
| gennaio-giugno 2013 33
data la scarsa capacità dei bambini di produrre quantità di
espettorato adeguate senza ricorrere a manovre invasive.
Si rende pertanto evidente come un’approfondita
conoscenza dell’attuale epidemiologia dell’infezione tubercolare, una valida attuazione delle strategie profilattiche, un adeguato utilizzo degli strumenti attualmente
a disposizione per la diagnosi di malattia tubercolare e,
ancor di più, di infezione latente costituiscano il primum
movens per il controllo e la prevenzione della TBC in
età pediatrica.
Strumenti diagnostici
IFN-g
AreaPediatrica | Vol. 14 | n. 1-2
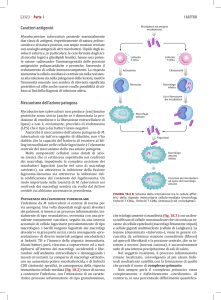
Figura 1. Meccanismo di attivazione immunitaria specifica
per la tubercolosi. A. Esposizione agli antigeni tubercolari per infezione primaria
conseguente all’inalazione di
Mycobacterium tuberculosis
o micobatteri non tubercolari
oppure per immunizzazione
attiva con Bacillo di CalmetteGuérin. B. Sensibilizzazione dei
linfociti T agli antigeni tubercolari presentati dalle APC.
C. Attivazione dei linfociti T
con conseguente produzione
di citochine ed interferone
(IFN-γ) e differenziazione in
cellule T della memoria specificamente sensibilizzate agli
antigeni tubercolari.
IL, interleuchina; TNF, fattore
di necrosi tumorale.
Come si fa
Nuove metodiche diagnostiche nella tubercolosi pediatrica
I test di rilascio di interferone-g hanno la capacità di discriminare
tra una reale infezione tubercolare, uno stato di immunità
acquisita dopo vaccinazione o un’infezione sostenuta
da altri micobatteri.
AreaPediatrica | Vol. 14 | n. 1-2
| gennaio-giugno 2013 34
un burst respiratorio atto a contenere la proliferazione dei
micobatteri fagocitati, limitando pertanto l’infezione. Nel
corso della risposta immunitaria primaria al micobatterio tubercolare si producono inoltre specifici linfociti T
della memoria, in grado di liberare cospicue quantità di
interferone-γ in seguito a nuovi contatti con gli antigeni
tubercolari (Figura 1).
Per più di un secolo il TST ha rappresentato lo strumento più utilizzato per la diagnosi dell’infezione tubercolare. Esso consiste nell’iniezione intradermica, a livello
della faccia volare dell’avambraccio, di 0.1 ml contenenti
5 unità di derivato proteico purificato tubercolinico (PDD);
una corretta esecuzione dell’iniezione intradermica prevede che durante la procedura si osservi un sollevamento di
6-10 mm della cute sovrastante l’inoculazione. Le cellule
T sensibilizzate da una pregressa infezione vengono reclutate nella sede di inoculo, dove rilasciano una serie di
citochine responsabili della formazione, dopo circa 48-72
ore dall’esecuzione del test, di un infiltrato dermico (Figura 2) le cui dimensioni, valutate in relazione ai fattori
epidemiologici e di rischio propri di ciascun paziente,
stabiliscono il risultato del TST7,14.
Per i bambini a basso rischio, ovvero residenti in aree
di bassa endemia, immunocompetenti, con anamnesi
negativa per contatti recenti con sorgenti di infezione e
senza sintomi di malattia tubercolare, si considera positivo
un infiltrato di diametro ≥15 mm. Nei bambini di età <4
anni, o affetti da linfomi, diabete mellito, insufficienza
renale cronica, malnutrizione15 o, ancora, provenienti da
aree ad elevata endemia, che
vivono in condizioni di soFigura 2. Illustrazione del
vraffollamento, istituzionalizmeccanismo d’azione del test
cutaneo alla tubercolina (TST).
zazione, esposti ad adulti con
A. Inoculazione intradermica
infezione da HIV oppure fadi 0,1 ml contenenti 5 unità
centi uso di droghe iniettive si
di derivato proteico purificato
tubercolinico (PDD), che
considera positivo il riscontro
contiene sequenze antigenidi un infiltrato ≥10 mm. Nei
che comuni a Mycobacterium
bambini a più alto rischio di
tuberculosis (MT), Bacillo
di Calmette-Guérin (BCG),
infezione e progressione a mamicobatteri non tubercolari
lattia, ovvero in caso di recente
(MNT). B. Riconoscimento
contatto con sorgente di infeantigenico e liberazione da
parte dei linfociti sensibilizzati
zione, infezione da HIV o altre
di citochine infiammatorie.
forme di immunosoppressione
C. Produzione di infiltrato
compresa quella iatrogena, opdermico palpabile.IFN, PIVKA;
IL, interleuchina; TNF, fattore
di necrosi tumorale.
Sequenza antigenica in comune con:
A
MT
BCG
MNT
B
in vivo
0.1 ml PDD
epidermide
derma
sottocute
PDD
Antigen Presenting Cell (APC)
Linfocita T
della memoria
IFN-g, TNF-a
IL-2, IL-8, ecc.
C
TST positivo:
infiltrato dermico
Antigen Presenting Cell (APC)
Linfocita T
della memoria
pure in presenza di sintomatologia o quadro radiologico
compatibili con malattia tubercolare, deve essere considerato positivo un infiltrato di diametro ≥5 mm16.
Tuttavia, come noto da tempo17,18, il TST presenta
significative limitazioni, principalmente secondarie ad
una scarsa specificità; il PDD presenta infatti antigeni in
comune con il Bacillo di Calmette-Guérin (BCG) e con
i MNT, pertanto il test può fornire risultati falsamente
positivi quando eseguito in individui precedentemente
vaccinati19, oppure con infezioni micobatteriche non tubercolari20,21.
Inoltre, in presenza di condizioni che inducono uno
stato di anergia quali immunodepressione, malnutrizione
o la stessa TBC in stato avanzato, può verificarsi una riduzione della sensibilità del test, con possibilità di risultati
falsamente negativi22.
La sensibilità alla tubercolina si sviluppa dopo 2-12
settimane dall’avvenuta infezione; trovandosi di fronte
ad un caso di esposizione certa ad una sorgente di infezione tubercolare il cui TST risulti negativo, è pertanto
consigliabile ripetere il test nelle settimane successive.
A tale proposito occorre tuttavia ricordare la possibilità di sviluppare un effetto booster, conseguente alla
sensibilizzazione dei linfociti T al PDD in occasione
dell’esecuzione del test, con successivo riscontro di risultati falsamente positivi difficilmente distinguibili da una
conversione post-infettiva23.
I test a puntura multipla (MPT) non sono accurati
quanto il TST poiché la dose esatta di antigene tubercolinico introdotta nella cute non è controllata, pertanto
non sono più utilizzati nella pratica pediatrica14.
I test IGRA, introdotti nella pratica clinica a partire
dal 200120, costituiscono una delle principali innovazioni
diagnostiche in ambito tubercolare; essi si basano sulla
determinazione, mediante saggio immunoenzimatico
(ELISA), della quantità di interferone-γ rilasciato dai
linfociti della memoria precedentemente sensibilizza-
in vitro
IFN-g
QuantiFERON-TB
A
T-SPOT TB
B
Figura 3. Illustrazione del meccanismo d’azione dei test di rilascio di interferone-γ (IGRA):
i test prevedono l’incubazione
in vitro dei linfociti del paziente con antigeni altamente
specifici per Mycobacterium
tuberculosis. A. QuantiFERON-TB: misurazione della
quantità di interferone (IFN)-γ
prodotta in vitro in seguito
ad incubazione linfocitaria
con antigeni ESAT-6, CFP-10 e
TB7.7. B. T-SPOT TB: determinazione del numero di linfociti
T producenti IFN-γ in seguito
ad incubazione in vitro con
antigeni ESAT-6 e CFP-10.
ti in vivo ed incubati in vitro
con antigeni peptidici specifici dei micobatteri tubercolari
(ESAT-6, CFP-10 e TB7.7);
tali antigeni vengono infatti
secreti precocemente nel corso dell’infezione e sono assenti
nel BCG e nella maggior parte
dei micobatteri non tubercolari, conferendo pertanto ai test
IGRA la capacità di discriminare tra una reale infezione
tubercolare, uno stato di immunità acquisita in seguito a
vaccinazione con BCG24 o un’infezione sostenuta da altri
micobatteri25, con l’eccezione di M. kansasii, M. szulgai
e M. marinum, che tuttavia condividono con il MT le
regioni genetiche di ESAT-6 e CFP-1026.
I test IGRA attualmente disponibili in commercio
sono due (Figura 3). Il QuantiFERON-TB Gold In-Tube
Assay (Cellestis Ltd, Australia) con metodiche ELISA
determina la quantità di interferone-γ rilasciato dai linfociti T in risposta agli antigeni ESAT-6, CFP-10 e TB7.7 e
deve essere eseguito su campioni di sangue fresco, incubato per 16-24 ore a 37° entro 16 ore dal prelievo e sottoposto
a centrifugazione per separare il plasma dalle cellule ematiche; il T-SPOT TB misura invece il numero di linfociti
T che producono interferone-γ in risposta ai soli antigeni
ESAT-6 e CFP-10 e va effettuato entro 8 ore dal prelievo
di sangue, che anche in questo caso deve essere incubato
per 16-20 ore a 37° prima della lettura dei risultati; incubazioni superiori alle 48-72 ore sembrano associarsi ad
un aumento della sensibilità della metodica27. Entrambi i
test prevedono inoltre controlli positivi e negativi, che ne
attestino la corretta esecuzione e forniscano nello stesso
tempo stime dei livelli di interferone-γ minimi e massimi
che il soggetto testato è in grado di produrre.
| gennaio-giugno 2013 35
ESAT 6, CPF 10
o TB 7.7
Nuove metodiche diagnostiche nella tubercolosi pediatrica
AreaPediatrica | Vol. 14 | n. 1-2
Come si fa
Come si fa
Nuove metodiche diagnostiche nella tubercolosi pediatrica
I test IGRA sono facilmente effettuabili e, a differenza
del TST, richiedono una sola visita ambulatoriale; tuttavia, per la complessità tecnologica della metodica, questi
test presentano costi di circa 3 volte superiori rispetto al
TST28.
È tuttavia fondamentale ribadire che, determinando
la presenza di una risposta immunitaria cellulo-mediata,
TST e test IGRA forniscono l’evidenza indiretta di un’avvenuta esposizione al micobatterio tubercolare, considerata surrogato di infezione, ma non sono altrettanto in
grado di distinguere tra LTBI e malattia tubercolare in
atto o pregressa.
Diagnosi di infezione tubercolare latente
AreaPediatrica | Vol. 14 | n. 1-2
| gennaio-giugno 2013 36
L
a diagnosi di LTBI costituisce un problema di
fondamentale importanza, poiché la precoce identificazione ed il trattamento dei soggetti infetti può contribuire notevolmente a ridurre lo sviluppo della malattia
e, conseguentemente, la trasmissione della TBC. Le
uniche metodiche laboratoristiche attualmente a disposizione per la diagnosi di LTBI sono TST ed IGRA,
nessuna delle quali può tuttavia essere ritenuta un gold
standard.
Mentre molto si sa sull’efficacia ed i limiti dell’utilizzo
della TST in età pediatrica, i dati attualmente disponibili
relativi a specificità e sensibilità dei test IGRA in questa
fascia di età necessitano ancora di studi ulteriori, non
permettendo quindi di delineare linee guida ampiamente
condivise.
Data la capacità dei test IGRA di distinguere tra infezioni tubercolari, non tubercolari e sensibilizzazioni da
BCG, vi è unanime concordanza nel riconoscere a tali
metodiche una specificità sensibilmente maggiore quando
confrontate con il TST, per la loro capacità di ridurre i
risultati falsamente positivi29.
Per quanto riguarda la sensibilità di queste nuove
metodiche diagnostiche, i dati attualmente disponibili in
età pediatrica appaiono meno favorevoli, e necessitano di
ulteriori approfondimenti. In particolare, sembra esistere
una correlazione inversa tra l’età del paziente e l’incidenza di falsi negativi ai test IGRA; inoltre, secondo lo studio condotto da Lighter et al.30 sull’efficacia diagnostica
del QuantiFERON-TB, vi sono minori probabilità di
ottenere un risultato positivo se l’esposizione al contagio
non è nota e pertanto non databile, se è avvenuta in
epoche non recenti o quando interessa bambini di età
<2 anni, a causa della minore efficienza della risposta
immunitaria cellulo-mediata propria dei primi anni di
vita che inficia la produzione dell’interferone-γ. Inoltre,
una coesistente infezione da HIV, oltre a costituire un
fattore di rischio per l’infezione tubercolare ed una sua
più precoce progressione in malattia, determina uno
stato di anergia della risposta immunitaria cellulo-mediata, incrementando la probabilità di ottenere risultati
falsamente negativi31. Per simili meccanismi, anche infezioni elmintiche o stati di malnutrizione, condizioni
estremamente frequenti nei paesi in via di sviluppo in
cui la TBC è endemica, si associano ad una riduzione
della sensibilità dei test IGRA32. Paradossalmente, per
l’altissimo rischio di progressione verso la malattia tubercolare, sono proprio queste le categorie di pazienti
che trarrebbero il maggior beneficio da una diagnosi precoce di LTBI e dal conseguente tempestivo trattamento6.
Secondo le più recenti metanalisi31,33 l’impiego dei test
IGRA da soli ed in sostituzione del TST nella diagnosi
di LTBI pediatrica, in particolar modo durante la prima
e seconda infanzia, è pertanto generalmente sconsigliato;
l’identificazione di valori di cut-off specifici per le diverse
fasce dell’età pediatrica potrebbe eventualmente contribuire ad incrementarne la sensibilità30.
Le linee guida sull’utilizzo associato di IGRA e TST
nella diagnosi della LTBI in età pediatrica sono numerose
ed eterogenee, riflettendo le differenze nelle politiche
socio-sanitarie e nei tassi di prevalenza dell’infezione
tubercolare34.
Secondo l’OMS e l’European Centre for Disease Prevention and Control (ECDC), mentre il TST rimane la
prima scelta nei soggetti provenienti da paesi a medioalta endemia, nei paesi industrializzati ed a bassa endemia è invece raccomandabile un approccio diagnostico
“two-step”, che prevede l’utilizzo dapprima del TST ed
in seguito di un test IGRA, ai fini di incrementare la
specificità dei risultati escludendo i falsi positivi secondari a vaccinazione con BCG ed infezioni da MNT, che
in questo modo non verranno sottoposti al trattamento
farmacologico previsto13,35.
Come si fa
Nuove metodiche diagnostiche nella tubercolosi pediatrica
Diagnosi di tubercolosi attiva
D
ue metanalisi38,39 pubblicate nel 2011 hanno
analizzato diversi studi eseguiti in paesi ad alta
e bassa endemia, su soggetti HIV e non e su bambini,
giungendo alla conclusione che i test IGRA non possono essere utilizzati come strumento diagnostico della
malattia tubercolare poiché non in grado di discriminare
tra LTBI, pregressa TBC o malattia attiva; inoltre, mentre un test IGRA positivo non indica necessariamente
una condizione di TBC attiva, varie casistiche30 hanno
riscontrato che un risultato negativo non può escludere
con certezza la malattia, soprattutto in età pediatrica ed
in presenza di altre condizioni che possano inficiare variamente la risposta immunitaria, tra le quali è compresa
anche la stessa TBC.
Secondo istituzioni internazionali quali AAP, CDC
ed ECDC16,20 l’utilizzo dei test IGRA nella diagnosi di
TBC attiva in età pediatrica deve pertanto essere inteso
come uno strumento aggiuntivo ai tradizionali criteri
diagnostici clinici, radiologici e microbiologici.
Per quanto riguarda l’utilizzo degli IGRA nella diagnosi di TBC attiva in paesi ad elevata endemia, le linee
guida OMS40 ne sconsigliano apertamente l’utilizzo,
per l’elevata prevalenza di LTBI che tali test non sono
in grado di discriminare dalla malattia in atto, portando quindi a sfavorevoli valutazioni del rapporto costoefficacia41.
È stato inoltre recentemente osservato che l’utilizzo
del test IGRA di tipo T-SPOT TB su fluidi extrasanguigni come liquido bronco-alveolare, essudato pleurico
e peritoneale, sembra determinare un incremento della
sensibilità e specificità diagnostica di tale metodica nella
diagnosi di malattia attiva38, tuttavia non sono attualmente disponibili dati analoghi ricavati su popolazioni
pediatriche.
Una sostanziale comparabilità tra i risultati di TST ed
IGRA in caso di TBC confermata dagli esami colturali è
stata osservata da Cruz et al.42. Parimenti ai test IGRA,
anche l’utilizzo del TST nella diagnosi di TBC attiva è
inficiato da scarsa sensibilità, per l’incapacità di discriminare la malattia non solo dalla condizione di LTBI, ma
anche da immunizzazioni di natura vaccinale, da infezioni
sostenute da NTB e per la possibilità di falsi positivi
secondari all’effetto booster precedentemente descritto.
Inoltre, anche il TST presenta una ridotta specificità e può
fornire risultati falsamente negativi in presenza di uno
AreaPediatrica | Vol. 14 | n. 1-2
L’esecuzione di un test IGRA in aggiunta al TST è
inoltre largamente raccomandata in caso di HIV, immunodepressione di altra natura o malnutrizione, per
ovviare al rischio di risultati falsamente negativi, ed in
caso di pregressa vaccinazione con BCG, per discernere
i risultati falsamente positivi36.
Le linee guida fornite dall’American Academy of Pediatrics (AAP) promuovono l’impiego aggiuntivo degli
IGRA in caso di positività al TST nei bambini di età >5
anni, mentre nei bambini più piccoli, specialmente se
coesiste un’infezione da HIV, ritengono sia preferibile
basarsi sui risultati del TST per intraprendere la terapia
farmacologica, preferendo anteporre la sensibilità alla
specificità del test diagnostico per l’elevato rischio di progressione in malattia. Concordi con l’utilizzo del TST da
solo prima dei 5 anni sono anche le raccomandazioni dei
US Centers for Disease Control and Prevention (CDC),
secondo le quali, tuttavia, superata questa età i due test
possono essere considerati equiparabili34.
Infine, dati ottenuti su soggetti adulti hanno dimostrato che un risultato IGRA negativo, quando confrontato
con il TST, si associa ad inferiori probabilità di sviluppare in futuro la malattia attiva29,37; sulla base degli studi
disponibili non è tuttavia possibile avanzare analoghe
considerazioni riguardanti l’età pediatrica.
| gennaio-giugno 2013 37
Il test cutaneo alla tubercolina rimane la prima scelta
nelle persone provenienti da paesi a medio-alta endemia
per la diagnosi di infezione latente.
Come si fa
Nuove metodiche diagnostiche nella tubercolosi pediatrica
stato di anergia; l’entità dell’infiltrato dermico non può
pertanto essere considerata espressione della probabilità
diagnostica di malattia tubercolare.
La diagnosi di TBC attiva rimane pertanto di pertinenza soprattutto clinica, radiologica (secondo i quadri
precedentemente descritti) e microbiologica, rispetto alle
quali TST ed IGRA assumono un ruolo subordinato ed
ausiliario20.
L’isolamento del MT all’esame colturale di un campione biologico sospetto costituisce ancor oggi il gold standard diagnostico della TBC attiva. Il prelievo di quantità
adeguate dell’espettorato nei bambini risulta di difficile
esecuzione, per cui è una pratica abbastanza comune ricorrere all’aspirazione, ripetuta in 3 giorni diversi, del
contenuto gastrico mattutino, più ricco dell’espettorato
ingerito durante la notte; tuttavia, a causa della peristalsi
e del conseguente svuotamento gastrico anche la quantità
di espettorato raccolta con questa procedura può risultare
insufficiente per lo svolgimento di una corretta indagine
AreaPediatrica | Vol. 14 | n. 1-2
| gennaio-giugno 2013 38
Bibliografia
1. Bloom BR, Small PM. The
evolving relation between humans and
Mycobacterium tuberculosis. N Engl J Med
1998; 338:677-8.
2. Mostowy S, Behr MA. The origin and
evolution of Mycobacterium tuberculosis.
Clin Chest Med 2005; 26:207-16.
3. Perez-Velez C, Marais BJ. Tuberculosis
in children. N Engl J Med 2012; 367:348-61.
4. Marais BJ, Gie RP, Schaaf HS, et
al. The natural history of childhood intrathoracic tuberculosis: a critical review of the
pre-chemotherapy era. Int J Tuberc Lung Dis
2004; 8:392-402.
5. Buonsenso D, Lancella L, Delogu G,
et al. A twenty-year retrospective study of
pediatric tuberculosis in two tertiary hospitals
in Rome. Pediatr Infect Dis J 2012; 31:1022-6.
6. Newton SM, Brent AJ, Anderson S,
Whittaker E, Kampmann B. Paediatric
tuberculosis. Lancet Infect Dis 2008;
8:498-510.
7. Stop TB Partnership Childhood TB
Subgroup World Health Organization.
Guidance for National Tuberculosis
Programmes on the management of
tuberculosis in children. Chapter 1:
introduction and diagnosis of tuberculosis
in children. Int J Tuberc Lung Dis 2006;
10:1091-7.
8. World Health Organization.
Global tuberculosis control: WHO
report 2011. http://whqlibdoc.who.int/
publications/2011/9789241564380_eng.pdf
[accessed April 23, 2013].
colturale. Occorre inoltre considerare che nei bambini
prevalgono le forme di TBC extrapolmonare, richiedendo pertanto il ricorso a tecniche bioptiche invasive per
prelevare campioni rappresentativi da sottoporre alle indagini microbiologiche. Secondo recenti metanalisi, esami
colturali positivi vengono riscontrati in meno del 30-40%
dei casi associati a quadri clinico-radiologici diagnostici;
occorre inoltre considerare le tempistiche di isolamento
colturale del patogeno, che possono richiedere fino a 8
settimane o più, precludendo i benefici che potrebbero
essere ottenuti da un inizio precoce della terapia farmacologica3,43.
La ricerca microscopica dei micobatteri, mediante
colorazione Ziehl-Neelsen o con osservazione al microscopio a fluorescenza, può essere eseguita su ogni tipo di
campione biologico e può fornire una risposta entro tempi
molto rapidi (in meno di un’ora); tale metodica presenta
tuttavia una sensibilità estremamente bassa, fornendo
risultati positivi in meno del 15% dei bambini con diagnosi
9. Menzies HJ, Winston CA, Holtz TH,
Cain KP, Mac Kenzie WR. Epidemiology
of tuberculosis among US- and foreignborn children and adolescents in the United
States, 1994-2007. Am J Public Health 2010;
100:1724-9.
10. Nelson LJ, Wells CD. Global
epidemiology of childhood tuberculosis. Int J
Tuberc Lung Dis 2004; 8:636-47.
11. Zar HJ, Hanslo D, Apolles P, Swingler
G, Hussey G. Induced sputum versus gastric
lavage for microbiological confirmation of
pulmonary tuberculosis in infants and young
children: a prospective study. Lancet 2005;
365:130-4.
12. Marais BJ, Pai M. Recent advances in
the diagnosis of childhood tuberculosis. Arch
Dis Child 2007; 92:446-52.
13. European Centre for Disease
Prevention and Control. Use of interferongamma release assays in support of TB
diagnosis. Stockholm: ECDC, 2011.
14. Kliegman RM, Behrman RE, Jenson
HB, Stantono BF. Nelson Textbook of
Pediatrics, 18th ed. Philadelphia, PA:
Saunders Elsevier, 2007.
15. American Academy of Pediatrics:
Red Book: 2006 Report of the Committee
on Infectious Diseases, 27th ed. Elk Grove
Village, IL: AAP, 2006:683.
16. CDC, National Center for HIV/AIDS,
Viral Hepatitis, STD, and TB Prevention:
Division of Tuberculosis Elimination.
Tuberculin skin testing. http://www.cdc.gov/
tb/publications/factsheets/testing/skintesting.
pdf [accessed April 23, 2013].
17. Edwards PQ, Edwards LB. Story of
the tuberculin skin test from an
epidemiologic viewpoint. Am Rev Respir Dis
1960; 81(Pt 2):1-47.
18. Snider DE Jr. Bacille Calmette-Guérin
vaccinations and tuberculin skin tests. JAMA
1985; 253:3438-9.
19. Wang L, Turner MO, Elwood RK;
Schulzer M, Fitzgerald JM. A metaanalysis of the effect of Bacille Calmette
Guérin vaccination on tuberculin skin test
measurements. Thorax 2002; 57:804-9.
20. Mazurek GH, Jereb J, Vernon A,
LoBue P, Goldberg S, Castro K; IGRA
Expert Committee; Centers for Disease
Control and Prevention (CDC). Updated
guidelines for using Interferon Gamma
Release Assays to detect Mycobacterium
tuberculosis infection - United States,
2010. MMWR Recomm Rep 2010; 59(RR5):1-25.
21. Farhat M, Greenaway C, Pai M,
Menzies D. False-positive tuberculin skin
tests: what is the absolute effect of BCG and
non-tuberculous mycobacteria? Int J Tuberc
Lung Dis 2006; 10:1192-204.
22. American Thoracic Society and
the Centers for Disease Control and
Prevention. Diagnostic standards and
classification of tuberculosis in adults and
children. Am J Respir Crit Care Med 2000;
161(4 Pt 1):1376-95.
23. Salles CG, Ruffino-Netto A, Lapa-eSilva JR, et al. The presence of a booster
phenomenon among contacts of active
pulmonary tuberculosis cases: a retrospective
cohort. BMC Public Health 2007; 7:38.
24. Diel R, Nienhaus A, Lange C,
Meywald-Walter K, Forssbohm
M, Schaberg T. Tuberculosis contact
Come si fa
and meta-analysis. Int J Tuberc Lung Dis
2011; 15:1018-32.
32. Lucas M, Nicol P, McKinnon E, et al.
A prospective large-scale study of methods
for the detection of latent Mycobacterium
tuberculosis infection in refugee children.
Thorax 2010; 65:442-8.
33. Machingaidze S, Wiysonge CS,
Gonzales-Angulo Y, et al. The utility of an
interferon gamma release assay for diagnosis
of latent tuberculosis infection and disease
in children: a systematic review and metaanalysis. Pediatr Infect Dis J 2011; 30:694700.
34. Denkinger CM, Dheda K, Pai M.
Guidelines on Interferon-γ release assays
for tuberculosis infection: concordance,
discordance or confusion? Clin Microbiol
Infect 2011; 17:806-14.
35. World Health Organization. Use of
tuberculosis interferon-gamma release assays
(IGRAs) in low- and middle-income countries:
policy statement. Geneva: WHO, 2011.
36. Perez-Velez CM. Pediatric tuberculosis:
new guidelines and recommendations. Curr
Opin Pediatr 2012; 24:319-28.
37. Andersen P, Doherty TM, Pai M,
Weldingh K. The prognosis of latent
tuberculosis: can disease be predicted?
Trends Mol Med 2007; 13:175-82.
38. Sester M, Sotgiu G, Lange C, et al.
Interferon-γ release assays for the diagnosis
of active tuberculosis: a systematic review
and meta-analysis. Eur Respir J 2011;
37:100-11.
39. Metcalfe JZ, Everett C, Steingart
KR, et al. Interferon-γ release assays for
active pulmonary tuberculosis diagnosis in
.
adults in low- and middle-income countries:
systematic review and meta-analysis. J Infect
Dis 2011; 204(Suppl 4):S1120-9.
40. World Health Organization. Strategic
and technical advisory group for tuberculosis
(STAG-TB). Report of the Tenth Meeting.
Geneva: WHO, 2010.
41. Ling DI, Pai M, Davids V, et al.
Are Interferon-γ release assays useful for
diagnosing active tuberculosis in a highburden setting? Eur Respir J 2011; 38:64956.
42. Cruz AT, Geltemeyer AM, Starke
JR, Flores JA, Graviss EA, Smith KC.
Comparing the tuberculin skin test and
T-SPOT.TB blood test in children. Pediatrics
2011; 127:e31-8.
43. Lalvani A, Millington KA. T cell-based
diagnosis of childhood tuberculosis infection.
Curr Opin Infect Dis 2007; 20:264-71.
44. Nicol MP, Workman L, Isaacs W, et
al. Accuracy of the Xpert MTB/RIF test for
the diagnosis of pulmonary tuberculosis in
children admitted to hospital in Cape Town,
South Africa: a descriptive study. Lancet
Infect Dis 2011; 11:819-24.
| gennaio-giugno 2013 39
investigation with a new, specific blood test
in a low-incidence population containing a
high proportion of BCG-vaccinated persons.
Respir Res 2006; 7:77.
25. Detjen AK, Keil T, Roll S, et al.
Interferon-gamma release assays improve the
diagnosis of tuberculosis and nontuberculous
mycobacterial disease in children in a country
with a low incidence of tuberculosis. Clin
Infect Dis 2007; 45:322-8.
26. Clinicians Guide to QuantiFERON®TB Gold. http://www.cellestis.com/irm/
content/gold/qft-gold_us_clinicianguide.pdf
[accessed April 23, 2013].
27. Cehovin A, Cliff JM, Hill PC, Brookes
RH, Dockrell HM. Extended culture enhances
sensitivity of a gamma interferon assay for
latent Mycobacterium tuberculosis infection.
Clin Vaccine Immunol 2007; 14:796-8.
28. Pooran A, Booth H, Miller RF, et
al. Different screening strategies (single or
dual) in the diagnosis of suspected latent
tuberculosis: a cost effectiveness analysis.
BMC Pulm Med 2010; 10:7.
29. Diel R, Goletti D, Ferrara G, et al.
Interferon-γ release assays for the diagnosis
of latent Mycobacterium tuberculosis
infection: a systematic review and metaanalysis. Eur Respir J 2011; 37:88-99.
30. Lighter J, Rigaud M, Eduardo R,
Peng CH, Pollack H. Latent tuberculosis
diagnosis in children by using the
QuantiFERON-TB Gold In-Tube test. Pediatrics
2009; 123:30-7.
31. Mandalakas AM, Detjen AK,
Hesseling AC, Benedetti A, Menzies
D. Interferon-gamma release assays and
childhood tuberculosis: systematic review
cità ma anche di peculiari mutazioni che si associano a
resistenza alla rifampicina. L’OMS raccomanda l’utilizzo
di Xpert MTB/RIF in sostituzione all’esame microscopico dell’espettorato per la diagnosi iniziale di sospetta
TBC multifarmaco-resistente o associata ad HIV8; lo
studio condotto da Nicol et al.44 ha confermato l’efficacia
di tale metodica nella diagnosi di TBC associata ad HIV
in età pediatrica. Indipendentemente dalla prevalenza
dell’infezione da HIV o della farmaco-resistenza, per la
sua maggiore sensibilità diagnostica tale metodica può
costituire un valido ausilio in caso di negatività dell’esame
microscopico, senza tuttavia sostituirsi ad esso; la ricerca
microscopica e, ancor di più, l’isolamento colturale del
patogeno costituiscono infatti strumenti imprescindibili
per valutare il trattamento farmacologico da intraprendere
e monitorarne la risposta
AreaPediatrica | Vol. 14 | n. 1-2
clinico-radiologica di TBC ed in meno del 25% di casi in
cui l’isolamento colturale del patogeno è stato possibile3.
Una novità di recente introduzione nell’ambito della
diagnosi microbiologica della TBC è rappresentata dalle
tecniche molecolari di amplificazione dell’acido nucleico
(nucleic acid amplification techniques o NAAT) che, utilizzando la reazione a catena polimerasica (PCR), sono in
grado di rilevare la presenza di materiale genetico proprio del MT all’interno dei campioni biologici analizzati.
Secondo Perez-Velez36 tali metodiche presentano una
sensibilità complessiva >95% in casi di TBC documentata microscopicamente e colturalmente, mentre in caso
di campioni biologici risultati negativi all’osservazione
microscopica e positivi all’esame colturale la sensibilità è
comunque compresa tra il 50% e l’85%, mentre la specificità è >97%. Dal 2010 è inoltre disponibile Xpert MTB/
RIF, un saggio di amplificazione del DNA tubercolare
in grado di rilevare in meno di 2 ore non solo la presenza
del MT con soddisfacenti valori di sensibilità e specifi-
Nuove metodiche diagnostiche nella tubercolosi pediatrica