I neuroni e l’elettrofisiologia
Capitolo 1
Capitolo 1:
I neuroni e l’elettrofisiologia
1.1 I neuroni
Alla fine del XIX secolo non era ancora chiaro come applicare al sistema nervoso la teoria
cellulare (formulata per la prima volta da Schleiden e Schwann nel 1839), che aveva già
prodotto importanti successi in altri ambiti della biologia e della medicina. Il tessuto nervoso
ha infatti una struttura molto complessa e si presenta come un fitto ed intricato reticolo in cui
l’identificazione di una cellula nella sua interezza è un operazione difficile e apparentemente
soggettiva.
Dopo i pionieristici lavori di Jan Purkinje all’inizio del secolo, nel 1865 Otto Deiters
descrisse e riprodusse una grande cellula nervosa motoria, identificando due tipologie di
ramificazioni (chiamate successivamente dendriti e assoni).
Nel 1885 il medico Camillo Golgi ideò un procedimento chimico (chiamato metodo della
“reazione nera”) che permetteva di evidenziare in un tessuto nervoso le ramificazioni di un
singolo neurone nella loro interezza.
Il metodo di Golgi rimase pressoché sconosciuto finché un istologo spagnolo, Santiago
Ramòn y Cajal, non vi “inciampò” nel 1888 [Ramon-Cajal94] .
Cajal perfezionò il metodo di Golgi e lo applicò a svariati tessuti nervosi (di diverse specie
animali), riuscendo ad ottenere una notorietà scientifica mondiale con una serie di
pubblicazioni tra il 1888 ed il 1891.
Cajal interpretò (a differenza di Golgi) la struttura ramificata evidenziata dal metodo come
una singola e distinta cellula nervosa, screditando definitivamente la diffusa “teoria
reticolare” del sistema nervoso (che negava l’esistenza di separazioni nette tra la fine di un
dendrite di una cellula e l’inizio di quello di una cellula attigua, in modo analogo alla
connessione capillare tra sistema arterioso e venoso).
Nel 1891 Wihlelm Waldeyer riuscì a formulare i risultati di Cajal e di altri (come quelli di
Wilhelm Hios sull’evoluzione embriologica delle cellule nervose) in modo organico e
scientificamente convincente, dimostrando – con un ritardo di 50 anni rispetto ad altri ambiti
della biologia – che la teoria cellulare era applicabile anche al sistema nervoso. Waldeyer
suggerì il termine “neurone” per la cellula nervosa, e l’ipotesi della sua unità prese il nome di
“dottrina neuronale”.
Negli anni ’50 David Robertson e altri, mediante l’utilizzo della microscopia elettronica,
dimostrarono definitivamente l’esattezza della teoria neuronale, mostrando che la membrana
cellulare del neurone è continua intorno a tutta la cellula, come tutte le membrane cellulari.
Ogni cellula nervosa è quindi un’entità anatomica (e genetica) indipendente ed i tessuti
nervosi sono costituiti da popolazioni (sistemi funzionali) di queste entità.
2
Capitolo 1
I neuroni e l’elettrofisiologia
In quegli stessi anni videro anche la luce le prime tecniche elettrofisiologiche: la creazione di
elettrodi di pochi micron di diametro consentì a D.Albe-Fessard e P.Buser nel 1953 di
registrare l’attività elettrica di singoli neuroni, mentre B.Katz e A.Hodgkin riuscirono a
registrare i singoli potenziali d’azione e a correlarli alle modificazioni delle concentrazioni di
sodio e potassio nella fibra nervosa. Ancora, William R.Hess nel 1952 riuscì a stimolare con
elettrodi piccole aree cerebrali e addirittura singole cellule, finché nel 1971 Erwin Neher e
Bert Sakmann effettuarono delicate misurazioni delle variazioni di corrente in singoli canali
del sodio al livello della fibra nervosa, per mezzo della nuova tecnica del patch clamp.
Se il neurone possedesse solo organelli citoplasmatici, non avrebbe la possibilità di
sviluppare e mantenere una struttura morfologica così complessa e stabile, essenziale per le
sue funzioni neuroelettrofisiologiche e neurochimiche.
Figura . 1 : Organelli citoplasmatici del neurone
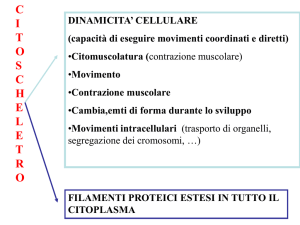
Il citoscheletro è una complesso reticolo di proteine fibrose presente all’interno del neurone,
localizzato in particolare nei dendriti e nell’assone; ha funzione di supporto strutturale ed è
composto da tre tipi di proteine: i mictotubuli, i neurofilamenti ed i microfilamenti (o
filamenti di actina).
Dopo il ritardo iniziale, lo studio della struttura intracellulare del neurone è progredito
seguendo l’evoluzione della biologia cellulare, adottandone i metodi (con le tecniche della
biochimica, della biologia molecolare, della microscopia elettronica e della elettrofisiologia) e
le basi teoriche (in particolare la genetica).
La neurobiologia molecolare studia la struttura interna del neurone (la membrana, gli
organelli interni, il nucleo) e l’organizzazione funzionale [Sheperd94].
3
I neuroni e l’elettrofisiologia
Capitolo 1
La struttura interna del neurone è qualitativamente identica a quella di tutti gli altri tipi di
cellule: è presente una membrana cellulare (costituita da due strati di molecole fosfolipidiche),
un nucleo (contenete l’informazione genetica organizzata in cromosomi), un nucleolo (sede di
produzione del RNA ribosomale), il citoplasma (contenente lisosomi, ribosomi, mitocondri, il
complesso di Golgi, il reticolo endoplasmatico liscio e ruvido).
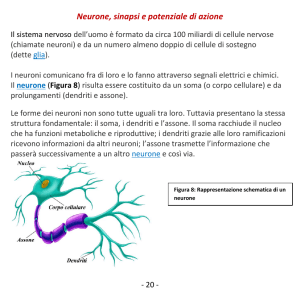
La complessa morfologia del neurone è caratterizzata da tre elementi: il corpo cellulare
(soma), i dendriti e gli assoni. Mentre il primo ha struttura compatta (approsimativamente
sferica, di circa 70 μm di diametro), i secondi presentano una struttura molto allungata e
ramificata.
La microscopia elettronica ha rivelato che il contenuto dei dendriti prossimali (larghi
dendriti che non si allontanano molto dal soma) è simile a quello del citoplasma cellulare,
rafforzando l’ipotesi secondo la quale i dendriti (e gli assoni) costituiscono semplici
estensioni del resto del corpo cellulare e non sono organelli distinti (come ad esempio ciglia e
flagelli in alcune cellule). Tuttavia con l’aumento della lunghezza dei dendriti (e quindi con
l’aumento della distanza dal soma e la diminuzione del diametro dendritico) tale contenuto
cambia: la densità degli organelli tende a diminuire e diviene predominante la presenza di una
struttura cellulare specializzata (stabile ed altamente ordinata) denominata citoscheletro.
-- microtubuli ornano lunghe strutture di forma tubolare di circa 25nm di diametro, disposti
longitudinalmente nei dendriti e nell’assone (in quest’ultimo sono orientati tutti nella stessa
direzione).
Possono raggiungere diversi millimetri di lunghezza e sono distanziati l’uno dall’altro da circa
80-200 nm.
--neurofilamenti sono disposti in fasci longitudinali (rispetto allo sviluppo assonico) di
diametro medio di circa 10nm, uniti da legami crociati che forniscono sostegno meccanico ed
impediscono la rottura dell’assone. Sono costituiti da lunghe proteine lineari a forma di
bastoncello, suddivisibili in 6 classi in base alle omologie della loro sequenza aminoacida.
-- I microfilamenti (o filamenti di actina) sono costituiti da filamenti di actina (1nm di
diametro medio ) che formano un fitto intreccio posto in prossimità della membrana cellulare
di tutto il neurone
L’assone è una lunga protuberanza (lunga anche un metro è più, nei neuroni motori degli
organismi animali superiori) che si proietta dal corpo della cellula nervosa: la sua funzione
consiste nella trasmissione di uno stimolo elettro-chimco (chiamato potenziale d’azione)
solitamente verso i dendriti di un’altra cellula nervosa, che può trovarsi anche molto lontano.
In genere lungo il suo percorso l’assone ha una forma cilindrica liscia e regolare, con sezione
di diametro costante. In prossimità della sua terminazione l’assone prende una forma
ramificata (terminazione pre-sinaptica) con una serie di rigonfiamenti (varicosità o bulbi
assonali) sedi di organelli (specializzati nella trasmissione di un segnale chimico – la sinapsi a strutture extracellulari attigue) chiamati vescicole sinaptiche. Questi rigonfiamenti possono
essere presenti alle estremità dell’assone o lungo di esso (sempre nel tratto terminale): si parla
nel secondo caso di varicosità assonali “en passant”.
Figura 2: Struttura dell’assone
4
Capitolo 1
I neuroni e l’elettrofisiologia
Alcuni assoni presentano lungo il loro percorso una struttura esterna chiamata guaina
mielinica che ha funzioni di protezione ed isolamento (con conseguente migliore trasmissione
del segnale) ed è creata da cellule specializzate (neuroglia oligodendrociti).Nonostante il suo
semplice sviluppo lineare l’assone si presenta con una grandissima varietà di forme e
dimensioni [Sheperd98].
I dendriti sono estensioni del corpo del neurone specializzate nella ricezione del segnale
sinaptico. Hanno in genere una struttura molto ramificata, ma a differenza dell’assone non si
proiettano dal corpo cellulare per grandi distanze (raramente raggiungono il millimetro di
lunghezza, e spesso molto meno).
I dendriti di alcuni tipi di neuroni – come i motoneuroni – hanno una struttura liscia ed
affusolata, mentre in altri mostrano una superficie irregolare ricca di piccole sporgenze sedi di
contatti sinaptici (chiamate specializzazioni sinaptiche), soprattutto lungo il loro tratto
terminale.
A causa del grande numero di forme che possono essere assunte dal neurone, non è sempre
facile individuare l’assone e distinguerlo dagli altri dendriti.
Nei cosiddetti “neuroni di proiezione” (che formano tessuti nervosi con lunghe fibre che
connettono altre regioni del sistema nervoso) l’identificazione dell’assone avviene facilmente
attraverso l’osservazione della sua estensione ed altre sue caratteristiche peculiari (un “cono
assonico” alla sua base sul corpo cellulare, diametro della sua sezione in genere costante,
eventuali ramificazioni secondarie ad angolo retto).
Negli altri tipi di neuroni (“neuroni intrinseci” o “interneuroni”, contenuti interamente in
una singola regione del sistema nervoso) l’assone può avere le stesse dimensioni dei dendriti
(o addirittura può non esserci affatto, nei “neuroni anassonali”): per identificarlo può essere
necessario analizzare la struttura fine delle ramificazioni, ed in particolare le componenti
intracellulari, la membrana o le strutture extracellulari prossime.
-- Alcune proteine sono presenti in una sola delle due strutture (Map2, fosfochinasi nei
dendriti, Gap-43 e Tau nell’assone); i microtubuli nell’assone sono tutti orientati con la parte
positiva verso la sua terminazione, mentre nei dendriti non hanno un orientamento
preferenziale.
-- L’assone presenta molti più neurofilamenti (fosforilati) e microfilamenti (actina) mentre
solo nei dendriti sono presenti ribosomi e RNA messaggeri per la sintesi proteica.
-- Differenze nella composizione molecolare della membrana (ed in particolare la presenza
e la densità di certe proteine di membrana) possono caratterizzare l’assone dai dendriti (ad
esempio il cono assonico ed i suoi segmenti non mielinizzati contengono moltissimi “canali
del sodio”)
-- La struttura extracellulare, ed in particolare la guaina mielinica (costituita dalle cellule di
Schwann o dagli oligodendrociti), è presente solo negli assoni, ma solo in quelli più estesi:
per gli assoni più corti può anche non essere presente (ed in quelli molto corti non lo è mai).
1.1.1 La neurogenesi
Nei vertebrati l’embrione, duranti i primi stadi di crescita, si differenzia in tre strati cellulari
(formando il disco embrionico): uno strato esterno (ectoderma), uno intermedio (mesoderma)
5
I neuroni e l’elettrofisiologia
Capitolo 1
ed uno più interno (endoderma). Il sistema nervoso ha la sua origine in una regione
dell’ectoderma chiamata neuroepitelio: il suo sviluppo è regolato da segnali biochimici
provenienti dall’adiacente mesoderma. Nell’epitelio una sezione dell’ectoderma si ispessisce
formando una placca neuronale i cui bordi successivamente si arrotolono su se’ stessi
(andando a formare il tubo neuronale che sarà la base della spina dorsale e del cervello). I
neuroni sono generati nella cosiddetta zona di proliferazione (che circonda il ventricolo
centrale di questo cervello embrionale) dalla differenziazione di cellule precursori chiamate
neuroblasti [Westermann]. Una volta generato, ogni neurone migra nella sua posizione finale,
attraverso il supporto strutturale di particolari cellule gliali radiali (che esistono solamente in
questo stadio dello sviluppo embrionale). Il posizionamento dei neuroni nel cervello
embrionale segue una sequenza che va dall’interno all’esterno: i primi neuroni generati
migrano negli strati più interni della placca neurale mentre quelli generati successivamente si
posizionano in strati più superficiali. Durante (o immediatamente dopo) questa migrazione
inizia il processo di differenziazione (o maturazione) neuronale, con l’emissione dal corpo
cellulare di lunghe estensioni citoplasmatiche chiamate neuriti, destinati a diventare assoni e
dendriti. All’estremità di ciascun neurite è presente una regione rigonfia
(approssimativamente sferica con un diametro medio di circa 5 μm) chiamata cono di
accrescimento (o cono assonico se ci si riferisce al futuro assone del neurone).
Già alla fine del XIX secolo Ramon y Cajal ha ipotizzato che questa regione sia la sede dei
cambiamenti morfologici del neurite, ovvero la sede dell’attività di movimento e crescita dei
dendriti e degli assoni: nel 1907 Ross Harrison ha confermato questa ipotesi, osservando
direttamente la neurogenesi in culture di neuroblasti embrionali.
In tempi più recenti, tecniche microscopiche a maggior grado di risoluzione hanno permesso
di dimostrare che il cono di accrescimento è rivestito da sottili protuberanze (con diametro di
0,1-0,2 μm e lunghezza massima di 50 μm) chiamate filopodi che esplorano lo spazio
circostante e determinano la direzione nella quale far crescere il neurite: ad esempio quando
alcuni di questi filopodi adericono a nuove superfici esercitano (probabilmente) una tensione
trainante che costringe il neurite ad accrescere verso la nuova superficie. La forte instabilità
intrinseca dei filopodi gioca anche un ruolo importante nel processo di biforcazione, anche se
non ne sono ancora chiariti i dettagli.
Figura 3: Filopodi del cono di crescita da un neurone
di lumaca di mare (Aplysia californica).i[5]
L’assemblaggio dei microtubuli
I microtubuli possiedono una parte centrale vuota circondata da una parte di filamenti lineari
chiamati protofilamenti (in genere 13 per microtubulo, ma occasionalmente il loro numero
può aumentare). I protofilamenti sono costituiti da catene lineari di una proteina chiamata
6
I neuroni e l’elettrofisiologia
Capitolo 1
tubulina, che è a sua volta composta da due catene polipeptidiche differenti (α-tubulina e βtubulina): attraverso analisi ai raggi X e mediante diffrazione ottica si è riscontrato che
ciascun protofilamento è costituito da sequenze di eterodimeri di tubulina (dimeri composti da
una molecola di α-tubulina e una di β-tubulina), assemblati in modo che catene di tubuline
omologhe formino una secondo geometria elicoidale destrosa, stabilizzando fortemente la
struttura.
Figura 4: Composizione dei microtubuli
I microtubuli possono allungarsi indefinitivamente (almeno teoricamente) mediante
polimerizzazione, ovvero catalizzazione dell’assemblaggio di nuove molecole di tubulina alle
loro estremità libere. I microtubuli, in certe condizioni, possono anche accorciarsi, mediante
disassemblaggio delle molecole di tubolina presenti alle estremità. L’assemblaggio ed il
disassemblaggio sono regolati dall’equilibrio tra gli eterodimeri di tubulina libera e di
tubolina legata (polimerizzata): esiste una concentrazione critica (locale) di tubulina libera al
di sopra della quale è favorito l’assemblaggio all’estremità del microtubulo, mentre al di sotto
è favorito il disassemblaggio (la velocità invece dipende dagli enzimi catalizzatori dei due
processi). La bassa temperatura e l’alta pressione favoriscono il disassemblaggio dei
microtubuli, spostando l’equilibrio verso la tubulina libera.
J.Rosenbaum ha incubato frammenti di tubulina marcati con isotopi radioattivi, con tubulina
non marcata, in condizioni che favoriscono la polimerizzazione della tubulina. Analizzando il
prodotto mediante autoradiografia al microscopio elettronico, si è scoperto che la maggior
parte della tubulina non radioattiva è concentrata a una sola estremità del microtubulo in fase
di allungamento: si è quindi concluso che l’assemblaggio del microtubulo è più rapido in
corrispondenza di una zona, detta estremità positiva, mentre l’altra viene definita estremità
negativa. La concentrazione critica dell’estremità positiva è più bassa di quella dell’estremità
negativa: quando la concentrazione di tubulina è più alta della concentrazione critica in
corrsipondenza dell’estremità positiva ma più bassa della concentrazione critica all’estremità
negativa, può verificarsi il fenomeno del treadmilling (allungamento del microtubulo
all’estremità positiva e accorciamento all’estremità negativo, con un effetto complessivo
simile al moto lineare). Questo fenomeno è facilmente osservabile nei microtubuli isolati, ma
non è altrettanto certo che si verifichi nelle cellule viventi.
7
Capitolo 1
I neuroni e l’elettrofisiologia
Il ruolo delle proteine MAPs
Nei primi anni ’70 Richard Weisemberg scoprì che i microtubuli si assemblano
spontaneamente negli estratti cellulari riscaldati a 37° in assenza di Ca2+ e in presenza di GTP;
inoltre i microtubuli formatisi in queste condizioni contengono molti tipi di proteine oltre alla
tubulina: queste proteine associate ai microtubuli (MAPs) costituiscono più del 10-15% della
massa dei microtubuli.
Le principali proteine che danno l’avvio all’essemblaggio del microtubulo appartengono alle
famiglie delle MAP1, MAP2 e Tau. Esse possono essere fosforilate in più siti da parte di
protein chinasi, il che rende possibile il controllo dell’assemblaggio (e quindi gli allungamenti
e le biforcazioni dei neuriti in accrescimento) da parte dei meccansimi di fosforilazione delle
proteine.
Il GTP e l’instabilità dinamica
L’eterodimero di tubulina possiede due siti di legame per il guanosin trifosfato (GTP): uno è
situato sulla α-tubulina, l’altro sulla β-tubulina. Non appena un eterodimero si lega
all’estremità del microtubulo in crescita, il GTP legato allla β-tubulina viene idrolizzato in
GDP (GTP+H20→GDP+Pi) fornendo energia libera per la reazione di polimerizzazione.
E’ stato osservato che in certe condizioni l’abbassamento della concentrazione di tubulina
provoca la scomparsa di alcuni microtubuli, mentre quelli che rimangono crescono di più. Per
spiegare questo fenomeno Tim Mitchison e Marc Kirschner hanno proposto l’esistenza di
un’instabilità dinamica dei microtubuli, in condizioni di basse concentrazioni di tubulina, a
causa della quale i microtubuli possono repentinamente passare da una fase di accrescimento
a una di riduzione. In condizioni di alte concentrazioni di tubulina e GTP, i complessi GTPtubulina vengon aggiunti all’estremità in crescita del microtubulo più rapidamente di quanto
venga effettuata l’idrolisi del GTP: il risultato è la formazione di una piccola regione stabile
(chiamata GTP cap) all’estremità del microtubulo, in corrispondenza della quale la β-tubulina
trattiene il GTP legato e viene fortemente favorita l’aggiunta di ulteriori eterodimeri di
tubulina. Se la velocità di allungamento dei microtubuli diminuisce perché scende la
concentrazione di tubulina libera, la velocità di idrolisi del GTP aumenta e la regione GTP
cap si defosforila divenendo un’estremità instabile, in corrispondenza della quale si verifica
una veloce perdita di eterodimeri di tubulina e quindi un repentino accorciamento del
microtubulo. La maggior parte di microtubuli è soggetto a cicli alterni di crescita e riduzione:
la lunghezza totale assume quindi un andamento nel tempo relativamente irregolare. Il
passaggio repentino dalla crescita alla riduzione del microtubulo, detto catastrofe del
microtubulo, si alterna quindi al ritorno alla fase di crescita (recupero del microtubulo) .
Questi due eventi si manifestano con frequenza rispettivamente inversamente e direttamente
proporzionale alla concentrazione di tubulina; inoltre sono più frequenti ed accentuati
all’estremità positiva del microtubulo.
1.1.2 Il trasporto assonico
Dal momento che il nucleo e l’apparato biosintetico del neurone sono localizzati nel corpo
cellulare, assai lontano dalle regioni distali dei dendriti e soprattutto dell’assone, si pone il
problema di come venga mantenuto l’apporto di molecole e di organelli essenziali per le
8
Capitolo 1
I neuroni e l’elettrofisiologia
funzioni dell’assone. La semplice diffusione non è una spiegazione adeguata, in quanto
perfino molecole di piccole dimensioni come il glucosio impiegherebbero mesi o anni per
percorrere le distanze che caratteriziiano un tipico assone. Per risolvere questo problema i
neuroni hanno sviluppato alcuni meccanismi per il trasporto di sostanze a grande velocità
(differente per le diverse sostanze trasportate) lungo gli assoni (ed in maniera simile nei
dendriti).
Sono stati identificati due tipi principali di trasporto: il primo, definito trasporto assonico
lento, sposta proteine e filamenti del citoscheletro lungo l’assone a una velocità di circa 1-5
mm al giorno. Benchè in questo tipo di trasporto sia probabilmente implicato il meccanismo
di scorrimento dei microtubuli, la forza responsabile di tale fenomeno non è stata a tutt’oggi
identificata con certezza.
L’altro tipo di rasporto viene definito trasporto assonico veloce, in quanto in questo caso le
sostanze vengono trasportate a una velocità circa cento volte maggiore (40 cm al giorno) Il
trasporto veloce è stato messo in evidenza per la prima volta attraverso l’iniezione di sostanze
radioattive nel corpo cellulare, e quindi monitorando la comparsa della radioattività in punti
diversi dell’assone (ad esempio mediante autoradiografie).
Oltre che per la velocità, i due tipi di trasporto si differenziano per i diversi materiali che
vengono trasportati: mentre il trasporto lento media lo spostamento di proteine e filamenti
citoscheletrici (come ad esempio gli eterodimeri della proteina tubulina, fondamentale per
l’allungamento dei microtubuli), il trasporto veloce media il movimento di organelli come per
esempio i mitocondri e le vescicole membranose. Inoltre il trasporto lento sposta materiali
esclusivamente in direzione della punta dell’assone (direzione anteretrograda), mentre quello
veloce sposta sostanze anche in senso opposto (direzione retrogada): gli spostamenti nelle
due direzioni sono regolati dalle proteine chinesina e dineina, che fanno aderire le sostanze
trasportate (in particolare le vescicole membranose) ai mictotubuli dell’assone e le fanno
scorrere lungo la superficie di questi.
1.1.3 I fattori di crescita
La crescita e lo sviluppo delle cellule nervose è controllato da una serie di fattori diversi, tra
cui uno dei più studiati è senza dubbio il nerve growth factor (NGF) scoperto negli anni ’50
da Rita Levi Montalcini e Viktor Hamburger. L’NGF non induce proliferazione cellulare
come molti altri fattori di crescita, ma stimola l’emissione dei neuriti nelle cellule nervose
embrionali. I bersagli principali dell’NGF sono i neuroni sensoriali, che trasportano gli
impulsi nervosi dalla periferia al sistema nervoso centrale, e i neuroni simpatici, presenti nel
sistema simpatico, responsabile degli atti neurovegetativi involonatari. Questi due tipi di
neuroni sopravvivono poco tempo in coltura in assenza di NGF (ma altre cellule continuano a
crescere bene in sua assenza). Quando il fattore viene aggiunto a una cultura di neuroni
sensoriali o simpatici, le cellule rispondono a questo trattamento con una sorprendente
massiccia emissione di neuriti (Fig. 1.6).
Il meccanismo di azione dell’NGF è complesso e non ancora completamente compreso: al
pari di molti altri fattori di crescita, l’NGF si lega ad un recettore della membrana plasmatica
che catalizza la fosforilazione dell’amminoacido tirosina, cui segue una lunga serie di eventi a
cascata.
Dopo la scoperta dell’NGF sono state identificate molte altre molecole collegate alla crescita
delle cellule nervose, tra cui il fattore di crescita insulino-simile di tipo II, proteine di matrice
extracellulare come la laminina, la fibronectina, il collagene, molecole di adesione come le
N-CAM e le caderine.
9
I neuroni e l’elettrofisiologia
Capitolo 1
Figura 5– Effetto del NGF su un neurone un vitro
1.1.4 I fattori di orientamento
Non è stato ancora completamente compreso il complesso insieme di meccanismi che
permette ai neuriti di orientarsi e di raggiungere la propria destinazione all’interno del SNC in
via di formazione. Questo vale soprattutto per molti neuriti precursori di assoni, che spesso
devono proiettarsi per diversi centimetri in direzione di una regione di terminazione
particolare, quindi entrare in contatto con la cellula bersaglio e con questi formare una sinapsi
in una posizione corretta.
Negli anni ’70 Roger Sperry ha mostrato come gli assoni nel sistema visivo degli anfibi
siano in grado di interagire in maniera selettiva con determinate regioni del cervello:
successivamente è stato possible identificare numerose interazioni che guidano il percorso
degli assoni negli embrioni di cavalletta, in cui le traiettorie di sviluppo embrionale dei singoli
assoni sono facilmente tracciabili.
Si distinguono in genere due tipi di meccansimi: in una prima fase predominano quelli non
dipendenti dall’attività neuroelettrofisiologica, mentre in una fase successiva tendono a
verificarsi meccanismi attività-dipendenti, per mezzo dei quali sono perfezionate le
connessioni instauratisi nella prima fase. Inoltre il grado di utilizzo dei vari tipi di meccansimi
all’interno di ciascuna fase varia nelle diverse regioni del SNC e nei diversi stadi di crescita
embrionale.
I meccanismi attività-indipendenti possono essere classificati in tre gruppi:
1) Stereotropismo: vari meccanismi utilizzano il contatto tra il cono di crescita e proteine di
superficie appartenente ad altri neuroni (simili o di altri tipi di tessuti nervosi) per guidare la
crescita dell’assone. Per esempio, quando gli assoni dei neuroni sensoriali in via di sviluppo
iniziano ad allungarsi, i loro coni di accrescimento si muovono inizialmente lungo le superfici
degli epiteli. Tuttavia, in punti specifici, la direzione di accrescimento del cono cambia
improvvisamente, in corrispondenza di sedi nelle quali i filopodi entrano in contatto con
neuroni specifici (cellule indicatrici): se questi neuroni vengono distrutti con un raggio laser,
gli assoni vagano in direzioni casuali. I coni di accrescimento utilizzano anche gli assoni di
neuroni circostanti già sviluppatisi come traccia lungo la quale estendersi (Labelled Pathways
Hipothesis)Error! Bookmark not defined.. I nervi periferici visibili macroscopicamente che
contengono assoni provenienti dal SNC si originano in questo modo (anche se in seguito gli
10
I neuroni e l’elettrofisiologia
Capitolo 1
assoni vengono avvolti singolarmente e isolati l’uno dall’altro mediante le guaine mieliniche
costituite dalle cellule di Schwann). Una famiglia di glicoproteine di superficie (fascicline) è
coinvolto nel processo attraverso il quale i coni di crescita riconoscono i fasci di assoni
appropriati.
2) Aptotassi: altri meccanismi utilizzano l’interazione diretta tra il cono di crescita e gradienti
di molecule appartenenti alla matrice extracellulare (oppure alle cellule gliali, come le
caderine e le proteine CAM, Cell Adhesion Molecule).
3) Chemotropismo: molti meccanismi infine utilizzano vari tipi di molecole diffusibili
generate dalle cellule-bersaglio dell’assone, che viene guidato dalla direzione dei gradienti di
concentrazione di queste molecole. Esperimenti in vitro hanno mostrato che particolari tessuti
nervosi esercitano a lunga distanza un’attrazione (chemoattrazione) o una repulsione
(chemorepulsione) sugli assoni di neuroblasti in coltura. E’ probabile che entrambi questi tipi
di effetti chemotattili concorrano a guidare l’assone verso il suo bersaglio: la stessa sostanza
può agire come attrattore per un’assone e come repulsore per un altro, permettendo
l’instaurarsi di connessioni molto precise.
1.1.5 Morfologia del neurone
La prima classificazione morfologica dei neuroni è stata proposta già da Ramon y Cajal
all’inizio del XX secolo: egli suddivise in sole tre classi le svariate forme assunte dalla cellula
nervosa, in base al numero di estensioni che dipartono dal corpo cellulare (Tab. 1.1).
Neurone (pseudo) unipolare: un sola
estensione citoplasmatica (che in genere
biforca in due lunghe estensioni, come
nei neuroni dei gangli dorsali).
Neurone biopolare: due estensioni
citoplasmatiche dal soma, uno delle quali
non ramifica (almeno nelle immediate
vicinanze) e funge da assone.
Neurone multipolare: molte estensioni
citoplasmatiche si estendono dal soma,
tra le quali l’assone.
Tabella 1 – Classificazione di Cajal della morfologia dei neuroni
Una classificazione più complessa può essere effettuata in base al dominio spaziale nel quale
si sviluppa la struttura dendritica [Fiala99]: si possono allora distinguere neuroni adendritici, a
fuso, radiali, laminari, cilindrici, conici ed a ventaglio (Tab. 1.2)
Un’altra caratteristica utile per diversificare le morfologie del neurone è il modo in cui i
dendriti occupano il loro dominio spaziale: si va da neuroni altamente selettivi (che creano
sinapsi con un solo assone), a neuroni che riempiono la maggior parte del loro dominio
(creando sinapsi con ogni assone che lo attraversa), passando per morfologie intermedie.
11
I neuroni e l’elettrofisiologia
Capitolo 1
La tendenza di un neurone a riempire un dominio spaziale può riflettere la sua propensione a
creare (pochi) contatti con gli assoni di un gran numero di celle oppure molti contatti con
assoni di poche cellule, in base anche alla disposizione geometrica degli assoni rispetto la
struttura dendritica. Ad esempi una cellula di Purkinje (con morfologia dendritica a ventaglio)
crea una o due sinapsi con ogni assone che la attraversa ortogonalmente al suo piano di
sviluppo, mentre crea fino a 17 sinapsi con ogni assone orientato parallelamente a questo
piano [Harvey91] .
I neuroni possono essere infine classificati in due grandi classi: neuroni che si sviluppano
interamente in una regione celebrale del SNC (neuroni intrinseci) e neuroni che collegano (in
genere attraverso il proprio assone) regioni diverse (neuroni di proiezione). Alcuni esempi
sono mostrati in fig. 1.7
Figura 6 – Esempi di neuroni di proiezione e neuroni intrinseci
Neuroni adendritici
Neuroni a fuso
Sono cellule nervose prive di strutture
dendritiche: dal corpo cellulare si dirama solo
un assone, che in genere si biforca dopo un
certo tratto, formando due lunghi assoni di
direzione opposta. Esempio: cellule gangliari
del sistema simpatico.
Alcuni neuroni hanno due soli dendriti che
emergono dal corpo cellulare in direzioni
opposte, ramificandosi poi scarsamente.
12
I neuroni e l’elettrofisiologia
Capitolo 1
Neuroni stellati
Neuroni cilindrici
Neuroni piramidali
Neuroni a ventaglio
Neuroni con radiazione sferica sono molto
comuni nel sistema nervoso centrale. Alcuni
neuroni hanno una radiazione sferica parziale,
con dendriti che si irraggiano in direzioni
ristrette ad una parte della sfera: ad esempio nei
neuroni attigui a nuclei celebrali i dendriti si
sviluppano solo in direzione di quest’ultimi.
Alcuni neuroni occupano un dominio spaziale di
forma cilindrica, orientato perpendicolarmente
agli assoni che li attraversono (così da costituire
un numero di sinapsi per neurone relativamente
costante). Questi tipi di neuroni formano la
quasi totalità delle cellule presenti nel globus
pallidus, una piccola regione del cervello dei
primati.
Molti neuroni assumono una morfologia a
doppio cono, con una ramificazione apicale ed
una basale, di distinti afferenti regioni assonali.
La lunghezza del cono apicale e basale
dipenderà dalla distanza del corpo cellulare
dalla regione dove i dendriti aquisiscono i
segnali eccitatori. Con molte variazioni: neuroni
monopiramidali (cellule granulose del bulbo
olfattivo); neuroni con una terza radiazione
cilindrica (dovuta ad un ulteriore assone che
passa attraverso l’asse dei coni, nelle cellule
corticali della corteccia visuale) o laminare
(cellule mitrali del bulbo olfattivo).
in alcuni neuroni un unico dendrite può
ramificarsi partendo dal corpo cellulare e
rimanere approssimativamente su un piano,
formando una struttura a ventaglio. L’esempio
più importante di questa classe morfologica è
costituito dalle cellule cerebellari di Purkinje,
che arrivano a sviluppare fino a 105 differenti
connessioni sinaptiche con altrettanti neuroni.
Tabella 2 – Classificazione dei neuroni in base al dominio spaziale occupato
1.1.6 L'impulso Nervoso
L'impulso nervoso rappresenta una trasmissione di segnali dai recettori sensoriali, al Sistema
Nervoso Centrale (dove sono ricevuti, identificati e interpretati) e dal SNC alle placche
motrici (dove producono contrazioni muscolari). Responsabile di queste caratteristiche è la
membrana plasmatica, semipermeabile, che delimita la cellula. In condizioni di riposo la
13
I neuroni e l’elettrofisiologia
Capitolo 1
membrana plasmatica presenta una differenza di potenziale elettrico fra l'esterno e l'interno di
-70mv. Questo potenziale è dovuto al fatto che sul lato interno della membrana sono presenti
grosse molecole proteiche con carica elettrica negativa, mentre sul lato esterno vi è una
elevata concentrazione di ioni Na+, con carica positiva, espulsi attivamente dalla cellula
mediante un meccanismo definito pompa sodio-potassio; quando è in riposo la membrana
plasmatica è impermeabile all'ingresso degli ioni Na+ (Sodio). Se un neurone viene in qualche
modo stimolato, la membrana plasmatica diventa permeabile agli ioni Na+, che entrano
dentro la cellula in grande quantità; il flusso di ioni Na+ provoca un'inversione di polarità:
all'interno della membrana c'è ora un eccesso di carica positiva, ed all'esterno una carenza di
carica positiva: la membrana si depolarizza, fino ad assumere un potenziale di +50mv, detto
potenziale d'azione.
figura 7: l’impulso nervoso
Una volta insorto, il potenziale d'azione si propaga da dove è stato applicato lo stimolo alla
zona di membrana successiva, causando la sua depolarizzazione, quindi la trasmissione
dell'impulso nervoso. La depolarizzazione della membrana continua lungo tutta la fibra
nervosa grazie a continui flussi di ioni che spostandosi da un lato all'altro della membrana
mantengono il potenziale d'azione, così il potenziale d'azione si propaga per tutto l'assone. La
condizione di depolarizzazione però dura solo circa 0.5 msec. Trascorso questo tempo
riprende l'attività della pompa sodio-potassio, che espelle attivamente gli ioni Na+ fuori dalla
cellula e ripristina quindi il potenziale di riposo della membrana plasmatica. L'intervallo di
tempo necessario perché venga ripristinata la condizione di riposo è chiamato periodo
refrattario, ed in questo lasso di tempo quel tratto di membrana è incapace di rispondere agli
stimoli. Nelle fibre nervose rivestite da guaina mielinica la depolarizzazione "salta" da un
nodo a quello successivo, così che l'impulso si può propagare per balzi, assai velocemente.
14
I neuroni e l’elettrofisiologia
Capitolo 1
figura 10: propagazione impulso
1.1.7 Le sinapsi
Le singole cellule nervose sono in contatto tra loro al fine di poter trasmettere l'impulso
nervoso. Questi contatti, denominati "sinapsi"(dal greco "sinapsis" = collegamento), sono
dispositivi al cui livello ha luogo la trasmissione dell'impulso nervoso da un neurone ad un
altro. In base alla modalità di funzionamento, le sinapsi vengono distinte in elettriche e
chimiche.
Nelle sinapsi elettriche il potenziale d'azione si propaga direttamente dalla membrana del
neurone presinaptico a quella del neurone postsinaptico. Nelle sinapsi di tipo chimico il
passaggio dell'impulso nervoso da un neurone a quello successivo avviene tramite la
liberazione di sostanze, dette neurotrasmettitori. Nell'organismo umano tutte le sinapsi sono di
tipo chimico, ed il neurotrasmettitore più diffuso è l'acetilcolina.
Le strutture componenti le sinapsi sono:
la membrana presinaptica, corrispondente alla terminazione assonica della cellula dalla
quale proviene lo stimolo;
la membrana postsinaptica, corrispondente alla membrana del neurone alla quale giunge lo
stimolo;
la fessura sinaptica, cioè lo spazio extracellulare fra i due neuroni coinvolti.
All'estremità, l'assone del neurone presinaptico si ramifica e forma espansioni, che a causa
della loro forma prendono il nome di bottoni sinaptici. Qui il citoplasma è ricco di vescicole
contenenti il neurotrasmettitore.
15
I neuroni e l’elettrofisiologia
Capitolo 1
figura 11: la sinapsi
L'arrivo dell'impulso nervoso provoca la rottura di queste vescicole, che liberano il
neurotrasmettitore nella fessura sinaptica. I dendriti del neurone postsinaptico possiedono
recettori chimici al quale si lega il neurotrasmettitore; questo legame modifica la permeabilità
agli ioni Na+ della membrana plasmatica e ne causa la depolarizzazione, cioè l'insorgenza del
potenziale d'azione. In questo modo l'impulso nervoso si trasmette da un neurone ad un altro.
La presenza della sinapsi è dunque all'origine di un piccolo intervallo nella trasmissione
dell'impulso nervoso, un intervallo brevissimo, che dura meno di un millesimo di secondo.
Sinapsi chimiche ed elettriche
Nelle sinapsi chimiche La variazione del potenziale transmenmbrana innesca il rilascio di un
neurotrasmettitore che diffonde attraverso la sinapsi e giunge in contatto con specifici
recettori sulla membrana cellulare opposta. Gli effetti di questo legame variano in relazione
alla natura chimica e alle proprietà del recettore. Ve ne sono di diversi tipi : colinergiche,
adrenergiche, GABA ergiche…etc a seconda del neurotrasmettitore rilasciato. Il bottone
sinaptico contiene mitocondri, vescicole ed aree di reticolo endoplasmatico; le moecole di
neurotrasmettitore sono disperse nel citoplasma o racchiuse entr vescicole sinaptiche. La
depolarizzazione della membrana presinaptica che segue l’arrivo di uun potenziale d’azione
costituisce lo stimolo per il rilascio del neurotrasmettitore, attraverso il fenomeno di esocitosi
delle vescicole sinaptiche.
Nelle sinapsi elettriche invece, le membrane cellulari pre e post sinaptiche sono strettamente
connesse tra loro, permettendo il passaggio di ioni o piccole molecole attraverso un gap di
circa 2-4 mm. Questa modalità elimina il ritardo sinaptico, che si può iinvece verificare con le
snapsi chimiche, a caua del tempo necessario per i rilascio del neurotrasmettitore e per il
verificarsi del suo effetto sulla membrana postsinaptica. Questo fenomeno può essere
descritto matematicamente mediante una corrente proporzionale alla differenza di potenziale:
delta V= Vpre-Vpost
La maggiorparte delle interazioni tra neuroni e tutte le comunicazioni tra neuroni ed effettori
periferich coinvolgoo sinapsi chimiche.
Una sinapsi chimica è più dinamica di una elettrica in quanto nella prima intervengono
anche altre sostanze che possono essere rilasciate ed esercitare la funzione di
16
Capitolo 1
I neuroni e l’elettrofisiologia
neuromodulatore, influenzando la risposta della cellula postsinaptica al neurotramettitore
stesso, in maniera diretta o indiretta (attaverso un secondo messaggero); le cellule in questo
caso, non sono direttamente accoppiate e le interazioni tra neurotrasmettitori eccitatori ed
inibitori rendno variabile la risposta della cellula postsinaptica. La risposta riflette tutti gli
aspetti dello stimolo, nelle sue componenti eccitatorie e inibitore, che agiscono sul neurone
postsinaptico in un dato momento: l’effetto finale non dipende solo dal neurone presinaptico,
ma è il risultato di un processo di integrazione dell’informazione a livello sinaptico. Un
singolo neurone viene incontatto con migliaiai di bottoni sinaptici;alcune sinapsi hanno
l’effetto di depolarizzare la membrana postsinaptica (potenziale postsinaptico eccitatorio,
EPSP), altre provocano una iperpolarizzazione transitoria della membrana postsinaptica
(potenziale inibitorio postsinaptico, IPSP)
Un tipico EPSP determina una depolarizzazione di circa 0,5mV, molto meno della
depolarizzazone dei 15-20 mV necessaria per raggiungere la soglia e generare il potenziale
d’azione; tuttatvia, singoli EPSP possono combinarsi tra loro e permettere di ottenere i valori
richiesti:
sommazione temporale : a livello di singola sinapsi, quando un secondo EPSP arriva prima
che gli effetti del primo siano comparsi
sommazione spaziale: effetti cumulativi di più bottoni sinaptici.
È possibile che si verifichino contemporanenamente, nella stessa parte della membrana
cellulare, EPSP e IPSP: in ogni momento le attività di ogni singolo neurone riflette il loro
bilancio.
Principali neurotrasmettitori e recettori
Le sostanze potenzialmente utilizzabili come neurotrasmettitori vengono definite
neurotrasmettitori candidati e sono normalmente concentrati in specifici neuroni. Microdosi di
neurotrasmettitori candidati, rilasciate nel SNC, danno vita a determinate risposte. Per essere
certi che un neurotrasmettitore sia il trasmettitore di una sinapsi deve soddisfare le seguenti
condizioni:
Il neurone presinaptico deve contenere il neurotrasmettitore, e deve altresì essere in grado di
sintetizzarlo.
Il neurotrasmettitore dev'essere liberato dal neurone ad una determinata stimolazione.
L'applicazione mediata di microdosi di neurotrasmettitore nella membrana sinaptica, deve
avere i medesimi effetti del normale rilascio dello stesso neurotrasmettitore da parte del
neurone.
Sostanze farmacologiche devono modificare allo stesso modo i due tipi di stimolazione (da
rilascio
normale
e
da
applicazione
indotta
di
neurotrasmettitore).
La maggior parte dei trasmettitori conosciuti fa parte di una di queste tre categorie:
Amine;
Aminoacidi;
Oligopeptidi.
17
Capitolo 1
I neuroni e l’elettrofisiologia
Sono stati fatti molti progressi nella scoperta dei neurotrasmettitori conivolti a livello
sinaptico nel sistema nervoso. I recettori neuronali più diffusi nel SN sono quelli per gli
amminoacidi.
I quattro amminoacidi di cui è più sicura la funzione di neurotrasmettitore sono:
-- l’acido glutammico e l’acido aspartico ce sono i principali mediatori dell’eccitamento.
-- l’acido gamma-aminobutirrico, GABA, che media le interazioni inibitorie nel cervello
-- la glicina, sostanza inibitoria a livello delle sinpasi tra le cellule nervose del midollo
spinale.
I recettori glutammaergici (il cui nome deriva da glutammato che è il loro più importante
neurotrasmettitore agonista) sono interessati in diversi processi come per esempio
l’apprendimento e il loro ruolo è fondamentale nel normale sviluppo delle connessioni
sinaptiche nel cervello.
Glutammato ed aspartato sono amminoacidi non essenziali che vengono sintetizzati a partire
dal glucosio e da altri precursori. Enzimi specifici per il glutammato e l’aspartato sono
localizzati in neuroni e cellule gliali.
Recettori glutammaergici
Il glutammato è il principale neurotrasmettitore eccitatorio nel SNC e promuove la
sopravvivenza neuronale durante lo sviluppo cerebrale e distrugge i neuroni danneggiati nel
cervello maturo. La presenza di recettori glutammaergici è stata scoperta in neuroni di molte
formazioni encefaliche, in particolare nella corteccia cerebrale dell’ippocampo, ma anche nei
nuclei della base e nella corteccia del cervelletto, ove si ritiene che tale acido sia
neurotrasmettitore nelle sinapsi formate dalle fibre parallele con le cellule del Purkinje, ed
anche nel midollo spinale. Sono in corso studi clinici per valutare se gli antagonisti del
glutammato siano in grado di eliminare i danni neuronali dopo un trauma cerebrale. Inoltre gli
antagonisti del glutammato sono considerati farmaci neuroprotettivi nelle malattie
neurodegenerative croniche, rallentando la progressione verso la morte cellulare.
L’acido glutammico è accumulato in vescicole sinaptiche e viene liberato per esocitosi Ca++
dipendente: la depolarizzazione della membrana presinaptica, che segue l’arrivo di un
potenziale d’azione, porta ad un aumento della pemeabilità al sodio e ad un rapido aumento
della permeabilità agli ioni calcio, che diffondono nel citoplasma del bottone sinaptico; il loro
aumento di cncentrazione attiva gli enzimi che determinano il rilascio del neurotrasmettitore
nello spazio sinaptico. Esso diffonde quindi attaverso lo spazio sinaptico verso opportuni
recettori, situati sulla membrana postsinaptica.
I recettori per amminoacidi eccitatori sono classificati in:
-- recettori ionotropici (l’attivazione del recettore è direttamnte accoppiata alla mebrana del
canale ionico): NMDA e non-NMDA(AMPA e KA)
-- recettori metabotropici (l’attivazione del recettore è accoppiata ad una cascata biochimica
intracellulare, che può portare ad apertura o chiusura di canali ionici): mGluRs
18
I neuroni e l’elettrofisiologia
Capitolo 1
I recettori non-NMDA appartengono alla classe dei recettori canale ionico, che attivati,
consentono il passaggio di K+ e Na+ secondo gradiente elettrochimico, portando alla rapida
depolarizzazione della membrana postsinaptica.
I recettori NMDA invece presentano un meccanismo d’attivazione più complesso: oltre a
quello per il glutammato, vi è anche un sito di legame per la glicina. L’ attivazione del
recettore avviene solo in presenza di entrambi i trasmettitori e di una depolarizzazione della
membrana cellulare di entità tale da vincere il blocco del canale prodotto dagli ioni Mg++ .
figura 12: canali NMDA e non
19
I neuroni e l’elettrofisiologia
Capitolo 1
1.2 L’elettrofisiologia
1.2.1 Le membrane biologiche
Le membrane cellulari svolgono molte funzioni: da quelle di barriera a quelle di
permeabilità selettiva per certe sostanze, dalla trasduzione di segnali in ingresso, alla
liberazione di sostanze come trasmettitori e ormoni.
Fisicamente la membrana è troppo sottile per cadere entro i limiti di risoluzione del
microscopio ottico. La sua esistenza è stata quindi dedotta dalle sue proprietà di barriera e
permeabilità. Infatti se si inietta un colorante nella cellula si osserva che il colorante diffonde
all’interno del citoplasma fino a raggiungere un limite oltre il quale non và. È quindi presente
una barriera che lo ferma. Se con un microago si punge la periferia della cellula si potrà
vedere il colorante e il contenuto della cellula stessa riversarsi all’esterno.
La sua permeabilità è bassa per le sostanze idrofiliche ma buona per le sostanze lipofiliche.
Questo condusse già nel 1899 Ernst Overton a proporre che le cellule sono circondate da uno
strato superficiale costituito da acidi grassi e colesterolo.
In seguito a opportuno trattamento di fissazione e colorazione la membrana può essere
osservata al microscopio elettronico che rivela la sua struttura a doppio strato. I due foglietti
lipidici hanno uno spessore di circa 2.5 nm e sono separati l’uno dall’altro da una banda
altrettanto spessa da cui risulta che lo spessore totale della membrana è di circa 7.5 nm.
Questa struttura a doppio strato è una costante per tutte le membrane biologiche comprese
quelle degli organelli intracellulari.
La struttura delle membrane biologiche
Le membrane biologiche sono costituite da lipidi e proteine, associati tra loro da
interazioni di tipo non covalente. Le membrane sono strutture fluide e asimmetriche (la
superficie interna ed esterna ha una composizione molecolare diversa).
Figura 13: i lipidi di membrana
20
Capitolo 1
I neuroni e l’elettrofisiologia
La componente lipidica
I principali costituenti lipidici della membrana sono fosfolipidi, colesterolo e glicolipidi. I
fosfolipidi e i glicolipidi di membrana hanno un carattere anfipatico. Sono costituiti da una
porzione polare e idrofilica, la testa e da una coda apolare e idrofobica Fig. 1A. Le teste polari
sono costituite da glicerolo, fosfocolina e dai gruppi carbossilici degli acidi grassi esterificati.
Le code invece sono formate dalle catene idrocarburiche degli acidi grassi. Per la
caratteristica distribuzione delle cariche elettriche nei lipidi di membrana, tali molecole hanno
la tendenza ad aggregarsi in modo da volgere tutte le teste polari verso l’ambiente acquoso e
le code apolari le une verso le altre a formare un ambiente apolare. Le teste polari quindi
formano le due superfici extracellulare e intracellulare della membrana plasmatica, mentre le
code formano la porzione apolare idrofobica intramembranosa. Questi doppi strati lipidici
hanno anche l’interessante tendenza di chiudersi in bollicine paragonabili alle bolle di sapone.
Le teste dei fosfolipidi presentano in genere una preponderante carica elettrica negativa,
pertanto sulle superfici delle membrane biologiche esistono delle cariche negative strutturali
che contribuiscono a determinare il potenziale della membrana (vedi oltre). Siccome il
movimento della testa di una molecola lipidica da una superficie all’altra della membrana
(movimento di flip flop) è un evento assai raro, questo rende possibile una certa asimmetria
nei componenti lipidici dei due strati. I glicolipidi ad esempio sono localizzati nello strato
rivolto verso l’ambiente extracellulare.
Il colesterolo Fig. 1B è presente nelle membrane plasmatiche degli eucarioti. In minor
misura è presente nelle membrane degli organelli all’interno di queste cellule, così come è
scarsamente rappresentato nella maggior parte delle membrane dei procarioti. Il suo nucleo
steroideo si dispone nella porzione interna del doppio strato lipidico, parallelamente alle code
degli acidi grassi. Negli eucarioti il colesterolo è il principale regolatore della fluidità delle
membrane.
La componente proteica
Oltre alla trama lipidica fondamentale le membrane sono composte da una frazione
variabile di proteine che in talune cellule supera il 50% in peso della membrana. Le proteine
sono di varie dimensioni e funzioni. Sono associate alla membrana, in parte sulla superficie
esterna o interna (periferiche) e talune sono inserite nella membrana attraversandola a tutto
spessore (integrali). Le proteine integrali formano numerose interazioni con le catene
idrocarburiche dei lipidi di membrana e possono essere estratte solo con detergenti, agenti che
competono con queste interazioni apolari. Le proteine periferiche sono associate alle
membrane con interazioni elettrostatiche e con legami idrogeno, interazioni che possono
essere rotte dalla aggiunta di sali (in opportune concentrazioni) o dal cambiamento del pH.
Singer e Nicholson hanno suggerito un modello di membrana a mosaico fluido. Secondo
tale modello le proteine assomigliano ad iceberg fluttuanti in un mare di lipidi Fig. 2.
Talune proteine sono effettivamente libere di diffondere, di andare alla deriva nella
membrana e questi spostamenti consentono loro di avvicinarsi alle altre molecole funzionali e
espletare le loro funzioni. Questo è il caso di alcuni recettori che quando vengono attivati dal
trasmettitore, per trasdurre il loro specifico segnale devono interagire con una seconda
proteina di membrana, una G-proteina, la quale non è associata al recettore in modo
permanente. Altre proteine invece non sono in grado di muoversi. Ne costituiscono un
esempio i recettori postsinaptici dell’acetilcolina nella placca neuromuscolare i quali si
trovano raggruppati in corrispondenza del bottone sinaptico e non sono liberi di diffondere per
21
Capitolo 1
I neuroni e l’elettrofisiologia
tutta la membrana della fibra muscolare. I possibili vincoli che trattengono i recettori sono con
il citoscheletro e con la matrice extracellulare.
Neurotrasmettitori e ormoni controllano le funzioni cellulari legandosi a specifici recettori
e attivando raffinati sistemi di trasduzione
Neurotrasmettitori e ormoni (esclusi gli ormoni steroidei) si legano ai recettori specifici
delle cellule bersaglio e svolgono la loro azione rimanendo confinati all’esterno della cellula.
Le membrane plasmatiche possiedono i sistemi necessari per trasdurre il segnale
extracellulare in un segnale citoplasmatico. Una volta formatosi il complesso ligandorecettore si avvia una catena di eventi che portano alla produzione di un segnale
citoplasmatico (secondo messaggero).
Figura 14: noradrenalina in fibre cardiache
Come esempio in Fig. 14 è rappresentata l’azione della noradrenalina sulle fibre cardiache.
Le proteine di membrana e citoplasmatiche implicate nel processo sono: il recettore adrenergico, la G-proteina con le sue subunità , , , l’adenilico-ciclasi (AC), la
proteinchinasi di tipo A (PKA) e il canale del Ca2+ che viene modulato.
I recettori sono glicoproteine che attraversano completamente lo spessore della membrana,
presentano una grossa porzione extracellulare dove si trovano i siti di legame per l’ormone o
il neurotrasmettitore o per qualsiasi altra molecola che il recettore è deputato a riconoscere. La
porzione immersa nel doppio strato lipidico, chiamata porzione transmembrana, è costituita da
una serie -eliche ricche di aminoacidi idrofobici. La porzione intracellulare è quella che
prende contatto con la G-proteina quando si forma il complesso ligando-recettore. Sulla
porzione intracellulare del recettore sono presenti siti di fosforilazione, punti di regolazione
dell’attività del recettore (ad es. durante i fenomeni di desensitizzazione).
Le G-proteine sono complessi proteici associati alla superficie interna della membrana.
Sono costituite da tre subunità , e . Quando la G-proteina è disattivata, alla subunità è
legata una molecola di GDP (guanosindifosfato). Quando si forma il complesso ligandorecettore, il recettore che prende contatto con la G-proteina ne determina cambiamenti di
affinità e induce la sostituzione della molecola di GDP con una molecola di GTP
(guanosintrifosfato). La subunità si stacca dalle altre due subunità e per diffusione lungo il
foglietto lipidico va ad attivare enzimi presenti sulla superficie interna della membrana, nel
nostro esempio l’adenilico-ciclasi. L’adenilico-ciclasi è l’enzima che catalizza la conversione
del ATP (adenosintrifosfato) in AMPc (adenosinmonofosfato-ciclico), in seguito alla sua
attivazione si verifica un aumento della concentrazione citoplasmatica di AMPc. Questo è il
secondo messaggero che attiva la PKA. La PKA, così come altri tipi di proteinchinasi, è un
enzima che fosforila le proteine cellulari. La sua attività dipende dalla presenza di uno
specifico secondo messaggero, l’AMPc. Le proteinchinasi riconoscono e fosforilano le
proteine a livello degli aminoacidi serina e treonina di specifiche sequenze consenso. La
fosforilazione delle proteine (siano esse enzimi, recettori, o canali) rappresenta un sistema di
regolazione della loro attività (può determinarne l’attivazione o l’inattivazione a seconda dei
22
Capitolo 1
I neuroni e l’elettrofisiologia
casi). L’attivazione della PKA della fibra cardiaca fosforila i canali del Ca2+, determinando,
durante la depolarizzazione della fibra, un aumento del flusso di Ca2+ e quindi producendo un
aumento della forza di contrazione della fibra (vedi oltre).
1.2.2 Gli ioni calcio
E’ noto che le variazioni in più o in meno del [Ca2+] extracellulare che si possono
verificare in malattie quali l'iperparatiroidismo o l'ipoparatiroidismo, inducono
rispettivamente una "debolezza muscolare" o una tendenza dei muscoli a contrarsi
spontaneamente. Questi effetti sono dovuti a variazioni del potenziale di membrana in senso
iperpolarizzante, quando aumenta il [Ca2+] extracellulare e in senso depolarizzante quando il
[Ca2+] diminuisce. La spiegazione di tale fenomeno sta nel fatto che alla superficie esterna dei
canali del sodio e più in generale su tutta la superficie della membrana plasmatica ci sono
delle cariche elettriche negative fisse, strutturali, dovute a gruppi ionizzati Fig.8. Tali cariche
negative esterne producono una diminuzione del potenziale positivo del compartimento
esterno in prossimità della superficie della membrana. Gli ioni Ca2+ nella soluzione
extracellulare, ma anche altri ioni bivalenti quali il Mg2+, esercitano un'azione di schermatura
di queste cariche di superficie, accentuando pertanto la differenza di potenziale tra le due
superfici della membrana. Il valore del potenziale di riposo si allontanerà quindi dalla soglia
per il potenziale d'azione e più in generale dai valori a cui i canali voltaggio-dipendenti si
attivano. Le porte voltaggio-dipendenti dei canali ionici presenti nella membrana, sono infatti
soggette al gradiente di potenziale elettrico che si forma alle due estremità del poro, piuttosto
che alla differenza di potenziale esistente tra i due compartimenti acquosi. Ecco quindi
spiegato il motivo per cui la diminuzione di [Ca2+] plasmatico aumenta la probabilità che si
inneschino potenziali d'azione e quindi l'eccitabilità muscolare e viceversa un aumento del
[Ca2+] diminuisce l'eccitabilità e induce una apparente "debolezza".
1.2.3 Pompa Na+-k+
Prima di prendere in considerazione il meccanismo di azione della pompa, consideriamo le
concentrazioni intra e extracellulari di Na+ e di K+ riportate nella Tab.2. Il Na+ è più
concentrato all’esterno che all’interno della cellula, mentre il K+ viceversa è più concentrato
all’interno. Esistono pertanto a cavallo della membrana due gradienti di concentrazione, uno
di Na+ diretto dall’esterno all’interno e uno di K+ diretto in senso opposto. Poichè la
membrana plasmatica presenta una certa permeabilità agli ioni Na+ e K+, è chiaro che
entrambe le specie ioniche tenderanno a muoversi lungo i loro gradienti di concentrazione
riducendo i gradienti stessi. Questa diffusione è controbilanciata dalla presenza di un
meccanismo attivo, la pompa Na+-K+, che mantiene lo squilibrio ionico operando contro
gradiente. Mantenere i due gradienti ionici, a cavallo della membrana è infatti essenziale per il
funzionamento cellulare, soprattutto per le cellule elettricamente eccitabili (nervi e muscoli)
che utilizzano i due gradienti per generare correnti elettriche.
L’attività della pompa Na+-K+ è pertanto molto importante: essa determina due flussi
strettamente accoppiati, di Na+ e di K+, diretti entrambi contro i relativi gradienti di
concentrazione secondo la reazione stechiometrica:
3 Na+int + 2 K+est => 3 Na+est + 2K+int
23
Capitolo 1
I neuroni e l’elettrofisiologia
Sia per il Na+ che per il K+ si tratta di un trasporto attivo; l’energia necessaria per l’attività
della pompa deriva dall’ATP e più precisamente dall’idrolisi dell’ultimo legame fosforico
dell’ATP secondo la reazione:
ATP => ADP + P
La pompa del Na+ ha quindi attività enzimatica, è un’ATPasi. La reazione stechiometrica
che descrive l’attività della pompa può pertanto essere completata in questo modo:
3Na+int + 2K+est + ATP
=> 3Na+est + 2K+int + ADP + P
Il fatto che il numero degli ioni Na+ e K+ implicati nel trasporto non sia lo stesso (ad ogni
ciclo sono pompati all’esterno 3 Na+ mentre all’interno solo 2K+) porta a due conseguenze:
La pompa ha attività elettrogenica in quanto trasporta fuori una carica positiva netta ad
ogni ciclo di funzionamento ed induce quindi una iperpolarizzazione (aumenta la negatività)
del potenziale di membrana.
È stata riconosciuta l’importanza dell’attività elettrogenica della pompa nelle cellule
pacemaker del cuore, dove cambiamenti del grado di funzionalità della pompa inducono
variazioni del potenziale di membrana e quindi dell’eccitabilità e della frequenza di scarica
delle cellule cardiache (vedi oltre).
Vediamo ora cosa suggeriscono i dati della biologia molecolare circa la struttura della
pompa Na+-K+ e il suo probabile meccanismo d'azione.
La pompa Na+-K+ è una proteina transmembrana costituita da due subunità glicoproteiche
e e forse una subunità di cui si ipotizza l'esistenza ma di cui non si conosce molto.
La subunità presenta un residuo aspartico fosforilabile e i siti di legame specifici per il
Na+, il K+ e l'ATP. La subunità , di dimensioni inferiori, ha un prevalente dominio
extracellulare.
Il meccanismo di azione della pompa si basa su modificazioni conformazionali cui la
molecola va incontro in seguito a fenomeni di fosforilazione e defosforilazione, a loro volta
attivati in modo allosterico dagli ioni Na+ e K+ che si legano ai propri siti di trasporto. I
fenomeni di fosforilazione e defosforilazione avvengono a carico del residuo aspartico
fosforilabile della subunità . Il meccanismo d'azione può essere spiegato in questo modo:
la pompa si trova inizialmente in una conformazione E1, che espone i siti di legame per il
Na+ e il K+ verso il lato citoplasmatico della membrana. In questa conformazione ha più
affinità per il Na+ che per il K+.
Il legame col Na+ porta all'idrolisi dell'ATP e alla fosforilazione della subunità della
pompa secondo la reazione:
ATP + E1 => E1-P + ADP
(in presenza di Na+ e Mg2+)
La pompa nella conformazione E1 fosforilata, con i 3 ioni Na+ legati
(conformazione E1-P-Na+3) va incontro ad una modificazione conformazionale per cui i siti
per il Na+ e il K+, che prima erano rivolti verso il lato citoplasmatico della membrana, si
spostano verso il lato esterno, con aumento dell’affinità per il K+ e diminuzione di quella per
il Na+.
24
Capitolo 1
I neuroni e l’elettrofisiologia
La nuova conformazione, che indichiamo con E2-P è più stabile della precedente
(infatti si raggiunge spontaneamente in quanto ha un contenuto energetico inferiore rispetto
all'intermedio E1-P-Na+3) e prevede la liberazione del Na+ nell'ambiente extracellulare e il
legame del K+ al suo sito specifico.
Il legame col K+ stimola l'attività fosfatasica della pompa per cui avviene il distacco
del gruppo fosforico secondo la reazione:
E2-P => E2 + Pi
(in presenza di K+ e Mg2+)
La defosforilazione induce il ritorno della pompa alla conformazione iniziale E1,
con i siti per il Na+ e il K+ rivolti verso il lato intracitoplasmatico e un'affinità per il Na+
maggiore di quella per il K+.
Lo ione K+ viene così liberato nell'ambiente intracellulare contro gradiente di
concentrazione e il ciclo ricomincia.
1.2.4 Pompa del Ca2+
Normalmente la concentrazione di Ca2+ intracellulare è molto bassa (10-7 M) mentre la
concentrazione di Ca2+ extracellulare è più elevata (10-3 M). Il Ca2+ a livello intracellulare è
in grado di attivare e regolare molti processi, quali la contrazione, l’esocitosi, l’endocitosi e
l’attivazione di enzimi fosforilanti. Pertanto è essenziale, quando questi processi non devono
essere attivati, che la concentrazione di Ca2+ si mantenga bassa e a questo compito
provvedono le pompe del Ca2+. Per diminuire la concentrazione di Ca2+ citoplasmatica, questo
ione viene in parte riversato all’esterno della cellula e in parte sequestrato all’interno di
organuli citoplasmatici come il reticolo endoplasmatico e i mitocondri. Distinguiamo due tipi
di ATPasi Ca2+ attivate:
Una pompa del Ca2+ presente a livello del reticolo sarcoplasmatico: questa pompa
trasporta Ca2+ all’interno del reticolo scambiando 2 ioni Ca2+ con 2 ioni H+ per 1 molecola di
ATP scissa. Questa pompa presenta forti analogie, sia per la struttura che per il meccanismo
di trasporto, con la pompa Na+-K+.
Una pompa del Ca2+ presente a livello della membrana plasmatica delle cellule.
Trasferisce 2Ca2+ nell’ambiente extracellulare per molecola di ATP scissa. Anche questa
pompa presenta estese analogie con la pompa Na+- K+: ad esempio ha un’attività fosfatasica
ed una chinasica legate a due conformazioni differenti. L’attività della pompa può essere
aumentata aggiungendo a livello citoplasmatico una proteina Ca2+ regolatrice, la calmodulina;
questo aumento di attività sembra essere legato al fatto che la calmodulina aumenta l’affinità
della pompa per il Ca2+.
Questi meccanismi di trasporto del Ca2+ sono praticamente ubiquitari. Quelle cellule che
per paricolari funzioni vanno incontro a notevoli aumenti della concentrazione di Ca2+
intracellulare (ad esempio le cellule muscolari duranti la contrazione) presentano sistemi di
trasporto del Ca2+ aggiuntivi, come il trasporto secondario Ca2+-Na+.
1.2.5 Il potenziale d’azione
Il potenziale d'azione o spike è un rapido transiente del potenziale elettrico a cavallo delle
membrane eccitabili quando queste vengono opportunamente stimolate Fig.19B. La
25
I neuroni e l’elettrofisiologia
Capitolo 1
membrana passa dal potenziale di riposo (solitamente -60 - 90mV) a circa +30mV e poi si
ripolarizza e riassume il potenziale di riposo, generalmente in pochi msec.
Affinché sia generato il potenziale d'azione, è necessario che lo stimolo induca una
variazione positiva del potenziale di riposo della membrana (depolarizzazione), portandolo
oltre il valore di soglia (circa -45mV). Quando il valore di soglia è superato, il potenziale
d'azione evolve in modo autonomo. Si dice pertanto che è un fenomeno tutto-o-nulla. Una
volta innescato avviene sempre nello stesso modo, il potenziale raggiunto al suo apice e la
durata sono pressoché indipendenti dall'entità dello stimolo attivante. D'altro canto stimoli
"deboli" possono essere inadeguati a innescarlo.
Quali sono le caratteristiche di uno stimolo affinché sia "adeguato"?
Il potenziale soglia
Supponiamo di metterci nelle condizioni sperimentali riportate nella Fig.15A, con un
elettrodo registrante misuriamo il potenziale elettrico E della cellula e attraverso un secondo
elettrodo, stimolante, pompiamo impulsi di corrente di varia intensità (I) e durata (t). In queste
condizioni possiamo determinare i valori di intensità e durata necessari affinché lo stimolo sia
in grado di innescare il potenziale d’azione Fig.15B,D. La curva nel diagramma intensitàdurata di Fig.20 indica per ciascun valore di durata dell’impulso, in ascissa, l’intensità minima
della corrente, in ordinata, necessaria per innescare il potenziale d’azione. L’andamento della
curva si approssima a quello di una iperbole dal momento che ogni punto della curva risponde
all’incirca alla legge: I t = costante. Questo significa che per raggiungere la soglia è
necessario pompare, a cavallo della membrana, una certa quantità Q = I t di cariche
elettriche. Queste cariche servono a caricare l’elemento capacitivo della membrana affinché il
potenziale si sposti dal valore di riposo al valore di soglia.
Figura 15
La curva si approssimerà all’iperbole quanto più la membrana si comporterà come un
elemento puramente capacitivo. Essendo tuttavia presente anche un elemento resistivo in
parallelo con l’elemento capacitivo, la curva tenderà a scostarsi dall’iperbole, in particolar
modo per impulsi di bassa intensità e di lunga durata. In questo caso la soglia potrebbe anche
non essere mai raggiunta perché la corrente pompata sfugge attraverso l’elemento resistivo. È
come versare acqua in un secchio bucato. Si può riempirlo all’orlo solo se si versa l’acqua
26
Capitolo 1
I neuroni e l’elettrofisiologia
necessaria in un tempo breve. Se la si versa lentamente, questa uscirà via via dal foro
(resistenza) e il secchio (condensatore) non si riempirà mai.
La fase ascendente del potenziale d’azione
Una volta superato il potenziale di soglia si ha un rapido incremento del potenziale di
membrana che non è più spiegabile in base alla sola corrente pompata attraverso l’elettrodo
stimolante. In altre parole il potenziale di membrana cresce molto più di quanto ci si potrebbe
aspettare in base alla legge di Ohm per la sola corrente di stimolazione. Si è scoperto che la
corrente che causa il rapido aumento di potenziale nella fase ascendente del potenziale
d’azione è trasportata da un flusso di ioni Na+ verso l’interno della cellula. Questi ioni
passano attraverso specifici canali per il Na+ voltaggio-dipendenti che si aprono in seguito alla
prima depolarizzazione indotta dallo stimolo. L’ulteriore depolarizzazione indotta
dall’ingresso di Na+ a sua volta fa aprire altri canali del Na+, innescando un feedback positivo
che spiega il carattere “esplosivo” del fenomeno. La membrana divenuta permeabile al Na+,
per la legge di Ohm, tende al potenziale di equilibrio del Na+ (circa +60mV).
La fase discendente del potenziale d’azione
In realtà nel potenziale d’azione la membrana non si depolarizza fino al potenziale
d’equilibrio del Na+ ma si ferma a circa +30mV. Il motivo per cui il potenziale di equilibrio
del Na+ non viene raggiunto è duplice. Da un lato i canali del Na+ si chiudono rapidamente
per effetto dell’inattivazione (vedi oltre). Viene quindi meno il flusso di Na+. Un secondo
motivo è rappresentato dall’apertura, in seguito alla depolarizzazione, di altri canali
permeabili selettivamente al K+. Questi danno origine a un flusso di cariche positive verso
l’esterno (il K+ è maggiormente concentrato all’interno della cellula). Questa nuova corrente
contraria a quella del Na+ inverte l’andamento del potenziale e ripolarizza la cellula.
La iperpolarizzazione postuma
La ripolarizzazione della membrana, in molte cellule, procede oltre il potenziale di riposo,
verso valori più negativi e più prossimi al potenziale di equilibrio del K+. Questa fase del
potenziale d’azione è detta iperpolarizzazione postuma e ha una durata variabile di diversi
msec. È causata dalla lentezza con cui i canali del K+ voltaggio-dipendenti si richiudono in
seguito alla ripolarizzazione. Dopo questa fase la membrana ritorna al potenziale di riposo.
Le conduttanze per gli ioni sodio e potassio
In Fig.15C è rappresentato l’andamento delle conduttanze per il Na+ e il K+ nel tempo,
durante il potenziale d’azione. È importante osservare che queste conduttanze pur essendo
entrambe voltaggio-dipendenti e pur attivandosi entrambe in seguito a una depolarizzazione,
presentano cinetiche diverse. La conduttanza per il Na+ si attiva più rapidamente della
conduttanza per il K+. Questo è un aspetto fondamentale per comprendere il potenziale
d’azione, perché la diversa velocità di attivazione implica una alternanza delle opposte
correnti di Na+ e K+ che è causa della oscillazione del potenziale.
27
I neuroni e l’elettrofisiologia
Capitolo 1
La refrattarietà
La refrattarietà è una diminuzione del grado di eccitabilità della membrana che si verifica
dopo un potenziale d’azione. Il fenomeno ha una durata variabile nell’ordine della decina di
msec durante i quali passa da un grado massimo (refrattarietà assoluta), via via a un grado
minore (refrattarietà relativa) fino a sparire del tutto. Può essere studiata stimolando la
membrana a tempi diversi dopo un potenziale d’azione. Per questo si utilizza un impulso test
di corrente depolarizzante, di intensità appena sopra la soglia del potenziale d’azione (riferito
alla membrana a riposo). La Fig.16 rappresenta in alto il potenziale di membrana in funzione
del tempo, in tre prove sovrapposte realizzate con i protocolli di stimolazione rappresentati
sotto. Quando l’impulso test segue il potenziale d’azione dopo un tempo abbastanza lungo
(STIM 1 e 2 in Fig.16), nella membrana può essere evocato un secondo potenziale d’azione.
Sotto un certo intervallo di tempo la membrana è nel periodo refrattario relativo, indotto dal
primo potenziale d’azione e l’intensità dello stimolo non è più sufficiente per eccitare la
membrana (STIM 3). Nel periodo refrattario relativo la soglia di eccitabilità è più elevata
pertanto sarà necessario uno stimolo più intenso per indurre il potenziale d’azione. Questo
periodo coincide circa con la iperpolarizzazione postuma che ne è in parte la causa. Infatti
l’iperpolarizzazione postuma allontana il potenziale di membrana dal potenziale soglia.
Figura 16
Un’altra causa della refrattarietà è l’inattivazione dei canali del Na+ che fa seguito alla
depolarizzazione. L’inattivazione è uno stato del canale per cui questo non è disponibile ad
aprirsi. Quanti più canali del Na+ sono inattivati tanto più la membrana è refrattaria. Il grado
massimo di inattivazione dei canali del Na+ è raggiunto in cima al potenziale d’azione e nella
fase discendente e corrisponde al periodo della refrattarietà assoluta. In questo periodo è
impossibile indurre un secondo potenziale d’azione. Durante l’iperpolarizzazione i canali del
Na+ si deinattivano gradualmente. La membrana passa quindi dalla refrattarietà assoluta alla
refrattarietà relativa.
La refrattarietà dopo un potenziale d’azione pone un limite alla frequenza massima di
scarica che una certa membrana può avere.
La tecnica del blocco di voltaggio
La tecnica del blocco di voltaggio o voltage-clamp è stata sviluppata alla fine degli anni
quaranta da Cole, è stata ampiamente sfruttata in quegli anni per studiare le caratteristiche
elettrofisiologiche della membrana dell’assone gigante di calamaro, permettendo a Hodgkin e
Huxley di caratterizzare le conduttanze all’origine dello spike. Questo sistema consente di
misurare l’intensità e la direzione delle correnti ioniche che fluiscono attraverso la membrana,
in funzione del potenziale di membrana che viene imposto e del tempo. Gli esperimenti
vengono condotti in condizioni ioniche intracellulari ed extracellulari controllate.
28
I neuroni e l’elettrofisiologia
Capitolo 1
L’andamento delle correnti nel tempo è legato alla conduttanza di membrana (G) dalla
relazione di Ohm:
I = G (Em Eioni )
In blocco di voltaggio si studia quindi come varia la conduttanza di membrana in seguito a
variazioni di potenziale o in seguito alla somministrazione di particolari sostanze.
Il blocco di voltaggio viene ottenuto con un meccanismo a feedback negativo, il segnale
del voltaggio misurato a cavallo della membrana è inviato a un circuito di controllo, un
amplificatore operazionale, che provvede a confrontarlo con il segnale di comando, ovvero
con il valore che si desidera imporre alla membrana Fig.17.
Ogni differenza tra il potenziale di membrana effettivo e il potenziale che si desidera
imporre, viene pressoché istantaneamente corretta, fornendo alla membrana corrente di
intensità e carica opportuna. Il sistema è così in grado di mantenere costante il potenziale
della membrana, nonostante vari nel tempo la sua conduttanza totale (per l’apertura o la
chiusura di canali ionici).
Quello che viene registrato è l’intensità e la direzione della corrente che è necessario
pompare per portare e mantenere la membrana ai potenziali desiderati, cioè la corrente che si
deve fornire per caricare la componente capacitiva della membrana e per controbilanciare la
corrente che fluisce attraverso i canali, quella che altrimenti determinerebbe la variazione di
potenziale.
Figura 17
Per realizzare una registrazione con la tecnica del blocco di voltaggio sono necessari due
microelettrodi in contatto con il citoplasma della cellula e un elettrodo di riferimento immerso
nel bagno di registrazione. Dei primi due citati, uno misura il potenziale di membrana, l’altro
serve a pompare corrente all’interno della cellula.
Registrazione in voltage-clamp di un assone
Prendiamo ora in considerazione un esperimento di registrazione, in voltage-clamp, delle
correnti che fluiscono attraverso la membrana di un nodo di Ranvier di un nervo di rana
Fig.18A,C.
In seguito a depolarizzazioni crescenti queste correnti presentano un andamento prima
verso il basso (per convenzione questo rappresenta un flusso di cariche positive entranti) e poi
nel tempo la deflessione diventa positiva (flusso di cariche positive uscenti). Questo
andamento delle correnti anche se a potenziali bloccati, è già indicativo di quanto avviene nel
potenziale d’azione. La corrente entrante è depolarizzante in condizioni fisiologiche e
genererà la fase ascendente del potenziale di azione. In un tempo successivo si attiva una
corrente di cariche positive, uscente, che ci può spiegare la ripolarizzazione della membrana
durante lo spike. Le due correnti sono state identificate e sono rispettivamente di Na+ e di K+.
Le registrazioni di voltage-clamp permettono di valutare quantitativamente le
caratteristiche cinetiche della corrente, tuttavia in questo tipo di registrazioni la corrente
misurata nei diversi istanti è il risultato della somma algebrica della corrente entrante,
29
I neuroni e l’elettrofisiologia
Capitolo 1
depolarizzante di Na+ e di quella uscente ripolarizzante di K+. Per poter studiare le singole
conduttanze è necessario isolarle facendo uso di tossine specifiche in grado di bloccare quelle
che non ci interessano. Le tossine sono fondamentali nello studio delle caratteristiche delle
singole conduttanze ioniche in un preparato in cui siano presenti diversi tipi di canali.
Nel nostro caso potremmo studiare la conduttanza di K+ una volta che è stata eliminata la
corrente di Na+ con tetrodotossina (TTX) Fig.18B. La TTX è una tossina presente nel pesce
palla. E’ un efficacissimo bloccante dei canali del Na+, che agisce a concentrazioni nell’ordine
di 10-9 M, (1nM).
Quando si vuole studiare la conduttanza di Na+, viene bloccata la corrente di K+
aggiungendo nel bagno di registrazione tetraetilammonio (TEA) Fig.18D. Il TEA è un
bloccante specifico dei canali del K+, agisce a concentrazioni millimolari sia quando viene
aggiunto internamente che esternamente alla cellula.
Figura 18
1.2.6 I canali ionici
I canali ionici sono macromolecole proteiche e possono essere immaginati come pori di
contenuto acquoso che attraversano il doppio strato lipidic. La proprietà delle membrane
biologiche di essere selettivamente permeabili ai vari ioni è dovuta proprio alla presenza di
questi canali. Gli ioni infatti non possono attraversare direttamente il doppio strato lipidico
perché sono elettricamente carichi. Il flusso degli ioni (principalmente Na+, K+, Cl- e Ca2+)
attraverso i canali è in sostanza una corrente che provoca variazioni del potenziale a cavallo
della membrana. Tali variazioni sono la forma fisica assunta da gran parte dell’informazione
quando viene trasdotta, elaborata, o trasportata attraverso l’organismo. Gli ioni Ca2+ si
comportano, oltre che da trasportatori di cariche, anche da secondi messaggeri. L’ingresso di
ioni Ca2+ nella cellula, oltre a depolarizzare la membrana modifica la concentrazione di Ca2+
citoplasmatica. Attraverso variazioni di [Ca2+] sono controllati nella cellula numerosi
processi, dalla secrezione di neurotrasmettitori nei terminali sinaptici delle cellule nervose a
quella di ormoni, all’accoppiamento eccitazione-contrazione nelle fibre muscolari.
Dal Ca2+ citoplasmatico dipende inoltre il grado di attivazione funzionale di numerose
proteine Ca2+-dipendenti che controllano a loro volta numerosi processi metabolici e
regolativi sia nel citoplasma che nel nucleo.
Lo studio dei canali ionici
Quando nei primi anni ‘50 Hodgkin e Huxley studiavano, nell’assone gigante di calamaro,
le correnti ioniche alla base del potenziale d’azione, non erano in grado di dire come questi
ioni passassero attraverso la membrana, se attraverso pori a contenuto acquoso o con altri
30
Capitolo 1
I neuroni e l’elettrofisiologia
meccanismi di trasporto. Negli anni ‘60 sono stati condotti esperimenti con TTX
radiomarcato, un bloccante selettivo delle correnti di Na+. Questi esperimenti hanno
consentito di stimare il numero di siti di legame del TTX nella membrana. Supponendo che la
TTX si legava dove erano i punti di passaggio del Na+ e dividendo la corrente totale di Na+
per il numero di siti, è stato possibile calcolare che in ogni punto individuato dalla TTX
passavano più di 107 ioni/sec. Tale flusso era troppo elevato per un qualche meccanismo di
trasporto mediato. Era invece compatibile se si assumeva che in ogni punto marcato fosse
presente un canale a contenuto acquoso attraverso la membrana. La prova definitiva
dell’esistenza dei canali ionici è però venuta con la tecnica del patch clamp.
La tecnica del patch-clamp
Tale tecnica sviluppata da E. Neher e B. Sakmann è una evoluzione della tecnica del
blocco di voltaggio. Il potenziale a cavallo della membrana cellulare è imposto utilizzando
una micropipetta di vetro opportunamente forgiata, con un diametro della punta di circa 1 um
.La micropipetta di vetro è riempita con una soluzione elettrolitica. Un filo di argento
clorurato è immerso in questa soluzione e assicura il collegamento con lo strumento di
registrazione. All'atto della registrazione la micropipetta viene appoggiata sulla membrana
cellulare, quindi viene applicata una leggera depressione al suo interno migliorando l'adesione
alla cellula. Il vetro dell'elettrodo e la membrana cellulare stabiliscono così un contatto ad
elevatissima resistenza elettrica. Se nella membrana sottesa alla punta della pipetta di vetro è
presente anche un solo canale è possibile registrare la corrente che lo attraversa. Questa
configurazione si chiama cell-attached .
-attached, producendo
una ulteriore depressione all'interno della pipetta si provoca la perforazione della membrana
sottesa alla punta dell'elettrodo, mettendo quindi in continuità la soluzione della micropipetta
con l'interno della cellula. In queste condizioni è possibile registrare le correnti che fluiscono
attraverso tutti i canali presenti nella membrana della cellula. La configurazione di questo tipo
è detta di whole-cell. Esistono altri due tipi di configurazioni che consentono registrazioni di
singolo canale. Dalla configurazione di whole-cell, se la pipetta viene leggermente allontanata
dalla cellula, si stacca un piccolo frammento di membrana. In questo caso si registra l’attività
dei canali rimasti nel pezzettino di membrana e la configurazione è detta di outside-out,
perché la superficie esterna del pezzettino di membrana (outside) rimane rivolta verso la
soluzione extracellulare (out). Un altro tipo di configurazione viene raggiunto partendo
ancora una volta dalla configurazione di cell-atteched. Allontanando la pipetta dalla cellula si
stacca una vescicola di membrana. La vescicola esposta all’aria si apre. Una volta riimmersa
nel bagno la superficie interna del pezzetto di membrana (inside) rimarrà rivolta verso la
soluzione extracellulare (out), questa configurazione è detta di inside-out.
La scelta del tipo di configurazione dipende dalle esigenze dello sperimentatore. Quando si
vuole studiare l’ampiezza e le cinetiche di attivazione della corrente attraverso i canali
dell’intera cellula si utilizza la configurazione di whole-cell. In genere viene studiata una certa
popolazione di canali e quindi vengono bloccate le correnti che non interessano. Sia la
composizione del bagno che quella all’interno della cellula vengono determinate dallo
sperimentatore, quando infatti si raggiunge la configurazione di whole-cell la soluzione
all’interno dell’elettrodo diffonde nella cellula sostituendosi in una certa misura al citoplasma.
Quando si desidera studiare il comportamento del singolo canale ci si orienta sulle altre
configurazioni. In particolare il vantaggio della configurazione di cell-attached è quello di
mantenere integra la cellula, molti canali per funzionare hanno bisogno di fattori presenti
all’interno del citoplasma che garantiscano il loro stato di fosforilazione. Uno svantaggio
invece è rappresentato dall’impossibilità di controllare e modificare la soluzione
intracellulare. Le configurazioni di outside-out e di inside-out permettono registrazioni di
singolo canale in cui si può cambiare rapidamente e più volte durante un esperimento sia la
31
Capitolo 1
I neuroni e l’elettrofisiologia
soluzione extracellulare che intracellulare. Per studiare l’effetto di mediatori chimici
extracellulari si preferirà la configurazione outside-out, aggiungendo il mediatore nel bagno di
registrazione (ad es. acetilcolina su recettore-canale nicotinico). Molti di questi studi possono
essere comunque condotti anche nella configurazione cell-attaced aggiungendo il mediatore
nella micropipetta.
La configurazione di inside-out si usa invece quando si vuole osservare l’azione di
mediatori sul versante citoplasmatico del canale, questi sono generalmente secondi
messaggeri o enzimi (proteinchinasi) che agiscono sul canale. La configurazione di inside-out
è stata usata ad esempio per studiare l’azione dell’AMPc e della PKA sui canali del Ca2+ nella
fibra cardiaca (vedi oltre).
Lo schema circuitale per il patch-clamp è concettualmente simile a quello già spiegato per
il blocco di voltaggio.
1.2.7 Modalità di risposta delle cellule nervose: I canali ionici
Si ritiene che l'informazione nel sistema nervoso sia codificata sotto forma di frequenze di
scarica di potenziali d'azione. L’intesità dello stimolo stesso è espresso in termini di frequenza
di potenziali d’azione. La scarica del neurone rappresenta l'informazione in uscita dal neurone
stesso. Tale output è il risultato dell'elaborazione che la cellula ha fatto delle informazioni in
ingresso provenienti da altre cellule (attraverso le sinapsi, i trasmettitori e gli ormoni che
diffondono nei volumi extracellulari, le giunzioni elettriche ecc.) oppure dall'ambiente esterno
(sotto forma di stimoli sensoriali). L'output di un neurone contiene inoltre informazioni che
provengono dall'interno stesso della cellula, ad esempio sotto forma di una diversa
espressione genica di quei componenti della membrana che determinano le caratteristiche
computazionali del neurone. La membrana plasmatica con le varie strutture molecolari
connesse, recettori, meccanismi di modulazione, canali ionici, rappresenta il livello più
importante al quale si verifica il confronto tra i vari tipi di informazione e dove avviene il
processo decisionale.
Nelle cellule eccitabili la frequenza di scarica è proporzionale alla intensità della corrente
di stimolazione
Vediamo ora alcune modalità di scarica in funzione dell'input e dei canali implicati. Se per
simulare un input eccitatorio si inietta un flusso continuo di corrente depolarizzante all'interno
di un assone che, come si è detto, generalmente ha un corredo di sole due conduttanze, una
per il Na+ e l'altra per il K+, si otterrà, a corrente costante, una scarica di frequenza costante
Fig.19. La frequenza della scarica sarà determinata da ciò che avviene tra un potenziale
d’azione e l'altro, cioè da quell'equilibrio dinamico fra il flusso di K+ verso l'esterno (che
ripolarizza la cellula dopo il potenziale d’azione e tende a mantenere il potenziale della
membrana a riposo) e il flusso di corrente depolarizzante che viene iniettato. Aumentando
l'intensità della corrente depolarizzante si otterrà un aumento di pendenza nell’andamento del
potenziale tra un potenziale d’azione e l’altro, con l'effetto di raggiungere più rapidamente la
soglia e di aumentare la frequenza di scarica. L'effetto opposto, di diminuzione della
frequenza, si potrà osservare se in qualche modo aumenterà il flusso ripolarizzante di K+
[Klinke03].
32
I neuroni e l’elettrofisiologia
Capitolo 1
Figura 19
1.2.8 Il codice neuronale e l’apprendimento
Possiamo riassumere così la comunicazione neuronale e i processi che la compongono:
I segnali di input al neurone alterano il voltaggio dello stesso. Quando il voltaggio supera una
certa soglia il neurone “spara”uno spike (potenziale d’azione)
Gli spike sono quindi dei segnali elettrici impulsivi con un’ampiezza di circa 100 mV e con
una durata di circa 1 ms. Il segnale si propaga ad una velocità che varia da 1 a 100 m/s. L’alta
velocità di conduzione è ottenuta per mezzo della guaina mielinica.
Il neurone a riposo è polarizzato con una ddp di -70 mV (potenziale membrana a riposo). La
concentrazione di ioni negativi è aggiore all’interno del neurone.
Iperpolarizzazione: aumento della polarizzazione (e.g. -90mV)
Depolarizzazione: diminuzione della polarizzazione (e.g. -50mV)
Lo spike non può superare il “gap” tra un neurone e l’altro quindi è a questo punto che entra
in gioco la sinapsi. Questa, come già spiegato è un meccanismo complesso che riesce a
decodificare lo stimolo in input mediante rilascio di neurotrasmettitore, che raggiunge il
neurone vicino e permette l’apertura/chiusura di canali ionici tale per cui anche il potenziale
di membrana del neurone postsinaptico subisce variazioni. Quando il voltaggio di questa
differenza di potenziale supera la soglia, il neurone postsinaptico “spara” il suo potenziale
d’azione e il viaggio ricomincia. L’ampiezza del segnale d’uscita è determinata dall’ampiezza
della depolarizzazione (iper) che, a sua volta è determinata dal numero e dalla frequenza degli
impulsi. Ovviamente, dopo avere generato lo spike il neurone entra in fase refrattaria e per
10ms non potrà più generare potenziali d’azione.
I potenziali d’azione hanno tutti la stessa forma, ampiezza e durata. Il segnale si pensa quindi
venga codificato nella frequenza di scarica (ovvero frequenza dei treni di spike).
Questa ovviamente è solo una teoria, in quanto ad oggi nessuno è riuscito a decifrare i segnali
neuronali ne tantomeno a capire “il linguaggio” che permette la codifica dell’impulso in un
rilascio chimico di neurotrasmettitore.
Quello che sembra assunto come “certo” tra i neurofisiologi è che lo stimolo elettrico sia da
cosiderare unicamente nella forma di spike, anche se ovviamente si ha coscienza del fatto che
tutte le volte che si va a registare, in vivo o in vitro, mediante tecniche più o meno invasive, il
codice neuronale venga alterato in una qualche maniera.
Ma un codice neurale può essere definito?
33
I neuroni e l’elettrofisiologia
Capitolo 1
Lord Ardian (Premio Nobel in Fisiologia e Medicina 1932) definì i seguenti principi:
[http://www.nbb.cornell.edu]
1) Neuroni individuali producono spike stereotipati (tutto o nulla)
2) In risposta ad uno stimolo statico, il “rate di spiking” cresce proporzionalmente all’ampiezza
dello stimolo
figura 20: Ampiezza dello stimolo vs numero di spike
Nel grafico (figura 20) appena mostrato, il numero di potenziali d’azione (response) è
proporzionale all’ampiezza dello stimolo (stimulus). Se il numero di spike viene riportato in
funzione dell’ampiezza, si crea una relazione lineare. Esempi di questo tipo di risposta
includono i recettori olfattivi e i recettori del freddo.
Ma che c’è di sbagliato in questa semplificazione? Per esempio, i neuroni non “sparano” ad
alte frequenza arbitrarie (il perido refrattario del neurone limita di creare un spike sopra una
certa frequenza)
figura 21: Saturazione
34
I neuroni e l’elettrofisiologia
Capitolo 1
Il fatto che i neuroni non rispondano con alte frequenze arbitrarie può essere descritto come
ua saturazione. Inoltre, molti neuroni non creano spike in risposta a stimoli con piccola
ampiezza. Questa proprietà può essere descritta introducendo una soglia di “firing” che può
variare.
figura 22: Potenziale soglia
Ma c’è un’errore in quanto detto finora, infatti, l’assunzione 1) non è valida per tutti i
neuroni:
3) Se uno stimolo viene applicato per lungo tempo, lo spiking rate inizia a decrescere
(adattamento).
figura 23: Adattattamento
Per qualche ragione, è difficile stabilire quali siano i parametri rilevanti nella risposta
neurale, parametri che di sicuro possono variere in base alla natura del neurone, allo stimolo,
alla situazione, etc.
35
Capitolo 1
I neuroni e l’elettrofisiologia
Possiamo cosiderare un semplice caso, il codice di frequenza. Il codice di frequenza significa
che il numero di spike durante un dato periodo contiene informazioni circa la natura e
l’ampiezza dello stimolo in questione.
Ma questo non risulta valido sempre. A volte infatti, il rate di spike , ovvero il numero di
spike sparati durante il tempo di osservazione non varia come una funzione dell’ampiezza
dello stimolo. Quello che varia è la frequenza di spike (figura 24):
figura 24: Ampiezza dello stimolo vs frequenza di spike
Similmente, se la finestra di osservazione diventa più piccola, il numero di potenziali
d’azione può variare come una funzione dell’ampiezza di stimolo.
Analogamente, in altri casi considerando finestre di osservazioni crescenti, entra in gioco un
altro parametro: primo intevallo di interspike. (figura 25)
36
Capitolo 1
I neuroni e l’elettrofisiologia
figura 25: Ampiezza dello stimolo vs primo intervallo di interspike
.
In qualche altro caso nessuno dei tre parametri descritti da informazioni sull’ampiezza dello
stimolo ed possibile risalire ad altri parametri, come per esempio la distribuzione degli
intervalli di interspike durante la risposta. Questa infatti risulta essere proporzionale
all’ampiezza dello stimolo.
figura 26: Distribuzione degli intervalli di interspike
37
Capitolo 1
I neuroni e l’elettrofisiologia
Recenti studi, poi hanno anche mostrato come alcuni neuroni usino come codice neuronale, i
singoli timing di ogni spike e non quindi le frequenze medie di tutti gli spike generati, e come
i neuroni della corteccia olfattiva sembrino utilizzare un codice che vede la partecipazione
attiva del tempo: gli output vengono codificati in termini di differenze di tempo tra uno spike
e un tempo di riferimento dato dall’analisi degli altro spike o dalle oscillazioni del
background. [Natschläger98]
Come si può vedere, i parametri in gioco sono tanti e quindi un codice neurale non è stato
ancora definito, ma probabilmente, in base ai risultati mostrati, non ne esiste uno universale,
per cui diventa importantissimo definire lo stimolo di interesse, definire il “time scale” di
interesse e definire il “sampling step”. Gli studi teorici e sperimentali finora condotti sono stati
basati sull’assunzione che lo stimolo elettrico sia definito unicamente dagli spike e tutte le
evidenze di “possibili codici” sono state trovate analizzandone la proporzionalità con
l’ampiezza di stimolazione. È semplice concludere che la strada verso una decodifica del
messaggio neurale sia ancora lunga.
Putroppo però, trovare il giusto codice diventa di giorno in giorno sempre più importante e
interessante, date le recenti scoperte sull’apprendimento. Questo pare creare delle modifiche
morfologiche e sinaptiche a livello neuronale (dentriti e assone), e tali modifiche, grazie alle
moderne tecniche di imaging non sono più un gran mistero. Il problema però rimane: si è
scoperto l’effetto ma si conosce poco o nulla sui meccanismi che causano tale effetto.
Vi è evidenza sperimentale, infatti di modifiche sinaptiche dipendenti da ogni possibile codice
prima mostrato, e dunque vi è in corso una dura lotta tra i neurofisiologi di tutto il mondo.
38