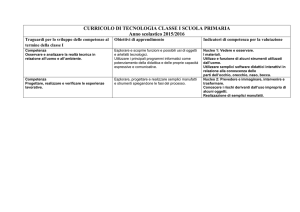
La sintesi organica è la
preparazione sistematica di un
composto a partire da materiale
di partenza facilmente accessibile
mediante uno o più stadi
Per risolvere un problema sintetico è necessario
leggere attentamente le indicazione
A volte il composto di partenza è specificato, altre
volte, invece, bisogna partire da un composto che
soddisfi un determinato criterio; per esempio, si può
richiedere di sintetizzare un composto da alcoli a
cinque atomi di carbonio o meno; oppure da composti
organici con non più di due atomi di carbonio o
ancora da un unico composto organico
Queste limitazioni hanno il significato di fornire delle
indicazioni utili per progettare una sintesi multistadio
Quando dobbiamo progettare una sintesi, un modo per
affrontare il problema e quello di osservare i materiali di
partenza e vedere se c’è una serie di reazioni ovvia che
fornisca un valido percorso per ottenere la molecola bersaglio
(cioè il prodotto desiderato “target”)
Talvolta questo è il modo migliore per affrontare una sintesi
“semplice”
Esempio:
cyclohexane
cyclohexa-1,3-diene
Poiché la sola reazione che un alcano può dare è l’alogenazione, decidere quale
deve essere la prima reazione è piuttosto facile
Una reazione E2 si ottiene utilizzando una base forte per favorire
l’eliminazione sulla sostituzione e quindi ci fornirà il cicloesene
La bromurazione del cicloesene darà un bromuro allilico, che porterà alla
desiderata molecola bersaglio grazie ad un ulteriore reazione E2 cioè
all’1,3-cicloesadiene
Br
Br2
terz-BuO
NBS
terz-BuO
h
terz-BuOH
h
terz-BuOH
Br
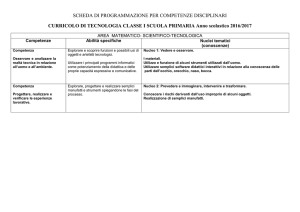
Per progettare una sintesi a più stadi
noi usiamo il procedimento
dell’analisi retrosintetica che
consiste cioè nell’andare a ritroso
partendo dal composto desiderato
allo scopo di determinare i composti
di partenza usati per sintetizzarlo
Per scrivere una sintesi a ritroso, dal prodotto al
composto di partenza, si usa una freccia aperta
per indicare, a sinistra il prodotto
e a destra il composto di partenza
e di norma i reattivi necessari a portare a termine ogni
stadio non si inseriscono fino a che la reazione non
viene scritta nella direzione diretta
Composto "target"
prodoto finale
Precursore
Precursore
freccia aperta
Composto di partenza
Composto "target"
prodoto finale
Precursore
Precursore
Composto di partenza
freccia aperta
Usando l’analisi retrosintetica, dobbiamo determinare quale
composto può essere convertito nel prodotto “target”
con una singola reazione
Cioè qual è il precursore immediato del composto “target”
Dopo che è stato individuato un appropriato precursore,
il processo viene portato avanti fino ad arrivare ad
uno specifico composto di partenza
Alcune volte conviene esaminare più di un percorso retrosintetico
multistadio, prima di decidere in particolare quale strada seguire
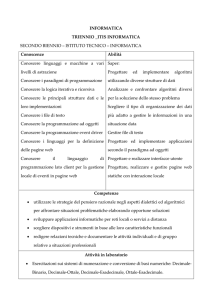
Nel progettare una sintesi, spesso le reazioni sono distinte in
due categorie
§ Quelle che formano nuovi legami carbonio-carbonio
§ Quelle che convertono un gruppo funzionale in un altro
Le reazioni che consentono la formazione del legame carboniocarbonio occupano un posto centrale nella sintesi organica in quanto
è possibile convertire composti di partenza più semplici e meno
pregiati in prodotti più complessi
E’ bene tener presente che, ogni volta che il prodotto di una sintesi
ha un numero maggiore di legami carbonio-carbonio,
rispetto al composto di partenza, la sintesi deve contemplare
almeno una di queste reazioni
Sviluppare un’analisi retrosintetica
Stadio (1) Confrontare lo scheletro carbonioso del composto di
partenza e del prodotto desiderato
§ Se il prodotto ha più legami s carbonio-carbonio, rispetto al
composto di partenza, la sintesi deve prevedere la formazione
di uno o più legami C-C
In caso contrario si verifica solo una conversioni di gruppi funzionali
§ Confrontare i carboni del composto di partenza con quelli del
prodotto, per individuare dove devono essere aggiunti i nuovi
legami C-C o dove devono essere modificati i gruppi funzionali
Sviluppare un’analisi retrosintetica
Stadio (2) Concentra l’attenzione sui gruppi funzionali
del composto di partenza e del prodotto e domandarsi:
§ Quali sono i metodi che permettono di introdurre i
gruppi funzionali presenti nel prodotto?
§ A che tipo di reazioni deve essere sottoposto il composto
di partenza?
Stadio (3) Vai a ritroso, partendo dal prodotto e in avanti, partendo
dal composto di partenza
§ Chiedersi: qual è l’immediato precursore del prodotto
§ Mettere a confronto ciascun precursore con il composto di partenza
per determinare se c’è una reazione a un solo stadio capace di
convertire l’uno nell’altro
Continuare questo processo fino ad arrivare al composto di partenza
§ Quando si lavora a ritroso considerare sempre precursori più semplici
§ Quando sono possibili più strade, usare quella che richiede meno
stadi
§ Tenere presente che potrebbe essere necessario valutare una serie di
differenti precursori per un dato composto
Stadio (4) Controlla la sintesi riscrivendola
nella direzione giusta
§ Per controllare un’analisi retrosintetica,
scrivere gli stadi iniziando dal composto di
partenza, indicando tutti i reagenti necesari
Progettare una sintesi per l’1-pentino partendo da acetilene e qualsiasi altro
reagente organico o inorganico
HC
CH
HC
ethyne
CCH2CH2CH3
pent-1-yne
Soluzione
I due carboni del composto di partenza corrispondono ai due carboni ibridati sp
del prodotto, quindi deve essere addizionata una unità a tre atomi di carbonio
composto "target"
(1)
HC
C
CH2CH2CH3
nuovo legame C-C
C Na+
HC
+
(2)
HC
_
CH3CH2CH2 X
CH
composto di partenza
Ragionando a ritroso:
(1) Formare un nuovo legame C_C usando un anione acetiluro ed un alogenuro alchilico 1°
(2) Preparare lo ione acetiluro dall’acetilene per trattamento con una base
SINTESI:
La deprotonazione dell’acetilene con NaNH2 forma
l’anione acetiluro che va incontro a una reazione SN2 con un
alogenuro alchilico per formare il composto “target”
cioè un alchino a cinque carboni
HC
HC
CH
NaNH2
CH
HC
C- Na+
1) NaNH2
_
_
CH3CH2CH2 Cl
2) CH3CH2CH2 Cl
HC
HC
C
C
CH2CH2CH3
CH2CH2CH3
Progettare una sintesi per il p-clorostirene, utilizzando come composto di partenza
il benzene e qualsiasi altro composto organico ed inorganico necessario
benzene
Cl
1-chloro-4-vinylbenzene
(p-clorostirene)
Soluzione
Br
Cl
Cl
Cl
Cl
Br
Cl
Cl2
C2H5Cl
NBS
C2H5O Na+
AlCl3
AlCl3
h
C2H5OH
Cl
1)
2)
3)
4)
Cl
Sostituzione elettrofila aromatica (clorurazione)
Ulteriore sostituzione elettrofila aromatica (alchilazione di Friedel-Crafts)
Bromurazione benzilica (via radicalica)
Eliminazione E2 (b-eliminazione) con una base forte per formare
il composto desiderato
Il composto non presenta centri stereogenici quindi nessuno stereoisomero
Cl
Progettare una sintesi per l’acido 4-nitrobenzoico, utilizzando come composto di
partenza il benzene e qualsiasi altro composto organico ed inorganico necessario
Soluzione
alchilazione di Friedel-Crafts
Ox
COOH
CH3
NO2
NO2
CH3
nitrazione
CH3
CH3
CH3Cl
HNO3
AlCl3
H2SO4
COOH
KMnO4
NO2
NO2
Sintetizzare il 3-metil-3-esanolo utilizzando come prodotto di partenza l‘1-bromobutano e
qualsiasi altro composto organico ed inorganico necessario. Dire inoltre quanti stereoisomeri
del prodotto finale si possono formare.
Br
OH
Soluzione
OH
O
+
OH
CH3CH2CH2MgBr
Br
Br
*
1) Hg(OAc)2, H2O
KOH
EtOH,
2) NaBH4
OH
1) CH3CH2CH2MgBr
K2Cr2O7
2) H2O
H2SO4
OH
O
*Un centro chirale quindi due stereoisomeri cioè una coppia di enantiomeri
OH
(R)-3-methylhexan-3-ol
HO
(S)-3-methylhexan-3-ol