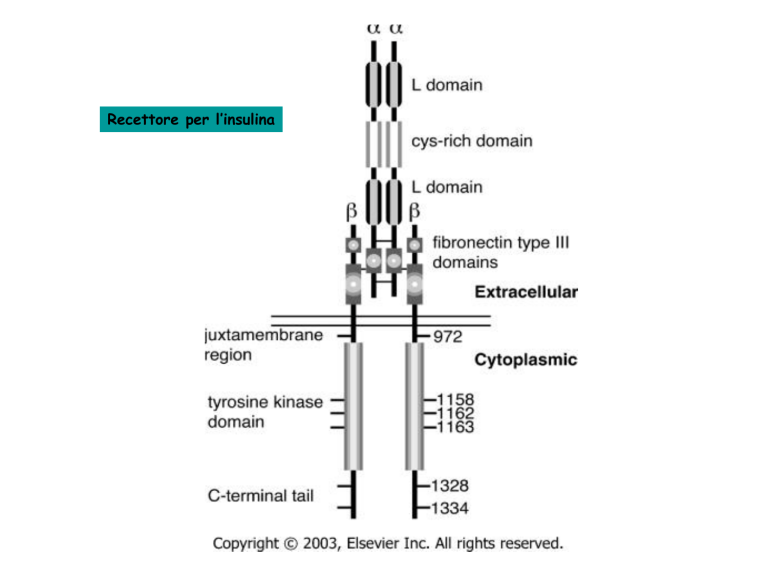
Recettore per l’insulina
Muscolo scheletrico
Fegato, muscolo sch.
Attivazione glicogenosintesi
Inibizione gluconeogenesi
Attivazione lipogenesi
Tess. adiposo
fegato
Casi di diabete (in milioni) in diverse parti del mondo
DIFETTI DI
SECREZIONE DA PARTE
DI b CELLULE
PANCREATICHE
DIFETTI DI
AZIONE
DELL’INSULINA
DIABETE DI TIPO I: distruzione autoimmune delle b cellule pancreatiche
DIABETE DI TIPO II: gruppo eterogeneo di alterazioni caratterizzato da diversi gradi di resistenza
all’insulina, diminuita secrezione di insulina, aumentata produzione di glucosio.
Nature Reviews of Immunology 11: 98, 2011 (febr)
Diminuito uptake di glucosio in risposta
all’insulina a livello
del muscolo scheletrico
Diminuita inibizione della sintesi di glucosio in risposta
all’insulina a livello
del fegato
Diminuita inibizione della lipolisi in risposta
all’insulina a livello
del tessuto adiposo
Vi sono diverse isoforme di IRS che sono espresse differenzialmente in diversi tessuti
Taniguchi et al. Nature Reviews Molecular Cell Biology 7, 85–96 (February 2006) | doi:10.1038/nrm1837
Quale tipico nodo critico del segnale insulinico, IRS è bersaglio di segnali
In grado di regolare negativamente la risposta all’insulina
Protein Tyrosine Phosphatase 1B
(PTP1B)
SEGNALE
(tirosin fosfatasi)
fosforilazione in serina da parte di diverse Ser/Thr chinasi inibisce il segnale
Taniguchi et al. Nature Reviews Molecular Cell Biology 7, 85–96 (February 2006) | doi:10.1038/nrm1837
1
2
3
4
Taniguchi et al. Nature Reviews Molecular Cell Biology 7, 85–96 (February 2006) | doi:10.1038/nrm1837
1. Assorbimento glucosio
Attivata da fosforilazione
Inibita da fosforilazione
Glicogenolisi e glicogeno sintesi sono regolate da diversi ormoni e mediante
segnali che esercitano azione opposta sugli enzimi limitanti queste due
vie metaboliche
Tratta da Marks et al. “Cellular Signal Processes”, Garland Science
2. glicogenosintesi
Ramificazione/Deramificazione
Glicogeno
Glicogeno sintasi I
Glicogeno sintasi D
(fosforilata)
Meno attiva
Glicogeno Fosforilasi b (defosforilata). Meno attiva
PP1
AMPc/PKA
Glicogeno Fosforilasi a (fosforilata). Attiva
Glucosio-1-P
Fosfoglucomutasi
Glucosio-6-P
Glucosio-6-Pasi
Glucosio
Insulina
Akt/PKB
Glicogeno sintasi
Chinasi (GSK3)
Glicogeno
Glicogeno sintasi I
PP1 (Protein Phosphatase 1)
Glicogeno sintasi D
(fosforilata)
Meno attiva
Glucosio-1-P
Glucosio-6-P
Glucosio
2. glicogenosintesi
La fosforilazione della glicogeno sintasi (e la sua conseguente inibizione)
non è mediata solo da GSK3, ma anche da altre chinasi che agiscono in modo
coordinato
Attivata da AMPc generato da
Segnali b-adr e glucagone
Costitutivamente attiva, consente
fosforilazione da parte di PKA
Attivata da aumento AMP
conseguente a riduzione ATP
(sensore di livello energetico)
Fosforilata e inibita da insulina
(mediante AKT/PKB)
Costitutivamente attiva, consente
fosforilazione da parte di GSK3 e AMPK
Tratta da Marks et al. “Cellular Signal Processes”, Garland Science
Phosphoenolpyruvate caboxykinase
“acetyl-CoA carboxylase”
3. Inibizione gluconeogenesi
“fatty acid sinthase”
In blue enzimi glicolitici e favorenti la lipogenesi. L’insulina aumenta la trascrizione dei geni codificanti
per questi enzimi
In rosso enzimi implicati nella gluconeogenesi. L’insulina inibisce la trascrizione dei geni codificanti
per questi enzimi
In verde enzimi la cui attività è regolata dall’insulina attraverso modificazioni del loro stato
di fosforilazione
1
2
3
4
Taniguchi et al. Nature Reviews Molecular Cell Biology 7, 85–96 (February 2006) | doi:10.1038/nrm1837
Inibiscono TSC2 e quindi attivano mTOR
Attivano TSC2 e quindi inibiscono mTOR
RAS
GAPs
Tuberina*
GTP-binding protein
Amartina*
mTORC1
Fattore iniziante la traduzione
* Mutate in una sindrome di tumori famigliari (“sclerosi tuberosa”): tumori benigni diffusi chiamati amartomi
a livello di rene, polmone, cervello e cute.
L’ipoglicemia e la carenza di nutrienti e ossigeno regolano positivamente
l’attività di un bersaglio della via PI3K/AKT (inibendo mTORC1)
ATTIVAZIONE TSC2 E INIBIZIONE mTORC1
mTORC1
Regolazione e funzioni di AMPK
metformina
sintesi proteica
glicogenosintesi
Liposintesi e sintesi colesterolo
Aumenta espressione Glut4 e trasporto
glucosio (mediante fosforilazione AS160)
Aumenta lipolisi e glicolisi
Tratta da Marks et al. “Cellular Signal Processes”, Garland Science
Sono molti i fattori che, in gran parte indirettamente (attraverso LKB1), attivano
AMPK, tra cui dei farmaci (biguanidi: metformina ed altri) usati per il trattamento
del diabete di tipo 2
AMP chinasi regola positivamente
autofagia/mitofagia e biogenesi
mitocondri, attraverso l’inibizione
di mTORC1
Segnali a valle del recettore per l’insulina regolano l’invecchiamento cellulare
In arancione proteine che inibiscono longevità. In verde proteine che promuovono longevità
Quale tipico nodo critico del segnale insulinico, IRS è bersaglio di segnali
In grado di regolare negativamente la risposta all’insulina
Protein Tyrosine Phosphatase 1B
(PTP1B)
SEGNALE
(tirosin fosfatasi)
fosforilazione in serina da parte di diverse Ser/Thr chinasi inibisce il segnale
Taniguchi et al. Nature Reviews Molecular Cell Biology 7, 85–96 (February 2006) | doi:10.1038/nrm1837
Obesità e ridotta sensibilità all’insulina: il tessuto adiposo diventa ipertrofico, va incontro a sofferenza
e ciò innesta un processo infiammatorio (“adiposite”) ed il conseguente rilascio di citochine (TNF-a; IL-1b)
che agiscono in loco (sull’adipocita) e a distanza (nel muscolo scheletrico e nel fegato)
attivando chinasi (JNK, IKK) che fosforilano IRS inibendo la trasduzione del segnale insulinico, ma anche
determinando una ridotta secrezione di insulina da parte delle cellule beta pancreatiche
CON QUALI MECCANISMI FINORA DIMOSTRATI OBESITA’, IPERGLICEMIA E
INFIAMMAZIONE INDUCONO INSULINO RESISTENZA??
1. ATTRAVERSO L’ADIPOSITE VERA E PROPRIA
DANNO ADIPOCITARIO E RILASCIO DI
CHEMOCHINE E CITOCHINE
RECLUTAMENTO DI MONOCITI
RILASCIO DI CITOCHINE CHE INIBISCONO IL SEGNALE INSULINICO
1. ATTRAVERSO L’ADIPOSITE VERA E PROPRIA
DANNO ADIPOCITARIO E RILASCIO DI
CHEMOCHINE E CITOCHINE
LINFOCITI TH1/CD8+
+
RECLUTAMENTO DI MONOCITI
LINFOCITI TH2/Treg
RECLUTAMENTO E INDUZIONE
MACROFAGI CON FENOTIPO M1
RILASCIO DI CITOCHINE CHE INIBISCONO IL SEGNALE INSULINICO
L’obesità induce una rapida alterazione del reclutamento di diversi tipi di linfociti T
(vedi Nat Med 15 (agosto 2009), pag. 846)
Mentre nel tessuto adiposo magro prevalgono linfociti Th2 e Treg (secernono IL-10 e inibiscono
l’adiposite), nel tessuto adiposo di topi obesi si accumulano TH1 e CD8 che richiamano macrofagi e
inducono infiammazione
1. ATTRAVERSO L’ADIPOSITE VERA E PROPRIA
DANNO ADIPOCITARIO E RILASCIO DI
CHEMOCHINE E CITOCHINE
EOSINOFILI
LINFOCITI TH2/Treg
RECLUTAMENTO DI MONOCITI
RECLUTAMENTO E INDUZIONE
MACROFAGI CON FENOTIPO M2
RILASCIO DI CITOCHINE CHE INIBISCONO IL SEGNALE INSULINICO
2. ATTRAVERSO L’AZIONE DI ACIDI GRASSI RILASCIATI
DAL TESSUTO ADIPOSO IPERTROFICO
Obesità e ridotta sensibilità all’insulina: prodotti del metabolismo di acidi grassi alterano il segnale
insulinico mediante attivazione di Ser/Thr chinasi che fosforilano IRS e ne riducono l’associazione con
Il recettore e la fosforilazione in tirosina.
. Clin. Invest. Simon Schenk, et al. 118:2992, 2008
Fatty acid metabolism and insulin action in
skeletal muscle or liver. Obesity results in an
increased flux of free fatty acids into the
circulation and uptake by the myocyte or
hepatocyte. Activated fatty acids (i.e., fatty acylCoAs) are “metabolized” primarily via one of
two pathways, oxidation or storage. When fatty
acid flux exceeds the ability of these pathways
to dispose of fatty acyl-CoAs, intermediaries of
fatty acid metabolism (e.g., DAG, PA, LPA,
ceramide) accumulate. In turn, these fatty acid
intermediates can activate a number of different
serine kinases that can negatively regulate
insulin action. Ceramide can also impair insulin
action through interactions with PKB/Akt. An
inability to completely oxidize fatty acids through
β-oxidation, which leads to an accumulation of
acylcarnitines, has also been hypothesized to
cause insulin resistance, although the precise
mechanisms leading to insulin resistance are, to
date, unknown. AGPAT, acylglycerol-3phosphate acyltransferase; PAP, PA
phosphohydrolase.
3. ATTRAVERSO L’AZIONE DEL GLUCOSIO E DI ACIDI GRASSI
CHE ATTIVANO L’INFLAMMOSOMA NLRP3 IN DIVERSI TIPI DI CELLULE
COMPRESE LE CELLULE BETA PANCREATICHE INDUCENDO:
-RILASCIO DI CITOCHINE
-INIBIZIONE DI AMPK E INIBIZIONE DI MITOFAGIA
AMPK E INFLAMMOSOMA STANNO EMERGENDO COME POTENZIALI
BERSAGLI DI TERAPIE ANTI-DIABETICHE
4. IPERALIMENTAZIONE, GLUCOTOSSICITA’, ACIDI GRASSI
INDUCONO UPR E UPR INDUCE INFIAMMAZIONE
PERK e IRE attivano NfkB e AP1 attraverso diversi meccanismi
Tratto da Zhang e Kaufman, Nature 454:455, 2008