TERMODINAMICA
DEGLI
STATI
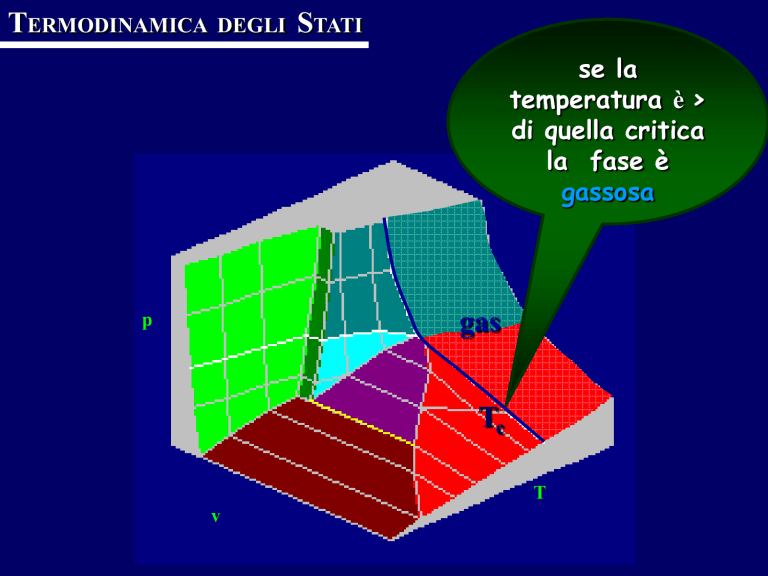
se la
temperatura è >
di quella critica
la fase è
gassosa
gas
p
Tc
T
v
TERMODINAMICA
DEGLI
A temperatura
ambiente il
c e
metano, l’aria
l’ossigeno sono in
fase gassosa
T>T
gas
per l’acqua ed
il propano
dipende dalla
pressione
STATI
sostanza
Tc [ °C]
metano
-82
acqua
374
aria
-141
ossigeno
-118
propano
97
TERMODINAMICA
DEGLI
STATI
gas ideale
p Quando
V = mil gas
R Tè
sufficientemente rarefatto
sostanza
p(p<0,10
c [ bar] pc) R [kJ/kg K]
46,4
0,518
si comporta,
indipendentemente dalla
acqua
220,9 da 0,461
temperatura,
gas37,7
ideale
aria
0,287
metano
ossigeno
50,8
0,260
propano
42,6
0,188
TERMODINAMICA
DEGLI
STATI
esperienza di Joule
gas
V1
V2
vuoto
La massa m di gas alla
temperatura T1 occupa
il volume V1
La pressione varrà
p1
m R T1
V1
TERMODINAMICA
DEGLI
STATI
gas
V1
V2
esperienza di Joule
Quando si apre il
rubinetto, la massa m
di gas va ad occupare
il volume V1 +V2
Joule osservò
sperimentalmente
che la temperatura
restava invariata
Conseguentemente la pressione diminuisce
p2
m R T1
V1 V2
TERMODINAMICA
gas
DEGLI
Q
STATI
L
esperienza di Joule
lungo la
trasformazione non c’è
trasferimento di
energia con l’ambiente
né come calore né
come lavoro e pertanto
l’energia interna del
sistema resta costante
Uf = Ui
Tf = Ti
Vf > Vi
Pf < pi
per il gas ideale
l’energia interna è
funzione solo della
temperatura
TERMODINAMICA
DEGLI
gas
STATI
calore specifico a volume costante
u
cv
T v
gas ideale u = u (T)
du
c v (T)
dT
du c v dT
TERMODINAMICA
DEGLI
STATI
T2
u u 2 u1 c v dT
T1
calore specifico costante con la temperatura
u c v T2 T1
gas
TERMODINAMICA
DEGLI
gas
STATI
calore specifico a pressione costante
h
cp
T p
gas ideale h = h (T)
dh
cp (T)
dT
dh cp dT
TERMODINAMICA
DEGLI
STATI
T2
h h 2 h1 cp dT
T1
calore specifico costante con la temperatura
h cp T2 T1
gas
TERMODINAMICA
DEGLI
hup v
dh du R dT
gas
STATI
huR T
cp dT c v dT R dT
cp c v R
TERMODINAMICA
DEGLI
STATI
T ds du p dv
du p dv
ds
T
T
c v dT R dv
ds
T
v
gas
TERMODINAMICA
DEGLI
STATI
cv
R
s
dT dv
T
v
calore specifico costante con la temperatura
s c v ln T2 T1 R ln v 2 v 1
gas
TERMODINAMICA
DEGLI
gas
STATI
T ds dh v dp
dh v dp
ds
T
T
ds
cp dT
T
R dp
p
TERMODINAMICA
DEGLI
STATI
s
cp
R
dT dp
T
p
calore specifico costante con la temperatura
s c p ln T2 T1 R ln p 2 p 1
gas
TERMODINAMICA
DEGLI
dT
dp
ds cp
R
T
p
STATI
p vR T
p dv v dp R dT
p dv v dp R dT
pv
RT
cp c v R
dv dp dT
v
p
T
s cp ln v 2 v1 c v ln p 2 p1
gas
TERMODINAMICA
DEGLI
gas
STATI
sostanza cv [kJ/kg K] cp [kJ/kg K]
metano
1,74
2,25
acqua
1,41
1,87
aria
0,72
1,01
ossigeno
0,66
0,92
propano
1,49
1,68
TERMODINAMICA
DEGLI
gas
STATI
Trasformazione isoterma
p vR T
p v cost.
Trasformazione isoentropica
dv
dp
0 cp
cv
v
p
ln v ln p cos t.
cp
cv
cp ln v c v lnp cost.
cp
cv
ln v p cost.
cp
v c p cos t.
v
p v k cos t.
TERMODINAMICA
DEGLI
gas
STATI
piano (p,v)
p
isoterma
p v = cost.
v=cost.
p dv + v dp = 0
p
p
v
v
T
p=cost.
T=cost.
s=cost.
v
isoentropica
p vk = cost.
p
p
k
v
v s
p k vk-1 dv + vk dp = 0
TERMODINAMICA
DEGLI
piano (p,v)
p
1
v
p
k c ln 2 c ln 2
s2
s
p 1v p cos vt. v p
1
1
s2
s1
s=cost.
v2
v
p
s2 s1 c p ln 2 cv ln 2
v1
p1
a pressione = cost.
2
p=cost.
v1
gas
STATI
v
Spostandosi nel verso di v crescente
(v2>v1) risulta s2>s1
TERMODINAMICA
DEGLI
gas
STATI
piano (p,v)
p
p vRT
a pressione = cost.
1
2
Spostandosi nel verso di v crescente
(v2>v1) risulta T2>T1
T2
p=cost.
T1
T=cost.
v1
v2
v
TERMODINAMICA
DEGLI
isobara
piano (T,s)
T
gas
STATI
v=cost.
p=cost.
Tds c p dT vdp
s=cost.
T
T
s p c p
T=cost.
isocora
Tds c v dT pdv
s
T
T
s v cv
TERMODINAMICA
DEGLI
piano (T,s)
p=cost.
T
p1
p2
1
2
T=cost.
s1
s2
gas
STATI
s
T
p
s2 s1 c p ln 2 R ln 2
T1
p1
a temperatura = cost.
T
p
s2 p
sv1 k
c pcos
ln t.2 R ln 2
T1
p1
spostandosi nel verso di s crescente
(s2 > s1) risulta p2 < p1
TERMODINAMICA
DEGLI
gas
STATI
T
v
s2 s1 c p ln 2 R ln 2
T1
v1
piano (T,s)
T
v1
1
v2
a temperatura = cost.
2
T=cost.
v=cost.
s1
s2
s
T
v
s2 p
sv1 k c pcos
ln t.2 R ln 2
T1
v1
spostandosi nel verso di s crescente
(s2 > s1) risulta v2 > v1












