Endospermic seeds: The endosperm is present in the mature seed and serves as
food storage organ. Testa and endosperm are the two covering layers of the embryo.
The amount of endosperm in mature seeds is highly species-dependent and varies
from an abundant endosperm layer (Nicotiana tabaccum) to a single layer (Arabidopsis thaliana).
Non-endospermic seeds
The cotyledons serve as sole food storage organs.
During embryo development the cotyledons absorb the food reserves from the endosperm
PROPAGAZIONE PER SEME
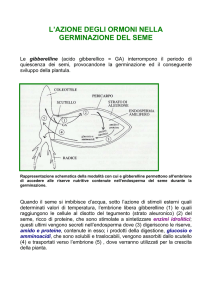
Germinazione : processo nel quale il seme si “risveglia” dalla fase quiescente
e l’embrione comincia a svilupparsi fino a formare una nuova plantula;
Si manifesta con l’emissione della radichetta e termina quando la pianta ha
Prodotto una superficie fotosintetica efficace
Fase 1: l’acqua penetra nel seme e innesca una serie di attività enzimatiche
che portano alla scissione delle riserve per renderle più assimilabili
Dalla plantula
Fase 2: sviluppo della plantula fino alla completa autonomia. Prevalgono
Processi di sintesi
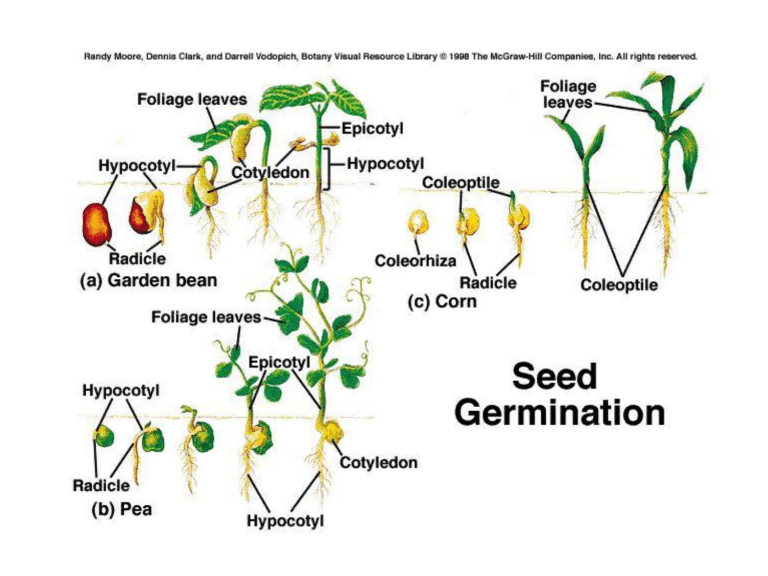
Le specie presentano diversi elementi caratteristici:
Specie con forte allungamento dell’ipocotile (germinazione epigea, Phaseolus);
I cotiledoni sono portati sopra la superficie del suolo; i cotiledoni fanno fotosintesi e
Vengono presto sostituiti da vere foglie diverse dalle forme cotiledonari
Specie che sviluppano maggiormente epicotile (germinazione ipogea), caratteristica
Di semi grossi e pesanti come Aesculus, Araucaria, Castanea, Quercus.
FATTORI CHE INFLUENZANO LA GERMINAZIONE
I semi possono essere definiti organismi in condizioni di vita sospesa o rallentata
Quiescenza: risposta del seme a condizioni esterne non favorevoli,
Dormienza: motivi inibitori interni che bloccano la germinazione, anche in condizioni
Ambientali favorevoli;
Dormienza secondaria: provocata da fattori esterni (T > 20°C pressochè costanti
Per cui il seme rientra in dormienza
Esistono quindi fattori esterni e interni che condizionano la germinazione
FATTORI ESOGENI
Temperatura: ha un ruolo primario per lo svolgimento dei processi biochimici
LE RICHIESTE TERMICHE POSSONO ESSERE MOLTO CONTENUTE: alcune
Specie di climi temperato-freddi una volta rimossa la dormienza possono germinare
Con T di poco superiori allo 0 (Fagus sylvatica, Prunus avium, Tilia cordata,
Viburnum lantana) mentre esistono piante di ambienti desertici che sopravvivono
In questa delicata fase a temperature altissime.
La germinazione di specie mediterranee (eriche cisti) è favorita da temperature
Costanti relativamente basse (15°C) che coincidono con la stagione più umida
dell’anno;
In numerose specie tipiche di climi temperato freddi, le temperature
fortemente alternanti (ad esempio, 20°C di giorno e 3°C di notte)
favoriscono la germinazione una volta eliminata la dormienza.
Il verificarsi di temperature ‘elevate’ (tra 20 e 30°C) dopo che il seme, in
condizioni naturali o artificiali, ha rimosso la dormienza può indurre in
dormienza secondaria i semi di alcune specie (molte rosacee, vari frassini,
faggio, ecc.)
Ossigeno
La presenza di ossigeno è fondamentale nei processi germinativi anche se
molte piante acquatiche, nonché la maggior parte delle specie che vivono in
ambienti umidi, germinano normalmente con percentuali di ossigeno molto
ridotte.
Un terreno mediamente umido rappresenta la condizione ideale per
la germinazione, mentre, se la quantità di acqua presente è troppo elevata, si
determina una saturazione delle porosità del suolo, con conseguente
diminuzione dell’ossigeno.
Acqua
L’acqua può determinare effetti negativi alla germinazione, oppure a
processi direttamente connessi, soprattutto quando si tratta di piogge
prolungate, quando si manifesta come grandine, quando rallenta la
fioritura, quando ostacola il volo degli impollinatori.
E’ stato osservato che, nelle specie dioiche, le piante maschili vegetano
più abbondantemente nei luoghi più umidi, mentre quelle femminili
tollerano meglio una minore disponibilità d’acqua in relazione alla
superiore capacità di resistenza agli stress idrici del gametofito
femminile
Luce
Vi sono semi (Pancratium maritimun, Helichrysum italicum, Rosmarinus
officinalis) in cui il buio favorisce la germinazione mentre altri sono favoriti dalla
luce (Arbutus unedo, Myrtus communis, Paulownia tomentosa).
Brevi esposizioni alla luce possono indurre alla rapida germinazione i semi di
molte specie cosiddette ‘infestanti’, come avviene dopo la lavorazione di
terreni da tempo incolti.
Naturalmente esistono, e sono la maggioranza, specie foto-indifferenti.
Fuoco
In realtà, interagisce intensamente con i fattori che condizionano la
germinazione a livello interno. L’azione degli incendi si manifesta
attraverso il calore, il fumo, le soluzioni acquose di cenere (che seguono le
piogge), anche se i meccanismi eco-fisiologici che favoriscono in qualche
caso la germinazione non si conoscono ancora bene. In ogni modo
fumo e soluzioni di cenere, si usanooggi per stimolare la germinazione di
semi di specie legate al ciclo degli incendi.
I cisti ed il rosmarino si possono rinnovare in massa per seme dopo gli
incendi. Sono anche fortemente infiammabili e quindi capaci di mantenere
la predisposizione all’incendio delle cenosi in cui abbondano.
Tipo di disseminazione
I frutti carnosi intensamente colorati o lucidi sono spesso legati alla
disseminazione tramite uccelli o piccoli mammiferi; questo meccanismo
ecofisiologico implica l’esistenza di dormienze complesse necessarie ad
assicurare l’integrità del seme durante il passaggio nel tratto digestivo.
Cibandosene, gli animali aumentano la germinabilità dei semi contenuti
nei frutti e li allontanano dalla pianta madre. E’ il caso del corbezzolo, dei
ginepri, del corniolo, del mirto, ecc..
FATTORI ENDOGENI
Dormienza
E’ uno stato di riposo, dovuto a cause fisiche e/o fisiologiche intrinseche, che
impedisce la germinazione, anche in condizioni ambientali favorevoli. E’
una caratteristica controllata geneticamente che interagisce in vario modo
con i fattori ambientali.
In alcuni casi esiste una barriera, identificabile nei tegumenti, che può
determinare una resistenza meccanica notevole, ma variabile da seme a
seme, oppure impedire l’assorbimento dell’acqua o gli scambi gassosi con
l’esterno.
Un tale meccanismo, diffuso in molte specie della famiglia delle
Leguminosae (molto presenti in ambito mediterraneo), assicura la
sopravvivenza della specie per molti anni anche in condizioni difficili
poiché solo una piccola percentuale dei semi presenti nell’ambiente
germinerà ad ogni nuova stagione.
Questo fatto consente alla specie di continuare a vivere nel suo ambiente
anche quando si verifichino per diversi anni consecutivi morìe di plantule e
impedimenti riproduttivi.
A seconda delle specie, l’impermeabilità del tegumento può essere
raggiunta in precedenza o immediatamente dopo la maturità fisiologica
del seme, ma il processo può avvenire anche dopo la disseminazione.
Col tempo, la barriera fisica può essere rimossa da funghi, da batteri o da
enzimi prodotti dal seme stesso.
In ambito vivaistico si effettuano trattamenti per ridurre l’impermeabilità
dei tegumenti, dato che questa comporta germinabilità ridotta nella stagione
di semina e forte scalarità dell’emergenza.
La pratica utilizzata per ottenere<la massima resa in plantule è detta
scarificazione ed è attuata sottoponendo i semi a bagno in acqua calda o in
soluzioni aggressive di acidi o basi forti
(acido solforico, idrossido di sodio),
oppure attuando sui semi incisioni od abrasioni del tegumento. In tutti i casi si
deve porre molta attenzione sia per l’integrità delle strutture seminali interne
sia per la sicurezza degli operatori.
Al fine di ottenere una germinazione simultanea, uno dei metodi più
impiegati per aggredire l’integrità dei tegumenti delle leguminose in vivaio
è l’immersione dei semi in acqua a temperature elevate per varie ore (anche
più di 12).
La fonte di calore deve essere allontanata prima di versare la
semente e la massa, costituita da dieci parti di acqua per ogni parte di seme,
si deve mescolare di tanto in tanto fino al raffreddamento.
Una volta tolto dall’acqua, il seme va asciugato in ambiente ventilato, ma non
esposto al sole, e seminato al più presto.
i semi con tegumenti più sottili possono essere danneggiati, e quindi sottoposti a
selezione genetica, che privilegia i semi con tegumenti duri.
In alternativa si può ricorrere alla scarificazione chimica, con acidi o
alcali, o meccanica con apposite macchine.
La scarificazione meccanica si esegue con apparecchi costituiti da un
cilindro di metallo, rivestito internamente da carta vetrata, e da una serie
Di alette centrali che, girando ad alta velocità, scagliano i semi contro la
parete e intaccano i tegumenti, ma raramente danneggiano l’embrione.
Per ogni campione occorre individuare la carta vetrata più idonea.
Quando gli ostacoli alla germinazione del seme sono di tipo chimico (presenza
di ‘inibitori’ che provocano la ‘dormienza’), bisogna operare trattamenti che
favoriscano la rimozione o la trasformazione delle sostanze inibenti.
In natura tale situazione viene superata tramite
la progressiva degradazione delle sostanze inibitrici, mentre in campo vivaistico
ciò può essere indotto artificialmente attraverso una pratica denominata
stratificazione.
Essa consiste nel porre i semi, mescolati con un substrato umido, in ambiente
arieggiato e freddo (stratificazione fredda o vernalizzazione o chilling) o
caldo (stratificazione calda o estivazione), per un periodo di tempo variabile
da specie a specie.
la stratificazione calda non si applica da sola, ma solitamente precede la
vernalizzazione perché consente il completamento dello sviluppo
dell’embrione in quelle specie che, al momento della disseminazione,
mostrano embrioni non ancora fisiologicamente maturi (rosacee, oleacee,
ecc.).
In alcuni casi (Prunus avium, Tilia cordata), data la complessa dormienza del
seme, si rende necessario condurre più cicli di stratificazione calda +
stratificazione fredda. I cicli finiscono sempre con la fase fredda.
Per la stratificazione si dispongono a strati i semi in un substrato soffice e
umido, costituito generalmente da torba, agriperlite, sabbia o vermiculite
utilizzati singolarmente oppure mescolati tra di loro in varie proporzioni. Il
rapporto in volume seme/substrato può variare da 1:1 a 1:3 circa. In certi
casi può risultare più pratico mescolare direttamente semi e substrato.
La stratificazione fredda è condotta a temperature tra 2°C e 6°C, in
ambienti controllati (frigoriferi, celle, ecc.) oppure all’aperto (cassoni, buche
scavate nel terreno, ecc.).
La stratificazione calda è condotta intorno ai 20°C. In entrambi i casi è
fondamentale mantenere un buon livello di umidità del substrato, evitando
ristagni d’acqua, ed assicurare temperature costanti ed uniformi in tutta la
massa.
Quando si impiega il termine ‘stratificazione’ tout court si intende la vernalizzazione.
La stratificazione condotta in condizioni controllate di laboratorio viene
generalmente effettuata negli stessi contenitori (detti germinatoi) in cui sono
successivamente svolte le prove di germinazione.
La disidratazione dei semi può richiedere anche alcuni mesi e, poiché non
tutte le specie presentano la stessa “tolleranza” alla conservazione in
condizioni artificiali, per essere eseguita correttamente comporta una
conoscenza approfondita della morfologia, dell’anatomia e dei parametri
fisiologici coinvolti nello sviluppo e nella maturità del seme. Questa
procedura, considerata a ragione la più delicata nel trattamento dei semi,
costituisce oggetto di dibattito e di sperimentazione da parte dei vari Enti di
ricerca che si occupano di conservazione ex situ.
Essa va monitorata attentamente poiché i vari stadi di sviluppo del seme
sono fortemente condizionati da fattori di natura meccanica, chimica,
morfologica e fisiologica che possono favorire la germinazione ma, in
condizioni sfavorevoli, innescare dormienze di difficile interpretazione.
Ogni categoria di semi (ortodossi, intermedi, recalcitranti) tollera, infatti, un
processo di disidratazione differente che, se mal eseguito, può
comprometterne la vitalità.
Semi ortodossi
tale tipologia di semi può essere deidratata senza danni; si
conservano a lungo se portati a bassi livelli di umidità (mc 5-8%) e
tenuti in contenitori ermetici a basse temperature (Manuale APAT
versione 8.0). Per una conservazione inferiore ai 5 anni si
applicano temperature variabili da 0 a -5°C mentre, per tempi di
conservazione più lunghi, sono preferibili temperature più basse
(comprese tra -15 e -18°C) (Di Noi A. & Piotto B., 2001).
In un mondo ideale tutti gli organismi dovrebbero vivere ed essere tutelati nel
loro habitat naturale, secondo una politica di conservazione che prende
comunemente il nome di "conservazione "in situ", attraverso la creazione
di aree protette quali parchi nazionali, parchi naturali, riserve, zone
umide,
ZPS,
ZSC.
Per quanto concerne le specie maggiormente minacciate, l’attività “in
situ” prevede la conservazione di popolazioni vitali in aree che devono
essere sufficientemente estese da consentire la sopravvivenza di un gran
numero di individui appartenenti ai taxa da proteggere. Per conservare la
variabilità genetica, che sta alla base della capacità delle varie specie di
evolversi e di adattarsi al mutare delle condizioni ambientali, l’ampiezza di tali
aree viene calcolata in funzione della densità demografica dalla specie in
natura.
La “conservazione ex situ” è una tecnica che, per tutelare le specie animali e
vegetali in pericolo, le preleva dal loro habitat naturale e le mette sotto la “custodia
protettiva” dell’uomo. Si tratta di una strategia fondamentale di conservazione a cui si
ricorre quando la conservazione “in situ” risulta insufficiente o quando una specie è
gravemente minacciata o rara.
I tipici ambienti nei quali si attua la conservazione ex situ sono: Zoo, Acquari, Vivai,
Orti Botanici, Arboreti e Banche (dei semi, di pollini, di colture cellulari, ecc.). Il ruolo di
queste strutture non è solo quello di conservare le specie ed il loro patrimonio
genetico in ambienti adeguati, ma anche di sensibilizzare il pubblico sull’importanza
della salvaguardia della biodiversità, e di rendere disponibile il materiale per la ricerca
(pura o applicata), al fine di incrementare le conoscenze sul ciclo biologico delle varie
specie e poter elaborare ex situ tutte le strategie da sperimentare successivamente,
in situ, per ricostituire o restaurare gli ecosistemi naturali degradati.
Banche del seme
La salvaguardia delle risorse vegetali attraverso la creazione di banche dei semi si
può far risalire al ventesimo secolo. Il primo grido d’allarme inerente l’erosione globale
della diversità vegetale fu lanciato nel 1920 da scienziati come Harry Harlan e da
Nikolai Vavilov che denunciarono i pericoli derivanti dall’abbandono delle colture
tradizionali a favore di nuove varietà selezionate dall’uomo e che si stavano
ampiamente diffondendo nel mondo.
Le banche dei semi sorgono però anche dalla necessità dei produttori di avere
accessibilità a stock di materiale rigenerabile. Il loro ruolo nella conservazione è in
prima linea a partire dal 1970, in conseguenza delle gravi perdite subite dalle
produzioni di mais americane e sovietiche e dovute, principalmente, alla mancanza di
diversità genetica tra le colture. In seguito a questi eventi, nel 1974, il governo degli
Stati Uniti istituì il Ministero per le Risorse Genetiche delle Piante (ora conosciuto
come IPGRI), il quale diede vita ad una rete mondiale delle banche dei semi (dette
anche gene banks). Tale organizzazione include, ad oggi, programmi universitari
di rigenerazione, unità governative di conservazione dei semi ed il Consultative
Group on International Agricultural Research (CGIAR), un’organizzazione su
scala mondiale costituita da 16 centri di ricerca per l’agricoltura, originariamente
fondata per diffondere la Rivoluzione Verde nello sviluppo delle Nazioni e promossa
dalla Banca Mondiale e dalle sue agenzie internazionali di assistenza.
Semi intermedi
in realtà, tra le possibili risposte dei semi alla conservazione, c’è un continuum di
comportamenti intermedi tra le estreme situazioni di ortodossia e recalcitranza
(Piotto B., e Amadei M., 2004). In generale questa tipologia di semi tollera una
disidratazione fino a valori di mc% compresi tra 7-10 e 20 (HONG et al., 1998) ma,
una volta essiccati sono danneggiati dalle basse temperature (Di Noi A. & Piotto B.,
2001).
Semi recalcitranti
difficili da conservare. In natura i semi recalcitranti presentano, al momento
della disseminazione, elevati contenuti di umidità (20-40%, in relazione alla
specie). Non tollerano una disidratazione significativa e, pertanto, non
possono essere conservati a temperature inferiori allo zero, in quanto
subirebbero danni ai tessuti determinati dal congelamento dell’acqua
disponibile al loro interno. In laboratorio, se essiccati, perdono rapidamente
la vitalità mentre, se lasciati con il naturale contenuto di umidità, germinano
in tempi piuttosto brevi ((Di Noi A. & Piotto B., 2001; Piotto B. & Amadei M.,
2004; Manuale APAT versione 8.0).