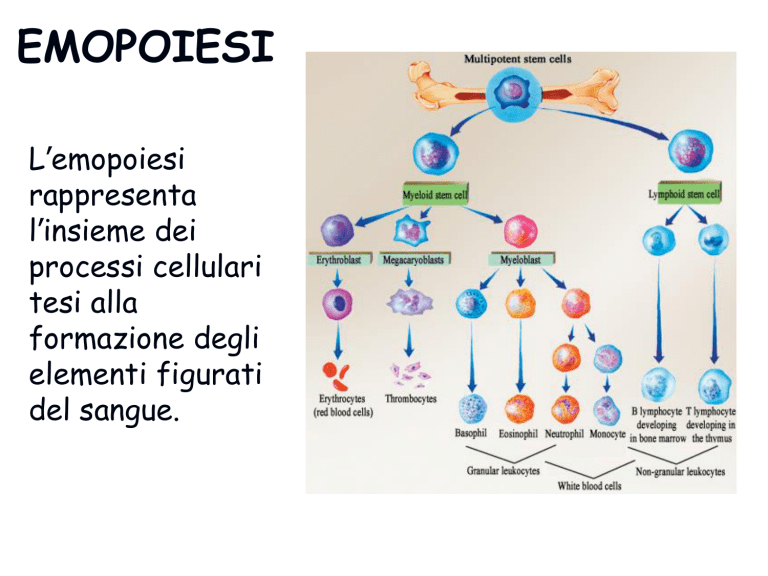
EMOPOIESI
L’emopoiesi
rappresenta
l’insieme dei
processi cellulari
tesi alla
formazione degli
elementi figurati
del sangue.
L’ENTITA’ DEL FENOMENO EMOPOIESI
In condizioni normali, ogni ora sono prodotti:
1010 globuli rossi
109 globuli bianchi
24 ore/24 per tutta la vita
In condizioni di stress (perdita acuta di sangue,
infezione) i fabbisogni aumentano di 10 volte e oltre
Inoltre le cellule prodotte dal midollo sono in grado
di funzionare in tutti i distretti dell’organismo in
modo autonomo
Nei vertebrati lo sviluppo delle cellule del sangue avviene in due fasi: una fase
embrionale transitoria e una successiva fase definitiva. Queste fasi
differiscono per i siti in cui gli elementi del sangue vengono prodotti, per la
tipologia delle cellule prodotte e per i tempi necessari all’emopoiesi.
L’emopoiesi prenatale è, a sua volta, suddivisa in 4 fasi:
PRENATALE
POSTNATALE
CELLULARITA'
(%)
100
MIDOLLO OSSEO
SACCO VITELLINO
Epatica
VERTEBRE
Mieloide
FEGATO
80
Mesoblastica
60
STERNO
Splenica
40
MILZA
COSTOLE
TIBIA
20
0
FEMORE
1
2
3
4
5
6
7
8
9
10
NASCITA
20
30
40
ETA'
50
60
70
Periodo epato-splenico
(12a settimana)
Umbilical
cord
Spleen
Adult bone marrow
Fetal liver
Yolk Sac
Periodo mesoblastico
(sacco vitellino)
Periodo epatico
(6a settimana)
Periodo midollare
(20a settimana)
Ontogenesi dell’Emopoiesi
SITI DELL’EMOPOIESI
Feto
Bambini
Adulti
0-2 mesi Sacco Vitellino
(mesoblastica)
0-8 mesi Fegato, Milza
5-9 mesi Midollo Osseo
(epatica, splenica)
(mieloide)
Il midollo osseo rosso si trova in tutte le ossa (canale midollare)
fino alla pubertà, poi viene lentamente sostituito da midollo
osseo giallo
Il midollo osseo rosso, attivo, si trova soprattutto nelle
estremità delle ossa lunghe , fra i due tavolati delle ossa
piatte (sterno, coste, scapole) e a livello delle ossa del bacino.
Adulto
Bambino
MIDOLLO OSSEO
Il midollo osseo si situa nelle
nicchie delimitate dalle
trabecole della spongiosa
ossea.
Il midollo osseo è un tessuto
da gelatinoso a semifluido.
TESSUTO EMOPOIETICO
Nella cavità del tessuto
spugnoso e nella cavità
midollare è contenuto il
midollo osseo rosso, con
funzione emopoietica, e
il midollo osseo giallo
(prevalentemente cellule
adipose)
CELLULE STAMINALI
Sono cellule non
specializzate
caratterizzate da due
fondamentali
proprietà che le
definiscono e
differenziano da
tutte le altre cellule:
-
La capacità di
autorinnovarsi
mediante divisioni
cellulari da cui si
originano cellule
identiche alla cellula
madre
-
La capacità di
differenziare dando
origine a cellule
specializzate
TOTIPOTENTI
-
PLURIPOTENTI
MULTIPOTENTI
UNIPOTENTI
+
DIFFERENZIAMENTO
CLASSIFICAZIONE DELLE
CELLULE STAMINALI
CELLULE STAMINALI
LE CELLULE STAMINALI
• CELLULE CAPACI DI DIVIDERSI (AUTORINNOVAMENTO) PER
TUTTA LA VITA DI UN ORGANISMO
• IN DETERMINATE CONDIZIONI SONO IN GRADO DI DIFFERENZIARSI DANDO ORIGINE ALLE CELLULE MATURE DI UN ORGANISMO;
• IN BASE AL POTENZIALE DIFFERENZIATIVO POSSONO ESSERE DISTINTE IN:
TOTIPOTENTI
LO ZIGOTE (UOVO FECONDATO)
PLURIPOTENTI
LE CS EMBRIONALI (da cui deririvano le cellule del MESODERMA
ECTODERMA, ENDODERMA)
MULTIPOTENTI
LE CS DELL’ADULTO
PROPRIETA’ DELLA CELLULA STAMINALE
EMOPOIETICA:
•
capacità di “self-renewal”
•
capacità di dare origine a progenitori multipotenti
•
capacità di dare origine a precursori “committed”
(differentiation plasticity)
•
Capacità di engraftment
•
Plasticità (developmental plasticity)
La cellula staminale emopoietica
PLASTICITA’ DELLE CELLULE STAMINALI
MICROAMBIENTE MIDOLLARE
Componente
cellulare
Componente vascolare
Cellule reticolari (istiociti)
Struttura nervosa
Adipociti, fibroblasti,
Macrofagi
Cellule stam. mesenchimali
Matrice
extracellulare
Fibre reticolari/collagene
Prolungamenti cell. reticolari
Proteine d’adesione
proteoglicani
IL MICROAMBIENTE EMOPOIETICO
Il microambiente (nicchia emopoietica) è composto
da una multitudine di cellule stromali ed
emopoietiche che forniscono:
Superfici
Matrice extracellulare
Fattori solubili che in concerto sono
responsabili della regolazione e proliferazione,
quiescenza, differenziazione, reclutamento ed
accumulo dei progenitori emopoietici e delle
cellule staminali.
Le funzioni della nicchia emopoietica sono diverse:
Fornire uno spazio anatomico
Istruire le cellule ad autorinnovarsi (stretto
rapporto
con
il
microambiente)
o
a
differenziarsi (lontano dalle cells stromali)
Influenzare la mobilità cellulare.
STRUTTURA DEL
MIDOLLO OSSEO
Cavità compartimentalizzate da
trabecole ossee, contenenti cellule
stromali
(adipociti,
fibroblasti,
macrofagi) e cellule emopoietiche
(eritroblasti,
granuloblasti,
megacariociti), con un complesso
sistema
vascolare
(arteriole
midollari e corticali, rete sinusale,
seno centrale) ed una specifica
matrice extracellulare che fornisce
una rete strutturale a cui le cellule
stromali ed emopoietiche possono
ancorarsi.
VASCOLARIZZAZIONE
Il sistema vascolare è permeabile
alle cellule ematiche mature per la
presenza di pori di migrazione
beanti
sulla
parete
sinusale
(passaggio per processo "attivo").
MIDOLLO OSSEO
IMMISSIONE IN CIRCOLO DEGLI ELEMENTI MATURI
La normale funzione del midollo dipende da:
1. Normalità del microambiente midollare specifico
2. Normale funzione delle CELLULE STAMINALI
3. Vit. B12, acido folico, ferro+ormoni, proteine+lipidi +zuccheri
CELLULE STAMINALI EMOPOIETICHE
Circa lo 0.1% di cellule nucleate del midollo sono
quiescenti e considerate pluripotenti. Per mitosi
generano una cellula pluripotente (autorinnovamento)
e una cellula staminale dalle quali origineranno le
cellula progenitrici (multipotenti)
- CFU-GEMM precursore della
linea mieloide
- CFU-Ly precursore della
linea linfoide
CFU= unità formanti colonie
Fasi dell’emopoiesi
Cellula
Staminale
Automantenimento
Orientamento
Mieloide
Linfoide
DIFFERENZIAZIONE
Eritroblasti
Granuloblasti
Megacariociti
B
T
Monoblasti
MATURAZIONE
linfociti
eritrociti
granulociti
monociti
piastrine
B maturi
T maturi
QUALI SONO I FATTORI CHE
FAVORISCONO L’EMOPOIESI?
- Il microambiente che si forma in nicchie
specifiche adatte al differenziamento delle
diverse linee ematiche
- Il contatto con la matrice extracellulare
- I fattori di crescita emopoietici
I FATTORI DI CRESCITA
I fattori di crescita sono
glicoproteine
prodotte
dalle
cellule stromali, dalle stesse
cellule emopoietiche, dal fegato
e dal rene.
Funzioni:
- Sono stimolatori dell’emopoiesi
per il continuo rinnovo delle
cellule
ematiche
(condizioni
normali)
-
Stimolano la produzione di
leucociti, eritrociti e piastrine in
caso di infiammazione, anemia,
trombocitopenia (condizioni di
stress)
LE CELLULE MESENCHIMALI (STROMALI)
Fibroblasti, mio-fibroblasti, adipociti,
osteoblasti, cellule endoteliali e macrofagi
Citochine solubili
Osteoblasti
Cellula staminale
Macrofago
Fibroblasti
Citochine di membrana
Cellula endoteliale
CSF,HGF, ILs
Trabecola ossea
SINTESI ED EFFETTI
Molte citochine sono prodotte dalle cellule stromali del
midollo ; agiscono a livello midollare e spesso anche in
siti ben precisi e specifici.
I fattori di crescita agiscono:
- inducendo la proliferazione dei progenitori emopoietici
- attivando le cellule mature
- stimolando le funzioni delle cellule mature
- stimolando la produzione di altri HGF
CSF, HFG, IL
-
Il termine Colony Stimulating Factor
(CSF) è un termine generico utilizzato
per indicare sostanze
capaci di
stimolare la crescita di colonie
ematopoietiche
-
Il termine Hematopoietic Growth
Factor (HGF) indica specifici fattori
capaci di agire a diversi livelli.
-
Il termine Interleukina (IL),
originariamente indicava molecole che
erano necessarie per le interazioni fra
cellule dell’immunità. Oggi con questo
termine si indica una classe di
molecole
attive
nella
cascata
emopoietica,
appartenenti alla
famiglia delle citochine., che agiscono
soprattutto sui leucociti.
PRODUZIONE ENDOGENA
La EPO fornisce l’esempio più
chiaro per quanto riguarda la
produzione endogena di fattori
emopoietici, in quanto si conosce il
sito
esclusivo
di
produzione
(apparato
iuxtaglomerulare
del
rene)
La TPO fornisce un altro esempio
riguardante il rapporto fra livelli
sierici e produzione di piastrine ed
è la citochina regolatrice della
produzione piastrinica (sintetizzata
soprattutto dal fegato).
EPO: eritropoietina
TPO: trombopoietina
Emopoiesi patologica
In presenza di patologie, i siti extramidollari possono
servire come siti primari per lo sviluppo delle cellule
ematiche
a. Siti ematopoietici fetali (milza e fegato) possono
diventare siti primari nell’adulto in alcune malattie
(anemia mediterranea)
milza
fegato
b. Siti midollari adulti, che sono normalmente non ematopoietici
(cervello, polmoni, esofago), possono trasformarsi in siti
ematopoietici per aumentare la produzione di cellule del
sangue o per presenza di malattie neoplastiche
esofago
polmone
cervello
EMOPOIESI
Il midollo osseo è sede prevalentemente di proliferazione e maturazione
delle cellule del sangue , ma può fungere anche da deposito.
Infatti:
Granulociti: il midollo funge da compartimento di proliferazione e
maturazione ma anche da deposito midollo sede di maturazione e
deposito
Eritrociti: nel midollo avviene la maturazione ma non il deposito di globuli
rossi perché la loro funzione è di agire da vettori di ossigeno e anidride
carbonica midollo come sito di maturazione, non di deposito
Megacariociti: nel midollo c’è la maturazione. Il 70% delle piastrine circola
nel sangue, il restante 30% è depositato nella milza, fegato midollo
come sito di maturazione, non di deposito
VIA LINFOIDE
La produzione dei linfociti inizia nel midollo
osseo con la differenziazione verso la linea
linfoide delle cellule staminali emopoietiche
multipotenti, dalle quali derivano tutte le cellule
del sangue. Si formano dapprima i progenitori
linfoidi precoci, dei quali un’aliquota permane nel
midollo osseo dove compie il processo
maturativo che porta alla formazione dei
linfociti B, mentre un’altra aliquota abbandona
precocemente il midollo per raggiungere, per via
ematica il timo dove ha inizio e si conclude la
maturazione dei linfociti T.
VIA MIELOIDE
Eritropoiesi
Mielopoiesi
Trombopoiesi
eritrociti
leucociti
piastrine
ERITROPOIESI
Gli eritrociti maturano in sei giorni, permangono in circolo come
reticolociti per due giorni e circolano nel sangue per centoventi giorni.
Durante la maturazione, il globulo rosso diventa sempre più piccolo in
volume e il nucleo da grosso scompare per frammentazione
(all’osservazione sembra che all’interno della cellula ci sia un “reticolo”),
venendo poi espulso.
Durante la maturazione agiscono:
Fattore delle cellule staminali (SGF)
IL3 e IL9
Eritropoietina
ERITROPOIETINA
ERITROPOIESI
Dalla citologia midollare:
Proeritroblasto
Eritroblasto basofilo
aumenta la sintesi di emoglobina (Hb)
colorazione
rosata del citoplasma
Eritroblasto policromatofilo
nucleo picnoticomasserelle
Eritroblasto ortocromatico (ammassamento
materiale nucleare, emoglobinizzazione del
citoplasma) espulsione nucleo
Reticolocita, dimensioni > della cellula matura,
con residui citoplasmatici di RNA
ribosomiale (policromasia=diffusa
colorazione grigiastra o bluastra),
frammenti di ribosomi e altri organelli.
Completa eliminazione dei residui avviene parte
nel midollo osseo e parte nella circolazione.
I globuli rossi normali trascorrono in circolo
1-2gg in forma di reticolociti e 120gg in
forma di eritrociti maturi.
CFU-E
EPO
CONTEGGIO DEI RETICOLOCITI
I reticolociti possono essere misurati manualmente o
automaticamente. Nel metodo manuale lo striscio di sangue viene
colorato con un colorante sopravitale (blu di metilene) che mette
in risalto il RE che persiste all’interno dei reticolociti. I metodi
automatici sono più accurati perché possono contare più cellule.
Un campione di sangue viene trattato
con un particolare colorante e passato
attraverso uno strumento che conta
le cellule e le caratterizza utilizzando
un laser. La diffusione della luce viene
usata per contare i reticolociti.
VALUTAZIONE DI LABORATORIO DELL’ERITROPOIESI
CONTEGGIO DEI RETICOLOCITI (valutazione eritropoiesi)
Il conteggio dei reticolociti è un importante indicatore dell’attività eritropoietica del
midollo.
Conteggio reticolociti osservato (CO): 0.5-2.5% dei globuli rossi circolanti. Nei neonati
2-6%.
In condizioni di funzionalità midollare normale e adeguate riserve di ferro reticolocitosi è
proporzionale alla perdita di sangue o distruzione dei globuli rossi.
Valutazione di emorragie: Un episodio emorragico singolo causa reticolocitosi che
inizia entro 24-48h e raggiunge un picco a 4-7gg, quando l’Hb si stabilizza si ritorna
a livelli normali. Reticolocitosi persistente indica una perdita di sangue continua o
ricorrente.
Il conteggio dei reticolociti è importante nella:
Diagnosi differenziale delle anemie
Es. reticolocitosi come test per valutare carenza vitamina B12: se somministrazione di
dosi fisiologiche di B12 non induce reticolocitosi non c’e carenza di B12
Es. anemia perniciosa e talassemia, eritropoiesi inefficace: popolazione eritroide
iperplastica, ma conteggio reticolociti basso perché le cellule non maturano mai a
sufficienza per entrare in circolo.
Valutazione della risposta alla terapia
Marziale (anemia da carenza di ferro): reticolocitosi indica che il midollo sta
rispondendo con un’aumentata produzione di eritrociti.
MIELOPOIESI
GM-CSF
G-CSF
M-CSF
GRANULOPOIESI
I globuli bianchi impiegano 14 giorni per la maturazione (durante la quale
passano attraverso le fasi di mielobla sto, promielocita, mielocita,
metamielocita, granulocita)
Vivono per 6-8 giorni, poi raggiungono il tessuto connettivale per due giorni.
I globuli bianchi nello striscio midollare sono più grandi dei globuli rossi, il
citosol è roseo e il nucleo è polilobato (più la cellula invecchia più il nucleo si
frammenta).
La formazione di granulociti neutrofili, eosinofili e basofili è
influenzata da:
G-CSF
IL1, IL5, IL6
GRANULOCITI: neutrofili eosinofili e
basofili.
Il > impegno della mielopoiesi è diretto vs la
produzione della serie neutrofila, che, tra i
leucociti circolanti, rappresenta
numericamente la prima popolazione
cellulare.
Granulopoiesi :
Pool proliferante o mitotico: mieloblasti
promielociti
mielociti
Pool maturativo :
metamielociti
cellule a banda
Pool di deposito (10gg):
neutrofili
Pool circolante (50%) Pool marginato
(strettamente aderente alla parete dei
piccoli vasi).
Normalmente non più del 5% dei granulociti
circolanti è immaturo e la grande
maggioranza di queste cellule si trova nel
penultimo stadio di maturazione (cellule a
banda).
MIELOPOIESI
G-CSF
MIELOPOIESI
M-CSF
MONOCITI
Nel midollo i precursori dei monociti
sono generalmente poco numerosi.
Stimolati da M-CSF:
Monoblasto promonocita
monocita maturo.
I monociti rimangono in circolo 12-14
ore prima di migrare nei tessuti e
diventare macrofago.
nei tessuti
TROMBOPOIESI
I megacariociti sono i precursori delle
piastrine circolanti e rappresentano
la cellula del midollo di maggiori
dimensioni.
- Trombopoietina controlla la loro
proliferazione e maturazione.
-
Durante la maturazione il nucleo va
incontro a successive divisioni non
seguite dalla divisione cellulare
cellula plurinucleata.
Successivamente la formazione di
membrane di demarcazione
all’interno del citoplasma separa le
singole piastrine che vengono
rilasciate in circolo: 1 megacariocita
molte migliaia di piastrine.
-
Il numero di piastrine circolanti è
mantenuto entro ristretti limiti di
variazione e sembra controllato dalla
massa totale di piastrine
nell’organismo e dal rilascio di
trombopoietina.
TROMBOPOIESI
Trombopoietina
TROMBOPOIESI
- Ciascun megacariocita durante la sua vita genera circa 4.000
-
piastrine
Le piastrine vivono mediamente 10-12 giorni
Ogni giorno vengono prodotte 30.000-40.000 piastrine/mmc
Se necessario, la loro produzione può aumentare anche di 8 volte
Dopo 10-12 giorni vengono fagocitate dal sistema
reticolo/endoteliale di milza e fegato
EMIVITA DELLE CELLULE DEL SANGUE
ERITROCITI
120 giorni
PIASTRINE
4-5 giorni
GRANULOCITI
MONOCITI
LINFOCITI
6-8 ore
8 ore
VARIABILE
VALUTAZIONE DI LABORATORIO DELL’EMOPOIESI
ASPIRATO MIDOLLARE
Permette di apprezzare i dettagli, i rapporti reciproci e gli aspetti
maturativi delle cellule midollari.
Prelievo per aspirazione di piccolo quantitativo di materiale midollare della
cavità midollare dalla cresta iliaca o dalla sterno e allestimento di uno
striscio (Colorazione di Wright-Giemsa).
Se non si riesce ad ottenere materiale dall’aspirazione:
-attività emopoietica depressa (aplasia midollare);
-il midollo contiene cellule molto immature, stipate, viscose (leucemia
acuta);
-fibrosi o metastasi midollari.
BIOPSIA MIDOLLARE
Prelievo di piccolo campione (cilindro) di tessuto midollare in genere dalla
cresta iliaca.
Permette di ottenere importanti informazioni sulla struttura del tessuto
osseo e delle cellule tra di loro e con gli altri elementi del tessuto
connettivale.
ASPIRATO MIDOLLARE
L’aspirato midollare nell’adulto è ormai quasi sempre
eseguito a livello della cresta iliaca posteriore
L’aspirato sternale, un tempo diffuso, è stato quasi del
tutto soppiantato dall’aspirato dalle spine iliache
posteriori superiori
Dove effettuare l’aspirato midollare
Sterno
Cresta iliaca
Tibia
ASPIRATO MIDOLLARE
vetrino
Dall’aspirato midollare si ottengono le seguenti informazioni:
-quantità totale di cellule;
-sequenza maturativa delle cellule della via eritro- e mielo-poietica.
-conta differenziale. Variazioni della distribuzione dei vari tipi
cellulari del midollo con l’età;
-rapporto mielo-eritrocitario (ME);
-presenza di anormalità citologiche: presenza di tipi cellulari rari
(mast cells, osteoblasti, osteoclasti…), di cellule anormali (cellule
neoplastiche metastatiche) o anormalità di maturazione.
-elementi meno abbondanti del midollo (es. megacariociti, linfociti e
plasmacellule);
-depositi di ferro (test di Pearls).
BIOPSIA MIDOLLARE
La biopsia osteomidollare è un tipo di indagine invasiva
che permette di ottenere un frustolo di midollo
emopoietico circondato da lamelle ossee. Il campione
bioptico
viene
processato
mediante
fissazione/decalcificazione, inclusione e sottoposto a
sezione. Le sezioni ottenute sono altamente
rappresentative della struttura midollare
BIOPSIA MIDOLLARE
Dalla biopsia midollare si ottengono le seguenti
informazioni:
- valutazione della cellularità e della sua distribuzione nel contesto del midollo
- valutazione dell’architettura dell’osso
- puntio sicca al mieloaspirato
- ricerca di metastasi occulte
L’aspirato midollare da informazioni migliori della
biopsia nella diagnostica delle leucemie acute,
delle mielodisplasie e di diversi tipi di anemie,
questo perché fornisce dettagli morfologici sulle
singole cellule, più precisi rispetto alle sezioni
bioptiche.
Aspirato
midollare
Biopsia
midollare
VALUTAZIONE DI LABORATORIO DELL’EMOPOIESI
rapporto tra cellule emopoietiche in via di
dfr e tessuto adiposo midollare.
Parametro relativamente costante 1:1 – 2:1 tra cellule e grasso.
Se > 1:1 – 2:1 indice di ipercellularità.
Natura della linea cellulare più rappresentata fornisce importanti
indicazioni sulla malattia in atto.
La cellularità midollare varia a seconda dell’età del soggetto e della
sede del prelievo.
CELLULARITA’ MIDOLLARE =
RAPPORTO MIELO-ERITROCITARIO (ME, valori normali 2:1-4:1)
Il sangue circolante contiene circa 1000x di più globuli rossi che
bianchi, mentre nel midollo le cellule nucleate della serie bianca
sono più numerose di quelle nucleate della serie rossa con un
rapporto di 3:1 (valori normali 2:1-4:1).
Il rapido ricambio di granulociti, la persistenza del nucleo in queste
cellule ed il fatto che cellule mieloidi mature vengano trattenute
nel midollo spiegano perché all’esame del midollo la maggior
parte delle cellule nucleate appartengano alla serie mieloide.
ASPIRATO MIDOLLARE
Granulocita
Leucemia acuta
Aspirato normale
BIOPSIA MIDOLLARE
Midollo osseo normale
BIOPSIA MIDOLLARE
Midollo osseo iperplastico Midollo osseo aplastico
Midollo osseo nell’anemia aplastica