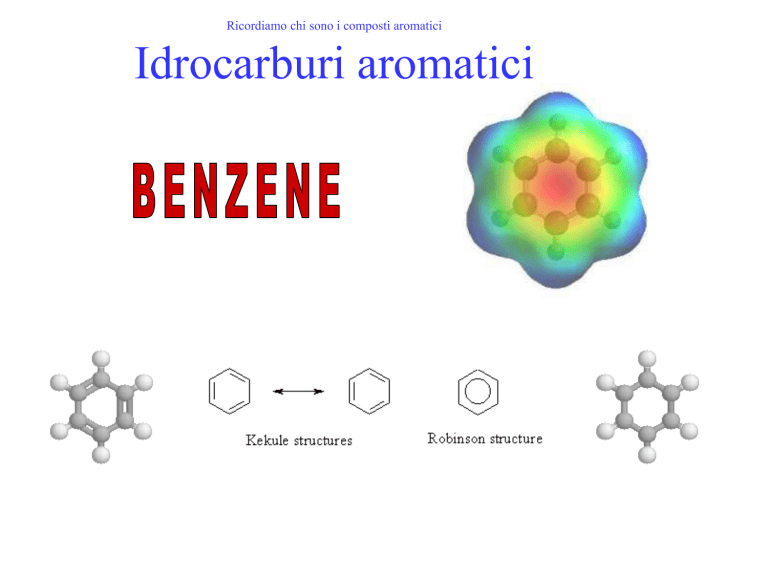
Ricordiamo chi sono i composti aromatici
Idrocarburi aromatici
La completa delocalizzazione dei sei elettroni in un
unico orbitale contenente sei elettroni è rappresentato
graficamente con un anello interno all’esagono nei cui
vertici sono collocati i sei atomi di carbonio.
H
H
H
H
H
a
H
b
Il benzene risuona fra le due forme limite.
Il passaggio dall’una forma all’altra si verifica
per semplice spostamento di cariche elettriche.
H
H
H
H
H
H
H
H
H
H
H
H
Nel benzene tutti gli atomi di carbonio hanno
ibridazione sp2 degli orbitali di valenza.
I sei orbitali pz paralleli non ibridati di ciascuno dei sei
atomi di carbonio contengono un elettrone
H
H
H
H
H
H
I 10 carboni del naftalene sono tutti ibridati sp2 e
ciascuno di essi contribuisce con 1 elettrone alla
aromaticità dell’idrocarburo
Regola di Huckel per prevedere il
comportamento aromatico di composti ciclici
Un composto è aromatico se ha un numero di
e-p = 4n + 2
o un numero dispari di doppietti
Dove n = serie dei numeri naturali
n
1
2
3
4
.
.
e-p
2
6
1
14
16
Composti aromatici policiclici
benzene
naftalene
antracene
fenantrene
Esempi di composti non aromatici
ciclooctatetraene
ETEROCICLICI
Aromatici
Non aromatici
Composti ciclici con
uno o più eteroatomi
che possiedono un
numero dispari di
doppietti quindi sono
aromatici
Es semiacetali
ciclici, esteri
ciclici (lattoni)
ETEROCICLICI AROMATICI : sono composti ciclici con l’anello formato non solo da atomi
di C e H ma con eteroatomi es O,N,S
Eterociclici con anello a 5 atomi
Eterociclici con anello a 6 atomi
piridina
5
6
4 N3
pirimidina
importante
N
2
1
Eterociclici con anelli condensati
Benzene+pirrolo = INDOLO
importante
N
importante
H
N
N
Pirimidina + Imidazolo = PURINA
N
importante
imidazolo
N
H
N
N
H
importante
eterocicli penta-atomici
pirrolo
N
1 eteroatomo
furano
tiofene
O
S
Anello degli zuccheri a 5 atomi
H
Si trova nell’eme
2 eteroatomi
tiofeni sono importanti composti
eterociclici utilizzati nella sintesi
farmaceutica per produrre molecole più
complesse
N
Imidazolo
Si trova nell’istidina
N
H
La risonanza è causa del carattere molto debolmente
basico del pirrolo
pirrolo
N
H
Kb = 2.5 x 10-14
L’anello del pirrolo è l’unità costitutiva
di vari pigmenti di grande importanza
biologica (es le porfirine)
Porfirine sistema coniugato di 18 elettroni p . Sono sostanze colorate
stabili capaci di formare ioni complessi con metalli, con perdita dei
due H+ e formazione di quattro legami di coordinazione
La Porfina è la molecola capostipite (cristalli
rossi) non esiste in natura ma con catene laterali
varie forma le principali sostanze biochimiche
come la porfirina che è stabile e si complessa con
igli ioni metallici
Porfina - H2 = Porfirina + Fe = eme
è un complesso chimico membro di una famiglia di
composti chiamati porfirine contenente un atomo di ferro.
L'eme costituisce il gruppo prostetico, cioè la parte non
proteica di una serie di proteine tra cui l'emoglobina, la
mioglobina e i citocromi. Questa molecola deve la sua
importanza al fatto che può legare l'ossigeno, sia in forma
molecolare che in altri composti (biossido di carbonio CO2,
monossido di carbonio CO, H2O, ecc) proprio grazie
all'atomo di ferro
Ferro eme
• Il composto basico aromatico porfirina agisce
da chelante del ferro, con 4 siti di
coordinazione planari. Gli H centrali sono
sostituti dal metallo.
• Le porfirine differiscono per i sostituenti
laterali. La più comune, protoporfirina IX è
nella emoglobina e citocromo P-450
• Fe solitamente come Fe(II), ma può ossidarsi
O2 è un ossidante e ha un
potenziale tale da poter
ossidare Fe(II) a Fe(III)
O2 + Fe2+ O2¯ + Fe3+
Fe(II) lega O2
Fe(III) non lega O2
Il Ferro si trova come
ione complesso cioè nello
stato di ibridazione d2sp3
e forma quindi 6 legami
dativi (Rippa 1 pag 369)
Spiegazione del perché
il Fe++ fa 6 legami
dativi
Fe 6e in 3d 2e in 4s quando è Fe++ si
ibridizza a d2sp3 e fa 6 legami dativi
Non esiste come tale in natura, ma in complessi di coordinazione
EME
CLOROFILLA
VIT B12
porfirina con Fe2+
porfirina con Mg2+
porfirina con Co 2+
Le porfirine sono composti macrociclici contenenti 4 anelli pirrolici tenuti
assieme da ponti metinici (cioè di un atomo di C)
EME = ferro porfirina
Mioglobina contiene
1 gruppo eme
Emoglobina contiene
4 gruppi eme
Pirrolo!!!
CH2
CH
eme
1C
C2
HC C
C CH
8
CH3 C C
N
7
COO-
HC C
6C
CH2
(Fe-protoporfirina IX)
C C CH CH2
Fe N
CH2 C C
CH2
3
N
N
Fe2+
CH3
CH2
COO-
C C CH3
4
C CH
C5
CH3
N
H
pirrolo
Nell’emoglobina il Fe è legato ai 4 N del pirrolo(porfirina) e gli altri due legami di coordinazione li fa
uno con l’imidazolo dell’istidina di una globina e l’altro con l’ossigeno
N
N
H
nella struttura di un amminoacido,
l’istidina, è presente un
eterociclico aromatico.
Nell’imidazolo sono presenti due
atomi di azoto
4
N
COOH
H2 N C H
CH2
3
5
N
2
N
1
H
imidazolo
N
H
istidina
aromaticità dell'imidazolo
H
N
C
H
C
N
H
C
H
L’imidazolo ha
carattere basico
Il Kb dell'imidazolo
H
N
H+
N
(Kb=1,6x10-7)
risonanza
è influenzato dalla
H
H
N
N
N
N
H
H
Stabilizzazione per risonanza
La possibilità che l’anello imidazolico contenuto nell’amminoacido istidina
possa accettare ioni H+ è molto importante nelle reazioni enzimatiche
specialmente quelle che catalizzano reazioni di idrolisi (rottura di legami per
aggiunta di acqua)
L’anello pirrolico è presente nel
gruppo indolico dell’amminoacido
triptofano
Benzene + pirrolo
(anelli condensati)
indolo
COOH
H2 N C H
CH2
N
N
H
H
triptofano
Nella piridossina e nella nicotinammide è presente
l’eterociclo aromatico piridina
N
O
PIRIDINA
C
CH2OH
NH2
N
NICOTINAMMIDE
(vit. PP)
HO
H3C
CH2OH
N
PIRIDOSSINA
(VIT. B6)
aromaticità della piridina
N
la piridina è una base (Kb=1,6x10-9)
altri eterocicli esa-atomici
44
33
N
55
66
22
N
11
O
pirimidina
g-pirano (anello deli zuccheri
Nucleo delle Basi
azotate RNA e
DNA (citosina
uracile e timina)
a 6 atomi)
6
5
1N
7
N
8
2
N
4
3
N9
H
purina
Nucleo delle Basi azotate (DNA e
RNA): adenina e guanina
Anello pirimidinico
+
imidazolo
NUCLEOTIDI
NUCLEOTIDE = BASE Azotata + RIBOSO + FOSFATO (mono-, bi- o
trifosfato)
BASE Azotata + RIBOSO= NUCLEOSIDE + Fosfato= NUCLEOTIDE
Legami:
Base –Zucchero (Ribosio o Deossiribosio) = legame N glicosidico
Zucchero – Fosfato = legame estere
BASI PURINICHE E PIRIMIDINICHE
Le basi puriniche e pirimidiniche sono costituenti dei nucleotidi. Nella
cellula, i nucleotidi hanno funzioni importanti: energetiche (ATP è la moneta
corrente per tutti gli scambi energetici della cellula), formano parte della
molecola dei coenzimi NAD+ e FAD (i trasportatori di elettroni nelle reazione
di ossido-riduzione del catabolismo ossidativo) e sono le unità costitutive
degli acidi nucleici (DNA e RNA).
Le basi puriniche sono formate da 2 anelli condensati, mentre le
pirimidiniche hanno un solo anello.
Sono dette “basi” perché alcuni azoti possono protonarsi (diventare H+)
sottraendo H+ dalla soluzione.
Basi puriniche (A e G)
N
N
N9
N
H
purina
Basi pirimidiniche (C, U, T)
4
N
5
6
N
1
3
2
pirimidina
Adenosina trifosfato (ATP)
Un esempio di nucleotide trifosfato è l’ATP (adenosine triphosphate):
l’ATP è la “moneta corrente” per tutti i processi che producono e che
consumano energia nella cellula. E’ caratterizzato da un alto potenziale
di trasferimento del fosfato: cioè l’idrolisi del legame anidridico che
unisce tra loro gli ultimi 2 fosfati, libera tanta energia:
ATP + H2O ADP + Pi (fosfato inorganico)
G = - 7.5 kcal/mole
I motivi sono chimici: la repulsione tra cariche negative sui fosfati
(minore quando perde un fosfato) destabilizza la molecola dell’ATP (=
alto contenuto energetico potenziale) e la stabilizzazione di risonanza
del fosfato (una volta idrolizzato) spinge la reazione verso l’idrolisi.
ATP (Adenosinatrifosfato)
Legame
Legami anidridici
adenina
estere
Legami Nglicosidico
ADP e ATP sono esempi di anidridi
dell’acido fosforico
Perché l’idrolisi
dell’ATP libera così
tanta energia?
• Simile alle anidridi aciliche
• Energia libera negativa alta per
l’idrolisi
dovuta a:
– repulsione elettrostatica
– stabilizzazione dei prodotti per
ionizzazione e risonanza
– fattori entropici (aumenta il n. di
molecole in soluzione
ribosio
Modello 3D dell’ATP
Esercizio sull'ATP
L'ATP dona energia mediante reazione di idrolisi, mediata dall'enzima ATPasi, che nella maggior
parte dei casi coinvolge il trasferimento di un gruppo fosfato.
ATP4- +H2O --> ADP3- + P + H+ con una variazione di energia libera di
- 30,5 kj/mole (ovvero 7,3 kcal/mole) ( esoergonica )
L'energia che si libera viene subito utilizzata grazie agli enzimi che coinvogliano questa
energia alle reazioni che ne hanno bisogno.
Nell'ATP c'è una tensione repulsiva tra gli atomi di ossigeno dei gruppi fosfato che a pH 7 sono
ionizzati. Questa repulsione non è sufficiente ad idrolizzare l'ATP perché l'energia di
attivazione è abbastanza elevata. Questi obbligano i due atomi di ossigeno carichi
negativamente ad avvicinarsi alle cariche positive presenti su di essi. Questo genera una
forte tensione. Quando gli ioni sono sottratti rimangono le cariche negative molto vicine tra
loro, e questo genera una violenta repulsione che porta alla rottura del primo legame del
gruppo fosfato con formazione di ADP e con ulteriore idrolisi di AMP
nucleotide
Componenti chimici degli acidi nucleici
2-desossiribosio
( 2-deoxyribose )
6
ribosio
NH 2
7
5
1N
N
N
N
8
2
N
4
N9
H
3
N
purina
N
H
adenina
guanina
NH 2
4
3N
5
2
6
N
1
N
H
pirimidina
citosina
N
O
uracile
timina
IMPORTANTE!!!
I legami glicosidici si hanno tra l’N della base e l’OH beta dello zucchero in particolare tra l’N9 se la base è purinica
o l’N1 se la base è quella pirimidinica
Quindi Base-Zucchero =legame beta glicosidico tra N9 o1 della base e OH 1 del ribosio in forma beta
Tra Zucchero e Fosfato= legame estere (OH dello zucchero in 3 o 5 e l’acido fosforico)(NB ricorda acido +
alcol=estere)
N n°1
N n°9
O
CH2OH
O
-O
-O
O
P
O
CH2
O-
OH
OH
O
OH
P O
O-
(Pirimidina)
3'- monofosfato
(Purina)
5'- monofosfato
I nucleotidi possono portare il gruppo fosfato
in posizione 5' o 3'
Non è l’azoto 3 ma l’1
Basi, nucleosidi e nucleotidi
Base
Nucleoside
Nucleotide
RNA
DNA
Adenina
Adenosina
Adenosina-5’-fosfato
(Acido adenilico)
AMP
dAMP
Guanina
Guanosina
Guanosina-5’-fosfato
(Acido Guanilico)
GMP
dGMP
Citosina
Citidina
Citidina-5’-fosfato
(Acido citidilico)
CMP
dCMP
Timina
Timidina
Timidina-5’-fosfato
(Acido timidilico)
Uracile
Uridina
Uridina-5’-fosfato
(Acido uridilico)
dTMP
UMP
DNA: Basi Adenina Timina Citosina e Guanina) Zucchero 2- deossiribosio) 2 eliche
BASE AZOTATA
Il DNA è un polideossiribonucleotide
E’ a doppio filamento
I suoi monomeri
sono i NUCLEOTIDI
I nucleotidi sono formati:
-gruppo fosfato
- zucchero deossiribosio
- base azotata
Gruppo fosfato
zucchero
Adenina e timina possono legarsi
con 2 legami a idrogeno
Guanina e citosina possono legarsi
con 3 legami a idrogeno
Le basi azotate sono 4:
-Adenina
purine, 2 anelli
-Guanina
-Timina
pirimidine, 1 anello
-citosina
complementarietà
Il legame 3’-5’-fosfodiestereo
unisce i nucleotidi adiacenti negli
acidi nucleici.
deossi nel DNA!
Adenina
Le formule
chimiche dei
quattro
nucleotidi
P
Guanina
Fosfato
Fosfato
Z
B
Deossiribosio
presenti nella
molecola di
DNA
Deossiribosio
Timina
Fosfato
T
A
C
G
G
C
A
T
Citosina
Fosfato
Deossiribosio
Deossiribosio
DNA
P
P
Z
T
A
P
struttura
chimica
P
Z
E….analogia
con la scala a
pioli
T
A
P
Z
C
G
Z
P
A
T
P
Z
Z
P
P
Z
Z
Z
P
G
C
Z
Struttura primaria degli acidi nucleici
• Come per le proteine, gli acidi nucleici hanno una
struttura primaria, costituita dalla sequenza di basi
e una direzionalità che presenta un’ estremità 5'
libera da un lato ed una 3' libera dall'altro.
• Per convenzione le sequenze degli acidi nucleici sono
scritte a partire dalla 5' finendo alla 3'. Secondo
questa convenzione i legami fosfodiesteri vanno dal
3' al 5'
Sequenza
Si descrive attraverso
l’ordine delle Basi Azotate
partendo dall’estremità 5’ fino
all’estremità 3’
Adenosina
(Base Azotata)
Fosfato
Zucchero
Timina
(Base Azotata)
Fosfato
Zucchero
Citosina
(Base Azotata)
Fosfato
-A-T-C-
Zucchero
Fosfato
La struttura secondaria del DNA
La doppia elica
Studi ai raggi X
Sistema regolare che si ripeteva con
una certa periodicità
Le quantità di A e di T erano sempre
uguali e che le quantità di G e C
erano uguali
Struttura secondaria del DNA
La struttura secondaria non è casuale ma
è dovuta ai legami ad idrogeno che si
formano tra le basi
Salvatore Consoli
Modello di Watson e Crick
• Il DNA è costituito da due catene polinucleotidiche a elica
avvolte intorno a un asse comune.
• Le eliche sono destrogire e i due filamenti si sviluppano in
direzioni opposte, con riferimento alle loro estremità 3' e 5'.
Salvatore Consoli
50
• Le basi puriniche e
pirimidiniche si trovano
all'interno dell'elica, su
piani che sono
perpendicolari all'asse
dell'elica, mentre i gruppi
deossiribosio e fosfato
formano la parte esterna
dell'elica.
Le due catene sono tenute insieme da coppie di
basi puriniche-pirimidiniche, legate con legami
idrogeno. L'adenina (A) è sempre accoppiata con
la timina (T) e la guanina (G) è sempre accoppiata
51
con la citosina (C). Salvatore Consoli
• L'adenina (A) è accoppiata con la timina (T) con
due legami ad idrogeno
• La guanina (G) è accoppiata con la citosina (C) con
tre legami ad idrogeno.
• Il diametro dell'elica è di 20 Å.
Le coppie di basi adiacenti sono
separate di 3,4 Å e si succedono
ad ogni avanzamento dell'elica di
36º. Ci sono perciò 10 coppie di
basi per ogni giro completo
dell'elica (360º) e la struttura si
ripete ogni 34 Å.
• Non c'è nessuna limitazione alla
sequenza di basi lungo una catena
polinucleotidica. Dalla sequenza
esatta però dipende
l'informazione genetica.
Salvatore Consoli
53
Stabilità della doppia elica
•
La formazione della doppia elica è favorita da
Interazioni idrofobiche derivanti dall'impaccamento delle basi
dalla formazione di legami ad Idrogeno tra le coppie di basi.
•
La formazione della doppia elica è sfavorita da:
Repulsione elettrostatica dei fosfati che si trovano sullo scheletro dei filamenti
Dall'entropia conformazionale
Formazione di legami ad Idrogeno con l'acqua.
•
Le Possibili strutture della doppia elica
Il modello di doppia elica proposto da Watson e Crick rappresenta la struttura del BDNA. La struttura ai
raggi X confermò essenzialmente il modello proposto, ma mostrava come essa fosse in realtà una
semplificazione in quanto la struttura molecolare mostrava molte variazioni e distorsioni locali rispetto
alla struttura ideale
E' importante comprendere che la struttura secondaria del DNA non è rigida ma flessibile e dipende dalla
esatta sequenza dei nucleotidi e può essere modificata in seguito ad interazioni con proteine ed altre
molecole.
Sotto altre condizioni è possibile che si produca un altro modello di elica ADNA.
Recentemente è stata descritta una ZDNA, destrosa, il cui significato biologico è sconosciuto. Qui c'è un
confronto tra i diversi modelli di elica. La forma A è la conformazione ad elica adottata dal DNA e RNA,
ARNA, in quanto l'ossidrile in posizione 2' del ribosio impedisce stericamente la formazione della
conformazione B.
•
La maggior parte del DNA della maggior parte dei microrganismi è una doppia elica nella sua forma B
Le eliche del DNA
(Tutte le molecole qui illustrate contengono dodici coppie di basi )
Tipo d'elica
Diametro
Coppie/giro
A DNA
B DNA
Z DNA
destrosa
destrosa
sinistrorsa
~26 Å
~20 Å
~18 Å
11
10.5
12
Viste laterali
Viste dall'alto
Salvatore Consoli
55
ADNA
BDNA
Quello di
Watson e
Crick
ZDNA
La struttura terziaria del DNA
A causa dell'estrema lunghezza del DNA, la sua struttura terziaria è molto
complessa. Comunque si possono discutere alcune strutture.
• Superavvolgimento
Il DNA di batteri, mitocondri, plastidi e alcuni virus è costituito da un
anello chiuso. Il DNA circolare può assumere un aspetto incurvato o
avvolto come dalle seguenti immagini al microscopio.
Il DNA puo'subire un
processo di denaturazione
(apertura dei due filamenti,
che se non sono ulteriormente
alterati ritornano
spontaneamente a formare la
doppia elica) dovuto ad un
aumento di calore. Tale
denaturazione puo'essere
reversibile, e si ha la
ricostituzione del DNA
(rinaturazione)
Ruolo
Scrive la nostra individualità
Immagazzina informazioni
organizzate in unità costituite da
sequenze di nucleotidi dette geni
Fa fluire le informazioni
immagazzinate alle proteine
che le esprimono fisicamente
Si duplica per conservare e
passare le informazioni a tutte
le cellule
RNA (acido ribonucleico)
L’RNA è un poliribonucleotide
costituito da un singolo filamento
I nucleotidi non sono tutti
uguali ma differiscono per le
basi
Ci sono 4 differenti tipi di
basi:
• Adenina
• Citosina
• Guanina
• Uracile
RNA (basi: Adenina, racile Citosina e Guanina) Zucchero :ribosio
Polinucleotide 1 sola elica)
Sostituisce il deossiribosio
Sostituisce la timina
Differenze
RNA
DNA
olimeri DNA e RNA sono polinucleotidi i cui nucleotidi sono legati tra loro da legami
sfodiesterici tra gli OH 5' di un nucleotide e il 3' di un idrossile seguente.
ucleotidi sono acidi forti in quanto i due pKa del fosfodiestere sono tra 0.7 ed 1 e 6.1 e
3.Di conseguenza lo scheletro dell'RNA e DNA sono normalmente carichi negativamente







![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)